46 xx 21ps что это значит у женщин
МЕДИКО-ГЕНЕТИЧЕСКИЕ АСПЕКТЫ БЕСПЛОДИЯ.
Акушерство, гинекология и репродукция. 2012; N2: c.35-40
Представлены результаты медико-генетического обследования 304 супружеских пар с бесплодием (608 индивидуумов). Выявлена частота генетических аномалий, представлена структура бесплодия. Проведён сравнительный анализ двух групп, в которые вошли пары с мужским и сочетанным бесплодием. Группы были сформированы по результатам лечения бесплодия с использованием ВРТ. Выявлены факторы, достоверно влияющие на наступление беременности.
Ключевые слова: бесплодие в браке, мужское бесплодие, сочетанное бесплодие, цитогенетический анализ, молекулярно генетическое исследование, хромосомные аномалии, хромосомные варианты, ВРТ
1 Кафедра репродуктивной медицины и хирургии ФПДО МГМСУ
2 Медико-генетический научный центр РАМН (Москва)
Бесплодие в браке – одна из наиболее важных и сложных медицинских, социально-демографических и экономических проблем. Частота бесплодных браков во многих странах мира колеблется от 8 до 29%. В Европе бесплодными являются около 10% супружеских пар, в США – 15%, в Канаде – 17%, доля бесплодных браков на территории России варьирует от 8 до 17,5%. Бесплодие как социальная проблема часто является причиной потери интереса к жизни, работе, развития тяжелых психосексуальных и эмоциональных расстройств [1,2].
Современная диагностическая и лечебная помощь при бесплодии опирается на основополагающие достижения в области репродукции, к которым относятся: расшифровка механизмов гормональной регуляции репродуктивного процесса, ультразвуковая диагностика, эндоскопическая хирургия, вспомогательные репродуктивные технологии. Тем не менее, в 8-10% случаев установить причину бесплодия не представляется возможным, что связано с большим числом разнообразных факторов, влияющих на репродуктивный процесс [2,3,4]. По данным некоторых авторов, на долю идиопатического бесплодия у мужчин приходится до 30% случаев [5]. Их связывают с ещё недостаточно изученными генетическими аспектами регуляции сперматогенеза [5], определённая доля случаев может относиться к патологии мейоза, нарушению дифференцировки и созревания сперматид в зрелую половую клетку и др. [4]. Но при использовании в диагностике молекулярно-генетических, молекулярно-цитогенетических, электронно-микроскопических методов частота выявления нарушений репродуктивной функции генетической природы значительно возрастает.
Цель нашего исследования – уточнение структуры и определение роли генетических нарушений при бесплодии.
Материалы и методы
В исследование включено 608 человек: 304 супружеские пары с бесплодием. Критерии включения: супружеские пары с мужским или женским бесплодием; супружеские пары с сочетанным бесплодием. Критерии исключения: злокачественные новообразования; тяжелая экстрагенитальная патология; наличие психических заболеваний.
Средний возраст мужчин составил 35,3±6,6 лет, средний возраст женщин – 32,1±5,7 года. Продолжительность бесплодия – 5,3±3,8 года (min – 1 год, max – 20 лет). Доля пациентов с первичным бесплодием составила 77,6% (мужчин – 82%, женщин – 72%), с вторичным – 22,4% (мужчин – 18%, женщин – 28%).
Всем пациентам был проведен цитогенетический анализ по лимфоцитам периферической крови, культивируемых в условиях in vitro, в соответствии со стандартной процедурой. Исследование проводили на препаратах метафазных хромосом, которые готовили по общепринятому методу. Результаты цитогенетического исследования приведены согласно Международной системе номенклатуры цитогенетики человека (ISCN, 2005). При подозрении на мозаицизм как мужчинам, так и женщинам проводили молекулярно-цитогенетическое исследование лимфоцитов крови для уточнения процентного соотношения линий клеток.
Из общей группы супружеских пар, прошедших цитогенетическое обследование, была выделена 161 супружеская пара с сочетанным или мужским фактором бесплодия. Эти пары были полностью обследованы и прошли лечение в специализированных клиниках с использованием ВРТ. Проведено одномоментное ретроспективное исследование. Супружеские пары были разделены на две группы: группа 1 – беременность наступила и длилась более 12 нед. (68 супружеских пар), группа 2 – беременность не наступила или прервалась до 12 нед. беременности (93 супружеские пары). Данные о пациентах вносились в специально разработанную таблицу, которая включала в себя 132 параметра. Статистическую обработку результатов исследований проводили с помощью пакета прикладных программ Statistica 6.0. Статистический анализ данных включал оценку формы распределения признака по критериям Колмогорова-Смирнова. Поскольку распределение признаков отличалось от нормального, были использованы непараметрические методы: критерий Манна-Уитни для оценки межгрупповых различий, ранговая корреляция Спирмена для оценки силы связи между изучаемыми факторами. Оценка влияния разных факторов на успех наступления беременности была проведена с помощью многофакторного регрессионного анализа.
Обследовано 608 человек с бесплодием (304 супружеские пары). Общая частота выявленных хромосомных аномалий составила 1,3% (8 человек), их них было выявлено равное количество числовых и структурных хромосомных аномалий (по 0,65%). Среди числовых хромосомных аберраций определены: синдром Клайнфельтера полная и мозаичная форма (2 случая – кариотипы 47,ХХУ и 46,ХУ/47,ХХУ), мозаичная форма моносомии хромосомы Х (1 случай – 46,ХХ/45,Х), мозаичная форма синдрома трипло-Х (1 случай – 46,ХХ/47,ХХХ). Среди структурных аномалий были выявлены сбалансированные транслокации с вовлечением как аутосом, так и половых хромосом: кариотип 46,Х,t(20;Y)(p13;q11.21) и 46,Х,-Y,der(22) t(Y;22), а также инверсии: кариотип 46,ХХ,inv9(p12,p24) и 46,ХУ,inv7(p22, q21).
При сравнении двух групп супружеских пар с сочетанным и мужским бесплодием, у которых в результате лечения с применением ВРТ наступила (группа I) и не наступила (группа II) беременность, статистически значимых различий по возрасту мужчин и женщин, продолжительности бесплодия в этих группах выявлено не было. Характеристика групп по возрастам представлена в таблице 1.
Таблица 1. Возрастная характеристика обследованных групп.
| Признак | Женщины | Мужчины | ||
| группа I | группа II | группа I | группа II | |
| Средний возраст | 30,3 | 32,1 | 34,8 | 35,3 |
| Минимальный возраст | 22 | 21 | 24 | 21 |
| Максимальный возраст | 39 | 47 | 49 | 56 |
| Стандартное отклонение | 4,4 | 5,7 | 5,4 | 6,6 |
| U критерий (критерий Манна-Уитни) | p=0.07 (p>0.05) | p=0.81 (p>0.05) | ||
Средняя продолжительность бесплодия в первой группе составила 5,2±3,5 лет, во второй – 5,5±3,9 лет. В группе, где беременность наступила, преобладало первичное бесплодие – 75%, во второй группе первичное и вторичное бесплодие распределилось практически поровну: 49,5 и 50,5% соответственно.
Факторы бесплодия в группах представлены в таблице 2. Количество пар с мужским бесплодием и соотношение факторов женского бесплодия в парах с сочетанным бесплодием практически не отличались. Исключение составил один показатель. Во второй группе в 1,7 раза было больше женщин с эндометриозом.
Таблица 2. Факторы бесплодия в исследуемых группах.
| Женский фактор | Группа I | Группа II | ||
| сочетанное бесплодие мужской фактор + | мужское бесплодие | сочетанное бесплодие мужской фактор + | мужское бесплодие | |
| ТПБ | 41,17% | 39,7% | 43% | 34,4% |
| Эндокринное бесплодие | 27,9% | 26,9% | ||
| Эндометриоз | 14,7% | 24,7% | ||
В структуре патозооспермии у мужчин как в первой, так и во второй группе преобладала астенотератозооспермия, далее следовали: азооспермия, астенозооспермия и тератозооспермия (см. рис.1).
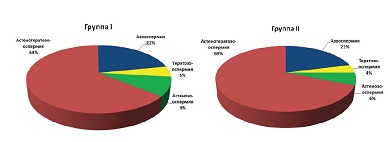 | Рисунок 1: Формы патозооспермии в группах. |
При тяжёлой форме патозооспермии мы проводили молекулярно-цитогенетические исследования половых клеток. Мужчин с азооспермией обследовали на наличие микроделеций в локусе AZF хромосомы У, на наличие мутаций в гене трансмембранного регуляторного белка муковисцидоза, проводили анализ длины GAG повтора в гене AR. Результаты обследования приведены в таблице 3. Частота выявленных микроделеций или генных нарушений в группе мужчин с тяжёлыми формами патозооспермии (31 человек) составила 16%.
Все супружеские пары проходили лечение в специализированных клиниках с использованием ВРТ. По показаниям применяли различные методы лечения. Некоторые пары имели по несколько попыток экстракорпорального оплодотворения или искусственной инсеминации, для анализа использованы результаты последнего протокола. В таблице 4 представлены использованные методы лечения в группах.
Таблица 4. Наступление беременности в зависимости от использованных методов вспомогательной репродукции, %.
| Использованные методы | Группа I | Группа II |
| ЭКО | 14,7 | 7,5 |
| ЭКО + ICSI | 47 | 48,3 |
| ЭКО + ICSI + TESЕ | 6,3 | 4,3 |
| ЭКО + ICSI + ДС | 5 | 2,1 |
| ЭКО + ДС | 8,8 | 6,4 |
| Криоперенос | 19,1 | 19,4 |
| ЭКО + IMSI | — | 1 |
| ЭКО +ДЯ | — | 1 |
| ИИ СД | — | 4,3 |
| ПГД | 1 | 4 |
При регрессионном многофакторном анализе влияния различных факторов на наступление беременности в исследуемой группе была получена значимая модель: χ²=9,428; р=0,00065. Выявлено, что достоверно влияет на наступление беременности отсутствие в анамнезе у женщин воспалительных заболеваний органов малого таза (р=0,002; р 26) снижает их активность и может приводить к нарушению сперматогенеза. В нашем исследовании увеличение длины СAG-повтора в гене AR выявлено у двух пациентов (6,4%) с первичным бесплодием: у пациента с азооспермией (27(СAG)) и у пациента с астенозооспермией (27(СAG)).
Таким образом, использование в диагностике молекулярно-генетических, молекулярно-цитогенетических методов значительно повышает частоту выявления нарушений репродуктивной функции генетической природы. Это следует учитывать при исследовании причин бесплодия в супружеских парах, особенно с идиопатическим бесплодием.
Результаты нашего исследования позволяют сделать следующие выводы:
В структуре бесплодного брака преобладает первичное бесплодие (до 77%).
При сочетанном бесплодии среди женских факторов на первом месте стоит трубно-перитонеальный фактор (до 43%), на втором месте – эндокринное бесплодие (до 30%), на третьем – эндометриоз (до 25%).
В структуре патозооспермии среди причин мужского бесплодия преобладает астенотератозооспермия (до 65%).
Частота генетических нарушений в общей группе (608 человек) составила 1,3% (хромосомная патология); при дополнительном молекулярно-генетическом обследовании 31 мужчины с тяжёлыми формами патозооспермии, преимущественно с азооспермией, выявлено 5 случаев (16%) генных нарушений.
Современные методы вспомогательной репродукции помогают парам даже с тяжёлыми формами бесплодия, в том числе обусловленными генетическими факторами, в преодолении бесплодия. Однако специалистам необходимо четко понимать, с каким типом хромосомных аберраций они имеют дело. Пациент должен получить консультацию медицинского генетика о риске передачи потомству генетической патологии, имеющейся у родителя. В настоящее время в арсенале специалистов имеются такие методы вспомогательной репродукции, как экстракорпоральное оплодотворение (ЭКО), интрацитоплазматическая инъекция сперматозоида в яйцеклетку (ИКСИ, ИМСИ), извлечение сперматозоида из яичка (TESE), преимплантационная генетическая диагностика (ПГД). Все они в совокупности с клинико-генетическим обследованием и медико-генетическим консультированием помогают решить проблему деторождения и снизить риск передачи потомству генетических нарушений.
MEDICO-GENETIC ASPECTS OF INFERTILITY
1 Chair of Reproductive Medicine and Surgery, Faculty of Postgraduate Education MSMSU
2 Medicogenetic Scientific Center, Russian Academy of Medical Science (Moscow)
Abstract: results of medico-genetic examination of 304 married couples with infertility (608 individuals) are presented in article. Frequency of genetic abnormalities and infertility structure are revealed. Comparative analysis between 2 groups of couples with male as well as combined infertility is performed. The groups were formed according the results of infertility treatment using methods of ART. The factors having had statistically significant impact on fertility were revealed.
Key words: infertility, male infertility, combined infertility, cytogenetic analysis, molecular-genetic analysis, chromosomal abnormalities, chromosome variants, ART.
Инверсия пола 46 XX
OMIM 400045
Наша команда профессионалов ответит на ваши вопросы
46,ХХ инверсия пола характеризуется наличием мужского фенотипа (с полной или неполной маскулинизацией), наличием тестикулярной ткани при отсутствии в кариотипе Y-хромосомы. При этом данное нарушение формирования пола может быть обусловлено либо наличием синдрома «46,ХХ-мужчина» либо овотестикулярной формой нарушения формирования пола (истинный гермафродитизм). 46,ХХ инверсия пола может быть связана с наличием фрагмента Y-хромосомы и/или скрытого мозаицизма по Y-хромосоме (Y-позитивная форма) либо с аутосомными или Х-сцепленными мутациями (Y-негативная форма).
46,ХХ инверсия пола тип 1 (OMIM 400045)
В большинстве случаев ХХ-инверсия пола является результатом транслокации небольшого фрагмента короткого плеча Y-хромосомы, несущего ген SRY (OMIM 480000; Yp11.3), на Х-хромосому или аутосому. Нарушение формирования пола является врожденным состоянием, при котором наблюдается полное или частичное аномальное развитие и строение половых желез, внешних половых признаков, обусловленное аномалиями строения половых хромосом. У пациентов с истинным гермафродитизмом гистологически могут быть обнаружены как зрелые ткани яичников с фолликулами, так и яичек с семенными канальцами.
Ключевую роль в детерминации мужского пола и в дифференцировке яичек связана с геном SRY (Sex-determining region Y chromosome). Делеции или точковые мутации этого гена приводят к развитию «чистой» формы дисгенезии гонад при кариотипе 46,XY (синдром Свайера), тогда как его присутствие в геноме больных с 46,ХХ инверсией пола (синдром де ля Шапеля или синдром «46,ХХ-мужчина») обуславливает развитие по мужскому типу, а у больных с мозаицизмом по хромосоме Y, в том числе при синдроме Шерешевского-Тернера – с наличием и выраженностью маскулинизации и/или двойственного полового развития.
Ген SRY расположен на коротком плече Y-хромосомы в непосредственной близости к PAR1 региону, области гомологичной конъюгации хромосом Х и Y, происходящей в сперматогенезе. В процессе мейотического обмена между Х- и Y-хромосомами участок Y-хромосомы, содержащий ген SRY, может быть транслоцирован на Х-хромосому, что может привести к образованию сперматозоидов с перестроенными (дериватными) хромосомами: с Y-хромосомой, утратившей ген SRY, и Х-хромосомой, несущей этот ген. При оплодотворении такими гаметами яйцеклетки, соответственно, возможно рождение мужчин с кариотипом 46,ХХ с транслокацией гена SRY и женщин с кариотипом 46,XY, но с делецией гена SRY. Так, 85-90% больных с ХХ инверсией пола имеют в геноме небольшую часть короткого плеча Y-хромосомы, невидимую при стандартном цитогенетическом исследовании. Последовательности Y-хромосомы у таких больных транслоцированы, как правило, на Х-хромосому, реже на одну из аутосом, унаследованных от отца. Транслоцированный участок Y-хромосомы при этом содержит ген SRY. В редких случаях может встречаться скрытый мозаицизм по Y-несущему клону (например, 46,ХY), о чем свидетельствует наличие локусов SRY, AMGL и других Y-специфичных маркеров.
Для идентификации в геноме последовательностей Y-хромосомы, а также выявления делеции гена SRY, используется метод мультиплексной полимеразной цепной реакции (мПЦР), позволяющий исследовать наличия данного гена, а также гена амелогенина (AMG, AMELX), локализованного на коротком плече Х-хромосомы и его гомолога, локализованного на коротком плече Y-хромосомы (AMGL / AMELY). Для анализа наличия точковых мутаций гена SRY – прямое секвенирование его кодирующей последовательности.
С целью анализа количественных аномалий (анеуполидий) и некоторых структурных аномалий половых хромосом, а также гоносомного мозаицизма и химеризма, может быть использован метод количественной флюоресцентной ПЦР.
46,ХХ инверсия пола тип 2 (ОMIM 278850)
Данный тип ХХ-инверсии пола вызван дупликацией регуляторной области гена SOX9. Ген SOX9 располагается на длинном плече хромосомы 17 в локусе q24.3. Кодируемый геном белок является транскрипционным фактором, играющим важную роль в процессе эмбрионального развития. Особенно важен данный белок для развития скелета и репродуктивной системы. Дупликации локуса 17q24 приводит к увеличению числа копий гена SOX9, что у плодов с кариотипом 46,ХХ вызывает дифференцировку гонад по мужскому типу и развитие тестикул в отсутствие гена SRY и других генов Y-хромосомы (SRY-негативная ХХ-инверсия пола). При этом в большинстве случаев дупликаций гена SOX9 не происходит формирования нормальных тестикул, что ведет к овотестикулярной форме нарушения формирования пола (истинный гермафродитизм).
Точковые мутации в гене SOX9 у пациентов с кариотипом 46,ХХ и 46,ХY приводят к развитию кампомелической дисплазии (OMIM 114290) – заболеванию, которое влияет на развитие скелета и репродуктивной системы и часто является угрожающим жизни состоянием в период новорожденности. Пациенты с кариотипом 46,ХХ и точковыми мутациями в гене SOX9 имеют дисгенезию гонад без инверсии пола (фенотипически женщины), а у пациентов с кариотипом 46,XY дисгенезия гонад приводит к XY – инверсии пола или двойственному развитию половых органов.
В Центре Молекулярной Генетики проводится анализ ключевых генов, контролирующих дифференцировку пола: с помощью количественного метода MLPA проводится поиск делеций и дупликаций генов SRY и SOX9.
46,ХХ инверсия пола тип 3 (ОMIM 300833)
Данная форма ХХ-инверсии пола вызвана дупликацией гена SOX3 или делецией его негативно-регуляторной области. Ген SOX3 (sex determining region Y-box 3) является Х-сцепленным гомологом гена SRY, располагается на длинном плече Х-хромосомы в локусе Xq27.1 и подвержен Х-инактивации. Кодируемый им белок является членом семейства SOX (SRY-related HMG-box) – транскрипционных факторов, вовлеченных в контроль дифференцировки различных типов клеток, а также в регуляцию формирования головного мозга в ходе эмбрионального развития, развитие гипоталамо-гипофизарной системы. Он поддерживает недифференцированное состояние у нервных клеток, противодействуя влиянию факторов, стимулирующих их специализацию. Также наличие данного белка необходимо для инициирования формирования пола по мужскому типу. В дифференцирующихся тестикулах белок SOX3 поддерживает дифференцировку и развитие предшественников ‘поддерживающих клеток’ бипотенциальных (индифферентных) гонад в клетки Сертоли, а не в клетки гранулезы овариальной ткани.
Мутации, делеции или дупликации гена SOX3 являются причиной X-сцепленного гипопитуитаризма, некоторых форм аномалии развития нервной трубки (септо-оптической дисплазии), а также X-сцепленной умственной отсталости с изолированным дефицитом гормона роста. Дупликации Xq26-q27, включающие ген SOX3, являются одной из причин SRY-негативной ХХ-инверсии пола (46,ХХ тестикулярной и овотестикулярной форм нарушения формирования пола). Описано несколько случаев ХХ-инверсии пола, вызванных микродупликациями и микроделециями в локусе Xq27.1. При этом спектр фенотипических проявлений (от бесплодия при нормальном мужском фенотипе до аномалий развития пола, микроцефалии с задержкой умственного развития) зависел от локализации и размера перестройки.
Медико-генетические аспекты бесплодия
Резюме: представлены результаты медико-генетического обследования 304 супружеских пар с бесплодием (608 индивидуумов). Выявлена частота генетических аномалий, представлена структура бесплодия. Проведён сравнительный анализ двух групп, в которые вошли пары с мужским и сочетанным бесплодием. Группы были сформированы по результатам лечения бесплодия с использованием ВРТ. Выявлены факторы, достоверно влияющие на наступление беременности.
Бесплодие в браке – одна из наиболее важных и сложных медицинских, социально-демографических и экономических проблем. Частота бесплодных браков во многих странах мира колеблется от 8 до 29%. В Европе бесплодными являются около 10% супружеских пар, в США – 15%, в Канаде – 17%, доля бесплодных браков на территории России варьирует от 8 до 17,5%. Бесплодие как социальная проблема часто является причиной потери интереса к жизни, работе, развития тяжелых психосексуальных и эмоциональных расстройств [1,2].
Современная диагностическая и лечебная помощь при бесплодии опирается на основополагающие достижения в области репродукции, к которым относятся: расшифровка механизмов гормональной регуляции репродуктивного процесса, ультразвуковая диагностика, эндоскопическая хирургия, вспомогательные репродуктивные технологии. Тем не менее, в 8-10% случаев установить причину бесплодия не представляется возможным, что связано с большим числом разнообразных факторов, влияющих на репродуктивный процесс [2,3,4]. По данным некоторых авторов, на долю идиопатического бесплодия у мужчин приходится до 30% случаев [5]. Их связывают с ещё недостаточно изученными генетическими аспек-тами регуляции сперматогенеза [5], определённая доля случаев может относиться к патологии мейоза, нарушению дифференцировки и созревания сперматид в зрелую половую клетку и др. [4]. Но при использовании в диагностике молекулярно-генетических, молекулярно-цитогенетических, электронно-микроскопических методов частота выявления нарушений репродуктивной функции генетической природы значительно возрастает. Цель нашего исследования – уточнение структуры и определение роли генетических нарушений при бесплодии.
Материалы и методы

Средний возраст мужчин составил 35,3±6,6 лет, средний возраст женщин – 32,1±5,7 года. Продолжительность бесплодия – 5,3±3,8 года (min – 1 год, max – 20 лет). Доля пациентов с первичным бесплодием составила 77,6% (мужчин – 82%, женщин – 72%), с вторичным – 22,4% (мужчин – 18%, женщин – 28%).
Всем пациентам был проведен цитогенетический анализ по лимфоцитам периферической крови, культивируемых в условиях in vitro, в соответствии со стандартной процедурой. Исследование проводили на препаратах метафазных хромосом, которые готовили по общепринятому методу. Результаты цитогенетического исследования приведены согласно Международной системе номенклатуры цитогенетики человека (ISCN, 2005). При подозрении на мозаицизм как мужчинам, так и женщинам проводили молекулярно-цитогенетическое исследование лимфоцитов крови для уточнения процентного соотношения линий клеток.
Из общей группы супружеских пар, прошедших цитогенетическое обследование, была выделена 161 супружеская пара с сочетанным или мужским фактором бесплодия. Эти пары были полностью обследованы и прошли лечение в специализированных клиниках с использованием ВРТ. Проведено одномоментное ретроспективное исследование. Супружеские пары были разделены на две группы: группа 1 – беременность наступила и длилась более 12 нед. (68 супружеских пар), группа 2 – беременность не наступила или прервалась до 12 нед. беременности (93 супружеские пары). Данные о пациентах вносились в специально разработанную таблицу, которая включала в себя 132 параметра. Статистическую обработку результатов исследований проводили с помощью пакета прикладных программ Statistica 6.0. Статистический анализ данных включал оценку формы распределения признака по критериям Колмогорова-Смирнова. Поскольку распределение признаков отличалось от нормального, были использованы непараметрические методы: критерий Манна-Уитни для оценки межгрупповых различий, ранговая корреляция Спирмена для оценки силы связи между изучаемыми факторами. Оценка влияния разных факторов на успех наступления беременности была проведена с помощью многофакторного регрессионного анализа.
Результаты исследования
Обследовано 608 человек с бесплодием (304 супружеские пары). Общая частота выявленных хромосомных аномалий составила 1,3% (8 человек), их них было выявлено равное количество числовых и структурных хромосомных аномалий (по 0,65%). Среди числовых хромосомных аберраций определены: синдром Клайнфельтера полная и мозаичная форма (2 случая – кариотипы 47,ХХУ и 46,ХУ/47,ХХУ), мозаичная форма моносомии хромосомы Х (1 случай – 46,ХХ/45,Х), мозаичная форма синдрома трипло-Х (1 случай – 46,ХХ/47,ХХХ). Среди структурных аномалий были выявлены сбалансированные транслокации с вовлечением как аутосом, так и половых хромосом: кариотип 46,Х,t(20;Y)(p13;q11.21) и 46,Х,-Y,der(22) t(Y;22), а также инверсии: кариотип 46,ХХ,inv9(p12,p24) и 46,ХУ,inv7(p22, q21).
При сравнении двух групп супружеских пар с сочетанным и мужским бесплодием, у которых в результате лечения с применением ВРТ наступила (группа I) и не наступила (группа II) беременность, статистически значимых различий по возрасту мужчин и женщин, продолжительности бесплодия в этих группах выявлено не было. Характеристика групп по возрастам представлена в таблице 1.
Средняя продолжительность бесплодия в первой группе составила 5,2±3,5 лет, во второй – 5,5±3,9 лет.
В группе, где беременность наступила, преобладало первичное бесплодие – 75%, во второй группе первичное и вторичное бесплодие распределилось практически поровну: 49,5 и 50,5% соответственно.
Факторы бесплодия в группах представлены в таблице 2. Количество пар с мужским бесплодием и соотношение факторов женского бесплодия в парах с сочетанным бесплодием практически не отличались. Исключение составил один показатель. Во второй группе в 1,7 раза было больше женщин с эндометриозом.
В структуре патозооспермии у мужчин как в первой, так и во второй группе преобладала астенотератозооспермия, далее следовали: азооспермия, астенозоос-пермия и тератозооспермия (см. рис.1).
Таблица1. Возрастная характеристика обследованных групп.
| Признак | Женщины | Мужчины | ||
| группа I | группа II | группа I | группа II | |
| Средний возраст | 30,3 | 32,1 | 34,8 | 35,3 |
| Минимальный возраст | 22 | 21 | 24 | 21 |
| Максимальный возраст | 39 | 47 | 49 | 56 |
| Стандартное отклонение | 4,4 | 5,7 | 5,4 | 6,6 |
| U критерий (критерий Манна-Уитни) | p=0.07 (p>0.05) | p=0.81 (p>0.05) | ||
Таблица2. Факторы бесплодия в исследуемых группах.
| Женский фактор | Группа I | Группа II | ||
| сочетанное бесплодие мужской фактор + | мужское бесплодие | сочетанное бесплодие мужской фактор + | мужское бесплодие | |
| ТПБ | 41,17% | 39,7% | ||
| Эндокринное бесплодие | 27,9% | 26,9% | ||
| Эндометриоз | 14,7% | 24,7% | ||
Рисунок1. Формы патозооспермии в группах.
Таблица3. Структура хромосомных аберраций в исследуемых группах.
При тяжёлой форме патозооспермии мы проводили молекулярно-цитогенетические исследования половых клеток. Мужчин с азооспермией обследовали на наличие микроделеций в локусе AZF хромосомы У, на наличие мутаций в гене трансмембранного регуляторного белка муковисцидоза, проводили анализ длины GAG повтора в гене AR. Результаты обследования приведены в таблице 3. Частота выявленных микроделеций или генных нарушений в группе мужчин с тяжёлыми формами патозооспермии (31 человек) составила 16%. Все супружеские пары проходили лечение в специализированных клиниках с использованием ВРТ. По показаниям применяли различные методы лечения. Некоторые пары имели по несколько попыток экстракорпорального оплодотворения или искусственной инсеминации, для анализа использованы результаты последнего протокола. В таблице 4 представлены использованные методы лечения в группах.
Таблица4. Наступление беременности в зависимости от использованных методов вспомогательной репродукции, %.
| Использованные методы | Группа I | Группа II |
| ЭКО | 14,7 | 7,5 |
| ЭКО + ICSI | 47 | 48,3 |
| ЭКО + ICSI + TESЕ | 6,3 | 4,3 |
| ЭКО + ICSI + ДС | 5 | 2,1 |
| ЭКО + ДС | 8,8 | 6,4 |
| Криоперенос | 19,1 | 19,4 |
| ЭКО + IMSI | — | 1 |
| ЭКО +ДЯ | — | 1 |
| ИИ СД | — | 4,3 |
| ПГД | 1 | 4 |
При регрессионном многофакторном анализе влияния различных факторов на наступление беременности в исследуемой группе была получена значимая модель: χ²=9,428; р=0,00065. Выявлено, что достоверно влияет на наступление беременности отсутствие в анамнезе у женщин воспалительных заболеваний органов малого таза (р=0,002; р 26) снижает их активность и может приводить к нарушению сперматогенеза. В нашем исследовании увеличение длины СAG-повтора в гене AR выявлено у двух пациентов (6,4%) с первичным бесплодием: у пациента с азооспермией (27(СAG)) и у пациента с астенозооспермией (27(СAG)).
Заключение
Таким образом, использование в диагностике молекулярно-генетических, молекулярно-цитогенетических методов значительно повышает частоту выявления нарушений репродуктивной функции генетической природы. Это следует учитывать при исследовании причин бесплодия в супружеских парах, особенно с идиопатическим бесплодием.
Результаты нашего исследования позволяют сделать следующие выводы:
В структуре бесплодного брака преобладает первичное бесплодие (до 77%).
При сочетанном бесплодии среди женских факторов на первом месте стоит трубно-перитонеальный фактор (до 43%), на втором месте – эндокринное бесплодие (до 30%), на третьем – эндометриоз (до 25%).
В структуре патозооспермии среди причин мужского бесплодия преобладает астенотератозооспермия (до 65%).
Частота генетических нарушений в общей группе (608 человек) составила 1,3% (хромосомная патология); при дополнительном молекулярно-генетическом обследовании 31 мужчины с тяжёлыми формами патозооспермии, преимущественно с азооспермией, выявлено 5 случаев (16%) генных нарушений.
Современные методы вспомогательной репродукции помогают парам даже с тяжёлыми формами бесплодия, в том числе обусловленными генетическими факторами, в преодолении бесплодия. Однако специалистам необходимо четко понимать, с каким типом хромосомных аберраций они имеют дело. Пациент должен получить консультацию медицинского генетика о риске передачи потомству генетической патологии, имеющейся у родителя. В настоящее время в арсенале специалистов имеются такие методы вспомогательной репродукции, как экстракорпоральное оплодотворение (ЭКО), интрацитоплазматическая инъекция сперматозоида в яйцеклетку (ИКСИ, ИМСИ), извлечение сперматозоида из яичка (TESE), преимплантационная генетическая диагностика (ПГД). Все они в совокупности с клинико-генетическим обследованием и медико-генетическим консультированием помогают решить проблему деторождения и снизить риск передачи потомству генетических нарушений.

