5 штамм аденовируса что это
«Спутник» и ложь во спасение. Почему у работоспособной вакцины плохая репутация
Илья Ясный
руководитель научной экспертизы Inbio Ventures
«Спутник V» — вакцина, которая спасла немало жизней, и повод для гордости: Россия одна из немногих стран, справившаяся с самостоятельной разработкой. С другой стороны, процесс разработки, производства и распространения вакцины сопровождается таким количеством нарушений, дезинформации и некомпетентности, что репутация у препарата неоднозначная. Фактически в нем, как в капле воды, отразились проблемы российской науки, фармацевтики и пиара. Руководитель научной экспертизы Inbio Ventures Илья Ясный анализирует факты и домыслы вокруг «Спутника» и разбирается, почему Европа и ВОЗ до сих пор не одобрили российскую вакцину.
Дисклеймер: автор и его семья привились «Спутником».
Прежде всего, необходимо различать три вещи:
Предыстория: Эбола и уголовное дело
Публичная история Спутника V началась 20 апреля 2020 года, когда директор института Гамалеи Александр Гинцбург на совещании у Путина заявил, что клинические исследования вакцины могут начаться 1 июня, а регистрация возможна с 15 июня. Конечно, постановление правительства разрешает сокращенный порядок исследований лекарств в период пандемии, но две недели на клинические исследования — это, мягко говоря, оптимистичный прогноз.
Правда, Гинцбург и другие сотрудники постоянно ссылаются на то, что платформа, на которой сделан «Спутник», хорошо изучена, и это уже третья вакцина, полученная по данной технологии. Действительно, раньше в России была зарегистрирована вакцина от Эболы, однако сделано это было в нарушение всяких правил по результатам фазы ½, результаты фазы 3 так и не были нигде опубликованы, а разрешение на исследование вписано в реестр задним числом.
Есть еще одна пикантная подробность: на самом деле «Спутник» — не третья, а четвертая попытка института Гамалеи создать векторную вакцину: первой была АдеВак-Флю, о которой сейчас Гинцбург не упоминает. Возможно, потому что деньги на ее создание были разворованы, а в хищении 424 млн рублей у Роснано обвиняется бывший сотрудник центра Гамалеи Рустам Атауллаханов. Гинцбургу и его заместителю Денису Логунову посчастливилось быть на этом процессе свидетелями.
Поспешная регистрация
В мае 2020 года разразился скандал с исследованием вакцины на сотрудниках института Гамалеи еще до тестирования на животных. Директор Гинцбург заявил, что это не имеет никакого отношения к клиническим исследованиям. Правда, по всем международным правилам, незарегистрированные новые препараты должны вводиться людям только в рамках клинических исследований: они должны подписывать информированное согласие, оформлять страховку и тщательно наблюдаться, потому что их здоровье и жизнь подвергаются повышенной опасности.
Наконец, регистрация вакцины 11 августа без каких-либо опубликованных данных стала настоящей сенсацией не только у нас, но и за рубежом, и оказала неоднозначное влияние на имидж вакцины. Все, что было доступно в течение двух месяцев — скупые данные из плохо написанной инструкции, из которых, однако, было понятно, что обе дозы вакцины в жидком виде получили ровно двадцать человек. Это не тянет даже на исследование фазы 2, не то что на регистрационное. Для сравнения, на тот момент детали по первым двум фазам исследований западных вакцин: Pfizer/BioNTech, AstraZeneca, Moderna уже были опубликованы в рецензируемых научных журналах, причем там участвовало в десятки раз больше человек, но никто не торопился регистрировать вакцину по этим предварительным данным.
Кроме того, сопровождающие регистрацию заявления о том, что это первая в мире зарегистрированная вакцина от коронавируса, не соответствуют действительности: 25 июня китайская вакцина CanSino была зарегистрирована для применения у военных. Также нелепо заявление разработчика Логунова о том, что временная регистрация необходима для вакцинации групп риска. Оно противоречит и мировой практике, и российскому руководству по клиническим исследованиям.
Публикации и испытания
В сентябре 2020 года в журнале Lancet вышла публикация результатов исследований фазы 1/2, которая подверглась резкой критике со стороны итальянского борца с лженаукой Энрико Буччи и других ученых с обвинениями в фальсификации данных. Группа Логунова ответила на критику, однако первичные данные, по которым можно было с уверенностью судить об отсутствии фальсификации, так и не были предоставлены. Но и помимо этой критики в статье много недостатков. Некоторое беспокойство с этической точки зрения вызвало то, что в исследовании принимали участия военные — это зависимая группа, и необходима особая внимательность, чтобы обеспечить добровольность и информированность участников.
СТАТЬИ ПО ТЕМЕ
«Спутник» выходит из тени. Что прояснила статья в The Lancet о российской вакцине
В сентябре же началось исследование фазы 3. В отличие от всех ведущих производителей вакцин, протокол «Спутника» опубликован не был. Между тем протокол — это ключевой документ клинического исследования, в нем описывается схема эксперимента, заранее указывается, какой результат и по какому критерию исследователи считают успешным, сколько для этой цели нужно добровольцев и прочие подробности. Мне удалось ознакомиться с августовским черновиком протокола. На первый взгляд он неплохо написан и похож на протоколы западных компаний, однако есть некоторые важные нюансы: описание того, заболел человек ковидом или нет, недостаточно детально и довольно субъективно, что во многом оставляет решение за врачом. Это позволяет манипулировать данными, если знать, кто в группе плацебо, а кто — вакцины. При том, что вакцина чаще вызывает побочные реакции, такой подход может привести к завышению ее эффективности.
Решение, заболел участник исследования ковидом или нет, во многом остается за врачом
В протоколе «Спутника», в отличие от протоколов других компаний, отсутствовали промежуточные точки анализа. Между тем ждать 180 дней после включения в исследования последнего пациента — это и впрямь слишком долго, поэтому из публикации о фазе 3 мы узнаём, что промежуточные анализы были внесены туда в ноябре. Изменение протокола третьей фазы, когда исследование уже идет, может привести к получению невалидных результатов, и требуется большая осторожность и хорошие обоснования, что всё сделано правильно. Как нетрудно догадаться, в статье это никак не комментируется.
Неясна ситуация и с эффективностью «Спутника» против новых штаммов. В центре Гамалеи, конечно, утверждают, что он эффективен против них, не приводя никаких доказательств (ждите, мол, публикацию в мае). Независимые ученые проанализировали сыворотку привитых аргентинцев и установили, что она хуже нейтрализует южноафриканский вариант вируса.
Производство
Одновременно c фазой 3 начинается масштабирование производства вакцины и к процессу подключаются Генериум, Биокад, Р-Фарм и другие компании. Передача производства в коммерческие компании повысила надежду, что вакцина будет качественной, но одновременно поставила вопрос о сопоставимости продуктов, произведенных на разных площадках. Скажем, продукт, произведенный в институте Гамалеи в реакторах объемом 5 л для целей клинического исследования совсем не обязан быть таким же, как произведенный в Генериуме в реакторе 1000 л для массового применения. Их сопоставимость требует отдельных исследований. О неполной сопоставимости косвенно свидетельствуют разные указания о хранении и применении для продукта разных производителей в инструкции на препарат.
Дальше обещания по количеству доз постоянно обгоняли реальные темпы производства. Впрочем, в том, что производство не удалось сразу масштабировать, нет ничего удивительного — в России не было опыта самостоятельного производства и масштабирования качественных инновационных препаратов, а к закупке оборудования для масштабирования приступили только в конце сентября. Итого на 12 мая в России произведено 33 млн доз, из которых экспортировано 15 млн. Так, Мексика получила 1,9 млн доз из положенных по контракту 24 млн. Минздрав Мексики заявил, что это из-за проблем с производством второй дозы, но РФПИ утверждает, что это неверная информация.
Наконец, в конце ноября были объявлены предварительные результаты третьей фазы для всех ведущих вакцин, в том числе для «Спутника». Как и у Pfizer и Moderna, эффективность «Спутника» оказалась на уровне 95%. Данные были опубликованы в виде пресс-релизов, но для западных вакцин более подробная информация стала довольно быстро доступной после одобрения вакцин в США и ЕС — агентства на этих территориях, в отличие от Минздрава РФ, публикуют подробную информацию и от производителя, и от регулятора, а в США доступно еще и видео заседания научного комитета. Подробностей о «Спутнике» пришлось подождать до февраля 2021 года, когда вышла статья в журнале Lanсet о результатах фазы 3. Впервые результаты исследования третьей фазы российского препарата были опубликованы в таком престижном международном журнале. Правда, и к этой публикации у исследователей возникли вопросы, которые во многом могли бы быть сняты предоставлением протокола исследования и первичных данных. В частности, выяснилось, что реактогенность вакцины вовсе не изучали. По руководству после прививки нужно собирать информацию о реакции на вакцину в течение нескольких суток, опрашивая пациентов. В протоколе это не было предусмотрено.
Сопоставимость вакцин, произведенных на разных площадках, нужно отдельно исследовать
Тем не менее в ноябре-декабре 2020 года начали накапливаться сведения из Telegram-каналов о привитых «Спутником». И у пожилых, и у людей с сопутствующими заболеваниями не наблюдалось серьезных побочных эффектов, вырабатывались антитела. Это в итоге и убедило меня посоветовать родителям привиться. Конечно, такая ситуация ненормальна, источником достоверной информации о лекарствах должны быть не соцсети, а официальные данные.
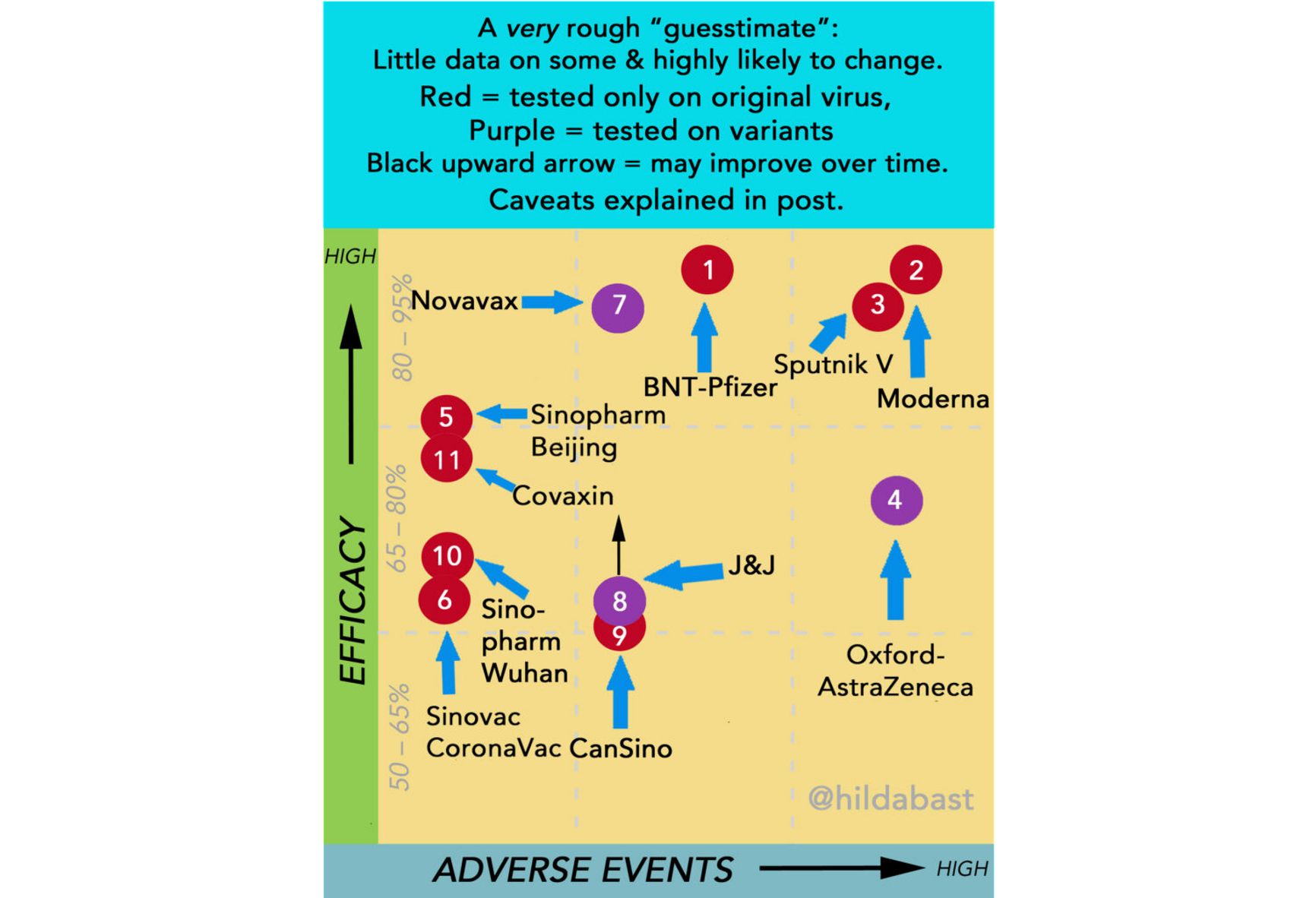
Правда, теперь у нас есть данные реального применения из Аргентины и Сан-Марино (но не из России). Надежно можно оценить разве что безопасность вакцины — количество побочных эффектов в сан-маринском исследовании находится на верхней границе других вакцин. Исследовательница Хильда Бастиан, одна из основателей Кокрейновского общества и эксперт по доказательной медицине, проводит сравнение вакцин по эффективности и безопасности, оговариваясь, что это ориентировочный график, потому что сравнивать данные из разных исследований напрямую не вполне корректно. На рисунке приведены данные на середину мая.
Как мы видим, у «Спутника» высокая заявленная эффективность, но и высокий уровень побочных эффектов. Число новых случаев ковида в Сан-Марино снизилось до нуля, при том, что «Спутником» там прививалось 80% населения.
Экспорт за рубеж
К «Спутнику» стали проявлять интерес в других странах — к ноябрю 2020 года заявки поступили из 50 стран на общий объем 1,2 млрд доз. Однако уже в декабре начались первые трения — Турция отказалась покупать «Спутник V» по причине несоответствия доклинических исследований надлежащей лабораторной практике (GLP, Good Laboratory Practice). Эти стандарты обеспечивают качественное выполнение исследований на животных, в первую очередь на токсичность. Если они не выполняются, нельзя быть уверенным, что препарат хорошо проверили на безопасность.
В ответ Гинцбург заявил, что «лабораторное производство сертифицировано по стандартам Минпромторга, но не по европейским сертификационным органам. У нас нет европейского сертификата, а имеем российский, как и вся наша промышленность». Это очень странный ответ — в претензии Турции речь шла вовсе не о производстве, а о доклинических исследованиях. Лабораторное производство не сертифицируется, лицензируется только промышленное производство. Стандарты лицензирования Минпромторга — это почти копия европейских стандартов.
Турция заявила, что проведет собственные исследования вакцины. Проделав это, турки одобрили вакцину 30 апреля и закупили 50 млн доз. Также они организуют собственное производство.
Вообще, для контекста важно понимать, что весь мир делится на две большие зоны — страны, где приняты самые современные нормы в отношении лекарств, разрабатываемые ICH (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к лекарствам для медицинского применения), и остальные страны. Наиболее сильное и современное регулирование в США, ЕС, Японии, Швейцарии, Канаде. Важно подчеркнуть, что эти руководства — не бюрократические преграды на пути производителей, выстроенные злой «бигфармой», а стройная, научно обоснованная, выстраданная после многих инцидентов система, обеспечивающая население этих стран безопасными, эффективными и качественными лекарствами.
Две страны Евросоюза вступили в переговоры с РФПИ о поставках «Спутника», несмотря на отсутствие одобрения со стороны ЕМА и ВОЗ: Венгрия и Словакия. Венгрия одобрила вакцину еще в январе 2021-го, но продолжала свои внутренние проверки. В феврале началась массовая вакцинация населения. Со Словакией получилось сложнее: одобрение вакцины и решение о закупке «Спутника» привело к политическому скандалу внутри страны. Затем, получив первые образцы вакцины, словаки заявили, что они не соответствуют тому, что было опубликовано в The Lancet, а данных из досье недостаточно, чтобы судить о безопасности и эффективности вакцины.
В ответ РФПИ потребовал вернуть поставленные 200 000 доз, ссылаясь на нарушение словаками контракта, в соответствии с которым вакцину могли тестировать только в сертифицированных ЕС лабораториях. Тогда Словакия опубликовала контракт, из которого видно, что там нет таких указаний. Однако 9 мая Словакия сообщила, что дозы, отправленные на тестирование в Венгрию, оказались удовлетворительного качества, и 26 мая одобрила вакцину для применения в стране. А чешский регулятор ранее заявлял, что данных в досье недостаточно, и они прекращают рассмотрение документов.
Наверное, самый громкий скандал разразился в Бразилии. Тамошнее регуляторное агентство ANVISA заявило, что пока не разрешит регистрацию «Спутника V» по причине неполноты данных и сразу нескольких моментов, которые беспокоят агентство:
РФПИ пообещал подать на ANVISA в суд за клевету. Но часть этих замечаний была понятна и до ANVISA, и их в любом случае придется устранить до того, как ЕМА или ВОЗ одобрят вакцину. Если РФПИ и Гамалея хотят зарегистрировать вакцину в Евросоюзе (а им было выдано такое распоряжение, как говорится, «на самом верху»), им придется пустить аудиторов ЕМА даже на такой сверхсекретный объект, как центр Гамалеи.
Между тем в Бразилии местная компания União Química наладила собственное производство «Спутника» по лицензии и подала на регистрацию. Так же поступила и индийская Dr. Reddy’s, причем индусы еще и провели собственное клиническое исследование, а также налаживают самое масштабное производство «Спутника» в мире.
Пиар черный и белый
Тут самое время упомянуть о позиции, которую занимают пиарщики РФПИ при любой попытке критиковать вакцину и даже просто сравнить ее с другими аналогами. С самого начала фонд сделал ставку не на открытость и готовность к диалогу, а на защитно-агрессивную позицию, причем с акцентом на принижение достоинств других вакцин и безапелляционные заявления о 97-процентной эффективности «Спутника». Так, в пресс-релизе написано, что заболеваемость среди 3,8 миллионов привитых россиян в январе-марте 2021 года составила 0,027%. Это означает, что среди дважды привитых «Спутником V» заболело 1026 человек. При этом, согласно информации Мосгорздрава, около 1000 человек к 31 марта заболело только среди миллиона привитых москвичей. Противоречие в цифрах очевидно.
На все упомянутые выше сигналы из разных стран представители РФПИ отвечали, что это «фейк-ньюс», была подключена и риторика «информационной атаки» на «Спутник» со стороны Госдепа США и подконтрольных ему организаций. Правда, государственная пропаганда США дала повод: согласно отчету Департамента здравоохранения США за 2020 год, они «убеждали Бразилию отказаться от российской вакцины». Отчет стыдливо удален с сайта Департамента, но кэш всё помнит.
Что касается очернения конкурентов, самая вопиющая история — с табличкой из Венгрии. В Twitter РФПИ была опубликована таблица с заражениями и смертями после вакцинации различными препаратами, из которой можно сделать вывод, что после вакцинации Pfizer/BioNTech смертность в почти в 20 раз, чем после «Спутника».
АДЕНОВИРУСЫ
Аденовирусы (греч. aden — железа + вирусы) — группа возбудителей респираторных и других заболеваний, включающая около 50 разновидностей (серотипов), выделенных от людей, обезьян, собак, рогатого скота, грызунов и птиц. Резистентны к действию эфира и кислот, обладают общим групповым комплементсвязывающим антигеном, эпителиотропны.
Вызывая по преимуществу заболевания дыхательных путей, аденовирусы, в отличие от других респираторных вирусов, значительно чаще поражают другие системы организма: конъюнктиву, лимфатические узлы, желудочно-кишечный тракт (см. Аденовирусные болезни). Легко преодолевая желудочный барьер в связи с резистентностью к кислотам, аденовирусы интенсивно размножаются в кишечнике.
Первые штаммы аденовирусов стали известны благодаря исследованиям Роу, Хюбнера, Гилмора, Парротта и Уорда (W. P. Rowe, R. J. Huebner, L. Gilmore. R. Parrott, Т. E. Ward, 1953), посвященным изучению цитопатогенного агента, выделенного из аденоидной ткани человека. Аденоидная ткань, извлеченная оперативным путем, культивировалась во вращающихся пробирках в среде, содержащей смесь коровьей амниотической жидкости (85%), эмбрионального экстракта (10%) и сыворотки (5%). Было замечено, что в такой культуре происходит спонтанная дегенерация клеток на 7—10-й день наблюдения. Последующие пассажи дегенерировавшей ткани на клетках перевиваемой линии HeLa и других тканях выявили наличие вируса, обладающего своеобразными свойствами. Выделенные новые штаммы вируса от клинически здоровых детей были отнесены к группе «латентных» и получили название «агентов аденоидной дегенерации». Вскоре было установлено, что такие же вирусы часто обнаруживаются не только в аденоидной ткани и миндалинах клинически здоровых детей, но и выделениях больных острым фарингитом и конъюнктивитом. Тогда вирусы получили второе название «аденоидно-фаринго-конъюнктивальных вирусов».
Независимо от первых исследователей Хиллеман и Вернер (1954), изучая этиологию заболеваний органов дыхания у военнослужащих, нашли, что часть заболеваний, протекающих по типу острых катаров дыхательных путей и атипичных пневмоний, связана с новым, ранее неизвестным вирусом, названным R1-67. Этот вирус удалось выделить от больных и вырастить в культуре ткани, в частности в клетках HeLa. В дальнейшем обе группы исследователей показали сходство изучаемых вирусов и нашли, что они могут быть выделены как от здоровых людей, так и от больных различными заболеваниями с преимущественным пораженцем дыхательных путей.
Первоначальные названия вирусов были заменены в 1956 году общим групповым названием «аденовирусы». В наст. время известно не менее 32 серотипов аденовирусов, выделенных от человека.
Аденовирусы имеют величину от 70 до 90 нм. Внутренняя структура вирусной частицы — вириона — состоит из наружной белковой мембраны и внутренних субъединиц величиной около 7 нм (рис. 1 и 2). Число субъединиц, называемых капсомерами, у всех исследованных аденовирус имеет постоянную величину и равно 252. Вирионы имеют кубическую исосаэдральную структуру. Аденовирусы содержат двунитчатую ДНК с молекулярным весом 20—25 млн. дальтон, составляющую 12—14% массы вириона с меньшим содержанием аденина и тимидина (43%), чем гуанина и цитозина (57%). В случае выраженной онкогенной активности (12-й и 18-й серотипы) соотношение гуанина к цитозину падает до 48—49% против 50—60% у неонкогенных аденовирусов. Белок составляет 87% массы очищенного вириона с молекулярным весом менее 35 000. Липиды, углеводы, собственные энзимы отсутствуют.
Содержание
Действие физических и химических факторов
Антигенная структура
С помощью хроматографии и электрофореза выделены три различных растворимых антигена, отличающихся по иммунологическим свойствам и связанных с различными морфологическими субъединицами вируса.
1. А-антиген, гексон,— групповой, общий для всех серотипов вируса антиген, локализованный в 240 капсомерах капсида, каждый из которых граничит с шестью соседними капсомерами, что определило название антигена (hexon). Антитела против очищенного гексонного антигена нейтрализуют инфекционные свойства только гомологичного серотипа. В то же время эта сыворотка реагирует в реакции связывания комплемента с любыми гетерологичными серотипами, так как в составе гексонного антигена имеются две реактивные группы, одна из которых стимулирует образование группоспецифических, а другая — типоспецифических антител.
2. В-антиген, пентон,— токсический антиген, вызывающий округление и скучивание (агрегация) чувствительных клеток однослойной культуры и отделение клеток с поверхности стекла. Локализован в капсомерах, расположенных на вершине двенадцати угловых участков вириона, каждый из которых граничит с пятью соседними капсомерами (pepton). Чувствителен к действию трипсина. Ингибирует активность интерферона (см.) и повышает тяжесть ассоциированных респираторных инфекций.
3. С-антиген — нитевой (fiber) антиген, имеет морфологически форму нити с узловым утолщением, прикрепленной к пентонному антигену. Представляет собой типоспецифический антиген, устойчив к действию трипсина, способствует адсорбции аденовирусов на эритроцитах обезьяны или крысы и их агглютинации.
Цикл размножения
Адсорбция аденовирусов на чувствительных клетках тканевой культуры занимает 4—6 час., после чего вирус проникает в цитоплазму с помощью пиноцитоза. Освобождение нуклеоида (депротеинизация) осуществляется в пиноцитарных вакуолях в течение 60—90 мин., вслед за чем вирусная ДНК транспортируется к ядру клетки. Латентный период репродукции продолжается от 13 до 15 час., когда в ядре синтезируется ДНК, а на цитоплазматических рибосомах — вирусные белки. Через 16 час. после заражения возникают зрелые структурные частицы, сборка которых происходит в ядрах клеток. Но более 10—15% вирусных ДНК и белков тканевой культуры используется для синтеза вирионов, вся остальная масса стимулирует поражения ядер клетки и нарушения синтеза клеточных ДНК и белков, с прекращением деления клеток через 10—11 час. после заражения культуры.
Максимальный выход вируса обеспечивается в случае массивного заражения и инкубации культуры до полного развития цитопатических поражений. Для получения максимального выхода вируса из достаточно сохранившихся клеток их разрушают повторным 3—6-кратным замораживанием и оттаиванием, гомогенизируют ультразвуком или механическим размалыванием. При этом концентрация вируса колеблется в зависимости от серотипа от тысяч до миллиардов частиц в 1 мл тканевой жидкости.
Размножение аденовирусов в тканевых культурах очень часто сопровождается параллельным развитием в ядрах клеток мелких вирионов диаметром около 200 А, икосаэдральной симметрии, получивших наименование аденоассоциированных вирусов (см.). По антигенной структуре и биологическим свойствам они не имеют ничего общего с аденовирусами. Размножение аденоассоциированных вирусов находится в полной зависимости от присутствия аденовирусов, оказавшихся «помощниками» этих, не способных к самостоятельному развитию агентов.
Клеточные поражения
Зараженные аденовирусами клетки округляются и формируют гроздевидные скопления различной величины, облегчающие распознавание агентов данной группы. Цитопатические изменения сопровождаются повышением гликолиза и скоплением органических кислот, подкисляющих тканевую жидкость.
Клеточный лизис отсутствует и зараженные клетки длительное время сохраняют жизнеспособность.
В процессе дегенерации клеток под действием аденовирусов различают две фазы (рис. 3): первая связана с токсическим эффектом, вторая — с истинным размножением вирусов, которое происходит внутри ядер и в цитоплазме. При этом аденовирусы образуют внутриядерные включения из вирусных частиц, которые составляют агломераты кристаллоподобного строения (рис. 4).
Электронномикроскопические исследования Перейры и Валентина (Н. G. Pereira, R. С. Valentine, 1958) показали, что одна цитопатогенная доза вируса содержит от 10 до 103 вирусных частиц.
Размножение в перевиваемых линиях клеток КВ, HeLa, а также в почечных культурах обезьян под агаровым покрытием сопровождается формированием видимых глазом колоний (бляшек) в районе пораженных клеток.
Гемагглютинирующие свойства
Все серотипы аденовируса человека, кроме типа 18, способны агглютинировать эритроциты обезьян резус или крыс. По этому признаку аденовирусы можно классифицировать на следующие четыре подгруппы: первая включает девять серотипов (3, 7, 11, 14, 16, 20, 21, 25, 28), агглютинирующих только эритроциты обезьян; вторая включает двенадцать серотипов (8, 9, 10, 13, 15, 17, 19, 22, 23, 24, 26, 27), агглютинирующих эритроциты крыс; третья — шесть серотипов (1, 2, 4, 5, 6, 12), агглютинирующих эритроциты крыс после взаимодействия с иммунной аденовирусной сывороткой против других типов (например, 6 типа); четвертая включает серотип 18, не способный к гемагглютинации.
Патогенность для человека и животных
В отличие от других респираторных вирусов, аденовирусы размножаются не только в цилиндрическом мерцательном эпителии верхних дыхательных путей, трахеи и бронхов, но и в под слизистой оболочке. С участием аденовирусов наиболее часто связано развитие острой респираторной инфекции, протекающей с явлениями ангины, фарингита, кашля, озноба, боли в мышцах, головной боли, при непостоянном насморке и повышении температуры (см. Аденовирусные болезни, Респираторные вирусные болезни).
Наиболее частыми возбудителями оказались первые семь серотипов, а также типы 14 и 21. У грудных детей часто развиваются тяжелые пневмонии, изредка с детальным исходом, вызванные серотипами 1, 2, 3, 7 и 7а.
Еще недавно считалось общепризнанным положение об отсутствии у аденовирусов человека патогенности для животных.
Многочисленные опыты заражения многих видов млекопитающих, включая обезьян, давали либо отрицательные, либо сомнительные результаты. Это остается справедливым для обычных условий получения экспериментальной инфекции, однако при изменении методов исследования получены новые данные. Дженнингс и Беттс (A. R. Jennings, А. О. Betts, 1962) адаптировали аденовирусы 1, 2, 4 и 6 серотипов к культуре ткани свиной почки. Затем интратрахеально заражали поросят, рожденных и выращенных в стерильных условиях в безмикробной внешней среде. На 4-й день после заражения у большинства животных развилась бронхопневмония с выраженной лимфоидной гиперплазией.
Интраназальное или подкожное заражение взрослых сирийских хомяков, собак, кроликов, а также новорожденных мышей и крыс вирусами 3, 4, 5, 7, 12, 18 типов приводило к развитию бессимптомных инфекций.
В ряде лабораторий нередко выделяются аденовирусы от больных вирусным гепатитом как из кала, так и из крови. Возможно, аденовирусы являются спутниками истинного возбудителя, но нельзя исключить и наличие у некоторых штаммов определенного гепатотропизма. Заслуживает внимания работа Л. Г. Руденко и др. (1972), где показана восприимчивость новорожденных хомяков в возрасте до 5 суток к аденовирусу 1 типа (штамм 1237) при подкожном заражении. У зараженных хомяков развивается гепатит и происходит избирательная репродукция вируса в печени.
Онкогенные свойства
Способность аденовирусов человека вызывать развитие злокачественных опухолей (сарком) у новорожденных сирийских хомяков, зараженных подкожно массивной дозой активного вируса, впервые выявлена у серотипа 12. Онкогенные свойства подтверждены сейчас у семи других типов аденовирусов человека, а также у шести типов от обезьян и у одного от птиц. Наибольшую активность проявили серотипы 12, 18 и 31; тип 12 вызывал опухолевый рост, помимо хомяков, также у новорожденных крыс, диких африканских грызунов Mastomys и некоторых линий мышей. В образовавшихся опухолях инфекционные частицы аденовирусов отсутствовали.
Злокачественная трансформация клеток наблюдалась также в опытах in vitro при заражении типом 12 нормальных эпителиальных клеток культуры почек новорожденных сирийских хомяков, а также фибробластов зародыша крысы. Через 3—10 нед. после инокуляции культур массивной дозой вируса развивался рост опухолевых клеток, свободных от инфекционного вируса. Клетки, трансформированные in vivo или in vitro, содержали два новых антигена: Т-антиген (неоантиген) и трансплантационный (TSTA) антиген. Их продукция индуцируется частью ДНК опухолеродного А. Весьма большой мол. вес ДНК аденовируса (более 20 млн. дальтон) обеспечивает возможность кодирования синтеза более 50 различных белков. Т-антиген, обнаруживаемый нерегулярно в ранние этапы обычной цитолитической инфекции, постоянно присутствует в опухолевых клетках и стойко передается при их культивировании in vitro. Обнаруживается в реакции связывания комплемента и по иммунофлуоресценции с сыворотками хомяков с развивающейся опухолью, которые не взаимодействуют со структурными белками вирусов. Т-антиген малоустойчив к нагреванию, воздействию кислоты и щелочи, не содержит РНК или ДНК, имеет мол. вес 78 000 дальтон.
По антигенным свойствам различают Т-антиген группы А (высокоонкогенные аденовирусы 12, 18 и 31 серотипов) и группы В (слабоонкогенные аденовирусы 3, 7, 11, 14, 16 и 21 серотипов). Попытки обнаружить Т-антиген групп А и В в опухолевых клетках и гомологичные для них антитела в сыворотках людей, болеющих раком различной локализации, дали отрицательный результат. В опухолевой ткани хомяков этот антиген присутствует в весьма высокой концентрации и легко обнаруживается с помощью флуоресцирующих антител в каждой опухолевой клетке.
Выделение аденовирусов осуществляется заражением чувствительных тканевых культур отделяемым из полости носа, зева, конъюнктивы, а также кишечным содержимым. Аденовирусы лучше размножаются (с развитием характерных цитопатических изменений) в перевиваемых эпителиальных культурах (HeLa, КВ, НЕр-2), а также в первичной культуре эмбриональной почки человека; слабее размножаются в первичных эпителиальных культурах человеческой трахеи, амниона, почечной ткани обезьян и кроликов. Оптимальный метод выделения — заражение первичной клеточной культуры эмбриональной почки человека с пассажами на перевиваемых линиях после адаптации вируса.
Серологическая идентификация выделенных штаммов
Для отнесения к группе аденовирусов выделенные агенты дифференцируются иммунологически путем установления общего группового антигена в РСК или в реакции преципитация (по методу диффузия в агаровом геле). Определение серотипа проводится с помощью реакции торможения гемагглютинации или нейтрализации. Для идентификации серотипа выделенного штамма определяют его принадлежность к одной из четырех подгрупп по гемагглютинации, после чего ставят реакцию торможения гемагглютинации (РТГА) с иммунными сыворотками кроликов или лошадей, обработанными каолином и истощенными чувствительными для данной подгруппы эритроцитами. Результаты РТГА проверяют в реакция нейтрализация на тканевых культурах с гомологичной иммунной сывороткой (см. Вирусологические исследования).
В современной классификации вирусов человека аденовирусы занимают самостоятельное положение среди ДНК-содержащих вирусов, четко дифференцируясь от других сочленов этой группы по свойствам вирионов.
Библиография
Руденко Л. Г. и др. Динамика репродукции аденовируса в печени новорожденных хомяков и изменение гуморальных факторов иммунитета при экспериментальном аденовирусном гепатите, Вопр. вирусол., № 3, с. 269, 1972; Смородинцев А. А. и Коровин А. А. Грипп, с. 73, Л., 1961, библиогр.; Шубладзе А. К. и др. Некоторые итоги изучения штаммов вирусов, выделенных от больных эпидемическим гепатитом, Всстн. АМН СССР, № 6, с. 49, 1963; Buescher Е. L. Respiratory disease and adenoviruses, Med. Clin. N. Amer., v. 51, p. 779,1967; Enderb J. P. a. o. Adenoviruses, Science, v. 124, p. 119, 1956; Ginsberg H. S. Identification and classification of adenoviruses, Virology, v. 18, p. 312, 1962, bibliogr.; Hilleman M. R. a. Werner J. H. Recovery of a new agent from patients with acute respiratory illness, Proc. Soc. exp. Biol. (N. Y.), v. 85, p. 183, 1954, bibliogr.; HuebnerR. J., Rowe W. P. a. Сhanосk R. M. Newly recognized respiratory tract viruses, Ann. Rev. Microbiol., v. 12, p. 49. 1958, bibliogr.; Pereira H. G. a. Valentine R. C. Infectivity titrations and particle counts of adenovirus type 5, J. Gen. Microbiol., v. 19, p. 178, 1958, bibliogr.; Rose H. M. Adenoviruses, в кн.: Diagnostic rocedures for viral a. ricket. infections, ed. у E. H. Lennette a. N. J. Schmidt, p. 205, N. Y., 1969;Rosen L. Hemagglutination-inhibition techniques for typing adenoviruses, Amer. J. Hyg., v. 71, p. 120, 1960; Sohier R., C hard onnet Y. a. Prunieras M. Adenoviruses. Progr. med. Virol., v. 7, p. 253, 1965, bibliogr.