72 часовая культура лимфоцитов периферической крови g окраска что это
Анализ кариотипа. Исследование кариотипа. Сдать кровь на кариотип. Кариотип цена
Что такое кариотип?
Лаборатории ЦИР проводит следующие анализы кариотипирования:
Когда сдается кровь на кариотип?
Обследование на кариотип является нерутинным анализом, к прохождению которого имеются свои показания.
Причинами, по которым доктор может предложить обследование могут быть:
Какой сдать анализ на кариотип?
Анализ на кариотип супружеской пары (кариотипирование супругов)
Для выявления возможной причины бесплодия в семье врач может назначить кариотипирование супругам. Супруги могут сдать анализ в разное время, это не влияет на интерпретацию. При наличии предположения о генетической природе бесплодия анализ на кариотип может быть назначен одному из супругов. Подробнее о кариотипировании супругов.
Как сдать анализ на кариотип? Где сдать анализ на кариотип?
Анализ на кариотип можно сдать в лаборатории ЦИР в любой из наших клиник. Специальная подготовка к анализу не требуется. Можно сдать не натощак. Анализ кариотипа без/с аберраций принимаем в определенные часы, просьба ознакомиться на страницах анализа: анализ без аберраций; анализ с аберрациями.
Кариотип: цена анализа
Узнайте цену анализа на кариотип в нашем прайс-листе, раздел «Цитогенетические исследования».
Анализ кариотипа: как проводится исследование кариотипа человека?
Для процедуры определения кариотипа цитогенетическим методом могут быть использованы любые популяции делящихся клеток. Для определения человеческого кариотипа используют, как правило, лимфоциты периферической крови. Для анализа кариотипа в стерильную пробирку берется кровь из вены. Каких-либо условий для сдачи анализа нет, перед посещением лаборатории можно позавтракать.
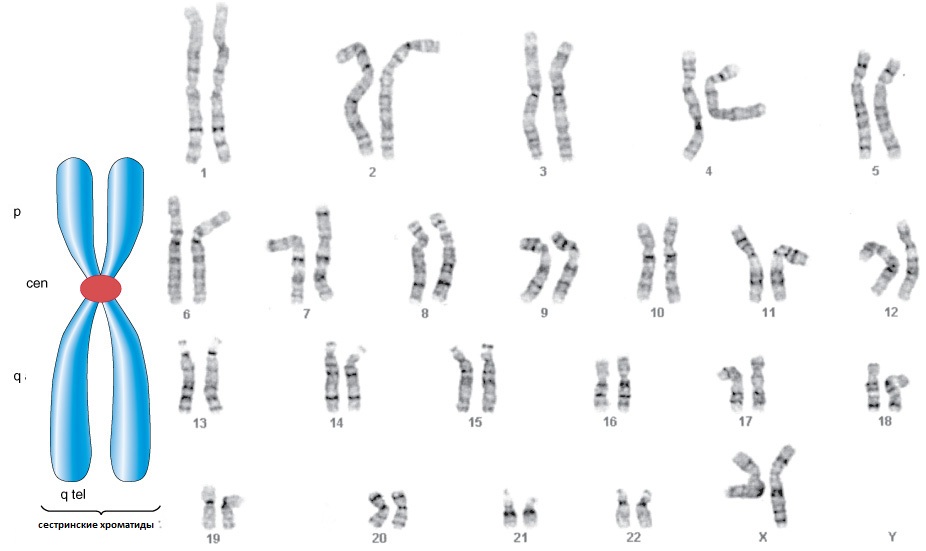
После фиксации препараты метафазных хромосом окрашивают и изучают под микроскопом.
Для получения классического кариотипа используется окраска хромосом различными красителями или их смесями: в силу различий в связывании красителя с различными участками хромосом окрашивание происходит неравномерно и образуется характерная полосчатая структура (комплекс поперечных меток, англ. banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов, локализуются различные аллельные варианты генов). Первый метод окраски хромосом, позволяющий получить такие высокодетализированные изображения, был разработан шведским цитологом Касперссоном (Q-окрашивание). \\Используются и другие красители, такие методики получили общее название дифференциального окрашивания хромосом.
Типы дифференциального окрашивания хромосом
G-окрашивание — модифицированное окрашивание по Романовскому — Гимзе. Чувствительность выше, чем у Q-окрашивания, поэтому используется как стандартный метод цитогенетического анализа. Применяется при выявлении небольших аберраций и маркерных хромосом (сегментированных иначе, чем нормальные гомологичные хромосомы).
Q-окрашивание — окрашивание по Касперссону акрихин-ипритом с исследованием под флуоресцентным микроскопом. Чаще всего применяется для исследования Y-хромосом (быстрое определения генетического пола, выявление транслокаций между X- и Y-хромосомами или между Y-хромосомой и аутосомами, скрининг мозаицизма с участием Y-хромосом).
R-окрашивание — используется акридиновый оранжевый и подобные красители, при этом окрашиваются участки хромосом, нечувствительные к G-окрашиванию. Используется для выявления деталей гомологичных G- или Q-негативных участков сестринских хроматид или гомологичных хромосом.
C-окрашивание — применяется для анализа центромерных районов хромосом, содержащих конститутивный гетерохроматин и вариабельной дистальной части Y-хромосомы.
T-окрашивание — применяют для анализа теломерных районов хромосом.
Хромосомный микроматричный анализ (ХМА)
Более современная технология исследования кариотипа. Анализ на кариотип выполняется молекулярно-генетическим методом aCGH (микроматричная сравнительная геномная гибридизация), который в отличие от классического цитогенетического метода, имеет высокую разрешающую способность, позволяющую обнаружить более мелкие структурные изменения кариотипа.
Флюоресцентная гибридизация in situ, англ. Fluorescence in situ hybridization, FISH
В последнее время используется методика так называемого спектрального кариотипирования (флюоресцентная гибридизация in situ, англ. Fluorescence in situ hybridization, FISH), состоящая в окрашивании хромосом набором флуоресцентных красителей, связывающихся со специфическими областями хромосом. В результате такого окрашивания гомологичные пары хромосом приобретают идентичные спектральные характеристики, что не только существенно облегчает выявление таких пар, но и облегчает обнаружение межхромосомных транслокаций, то есть перемещений участков между хромосомами — транслоцированные участки имеют спектр, отличающийся от спектра остальной хромосомы.
Исследование кариотипа (количественные и структурные аномалии хромосом) по лимфоцитам периферической крови (1 человек)
Цитогенетическое исследование – кариотипирование – является основным методом диагностики хромосомных нарушений и проводится в целях выявления нарушений количества и структуры хромосом. Используется для пренатальной диагностики.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Кариотипирование – цитогенетическое исследование, изучение хромосомного набора человека, позволяющее обнаружить отклонения в структуре и числе хромосом. Оно помогает выявить нарушения хромосом, вероятно, не влияющие на здоровье человека, но тем не менее важные для планирования будущей беременности и для здоровья будущего ребенка (патологии плода, аномалии развития).
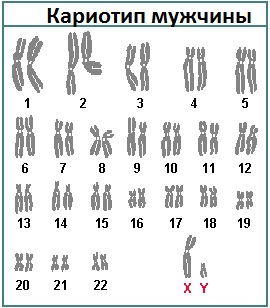
Кариотип – это полный хромосомный набор клетки человека. В норме он состоит из 46 хромосом, из них 44 аутосомы (22 пары), имеющих одинаковое строение и в мужском, и в женском организме, и одна пара половых хромосом (XY у мужчин и XX у женщин). Каждая хромосома несет гены, ответственные за наследственность. Кариотип 46, ХХ – соответствует нормальному женскому кариотипу, а кариотип 46, XY – это нормальный мужской кариотип. Кариотип остается неизменным в течение всей жизни.
Нарушения хромосомного набора могут являться причиной наследственной патологии, бесплодия, невынашивания беременности, рождения ребенка с различными пороками развития.
Хромосомные аберрации (отклонения от нормы), нарушая баланс наследственных факторов, являются причиной многообразных отклонений в строении и функциях организма, проявляющихся в так называемых хромосомных болезнях. Около 170 из 1000 эмбрионов погибают до рождения, в 40% причиной являются хромосомные нарушения.
Для цитогенетического исследования хромосом чаще всего используют препараты кратковременной культуры крови, реже клетки костного мозга и культуры фибробластов.
Кариотипирование культуры лимфоцитов периферической крови человека – сложное многоступенчатое цитогенетическое исследование, проводится, когда клетки входят в фазу митоза – непрямого деления с тождественным распределением генетического материала между дочерними клетками. Оно включает в себя следующие этапы:
Различают несколько видов нарушений структуры хромосом:
Хромосомные аберрации различаются также по принципу регулярности. Регулярные мутации присутствуют при делении каждой клетки или большинства клеток. Они проявляются в момент зачатия плода либо в первые несколько дней беременности. Нерегулярные аберрации появляются в результате негативного воздействия радиации, химических средств и т.д.
Нарушение расхождения хромосом может произойти во время клеточного деления (мейоза). Если такое нарушение происходит в процессе образования сперматозоидов или яйцеклеток, то в половой клетке появляется лишняя хромосома, которая при зачатии будет передана ребенку. В результате она будет присутствовать во всех клетках организма ребенка. Примером трисомии может служить синдром Дауна (лишняя 21-я хромосома) или синдром Патау (трисомия 13-й хромосомы). Также нарушение расхождения хромосом может произойти при первых делениях оплодотворенной яйцеклетки. Например, утрата Х-хромосомы приводит к развитию Х0-синдрома, или синдрома Шерешевского – Тернера. Аномалии, связанные с нарушением расхождения хромосом, встречаются не так часто, поэтому вероятность их повторения в одной и той же семье достаточно мала.
Структурные же нарушения хромосом передаются по наследству, при этом степень семейного риска и дальнейшая передача дефекта от поколения к поколению становится значительно высокой.
Кариотипирование рекомендуют проводить в тех семьях, где есть высокая вероятность рождения ребенка с болезнью, сцепленной с Х-хромосомой. Например, дальтонизм – многие гены, участвующие в процессе цветовосприятия, находятся на Х-хромосоме, что является причиной возникновения дальтонизма у мужчин, а не у женщин, поскольку Х-хромосома у мужчин одна. Следовательно, если женщина носительница гена заболевания, то вероятность данного заболевания у ее сыновей равна 50%. Дочери этой женщины сами будут здоровы, но с вероятностью 50% будут носительницами дефектного гена.
Когда назначается исследование?
Показания для кариотипирования супружеских пар:
Показания для кариотипирования детей:
Что означают результаты?
В соответствии с выявленными нарушениями (или их отсутствием) составляется заключение, включающее оценку генетического риска.
Литература
Подписка на новости
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
72 часовая культура лимфоцитов периферической крови g окраска что это
здоровым людям (взрослым и детям) для оценки индивидуальных показателей иммунограммы в стабильном, здоровом состоянии. Это необходимо знать для оценки иммунного статуса пациента при заболевании в сравнении с его границами нормальных показателей. Для каждого пациента более информативна именно индивидуальная норма, нежели показатели границ нормальных колебаний из стандартного бланка анализа. В этом аспекте как раз и повышается значимость наблюдений за изменениями иммунологических показателей в динамике.
пациентам (взрослым и детям), страдающим тем или иным заболеванием (как в стадии обострения, так и при хроническом течении), для возможности сделать вывод о наличии изменений в иммунном статусе, вызванных заболеванием. При обнаружении существенных отклонений иммунного статуса от нормы в двух и более показателях, даже при отсутствии симптомов болезни, пациент относится к группе повышенного риска развития иммунопатологии.
женщинам с привычным невынашиванием беременности, при бесплодии, в том числе неясного генеза, при многократных имплантационных потерях, как однократное самопроизвольное прерывание беременности, так и привычная потеря плода в естественном цикле и после применения ВРТ (ЭКО). Это позволяет выявить особенности иммунного статуса у женщин с такими проблемами и подобрать терапию при подготовке к беременности.
женщинам и мужчинам с рецидивирующими смешанными инфекциями урогенитального тракта для исключения нарушений в системном иммунитете и развитии вторичных иммунодефицитных состояний, которые часто становятся причиной хронизации инфекционных процессов и развития резистентности к общепринятой терапии
Основные показания к назначению анализа:
рецидивирующие инфекции, инфекционные заболевания с хроническим и затяжным течением (в том числе ВИЧ, гепатиты В и С, герпес, ВПЧ);
частые простудные заболевания (бронхиты, синуситы, отиты);
хронические тонзиллиты, гаймориты;
аллергические заболевания (крапивница, бронхиальная астма, атопический дерматит, поллиноз и др.);
подозрение на генетически обусловленный (первичный иммунодефицит, ПИД) или приобретённый иммунодефицит (вторичный иммунодефицит, ВИД);
подозрение на синдром приобретённого иммунодефицита (СПИД);
обследование реципиентов до и после трансплантации органов;
обследование пациентов перед серьёзными оперативными вмешательствами; осложнённое течение послеоперационного периода;
Возможные причины повышения и снижения показателя
Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при T-клеточных лейкозах. Увеличение относительного показателя встречается при некоторых вирусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний. Может повышаться при приёме биологически активных добавок, длительном приёме лекарственных препаратов (особенно монотерапии), интенсивном занятии спортом и при беременности.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета. Выявляется при воспалениях разнообразной этиологии; вирусных, грибковых и паразитарных хронических инфекциях; аутоиммунных заболеваниях; доброкачественных и злокачественных новообразованиях; после травмы, операций, инфаркта, кровоизлияний, ожогов, стрессов; при курении, алкогольном циррозе печени, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является однозначным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Повышение выявляется при острой фазе аллергии, при ряде Т-клеточных лимфом, практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции.
Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях, иммуносупрессивной терапии.
Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных (особенно цитомегаловирусной инфекции и хроническом вирусном гепатите) и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, остром и хроническом стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях, сепсисе, гемофилии, малярии, шистосомозе, инфекционном мононуклеозе, кори, язвенном колите, перитоните, иммунодефиците с тимомой. Является однозначным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
NK-клетки способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных и вирусных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, хроническом стрессе, дефиците цинка.
Т-лимфоциты, экспрессирующие маркеры NK-клеток
Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Т-клетки активированные (CD3+HLA-DR+D45+)
Маркер поздней и длительной активации клеток, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
В норме клетки с подобным фенотипом в кровотоке присутствуют в незначительном количестве. Они представляют собой высокодифференцированные клетки памяти
Лейкоцитарная формула с обязательной «ручной» микроскопией мазка крови (венозная кровь) (венозная кровь) в Москве
Приём и исследование биоматериала
Когда нужно сдавать анализ Лейкоцитарная формула с обязательной «ручной» микроскопией мазка крови (венозная кровь)?
Подробное описание исследования
В лейкоцитарной формуле определяют следующие виды лейкоцитов:
Исследование по подсчету лейкоцитарной формулы в Лаборатории Гемотест проводится на автоматических гематологических анализаторах, в которых используется современная технология проточной цитофлуориметрии, кондуктометрии. Анализатор оценивает 10000 клеток в одном образце, определяя размеры, структурные, цитохимические и другие характеристики. После этого производится обязательная микроскопия окрашенного мазка крови, для определения морфологической характеристики лейкоцитарных клеток. При выявлении патологии в цитоплазме или ядре клеток, эта информация обязательно указывается в примечании к анализу. При микроскопии лейкоцитарной формулы используют окраску по Романовскому. При подсчете лейкоцитарной формулы используют лабораторные клавишные счетчики. В мазке подсчитывают 100 лейкоцитарных клеток с последующим выведением процентного, и абсолютного количества клеток, исходя из общего количества лейкоцитов.
Учитывая, что автоматический и ручной метод подсчета обладают разной погрешностью и воспроизводимостью, более диагностичным является автоматический подсчет клеток. При микроскопии происходит дифференцировка незрелых форм гранулоцитов на промиелоциты, миелоциты и метамиелоциты, указываются палочкоядерные нейтрофилы, плазматические клетки и, при обнаружении, отмечаются лимфоциты разной степени зрелости, значительная вариация размеров клеток лимфоидного ряда; полиморфизм ядер лимфоцитов; краевая базофилия и вакуолизация цитоплазмы лимфоцитов, неровный контур ядра и цитоплазмы. При визуальном дифференциальном подсчете имеются три главных источника ошибок: неравномерное распределение клеток в препарате, нераспознование клеток и наличии погрешности при повторных анализах. Данный метод сложно стандартизировать и устранить «человеческий» фактор аналитических ошибок. Преимуществом данного анализа является визуальная оценка морфологии клеток лейкоцитарного ряда врачом КЛД.
Венозная кровь считается лучшим материалом для лабораторных исследований:
Подготовка к исследованию
Кровь следует сдавать в утренние часы натощак (или в дневные/вечерние часы, спустя 4-5 часов после последнего приема пищи). За 1-2 дня до исследования исключить из рациона продукты с высоким содержанием жиров.
Согласно ГОСТ Р 53079.4-2008 показания к взятию капиллярной крови возможны у новорожденных, у пациентов с очень мелкими или труднодоступными венами, при ожогах большой площади, выраженном ожирении пациента.
Биоматериал для исследования:
Взятие капиллярной крови на исследования проводится только детям до 7 лет (по особым показаниям)!
Иммунофенотипирование в диагностике острых лейкозов
Санкт-Петербургский Медицинский Университет им. акад. И.П.Павлова, Санкт-Петербург, Российская Федерация
Резюме
На сегодняшний день иммунофенотипирование онкогематологических заболеваний представляет собой одно из наиболее востребованных клинических приложений проточной цитометрии. Рассмотрены основные критерии выявления лейкозных бластов, верификации их линейной принадлежности и определения аберрантности фенотипа с использованием преимуществ многоцветного анализа.
Резюме
На сегодняшний день иммунофенотипирование онкогематологических заболеваний представляет собой одно из наиболее востребованных клинических приложений проточной цитометрии. Рассмотрены основные критерии выявления лейкозных бластов, верификации их линейной принадлежности и определения аберрантности фенотипа с использованием преимуществ многоцветного анализа.
Лабораторная диагностика ОЛ начинается с выявления в периферической крови, костном мозге, и, реже, спинномозговой жидкости бластных клеток, которые идентифицируются методом световой микроскопии. Подробное морфологическое и цитохимическое описание разных типов бластов в настоящее время обязательно присутствует в каждом руководстве по онкогематологии, но фактически требует от патолога значительного опыта и далеко не всегда дает однозначную оценку бластов. Детально разработанная в конце 70-х годов (1976-1980) гематологами и патологами Франции, США и Великобритании ФАБ-классификация (France-America-Britain) разделила острые лейкозы на лимфобластные и нелимфобластные (миелобластные). При оценке бластов миелоидного происхождения морфологические критерии ФАБ-классификации достаточно информативны, однако, для верификации бластов лимфоидного происхождения их применение признано нецелесообразным (ВОЗ, 2000). В настоящее время основой для диагностики гемобластозов (заболеваний, связанных с пролиферацией гемопоэтических клеток предшественников и клеток крови на разных стадиях дифференцировки) служит классификация ВОЗ 2000г.
Годы активного внедрения ФАБ-классификации в клиническую онокогематологию одновременно стали временем объединения фундаментальных открытий в биологии и биотехнологии, временем накопления знаний о путях дифференцировки клеток костного мозга, о роли Т- и В-лимфоцитов в развитии онкогематологических заболеваний, об особенностях лейкозных клеток. Поистине революционное значение для диагностической иммунологии и гематологии оказала разработка методов получения моноклональных антител, что было подтверждено в 1984 присуждением Нобелевской премии Kohler и Milstein вместе с Jerne за вклад в развитие теоретической иммунологии и биотехнологии. Создание гибридом вобрало в себя основные положения теории антителообразования: клональный принцип строения лимфоидной ткани, моноспецифичность антител, функционирование генов иммуноглобулинов только в лимфоидных клетках и их производных. Применение моноклональных антител в диагностике позволило охарактеризовать структуру и функцию линейно-ассоциированных и дифференцировочных антигенов, а затем и антигенов, экспрессия которых обусловлена активацией и пролиферативной активностью клеток. В 80-е годы прошлого века острый лейкоз рассматривался как блок дифференцировки клетки на определенной стадии ее развития, поэтому и варианты лимфобластных лейкозов получали свое название соответственно той стадии дифференцировки, антигены которой выявлялись на бластах в первую очередь. Дифференцировочный статус гемопоэтических новообразований определялся как «замороженная» стадия онтогенеза, т.е. аксиомой было сохранение опухолью направления и стадии дифференцировки клетки-предшественницы. Догмой онкогематологии было представление о том, что опухоли гемопоэтической системы представляют собой наиболее яркий пример сохранения дифференцировочного/антигенного статуса нормальных клеток при их опухолевой трансформации. И это рассматривалось как исключение из правила классической онкологии, согласно которому нарушение гистотипа с более или менее выраженной утратой тканевой специфичности является характерным признаком эпителиальной опухоли.
В настоящее время сохранение дифференцировочного статуса при всех формах гемобластозов расценивается как свидетельство существования различных форм взаимодействия трансформации и дифференцировки. Стало очевидно, что клональность происхождения не означает неизменности характеристик лейкозных бластов в течение болезни: антигенный дрейф, или изменение антигенной экспрессии в течение заболевания или в ответ на адекватную терапию является одним из отражений опухолевой прогрессии. Сохранение гемобластозами дифференцировочного статуса клетки-предшественницы в основном связано с тем, что опухолевая трансформация гемопоэтических клеток включает (запускает) механизмы нормальной дифференцировки и опирается на них. Эти механизмы участвуют как в самом процессе трансформации (ошибки физиологических рекомбинаций), так и в поддержании опухолевого фенотипа (активация протоонкогенов, блокировка созревания и т. д.). Одной из характеристик лейкозной клетки является ее способность избегать уничтожения либо за счет увеличения пролиферативного потенциала, либо за счет изменения продолжительности жизни. Клетка теряет способность воспринимать физиологические сигналы о необходимости прекращения функции, о необходимости к переходу в другое состояние для обеспечения поддержания нормального гомеостаза организма. Говоря иными словами, клетка учится избегать старения, увядания, т.е. всего того, что приводит ее к смерти. Необычно высокая экспрессия белков гиперсемейства генов, контролирующих клеточную гибель, вызывает изменение срока жизни клетки, популяции и влияет на эффективность отдельных видов химиотерапии. Баланс активности проапоптотических и антиапоптотических генов является в какой-то мере определяющим в формировании клинической картины лейкоза и особенностей его прогрессии. Тесное взаимодействие трансформации и дифференцировки является, по-видимому, уникальной особенностью гемобластозов и создает возможность их «дифференцировочной» терапии. Широкое, быстро превращающееся в рутинное использование моноклональных гуманизированных антител для терапии онкогематологических заболеваний подтверждает это положение. Моноклональные антитела, специфичные к антигенам опухолевых клеток-мишеней, становятся препаратами выбора для отдельных форм лимфопролиферативных заболеваний (Rituximab, Genistein, Campath и другие).
Иммунодиагностика гемобластозов основана на сопоставлении морфофункциональных характеристик лейкозных бластов и нормальных/нетрансформированных клеток гемопоэза. Известно, что нормальный процесс дифференцировки клеток в костном мозге и/или тимусе происходит с определенной, достаточно постоянной скоростью, определяемой потребностью организма в кроветворных и иммунокомпетентных клетках. По мере функционального созревания лимфоидных и миелоидных клеток происходит перестройка генов, кодирующих специфические рецепторы клеток, а значит, происходит изменение набора рецепторов для различных факторов роста, дифференцировки и межклеточного взаимодействия. По набору мембранных и цитоплазматических антигенов можно установить линейную принадлежность, стадию зрелости и функциональное состояние клетки. С начала 80-х годов ХХ века, когда развитие моноклональных антител пошло по экспоненте, стало возможным нарастающее по сложности иммунофенотипирование. Затем, качество реагентов и оборудования улучшилось, как следствие, методики стали проще и воспроизводимее. были разработаны программы внешнего контроля качества типирования ОЛ. К настоящему времени ИФТ превратилось в быстрый и полезный способ получения подробной характеристики опухолевых клеток, необходимой для диагностики ОЛ. Сходство между лейкозными и нормальными клетками позволяет установить линейность и стадию созревания патологических клеток, что необходимо для иммунофенотипического диагноза, классификации и прогностической оценки различных типов онкогематологических заболеваний. Фенотипические аберрации, характеризующие лейкозные клетки, позволяют выявлять случаи с максимальной вероятностью специфических генетических поломок, для подтверждения которых необходима молекулярная диагностика.
Для количественного определения популяционного состава лейкоцитов используется способность их рецепторов взаимодействовать со специфическими антителами с образованием стабильных комплексов на поверхностной мембране клетки. Фактически, как это часто бывает в жизни, мы определяем вещи (в данном контексте клетки) по признакам, не имеющим ничего общего с их функциями. Так и молекулы на мембране или внутри клеток, делая доступным и простым их распознавание по признаку антигенности, могут выполнять функции, отличные от иммунных.
На основании классической реакции антиген-антитело разработано довольно много способов количественного учета клеток, часть из которых имеет сугубо историческое значение, другие применяются в основном для научных исследований. Для практических целей максимально адаптированы и дают наиболее воспроизводимые результаты иммуноцитохимия (световая и люминесцентная микроскопия) и проточная цитометрия (рис.1). Однако не только в клинически сложных случаях, но и в повседневной практике микроскопирование все чаще уступает место проточной цитометрии, ставшей основным методом ИФТ в диагностике гемобластозов.
Выявление лейкозных бластов
Выявление лейкозных бластов в периферической крови и/или костном мозге методом проточной цитометрии основано на отличии их фенотипа от фенотипа неизмененных клеток. Нормальные клетки, сохраняющиеся в некотором количестве даже при выраженной опухолевой экспансии, могут использоваться как внутренний стандарт антигенной экспрессии. Именно уровень антигенной экспрессии и физические характеристики определяют местоположение каждой популяции клеток в многомерном пространстве проточной цитометрии.
При работе с бластными популяциями обогащение образца, т.е. отбор определенных, интересующих клеток можно проводить двумя путями:
o сохраняет возможность анализа образца в целом, всех составляющих его популяций;
o дает возможность выбрать любую нужную популяцию и определить ее иммунофенотипический профиль при дальнейшем, более прицельном анализе, не теряя дополнительное время на выделение суспензии мононуклеаров.
При диагностике гематологических заболеваний предпочтительно использовать селективное гейтирование, в частности, по панлейкоцитарному маркеру CD45. Гейтирование по гистограмме SSC/CD45 является удобным средством идентификации патологических клеток, так как обычно бласты занимают (на гистограмме SSC/CD45) такое положение, где располагается очень мало здоровых клеток. Особенно ярко это видно на образцах периферической крови (рис.2). При гейтировании по CD45 следует соблюдать определенную осторожность, так как
? ядросодержащие эритроидные клетки костного мозга, равно как и некоторые лейкозные клетки могут быть отрицательны по этому антигену;
? при Т-клеточных опухолевых процессах интенсивность СD45 очень высока, но для дифференциальной диагностики этот факт имеет ограниченную ценность;
При цитопении неясной этиологии и при отсутствии клеток волосатоклеточного лейкоза (ВКЛ) с классической морфологией использование гистограммы SSC/CD45 может помочь выявить популяцию опухолевых клеток: трансформированные клетки располагаются в обычном месте расположения моноцитов, но средний уровень флюоресценции этих клеток по CD45 выше, чем у нормальных лимфоцитов и даже моноцитов.
Для получения подробной характеристики бластов при лимфобластных лейкозах более специфичным является гейтирование по CD19 или CD7 (соответственно SSC/CD19 и SSC/CD7). Линейно-ассоциированные лимфоидные бласты В- или Т-клеточного происхождения, экспрессирующие соответственно CD19 или CD7, обладают, как и лимфоциты, низким уровнем гранулярности и располагаются в строго определенном пространстве гистограммы. В гистограммах здорового костного мозга это пространство обычно пустует, там не располагаются нетрансформированные клетки (Рис.3). Использование определенного маркера для селективного гейтирования патологической популяции предполагает, что моноклональные антитела к этому маркеру должны быть включены во все пробирки, подготовленные к анализу на проточном цитометре Желательно, чтобы гейтирующий маркер был конъюгирован с флуорохромом для учета по третьему, или, если есть техническая возможность, по четвертому каналу флуоресценции, так как это дает максимальный простор для выбора других маркеров и определения их сочетанной экспрессии внутри патологической популяции.
Однако, даже теоретически, не может быть определен вариант гейтирования, подходящий для всех вариантов злокачественной трансформации гемопоэтических клеток. Поэтому так важно иметь широкий выбор диагностических моноклональных антител для определения фенотипа злокачественных клеток в разных клинических ситуациях. Информация о вариантах гейтирования, применяемых в онкологических центрах всего мира, постоянно публикуется в Интернете в открытом доступе. Необходимо, чтобы накопление опыта селективного гейтирования стало доступно отечественным врачам на родном языке в режиме реального времени (on-line).
При определенных усилиях процессы пробоподготовки (доаналитический этап) и получения данных (собственно аналитический этап) могут быть автоматизированы, что оправдано технически и экономически в крупных гематологических центрах, проводящих в день определение иммунофенотипа патологических клеток у большого количества пациентов (более 20-40 человек). Анализ же полученной информации, установление варианта лейкозной трансформации и соотнесение ее с данными других лабораторных технологий является задачей врача и требует накопления определенного опыта.
Определение количества лейкозных клеток
В большинстве случаев количество бластов указывается в миелограмме, сопровождающей костный мозг, направленный на ИФТ. Однако, на практике, материал стернальной пункции одновременно направляется морфологу для получения детальной миелограммы и иммунологу на иммунофенотипирование для определения варианта лейкоза, т.е. клеточность образца неизвестна. Первым следствием этого является необходимость вносить специфические антитела в некотором избытке, а не из расчета на количество клеток. Затем, для определения уровня бластоза при проточной цитометрии необходимо средствами программного обеспечения отделить собственно клетки от дебриса и от дуплетов клеток (слипшихся клеток), которые могут в разном количестве присутствовать в анализируемом образце. Дуплеты особенно часто наблюдаются при В-лимфопролиферативных заболеваниях и обладают более высокими значениями по светорассеянию и флуоресценции по сравнению с одиночными клетками. Если между временем получения костного мозга (периферической крови) и началом пробоподготовки проходит более двух-четырех часов или были грубо нарушены условия транспортировки, то из анализа должны быть исключены мертвые клетки в связи с их способностью к неспецифическому связыванию антител. В некоторых случаях, при вынужденном длительном хранении образца, в частности, при транспортировке из географически удаленных регионов, селективное гейтирование должно проводится по жизнеспособным клеткам, что может позволить анализировать только функционально сохранные клетки. Для оценки жизнеспососбности клеток анализируемого образца оптимально использование 7AAD (7-аминоактиномицин D), который может быть применен одновременно с антителами, мечеными ФИТЦ и фикоэритрином.
При определении количества лейкозных клеток в костном мозге, надо помнить о возможном разведении образца периферической кровью, что может серьезно влиять на конечный результат определения количества патологических клеток в образце. Характеристика лейкозных клеток
При выявлении в образце неопластических клеток и определении их количества должны быть решены две основные задачи ИФТ гемобластозов:
1) идентификация патологических клеток и
2) иммунофенотипическая характеристика бластов, в том числе
? определение линейной принадлежности бластов и уровня их дифференцировки;
? Определение степени гетерогенности клеток патологической популяции за счет выявления различных патологических клонов или наличия клеток на разных стадиях дифференцировки;
? получение подробной фенотипической характеристики каждой выявленной субпопуляции патологических клеток.
И если первая задача может быть выполнена в течение одного-двух часов, то формулировка диагноза требует иногда гораздо большего времени, особенно при низком уровне бластоза в образце.
Определение линейной принадлежности лейкозных бластов является обязательной частью обследования пациентов с подозрением на гемобластоз. Для этого может быть достаточной оценка экспрессии маркеров скриннинговой панели:
i) линейную принадлежность клеток определяют:
(a) миелоидные маркеры:
МПО, CD13, CD33;
(b) Лимфоидные маркеры:
1. Маркеры Т-лимфоцитов
i. CD2, CD7, cyCD3 и sCD3;
2. Маркеры В-лимфоцитов
i. CD10, CD19, cyCD22 и sCD22.
ii) незрелость клетки характеризуют TdT, CD34, HLA-DR.
Определение линейной коммитированности опухолевых клеток тем проще, чем больше дифферецировочных маркеров выявляется на их мембране. Трудности в определении линейной принадлежности бластов чаще всего связаны с отсутствием экспрессии линейных маркеров на поверхностной мембране клеток и с существованием перекрестной экспрессии линейных антигенов. Поверхностные линейно-ассоциированные маркеры не выявляются при опухолевой трансформации самых ранних клеток-предшествеников гемопоэза или, в отдельных случаях, утрачиваются при опухолевой прогрессии после химиотерапии. При отсутствии экспрессии линейных маркеров на поверхностной мембране клеток необходимо проводить выявление маркеров линейной принадлежности (миелопероксидаза, CD3, CD79a, CD22) в цитоплазме, что требует введения дополнительных шагов в протокол пробоподготовки. Для того, чтобы избежать необходимости последовательного проведения дополнительных окрашиваний, логичнее с самого начала включить в диагностическую панель несколько пробирок для выявления внутриклеточных антигенов. Это требует минимального увеличения времени пробоподготовки за счет фиксации и пермеабилизации, но компенсируется получением абсолютно достоверной информации о линейной принадлежности бластов.
Наиболее специфичным маркером Т-ряда является поверхностный и/или цитоплазматический CD3 и Т-клеточный рецептор (TCR). Предшественники Т-клеток ОЛЛ обычно положительны по CD7 и отрицательны по CD19. Для установления варианта Т-ОЛЛ необходимо оценить экспрессию CD1a, CD2, cyCD3, CD4, CD5, CD8, CD16, CD56, варианта TCR (Табл.2).
Одновременное отсутствие или аномальная реактивность с маркерами CD7 и CD19 при наличии позитивной реакции с миелоидными маркерами является доказательством нелимфоидного происхождения лейкоза даже при отсутствии МРО. Для миелоидных клеток наиболее высокоспецифичными маркерами являются миелопероксидаза и лизоцим. До настоящего времени иммунологическая классификация миелолейкозов до сих пор очень несовершенна (Табл.3). Исключением являются мегакариоцитарные маркеры CD61, CD41, CD42 и эритроидный антиген гликофорин А, с помощью которых можно верифицировать мегакариобластный лейкоз (ОМЛ, вариант М6) и острый эритромиелоз (ОМЛ, вариант М7), но именно эти формы максимально узнаваемы клинически и морфологически и редко требуют проведения ИФТ с диагностической целью.
При обнаружении на бластных клетках одновременной яркой экспрессии антигенов различных гемопоэтических линий, т.е. при подозрении на бифенотипический лейкоз (БФЛ) дополнительным шагом интерпретации данных ИФТ является балльная оценка экспрессии маркеров (табл.4). Она проводится, согласно рекомендациям Европейской группы по исследованию лейкозов (EGIL), если не менее 10-20% лейкозных бластов одновременно экспрессируют миелоидные и лимфоидные маркеры. Каждый маркер оценивается определенным баллом. Диагноз БФЛ ставится при оценке больше 2 для миелоидной и 1 для лимфоидной линии. Предполагая БФЛ надо обращать внимание на внутриклеточную экспрессию не одного, а как минимум двух маркеров миелоряда, чтобы избежать ошибочной гипердиагностики. Кроме того, нужно помнить, что этот вариант острых лейкозов на самом деле является достаточно редким, для него не разработано специфических схем полихимиотерапии (ПХТ). Больные получают ПХТ согласно группе риска, определяемой по совокупности данных клиники, морфологии, цитохимии, цитогенетики и ИФТ.
Использование многоцветного (мультипараметрического) анализа показало, что практически у всех пациентов с острыми лейкозами фенотип патологических клеток является аберрантным, т.е. не полностью соответствующим какому-то определенному уровню дифференцировки нормальной клетки крови. Эта аномальная экспрессия отражает генетические изменения, лежащие в основе опухолевого перерождения лейкозной клетки. Таким образом, именно аберрации антигенной экспрессии позволяют отделять/дискриминировать здоровые клетки от патологических при анализе биологического материала пациентов с подозрением на онкогематологическое заболевание. К основным типам аберрантности фенотипа при острых лейкозах относятся
? эктопическая, (например, тимус-ассоциированная при Т-ОЛЛ, т.е. выявление в костном мозге или периферической крови бластов с фенотипом тимических лимфоцитов);
? полное отсутствие или низкий уровень экспрессии антигена, характерного для данной стадии дифференцировки, например, в некоторых случаях острого миелолейкоза с признаками созревания уровень экспрессии линейного маркера несопоставим с уровнем его экспрессии на неизмененных клетках миелоряда (Рис.4);
? асинхронная, т.е. одновременная экспрессия антигенов, относящихся к разным стадиям дифференцировки (в норме никогда не определяется одновременная экспрессия ранних и поздних антигенов) (Рис.5 А);
? избыточная экспрессия антигена (например, очень высокий уровень экспрессии CD10 при B II варианте острого лимфобластного лимфобласте);
? фенотипический профиль, практически не встречающийся в норме (клетки с яркой экспрессией CD7 определяются в костном мозге в норме с частотой Список литературы
4. Bene MC, Bernier M, Castoldi G. et al. Impact of Immunophenotyping on management of acute leukemias//Hematologica 1999 (84): 1024-1034.
5. Basso G, Buldini B., L.de Zen, Orfao A. New methodological approaches for immunophenotyping acute leukemias// Hematologica 2001 (86): 675-692.
6. Hoelzer D., Gokbuget N., Ottman O. et al. Acute Lymphoblastic leukemia//Hematology 2002(1):162-192.