achromobacter xylosoxidans что это такое
Передача Achromobacter от пациента к пациенту и устойчивость к антибиотикам при муковисцидозе
Achromobacter – разновидность бактерий, которые являются важным источником хронических легочных инфекций у людей с муковисцидозом (МВ). В своем докладе ученые из Дании показывают доказательства передачи бактерий от пациента к пациенту и возникновение у них устойчивости к антибиотикам.
Большинство людей с МВ живут с хроническими бактериальными инфекциями в дыхательных путях из-за проблем со слизью и ее очищением. Наиболее частым возбудителем этих инфекций является синегнойная палочка.
Но недавние исследования показывают, что некоторые виды бактерий Achromobacter все чаще обнаруживаются у пациентов с МВ и связаны с устойчивостью к антибиотикам и приводят к более тяжелым заболеваниям.
Однако мало что известно о передаче этой бактерии и ее устойчивости к антибиотикам среди пациентов.
Команда под руководством исследователей из Центра геномной медицины в Копенгагене провела анализ ДНК бактерий Achromobacter, выделенных у 51 пациента с МВ. Их цель состояла в том, чтобы лучше понять, как распространяются эти патогены и насколько они устойчивы к лечению.
Перед этим исследованием все изоляты были идентифицированы как Achromobacter xylosoxidans с использованием обычных микробиологических методов.
Чтобы исследовать передачу от пациента к пациенту, результаты генома сравнивали для выявления конкретных бактерий со связанным общим предком (тот же клональный тип). Близкородственные бактерии одного вида будут иметь меньше генетических вариаций, чем более отдаленные родственные бактерии того же вида – это и может означать передачу бактерий от пациента к пациенту. В результате анализа было обнаружено 16 случаев подозрения на передачу инфекции от пациента к пациенту, которые были исследованы дополнительно.
Из 14 случаев подозрения на передачу с полной филогенетической информацией в 12 случаях подтвердили передачу от пациента к пациенту, поскольку было обнаружено, что бактерии одного пациента произошли от бактерий другого пациента.
Чтобы подтвердить это генетическое свидетельство передачи, исследователи искали частичное совпадение посещений пациентами клиники. Из 16 пар пациентов с подозрением на передачу инфекции все, кроме одной пары пациентов с микробиологическим анализом, находились в одной больничной палате в один и тот же день.
«Чем больше дней пациенты могли контактировать, тем больше была вероятность передачи, чем у пациентов без передачи», – написала команда исследователей.
В целом, 15 из 16 случаев подозрения на передачу инфекции от пациента к пациенту были подтверждены генетическим анализом и филогенетическими или эпидемиологическими данными. A. ruhlandii типа клон AX01DK01 показал большинство передач, и он был обнаружен у 13 пациентов.
Чтобы исследовать устойчивость к антибиотикам были проведены стандартные диагностические измерения профилей чувствительности к антибиотикам, они были исследованы к 21 антибиотику для 92 изолятов. У 21 пациента с единичными изолированными образцами эти бактерии были устойчивыми или частично устойчивыми в среднем к 14 антибиотикам. У 30 пациентов образцы, которые были изолированы на раннем этапе, были устойчивы в среднем к 14 антибиотикам, в то время как те, которые были собраны позже, были устойчивы к 18 антибиотикам.
Статистический анализ показал, что бактерии, изолированные позже, значительно менее восприимчивы к антибиотикам (то есть более устойчивы к ним), чем ранние и отдельные изоляты. Почти все изоляты показали устойчивость или частичную устойчивость к девяти антибиотикам; пять показали некоторую эффективность. Ни один антибиотик не оказался эффективным против всех протестированных бактерий.
«[Мы] обнаружили геномную и эпидемиологическую составляющие передачи от пациента к пациенту у всех трех видов Achromobacter и предложили новую идентификацию разновидностей генов, которую следует учитывать при оценке предполагаемых случаев передачи инфекции между пациентами», – пишут исследователи.
«Наконец, мы показали, что устойчивость к антибиотикам развивается у всех трех видов Achromobacter».
Эти результаты, добавила команда, «позволяют нам лучше понять динамику устойчивости к антибиотикам и передачу Achromobacter от пациента к пациенту с МВ, что может помочь предсказать клиническое прогрессирование инфекций, вызванных ахромобактерией, и предотвратить инфицирование».
Муковисцидоз – редкие бактерии (руководство для пациентов в Германии)
Под «редкими бактериями» понимают патогенные микроорганизмы, которые обнаруживаются только у некоторых пациентов с МВ. Важность этих бактерий для течения заболевания муковисцидозом до сих пор не до конца ясна.
Что такое “редкие бактерии” при муковисцидозе?
Под «редкими бактериями» понимают патогенные микроорганизмы, которые обнаруживаются только у некоторых пациентов с МВ. Важность этих бактерий для течения заболевания муковисцидозом до сих пор не до конца ясна.
Новые результаты приведут к измененной оценке роли бактерий в дыхательных путях. Тем не менее, такие исследование все еще находится на начальном этапе.
Ниже мы кратко представим некоторые «редкие» бактерии.
1. Achromobacter xylosoxidans
Каковы характерные свойства? Откуда берется Achromobacter xylosoxidans?
Achromobacter (A.) xylosoxidans – это глобально распределенная подвижная бактерия, для роста которой необходим кислород. Она живет в почве и в воде. Также в клиниках A. xylosoxidans была обнаружен во влажных помещениях. Бактерия устойчива ко многим антибиотикам.
В случае с ослабленным иммунитетом или тяжелыми пациентами A. xylosoxidans может вызвать различные инфекции, такие как заражение крови, пневмония, инфекция мочевых путей или перитонит.
Насколько распространен A. xylosoxidans при кистозном фиброзе? Какое значение имеет обнаружение патогена?
При обычных контрольных осмотрах от 2 до 10% у пациентов с МВ A. xylosoxidans обнаруживаются в мазке из горла или мокроте. В большинстве случаев это временная колонизация, но также возникают хронические инфекции.
Иногда также появляются сообщения о повышенной распространенности инфекции. Например, в итальянской амбулаторной клинике МВ за пятилетний период удвоилось число пациентов с ахромобактерией до 16% в 2010 году. Особенно у тяжело больных пациентов выделялись патогены, которые росли в биопленках и были устойчивы к различным антибиотикам. Считалось, что причиной увеличения частоты обнаружения в этой амбулаторной клинике является особая «адаптивность» бактерий.
У некоторых пациентов с МВ с A. xylosoxidans в дыхательных путях вырабатываются антитела к патогену. Это указывает на то, что это заболевание, а не просто колонизация. Также была описана связь между ухудшением функции легких и обнаружением A. xylosoxidans.
В этих случаях может быть полезно лечить антибиотиками. Учитывая лекарственную устойчивость, препараты должны быть тщательно подобраны. Предпочтительно вводить комбинации различных антибиотиков, например ципрофлоксацин в дополнение к имипенему или меропенему. Кроме того, антибиотики для ингаляций используются против Achromobacter.
Существует доказательство того, что бактерии могут передаваться от пациента к пациенту.
2. Stenotrophomonas maltophilia
Каковы характерные свойства? Где обитает Stenotrophomonas maltophilia?
Stenotrophomonas (S.) maltophilia ранее называлась Pseudomonas maltophilia, а затем Xanthomonas maltophilia, пока бактерия в 1993 году не получила своего нынешнего названия.
S. maltophilia – это подвижная палочковидная бактерия, которая относится к группе грамотрицательных бактерий и нуждается в кислороде для роста. Бактерия распространяется по всему миру и встречается во влажной среде, в почве, у животных и на растениях. S. maltophilia устойчива ко многим антибиотикам.
Какие осложнения и заболевания вызывает S. maltophilia?
S. maltophilia может вызывать тяжелые инфекции, такие как пневмония, сепсис или менингит. Пациенты с ослабленной иммунной системой могут умереть от такой инфекции.
Насколько распространен S. maltophilia при муковисцидозе? Какое значение имеет обнаружение патогена?
S. maltophilia была обнаружена с возрастающей частотой у пациентов с муковисцидозом в последние годы. Что касается всех людей с МВ, от 5% до 30% больных имеют S. maltophilia в мокроте или мазке из горла. Пожилые и больные пациенты чаще колонизируются. В некоторых амбулаторных клиниках S. maltophilia чаще встречалась у тех пациентов, которые ингалировали долгосрочные антибиотики от Pseudomonas aeruginosa (см. Часть 1 этой серии). Последующие осмотры показывают, что у одних пациентов S. maltophilia самопроизвольно исчезает, но у других обнаруживается надолго.
Есть признаки того, что хроническая инфекция S. maltophilia может неблагоприятно влиять на течение заболевания при муковисцидозе. Поэтому лечение может быть полезным. Из-за частой резистентности возбудителя выбор подходящих антибиотиков не так прост. Поэтому врачи должны тщательно взвешивать и для каждого конкретного пациента решать, следует ли лечить S. maltophilia или нет. Одной из причин терапии может быть то, что никакая другая бактерия не является причиной ухудшения функции легких. Если кто-то выбирает терапию, котримоксазол, доксициклин и левофлоксацин являются предпочтительными. Часто врачи также назначают дополнительный антибиотик для комбинированной терапии.
Что касается перекрестного инфицирования, то считается, что S. maltophilia маловероятно или редко передается от пациента к пациенту.
3. Виды Pandoraea
К Pandoraea относятся несколько видов грамотрицательных, палочковидных бактерий, движущиеся, такие как Pandoraea apista или Pandoraea pulmonicola. Из-за тесной связи родов Pandoraea и Burkholderiakommt, их иногда неправильно определяют.
Рабочая группа из Копенгагена обнаружила признаки того, что виды Pandoreae негативно влияют на заболевание легких при муковисцидозе. Кроме того, по-видимому, также происходит его передача от пациента к пациенту. Поэтому может иметь смысл изолировать таких пациентов от других страдающих муковисцидозом, подобно Burkholderia cepacia.
Другие авторы сообщали об единичных пациентах с МВ, которые были колонизированы Pandoraea sputorum в течение нескольких лет подряд и испытали значительное ухудшение заболевания легких.
4. Burkholderia pseudomallei
Подобно другим видам Burkholderia, Burkholderia (B.) pseudomallei также являются грамотрицательными палочковидными бактериями (рис. 1). Однако B. pseudomallei не относится к комплексу Burkholderia cepacia (см. Часть 4 этой серии), но образует отдельный вид.
Burkholderia pseudomallei встречается в почве и поверхностных водах тропических и субтропических районов. Большинство сообщений поступает с севера Австралии и стран Юго-Восточной Азии. Здесь возбудитель вызывает мелиоидоз, серьезную опасность для жизни, пневмонию с заражением крови. Большинство случаев мелиоидоза происходит в сезон дождей. Особенно страдают пациенты с хроническими заболеваниями легких. Работа,
связанная с контактом с почвой и водой, например, с рисоводом, также может способствовать заражению B. pseudomalley (рис. 2).

© Dennis Kunkel Microscopy, Inc.
5. Группа Streptococcus milleri
Стрептококки представляют собой грамположительные глобулярные бактерии, которые не могут активно двигаться самостоятельно. Своим именем они обязаны своим шарико-образным видом (гр. Streptos: ожерелье, рис. 3).
В группу Streptococcus milleri (SMG) входит несколько патогенов, включая S. anginosus, так что иногда говорят о группе Streptococcus anginosus (SAG). Представители группы вызывают тяжелые гнойные инфекции и абсцессы.
При муковисцидозе было описано несколько пациентов, чье острое ухудшение было связано с SMG. В мокроте обнаружена очень высокая плотность бактерий SMG, которая снизилась после целевой антибактериальной терапии. Жалобы также уменьшились. Исследовательская группа сообщила, что у взрослых с МВ до 40% обострений вызываются SMG.
6. Prevotella
Prevotella – грамотрицательные палочковые бактерии длиной 20-50 мкм. Они принадлежат к анаэробам, то есть они также растут в средах без кислорода. Они обычно находятся в полости рта, кишечнике и мочевыводящих путях. Prevotella также может приводить к болезни, потому что он изолирован от инфекций в различных частях тела. Часто Prevotella встречается вместе с другими возбудителями.
Также у пациентов с кистозным фиброзом Prevotella обнаруживалась в мокроте или в жидкости лаважа легких. В зависимости от того, насколько чувствительными были методы обнаружения, исследователи сообщали о 80% пациентов, хотя и в небольших исследованиях.
Однако значение этих патогенов для течения заболевания МВ до сих пор неясно. Есть признаки того, что Prevotella усиливает повреждения, вызванные Pseudomonas aeruginosa. Антитела к Prevotella были также обнаружены в крови пациентов с МВ, то есть иммунная система организма имела дело с патогенами. Хотя Prevotella устойчивы ко многим антибиотикам. Тем не менее, меропенем или пиперациллин/тазобактам считаются эффективными.
Вывод
«Редкие бактерии» выделяются из дыхательной секреции только у нескольких человек с МВ. Часто эти микробы безвредны. Тем не менее, не всегда легко решить, оказывают ли они на неблагоприятное влияние на заболевание легких или нет. Кроме того, редкие бактерии часто устойчивы к обычно используемым антибиотикам.
По мере того, как исследователи разрабатывают новое понимание этих бактерий, станет легче оценивать статус заболевания при наличии «редких» бактерий.
Мониторинг инфицирования и резистентности Achromobacter xylosoxidans у взрослых пациентов с муковисцидозом
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цель исследования: оценить частоту инфицирования и резистентность выделенного Achromobacter xylosoxidans к карбапенемам у взрослых пациентов с муковисцидозом (МВ).
Материал и методы: проведен ретроспективный анализ результатов культуральных посевов и времяпролетной масс-спектрометрии MALDI-TOF 685 образцов мокроты 58 взрослых пациентов с МВ за период в 5 лет (2016–2020 гг.). Для оценки чувствительности к имипенему и меропенему использовали метод градиентной диффузии в агар и дискодиффузионный метод.
Результаты исследования: частота инфицирования A. xylosoxidans взрослых пациентов с МВ в динамике за период с 2016 по 2020 г. при мониторировании единой выборки пациентов (n=24) для оценки частоты встречаемости данного патогена с увеличением возраста составила от 16,6% в 2016–2017 гг. с нарастанием до 37,5% в 2018–2019 гг. и с дальнейшим снижением до 20,8%, связанным с летальным исходом заболевания у 3 из 9 инфицированных пациентов. Не получено статистически значимой зависимости летального исхода от инфицирования A. xylosoxidans. При анализе всего пула больных (n=58) с 2016 по 2020 г. частота выделения Pseudomonas aeruginosa остается примерно одинаковой, варьируя от 63,3% до 46,5% и сохраняя численный перевес во всех периодах наблюдения, а инфицированность A. xylosoxidans находится в пределах от 13,7% до 39,3%. В 2016–2018 гг. чувствительны к карбапенемам были 50% изолятов, в 2018 г. — 53,8% изолятов, в 2019–2020 гг. активность выделенных изолятов снизилась до 37,5% и 30,7% соответственно.
Заключение: несмотря на динамику показателей и численность выборки, в динамике за 5 лет сохранялась общегрупповая пропорция видов микробиома с доминированием в первую очередь синегнойной инфекции и A. xylosoxidans. В нашем наблюдении активность карбапенемов в отношении A. xylosoxidans снизилась почти вдвое.
Ключевые слова: муковисцидоз, Burkholderia cepacia compleх, Achromobacter xylosoxidans, Pseudomonas aeruginosa, летальность, антибиотикорезистентность, карбапенемы.
Для цитирования: Махмутова В.Р., Гембицкая Т.Е., Черменский А.Г. и др. Мониторинг инфицирования и резистентности Achromobacter xylosoxidans у взрослых пациентов с муковисцидозом. РМЖ. Медицинское обозрение. 2021;5(7):462-467. DOI: 10.32364/2587-6821-2021-5-7-462-467.
1 Multidisciplinary Сity Hospital No. 2, St. Petersburg, Russian Federation
2 I.P. Pavlov First St. Petersburg State Medical University, St. Petersburg, Russian Federation
Aim: to evaluate the infection rate and resistance of isolated Achromobacter xylosoxidans to carbapenems in adult cystic fibrosis patients (CF).
Patients and Methods: a retrospective analysis of the results of culture test and time-of-flight mass spectrometry MALDI-TOF was conducted: 685 sputum samples of 58 adult CF patients for a period of 5 years (2016–2020). To assess the sensitivity to imipenem and meropenem, the agar gradient diffusion and disk diffusion method were used.
Results: the incidence of infection with A. xylosoxidans in adult CF patients for the period from 2016 to 2020 when monitoring a single sample of patients (n=24) to evaluate the occurrence of this pathogen with increasing age ranged from 16.6% in 2016–2017, increasing to 37.5% in 2018–2019, and with a further reduction to 20.8% (associated with disease fatal outcome in 3 of the 9 infected patients). There was no statistically significant dependence of the fatal outcome on infection with A. xylosoxidans. When analyzing the entire pool of patients (n=58) from 2016 to 2020, the release frequency of Pseudomonas aeruginosa remains approximately the same, varying from 63.3% to 46.5% and maintaining a numerical advantage in all follow-up periods, while the A. xylosoxidans infection ranges from 13.7% to 39.3%. In 2016–2018, 50% of isolates were sensitive to carbapenems, in 2018 — 53.8% of isolates, in 2019–2020 — the activity of obtained isolates decreased to 37.5% and 30.7%, respectively.
Conclusion: despite the dynamics of indicators and the sample size, the dynamics over 5 years maintained a group-wide proportion of microbiome species dominated primarily by Pseudomonas infection and A. xylosoxidans. In our follow-up, the activity of carbapenems in relation to A. xylosoxidans has almost halved.
Keywords: cystic fibrosis, Burkholderia cepacia complex, Achromobacter xylosoxidans, Pseudomonas aeruginosa, lethality, antibiotic resistance, carbapenems.
For citation: Makhmutova V.R., Gembitskaya T.E., Chermensky A.G. et al. Achromobacter xylosoxidans infection and resistance monitoring in adult cystic fibrosis patients. Russian Medical Inquiry. 2021;5(7):462–467 (in Russ.). DOI: 10.32364/2587-6821-2021-5-7-462-467.
Введение
Муковисцидоз (МВ) — это частое моногенное заболевание, обусловленное мутациями гена CFTR (МВТР). МВ характеризуется мультисистемной патологией, при которой микрофлора дыхательных путей является главной причиной развития осложнений и летальности. Микрофлора, вызывающая воспалительный процесс в легких при МВ, уникальна и практически не встречается при других заболеваниях [1]. Профиль микробиома также является важным фактором прогрессирования патологического процесса.
Часть возбудителей — это условно-патогенные микроорганизмы, которые приобрели наибольшую актуальность в последние 10 лет, именно к этой группе относятся
A. xylosoxidans и ВСС. Их появление требует соблюдения мер профилактики не только в медицинских учреждениях, но и в амбулаторных условиях. Заражение ВCC, A. xylosoxidans., P. aeruginosa и метициллин-резистентным золотистым стафилококком (Methicillin Resistant S. aureus, MRSA) происходит преимущественно воздушно-капельным путем, источником при этом являются другие больные МВ. Возможна также передача возбудителя между пациентами через загрязненные при кашле руки. Пациенты, выделяющие бактерии ВСС, Achromobacter spp., P. aeruginosa и MRSA, могут также обсеменять ими больничные помещения и оборудование для респираторной терапии.
Первое упоминание о выделении Achromobacter spp. у пациента с МВ относится к 1985 г. [3]. Представители рода Achromobacter — грамотрицательные неферментирующие микроорганизмы, способные вызывать оппортунистические инфекции (оксидазо- и каталазоположительные) и, что наиболее важно, обладающие природной устойчивостью ко многим антибиотикам.
До 2011 г., когда начал действовать проект ежегодного регистра МВ, в Российской Федерации не контролировались структура и динамика распространения респираторной микрофлоры. Меры профилактики были недостаточными и не предупреждали перекрестного инфицирования больных МВ такими бактериями, как ВСС и Achromobacter spp., о чем свидетельствовали многочисленные вспышки заболевания у пациентов в различных стационарах на территории Российской Федерации. Эпидемиологический контроль за неферментирующей грамотрицательной флорой позволил зафиксировать внутрибольничные вспышки инфекции, вызванные данными микроорганизмами. Важно отметить в контексте диагностирования хронической инфекции дыхательных путей, что у пациентов с МВ очень часто A. xylosoxidans ложно диагностируют как BCC из-за фенотипического сходства при культивировании на 5% кровяном агаре и роста на cелективном для ВСС агаре [4]. Для подтверждения принадлежности бактерии к роду Achromobacter необходимо использовать тест-системы MALDI-TOFF. Методика масс-спектрометрического анализа для проведения MALDI-TOFF прямого белкового профилирования неспорообразующих микроорганизмов имеет решающее значение. Значимость корректной микробиологической диагностики при МВ в регионах Российской Федерации отдельно отмечено и в Национальном консенсусе «Муковисцидоз: определение, диагностические критерии, терапия» [5].
В отличие от терапии синегнойной инфекции, пока не разработано эффективных, с высокой степенью доказательности схем антибактериальной терапии для других неферментирующих грамотрицательных микроорганизмов. Для Российской Федерации, в отличие от других стран, характерна высокая частота данной инфекции, что обусловливает актуальность и необходимость организации идентификации ВСС и A. xylosoxidans и мониторинга их антибиотикорезистентности [6].
Обращает на себя внимание рост высева Achromobacter spp. у пациентов после пересадки легких [7], а также увеличение случаев инфицирования в последние годы у пациентов с бронхоэктатической болезнью и болезнью Картагенера [8, 9]. Антибиотикотерапия не всегда приводит к эрадикации бактерий, в связи с чем формируется хроническая инфекция легких, обусловленная персистенцией мультирезистентных клонов бактерий, и больные МВ, являясь источником таких бактерий, находятся в группе риска по тяжелому течению заболевания, а также представляют опасность для контактных лиц. Таким образом, мониторинг локальной эпидемиологической ситуации и изучение динамики чувствительности современных патогенных микроорганизмов при МВ являются критически важными.
Цель исследования — оценить частоту инфицирования и резистентность выделенного A. xylosoxidans к карбапенемам у взрослых пациентов с МВ за период в 5 лет (2016–2020 гг.).
Материал и методы
Был проведен ретроспективный анализ микробиологических образцов, полученных от 58 пациентов старше 18 лет (32 (55,2%) мужчины и 26 (44,8%) женщин; средний возраст — 27,21 года; диапазон 18–62 года), проживающих в Санкт-Петербурге и Ленинградской области, с установленным диагнозом МВ согласно стандартным критериям Европейского общества муковисцидоза, регулярно посещающих центр МВ в СПб ГБУЗ «ГМПБ № 2».
Образцы мокроты были собраны в период с января 2016 г. по декабрь 2020 г. Диагноз МВ был поставлен на основе стандартных методов (результаты теста на хлориды пота выше 60 ммоль/л с пилокарпином и две соответствующие мутации трансмембранного регулятора гена МВ). Частота микробиологического исследования образцов мокроты у пациентов с МВ составляла 1 раз в 3 мес. Исследовалась свободно отделяемая мокрота как оптимальный биоматериал для микробиологического исследования респираторных инфекций [10]. Сбор и транспортировка образцов биоматериала проводились согласно методическим указаниям [11].
Основным методом диагностики хронической респираторной инфекции являлся культуральный метод с посевом респираторных образцов на неселективные, селективные и хромогенные питательные среды (рекомендуемые питательные среды для основных этиологически значимых микроорганизмов респираторных инфекций при МВ [12]). Грамотрицательные бактерии, выявление которых могло вызывать трудности (A. xylosoxidans, BCC), были идентифицированы методами молекулярной идентификации (времяпролетная масс-спектрометрия MALDI-TOF MS) согласно рекомендациям [13]. Определение чувствительности микроорганизмов, выделенных от пациентов с МВ, к антибактериальным препаратам и интерпретацию результатов проводили в соответствии с Клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам» [14]. Для оценки чувствительности к имипенему и меропенему использовали метод градиентной диффузии в агар и дискодиффузионный метод.
Статистическая обработка данных проводилась с использованием программы Statistica 6.0 for Windows 7.0 от 30.11.2018. Статистическое распределение в группах отличалось от нормального во всех группах сравнения, расчет межгруппового сравнения проводился с помощью критерия Манна – Уитни. Cтатистически значимым считали уровень р 0,05) по возрасту пациентов в группах с хронической синегнойной инфекцией и Achromobacter spp., медиана возраста составила 26 и 28 лет соответственно.
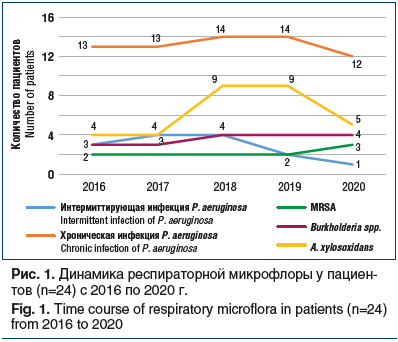
В отношении Burkhalderia spp. наблюдался меньший рост встречаемости возбудителя, максимально составивший до 16,6% в общей доле, в то время как показатель MRSA был одинаков на протяжении всего времени наблюдения, возбудитель стабильно высевался у 2 пациентов с частотой 8,3% за все 5 лет наблюдения.
Следует отметить симметричное снижение количества пациентов к концу периода наблюдения в группах больных, инфицированных синегнойной инфекцией и Achromobacter spp., что мы объясняем смертью пациентов именно в этих двух микробиологических группах: 3 больных из группы Achromobacter spp. умерли в 2020 г., так же как и 1 пациент из группы хронической синегнойной инфекции. Все погибли от прогрессирования основного заболевания. В контексте обсуждения смертельных исходов в период пандемии COVID-19 в 2020 г. необходимо уточнить, что клиническая картина у 4 умерших пациентов была характерна для тяжелого обострения МВ, вызванного тяжелой бактериальной инфекцией, и не соответствовала клинико-рентгенологическим признакам коронавирусной инфекции COVID-19. Также все 4 пациента проходили неоднократное лабораторное исследование назофарингеальных мазков методом полимеразной цепной реакции на SARS-CoV-2 в период обострения, приведшего к летальному исходу, и результаты тестов были отрицательными во всех случаях. Таким образом, самая высокая летальность наблюдалась в группе больных с Achromobacter spp. — 12,5% к пятому году наблюдения, в группе хронической синегнойной инфекции она была меньше, чем в первой, и составила 4,1% к пятому году наблюдения.
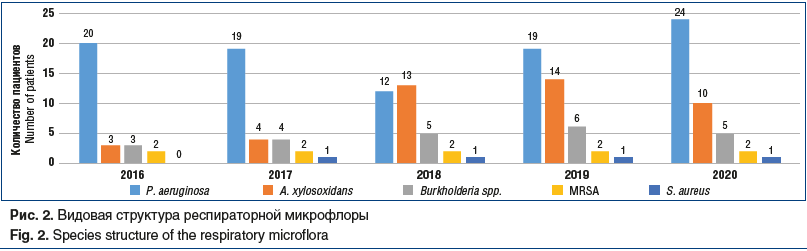
На рисунке 2 представлена видовая структура респираторной микрофлоры всех 58 взрослых пациентов с МВ, наблюдавшихся в центре СПб ГБУЗ «ГМПБ № 2» за период 2016–2020 гг., с учетом ежегодного роста количества пациентов. Часть из них (18 (70,8%) человек от всех новых пациентов за период 2016–2020 гг.) перешли из детской сети, часть — поступили на учет в центр при первичном выявлении заболевания во взрослом возрасте (в 2018 г.1 пациент в возрасте 35 лет, в 2019 г. 3 пациента в возрасте 21, 30 и 41 год соответственно) или по причине переезда пациентов с МВ из других регионов РФ с уже установленным диагнозом в возрасте младше 18 лет, наблюдавшихся до этого в других центрах МВ (по 1 пациенту в 2016, 2017 и 2019 гг. соответственно).
Полученные данные, представленные на рисунке 2, согласуются по структуре распределения флоры и ее динамики с данными рисунка 1 и не противоречат общемировой тенденции микробиологического спектра взрослых пациентов с МВ, у которых доминирует хроническая синегнойная инфекция, далее A. xylosoxidans и BCC. Интересно отметить единственного пациента 20 лет (генотип F508del/394delTT), у которого на протяжении периода наблюдения микрофлора была представлена изолированно S. aureus, что коррелировало со стабильным течением среднетяжелой формы МВ, редкими обострениями (менее 1 раза в год) и нормальным функциональным статусом. С 2016 по 2020 г. (рис. 2) частота выделения P. aeruginosa остается примерно одинаковой, колеблется от 63,3% до 46,5%, сохраняя численный перевес во всех периодах наблюдения, а распространенность A. xylosoxidans — в пределах от 13,7% до 39,3%.
Обращает на себя внимание смена соотношения высеваемых микроорганизмов в сторону увеличения доли A. xylosoxidans с сохранением видового состава при анализе как динамики единой выборки на протяжении 5 лет, так и общего пула наблюдающихся пациентов с МВ.
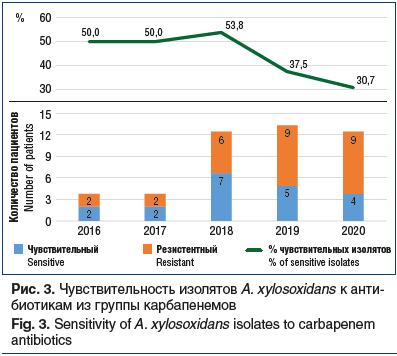
Результаты оценки динамики резистентности A. xylosoxidans к карбапенемам (рис. 3) являются неутешительными. При сравнительном анализе активности карбапенемов (имипенем, меропенем) в отношении A. xylosoxidans в период 2016–2017 гг. выявлены следующие закономерности. Карбапенемы были активны в отношении 50% штаммов A. xylosoxidans. В 2018 г. карбапенемы также демонстрировали достаточно высокую чувствительность к исследуемому микроорганизму, но в 2019–2020 гг. активность снизилась до 37,5% и 30,7% соответственно, что значительно ниже, чем в предыдущие годы.
Доля взрослых пациентов с МВ в Санкт-Петербурге в 2019 г., согласно Регистру больных муковисцидозом РФ [15], составила 27,6%, а общая доля всех таких пациентов в Санкт-Петербурге в общероссийском регистре составляет 5,1%, что является вторым по численности значением после г. Москвы.
При оценке динамики показателей национального регистра по муковисцидозу 2011–2019 гг. c 2014 г. учитывается частота инфицирования больных МВ Achromobacter spp. Отмечается тенденция к росту ее распространенности с 3,2% в 2014 г. до 4,6% к 2017 г. и 6,6% в 2019 г. Распространенность других патогенов остается приблизительно одинаковой [16]. Согласно данным регистра с 2011 г. по 2016 г. частота выделения S. aureus, P. aeruginosa, ВСС у больных МВ в динамике была практически на одинаковом уровне [15].
Следует подчеркнуть, что у пациентов с МВ в последние годы во всем мире увеличивается распространенность A. xylosoxidans [17]. Согласно результатам нашего исследования, несмотря на максимальную летальность именно в группе A. xylosoxidans, убедительно не доказана зависимость между данной хронической инфекцией и летальными исходами в изучаемой выборке.
За последнее десятилетие в мире возросла выживаемость пациентов с МВ (средний возраст — более 30 лет), и, соответственно, появились новые возбудители инфекционного процесса в респираторной микрофлоре у больных МВ. Доля больных МВ, инфицированных A. xylosoxidans, по стране на 2019 г. составила 6,6% [15], что занимает третье место по численности после S. aureus и P. aeruginosa и доказывает значение этого возбудителя с учетом его патогенности для больных МВ. На долю A. xylosoxidans приходилось 52% инфекций среди инфекций, вызванных Achromobacter spp. [18], в то время как, согласно нашим данным, все выявленные изоляты соответствовали виду A. xylosoxidans.
Как подчеркивается в современных исследованиях [19, 20], интенсивное применение антибиотиков может быть одним из факторов, повышающих вероятность оппортунистических инфекций резистентными микроорганизмами.
Мы обнаружили в нашей когорте исследуемых высокую распространенность инфекции A. xylosoxidans (15,5% из всех 58 пациентов), что выше, чем в европейских исследованиях (8,8% [21]. Причина высокой распространенности A. xylosoxidans в нашей популяции, вероятно, связана с более высоким средним возрастом пациентов нашей выборки. Около 12% больных (7/58) умерли в исследуемый период, 4 пациента были хронически инфицированы A. xylosoxidans, 3 пациента — P. aeruginosa. Минимальная доля пациентов с чувствительными изолятами A. xylosoxidans к карбапенемам составила 30,7%.
Таким образом, появление и распространение данного патогена можно связать с совершенствованием методов идентификации микроорганизмов в мокроте пациентов с МВ, кроме того, существенное влияние оказало как увеличение продолжительности жизни пациентов, так и широкое применение ингаляционной антибактериальной терапии у них. Численность пациентов, инфицированных A. xylosoxidans, в нашей выборке выше, чем в целом по России. При сопоставлении с европейскими данными наши показатели также демонстрируют более высокое значение частоты встречаемости A. xylosoxidans [18].
В заключение можно резюмировать, что за 15-летний период мирового наблюдения (с 2000 г. до 2015 г.) видовой состав микрофлоры дыхательного тракта у больных МВ не изменился, однако значительно поменялось соотношение высеваемых микроорганизмов. Установленная нами изменчивость чувствительности к карбапенемам (имипенем, меропенем) является клинически и эпидемиологически значимой и указывает на необходимость мониторинга антибиотикорезистентности в динамике для эффективного лечения пациентов с МВ в условиях смены ведущей микрофлоры.
Заключение
Частота инфицирования взрослых пациентов с МВ A. xylosoxidans в динамике за 2016–2020 гг. при мониторировании единой выборки пациентов (n=24) составила от 16,6% в 2016–2017 гг. с нарастанием до 37,5% в 2018–2019 гг. и дальнейшим снижением до 20,8%, связанным с летальным исходом заболевания у 3 из 9 инфицированных пациентов. Нами не было получено статистически доказанной зависимости летального исхода от инфицирования A. xylosoxidans.
При анализе структуры общего пула пациентов за период наблюдения в 5 лет в центре СПб ГБУЗ «ГМПБ № 2», несмотря на разноплановую динамику показателей и численность выборки, сохранялась общегрупповая пропорция видов микробиома с доминированием в первую очередь синегнойной инфекции и Achromobacter соответственно.
При сравнительном анализе активности карбапенемов в отношении Achromobacter spp., а именно A. xylosoxidans, были выявлены следующие закономерности: в 2016–2018 гг. чувствительны к карбапенемам были 50% изолятов A. xylosoxidans, в 2018 г. — 53,8% изолятов, в 2019 и 2020 гг. — 37,5% и 30,7% соответственно.
В 2018 г. карбапенемы демонстрировали достаточно высокую чувствительность к исследуемому микроорганизму. В 2019–2020 гг. чувствительность снизилась до 37,5% и 30,7% соответственно, отмечен более низкий показатель, чем в предыдущие годы, активность снизилась почти вдвое (на 43%) за 5 лет.
Учитывая тенденцию к росту антибиотикорезистентности респираторной микрофлоры при МВ, отсутствие новых классов антимикробных препаратов, критично важной остается необходимость эффективной ежедневной муколитической терапии. Из-за дефектов эпителия при переносе ионов воды происходят нарушения клиренса и адгезии слизи к поверхности дыхательных путей. Увеличение секреции и вязкости мокроты приводит к формированию порочного круга поражения легких при МВ: обструкция, воспаление и инфекция, а также раннее поражение мелких дыхательных путей с последующим развитием бронхоэктазов. Аэрозольный раствор дорназа альфа в сочетании с кинезитерапией обладает потенциальными преимуществами за счет улучшения мукоцилиарного клиренса, уменьшения обструкции, снижения частоты обострения хронического инфекционного процесса.
Структура и динамика респираторной микрофлоры взрослых пациентов с МВ, ее чувствительность к антибактериальным препаратам претерпевают изменения ввиду увеличения продолжительности жизни больных МВ и требуют дальнейшего мониторинга и изучения.
Сведения об авторах:
Махмутова Виктория Ринатовна — врач-пульмонолог пульмонологического отделения № 2 СПб ГБУЗ «ГМПБ № 2»; 194354, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-1105-1204.
Гембицкая Татьяна Евгеньевна — д.м.н., профессор, руководитель отдела терапевтической пульмонологии НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-2293-3739.
Черменский Алексей Георгиевич — к.м.н., старший научный сотрудник НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-1487-4182.
Титова Ольга Николаевна — д.м.н., профессор, директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-4678-3904.
Кузубова Наталия Анатольевна — д.м.н., заместитель директора НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-1166-9717.
Контактная информация: Махмутова Виктория Ринатовна, e-mail: eladaspb@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 05.07.2021.
Поступила после рецензирования 28.07.2021.
Принята в печать 20.08.2021.
Victoria R. Makhmutova — pulmonologist of the Department of Pulmonology No. 2, Multidisciplinary Сity Hospital No. 2; 5, Ucheblyi Lane, St. Petersburg, 194354; Russian Federation; ORCID iD 0000-0002-1105-1204.
Tatiana Y. Gembitskaya — Dr. Sc. (Med.), Professor, Head of the Department of Therapeutic Pulmonology of the Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-2293-3739.
Alexey G. Chermensky — C. Sc. (Med.), Senior Researcher at the Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-1487-4182.
Olga N. Titova — Dr. Sc. (Med.), Professor, Director of the Research Institute of Pulmonology, I.P. Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Natalia A. Kuzubova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Pulmonology, I.P. Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Contact information: Victoria R. Makhmutova, e-mail: eladaspb@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Только для зарегистрированных пользователей