acinetobacter baumannii чем лечить
Ацинетобактер
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.
Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Ацинетобактер (или ацинетка, как любит обзывать ее автор), является фактически «кровной родней» другого общеизвестного неферментера – синегнойной палочки. Но, в отличие от синегнойки, природно-устойчивого ацинетобактера вам могут принести прямо с улицы. То есть в природе имеются штаммы, и в очень большом количестве, которые изначально природно-устойчивы фактически ко всему арсеналу имеющихся в медицине антибиотиков. А еще таких же, но уже внутрибольничных мутантов не менее «удачно» выращивают в отделениях с высокой частотой использования антибактериальных препаратов. И это при том, что принести такого микроба в больницу, а также занести его в больного, может вообще любой человек, так как изначально ацинетка, как и синегнойка, является почвенным микробом, а потому горшки с цветами, садоводы-огородники, зимой растящие рассаду, летом ковыряющиеся на даче, а потом, нормально не отмыв руки, начинающие перевязывать раны или менять катетеры, да просто посетители с пылью на ботинках – все они в каждый момент времени приносят в больницы миллиарды подобных микробов. И это как раз то, о чем автор упоминал в разговоре о клебсиелле – вывести ацинетку, в отличие от синегнойки, несопоставимо труднее. Напомню, синегнойка предпочитает мокрую теплую грязь, поэтому ее проще отсечь от заноса в чистые отделения и внутри самой больницы проще выбить. А теперь представьте, чего будет стоить избавиться от пыли, комнатных растений, любителей-огородников и ломящихся, теперь уже даже в реанимации, посетителей. Практически нереально, если это только не ламинарный бокс.
Поэтому будем изучать врага в лицо
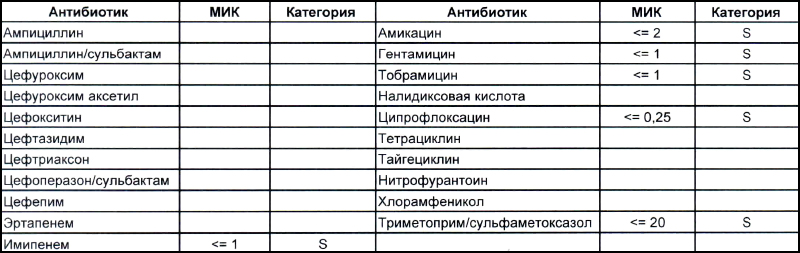
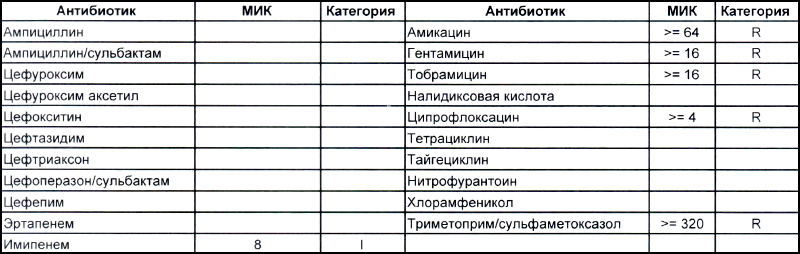
Общее представление о том, что из себя представляют дикие и непуганые антибиотиками ацинетобактеры, можно составить на EUCAST. Для тех, кто никогда не пользовался данным ресурсом, небольшая подсказка – тыкаем мышкой (или пальцем, смотря откуда читаете этот опус) в плашку «Species», выбираем один из 25-ти ацинетобактеров и наслаждаемся изучением. Общую антибиотикочувствительность семейства Acinetobacter spp. можно рассмотреть тут. Небольшое пояснение для тех, кто здесь впервые, – клинически значимыми минимальными подавляющими концентрациями (MIC), которыми можно и нужно пользоваться в клинической практике (а также как маркер того, какие антибиотики будут работать, а какие нет – их MIC указаны с чисто исследовательскими целями), являются показатели, отмеченные синими клеточками. На эти же показатели настроены аппараты для определения антибиотикочувствительности, с помощью которых продемонстрированы антибиотикограммы в наших статьях.
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Хороший вопрос. Точно такой же, как «чем лечить внутрибольничную клебсиеллу», которым мы задавались ранее.
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.
Acinetobacter baumannii чем лечить
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Acinetobacter baumannii

Acinetobacter baumannii широко распространены в природе, а также во внутрибольничной среде и обладают множественными механизмами резистентности к антибиотикам. Acinetobacter baumannii могут колонизировать желудочно-кишечный тракт, кожу пациента, рото- и носоглотку, конъюнктиву, влагалище и уретру.
В то же время Acinetobacter baumannii могут являться причиной пневмонии, трахеобронхита, сепсиса, инфекций мочевыводящих путей, эндокардита, раневой и хирургической инфекции, инфекций кожи и мягких тканей (включая некротизирующий фасциит), менингита, вентрикулита, абсцессов мозга, интраабдоминальных абсцессов, хориоамнионита, остеомиелита, артрита, синусита и перитонита.
Acinetobacter baumannii — возбудитель внутрибольничных инфекций
Проблема нозокомиальных (внутрибольничных) инфекций, вызываемых Acinetobacter baumannii, становится всё более актуальной из-за растущей резистентности данных микроорганизмов к антибактериальным препаратам. Резистентность Acinetobacter baumannii к цефтазидиму и ампициллину/сульбактаму за 5 лет увеличилась в 2–2,5 раза, к амикацину и ципрофлоксацину — в 8–9 раз. Встречаются штаммы, резистентные ко всем применяемым антибактериальным препаратам. Появление таких устойчивых внутрибольничных микроорганизмов связано с необоснованным и неограниченным использованием антибиотиков.
Acinetobacter baumannii вызывает 2-10 % всех грамотрицательных инфекций в Европе и США и до 1% всех внутрибольничных инфекций. В России Acinetobacter baumannii, наряду с Pseudomonas aeruginosa и Klebsiella pneumoniae, относится к трём самым часто происходящим и опасным возбудителям нозокомиальных инфекций. Во внутрибольничных условиях вспышки инфекций, вызываемые Acinetobacter baumannii в 60% случаев происходят во «взрослых» отделениях реанимации и интенсивной терапии. Оставшиеся 40% приходятся на отделения реанимации и интенсивной терапии новорожденных, ожоговые, нейрохирургические, хирургические, онкологические и гематологические отделения. Способствующими факторами являются: организация работы в этих отделениях – широкое использование инвазивных диагностических и лечебных мероприятий (катетеризация магистральных сосудов, искусственная вентиляция лёгких, длительная инфузионная терапия, энтеральное питание, методы внепочечного очищения крови), высокая концентрация больных с тяжелыми заболеваниями и сниженной иммунологической защитой, широкое и часто нерациональное использование антибактериальных и кортикостероидных препаратов, цитостатиков. Acinetobacter baumannii в большинстве случаев вызывает заболевания у тяжелобольных иммуноскомпрометированных пациентов (Ю.Л. Горбич, И.А. Карпов, 2012).
Acinetobacter baumannii относится к основными возбудителями раневых инфекций (Д.О. Вагнер).
Acinetobacter baumannii в систематике бактерий
Антибиотики, активные в отношении Acinetobacter baumannii
В течение многих лет основой терапии инфекций, вызванных Acinetobacter baumannii, были бета-лактамные антибиотики, часто в сочетании с аминогликозидами в случаях тяжелых инфекций. Однако большинство внутрибольничных Acinetobacter baumannii в настоящее время устойчивы к этим препаратам. Фторхинолоны, тетрациклины и глицилциклин, триметоприм-сульфаметоксазол, карбапенемы (за исключением эртапенема), полимиксины могут сохранять активность в отношении некоторых внутрибольничных штаммов. Однако в большинстве стран наблюдается быстрое нарастание резистентности к этим группам антибиотиков. В настоящее время наиболее клинически и финансово эффективным является использование монотерапии ампициллином/сульбактамом в дозах 24 г/сут или комбинированных режимов, включающих карбапенемы и ампициллин/сульбактам или карбапенемы и цефоперазон/сульбактам и нетилмицин. Последняя комбинация является экономически менее выгодной (Н.Д. Дмитриева и др., 2012).
По данным отечественного проекта «РЕЗОРТ», наибольшую активность в отношении 459 протестированных нозокомиальных штаммов Acinetobacter baumannii проявляли цефоперазон/сульбактам, имипенем и меропенем (2,2, 2,2 и 3,5% устойчивых изолятов соответственно), наименьшую – цефоперазон, гентамицин и пиперациллин (97,8, 89,1 и 91,7% соответственно) (Козлов С.Н., Белькова Ю.А. ).
Из представленных в данном справочнике антимикробных средств в отношении Acinetobacter baumannii (в общем) активны: левофлоксацин, нифурател, доксициклин. Acinetobacter baumannii устойчив к рокситромицину.
Выбор для Acinetobacter baumannii: умереть от бактериофага или от антибиотика
Acinetobacter baumannii — опасный противник. Известный своей устойчивостью к высыханию, истощению запаса питательных веществ и дезинфектантам, A. baumannii тяжело поддается уничтожению, когда бактерия приживается на медицинских объектах [1]. Способный избегать воздействия многих антибиотиков, A. baumannii представляет серьезную проблему для врачей и медперсонала, которые лечат зараженных пациентов и ухаживают за ними [2]. Всемирной организацией здравоохранения эта угроза признана, а A. baumannii получил статус важнейшего приоритета для исследований и разработки новых противомикробных препаратов [3]. В статье «Устойчивые к бактериофагам Acinetobacter baumannii получили повторную чувствительность к противомикробным препаратам» авторами продемонстрировано, что фаги могут дать второе дыхание для применения антибиотиков, которые уже есть в распоряжении врачей.
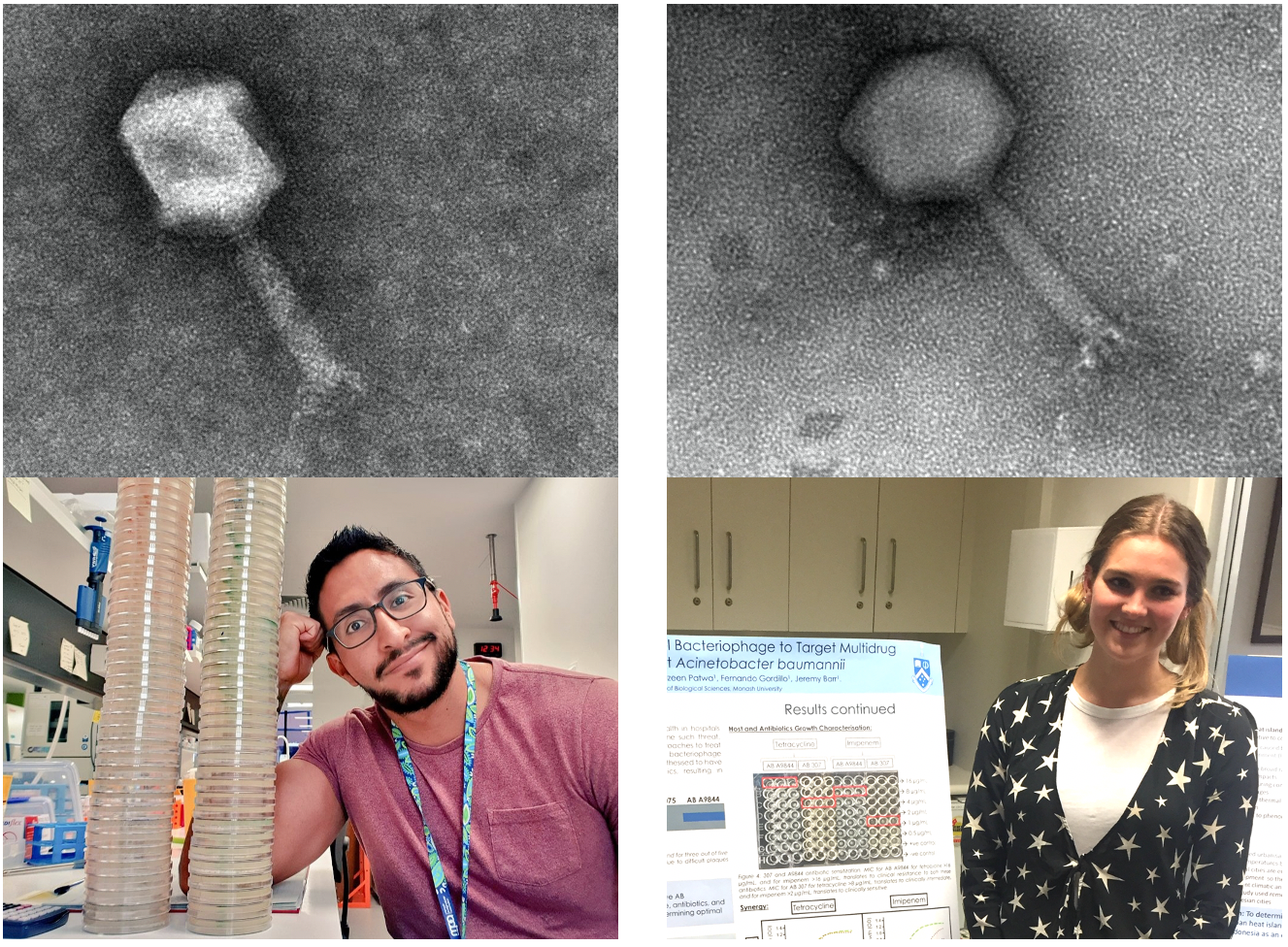
Идея, лежащая в основе этого проекта, возникла после того, как первый автор, Джереми Барр, ныне заведующий лабораторией в Школе биологических наук университета Монаша в Австралии, принял участие в первом клинически успешном применении фаговой терапии против системного A. baumannii, зарегистрированного в США [4, 5]. После последовательного приема смесей фагов командой ученых были осуществлены три, казалось бы, не связанных между собой наблюдения. Во-первых, изолят A. baumannii, полученный от пациента, приобрел устойчивость к смеси фагов. Во-вторых, он потерял устойчивость к антибиотику миноциклину. В-третьих, было выявлено, что бактерии потеряли полисахаридную капсулу. Могут ли быть связаны эти обнаруженные явления? И если да, то как? Это и стало отправной точкой в исследовании ученых.
Чтобы собрать вместе детали головоломки, ученые использовали два филогенетически отдаленных клинических штамма A. baumannii и два разных бактериофага, выделенных из неочищенных сточных вод. Как сказал один из авторов, Фернандо Гордиллио Альтамирано, эта работа является свидетельством того, как часто его любовь к микробиологии подвергалась проверке на прочность при работе с образцами неочищенных сточных вод (их помещали в инкубатор на ночь, добавляя в пробирки богатую питательными веществами среду). Фернандо Альтамирано приносит коллегам свои извинения за то, что запах смесей из сточных вод часто вынуждал их покидать лабораторию. Выделение фагов может оказаться сложной задачей, и, похоже, Фернандо Альтамирано положил начало тенденции в качестве награды в их исследовательской лаборатории давать фагам имена людей, которые их выделяют. В статье присутствуют изображения фагов øFG02 (Фернандо Альтамирано) и øCO01 (Коди Оливьера).
Исследователи обнаружили, что открытые ими фаги используют полисахаридные молекулы капсулы A. baumannii в качестве своего основного рецептора. Ученые пришли к такому выводу после наблюдения следующего:
То, что казалось простым процессом, на самом деле оказалось самым сложным шагом в исследовании. Ученые выявили, что с бактерией A. baumannii сложно проводить генетические манипуляции, а многочисленные попытки трансформации (естественной, химической и электропорацией) оказались безуспешными. Успешные же попытки экспериментов ученые связывают с фактором везения и настойчивостью соавторов Джона Форсайта и Рузин Патва.
Бактериальная капсула — основной фактор вирулентности A. baumannii, защищающий ее от иммунной системы, снижая проницаемость для антибиотиков [6]. Опираясь на фактические сведения, ученые полагают, что толстая капсула исследуемых штаммов дикого типа также играет роль в их очень низкой степени трансформации. В любом случае, исследователи были взволнованы, узнав, что капсуло-дефицитный, устойчивый к фагам A. baumannii стал повторно чувствительным к системе комплемента человека и пострадал от снижения до минимальных ингибирующих концентраций семи антибиотиков, в первую очередь β-лактамов, но также и миноциклина. Выделенные учеными фаги поставили A. baumannii перед дилеммой: умереть от фага или от антибиотика. Результаты исследования подчеркивают важность для терапии идентификации бактериальных рецепторов, которые используются любым фагами; они также вдохновили ученых на статью о перспективах, в которой они размышляют на эту тему [7].
Только в течение последнего десятилетия среди патогенных штаммов микробов, таких как Pseudomonas aeruginosa [8], Enterococcus faecalis [9], Staphylococcus aureus [10] и Klebsiella pneumoniae [11], было выявлено подобное взаимодействие между механизмами устойчивости к фагам и бактериальной адаптацией. Авторы данной работы добавляют в этот список бактерий A. baumannii, что еще раз подчеркивает многогранный потенциал фаговой терапии в борьбе с антибиотикорезистентностью.
Acinetobacter baumannii чем лечить
Инфекции, связанные с оказанием медицинской помощи, выявляют у 5-10 % пациентов, находящихся в стационаре [1]. И, если ранее, наиболее частыми возбудителями нозокомиальных инфекций (НИ) были грамположительные бактерии, то в последние десятилетия в их структуре преобладают грамотрицательные микроорганизмы. В этой ситуации особую тревогу вызывает неуклонный рост числа НИ, вызванных неферментирующими грамотрицательными микроорганизмами, в том числе бактериями рода Acinetobacter. В Европе и США A. baumannii является этиологическим агентом 2-10 % всех грамотрицательных инфекций [2] и до 1 % всех НИ [3]. В 2006-2008 гг. A. baumannii в России был третьим по частоте (15,3 %) грамотрицательным возбудителем НИ [4], а по результатам многоцентрового эпидемиологического исследования МАРАФОН России в 2011-2012 гг. этот возбудитель составил 13,9 % из всех выделенных бактериальных возбудителей [5].
По данным ряда авторов в стационарах городов России A. baumannii достигает 15,5-39,8 % в спектре грамотрицательных возбудителей [6,7]. В многопрофильных стационарах Санкт-Петербурга доля карбапенемустойчивых штаммов A. baumannii в 2010-2014 гг. составила 41,4 % к меропенему, 47,5 % к имипенему и 34,3 % к меропенему и имипенему [8]. Среди возбудителей раневой ожоговой инфекции к бактериям рода Acinetobacter принадлежало 13,3 % микроорганизмов [9]. По данным РОНЦ им. Н.Н. Блохина частота выделения A. baumannii в общей структуре микроорганизмов возросла от 2,5 % в 2005г до 9,7 % в 2010 г. [10].
Особую тревогу вызывает быстрое распространение практически во всех странах мультирезистентных штаммов A. baumannii, что значительно ухудшает результаты и сокращает возможности лечения инфекций, вызванных этим возбудителем. В РОНЦ им. Н.Н. Блохина в 2010 г. PDR штаммы A. baumannii были выделены в 40,7 % случаев [10].
Наиболее эффективным и эпидемиологически значимым механизмом резистентности у нозокомиальных штаммов A. baumannii является продукция приобретенных карбапенем-гидролизующих β-лактамаз класса D (CHDL): ОХА-23, ОХА-40, ОХА-58-подобных, а также металло-β-лактамаз, таких как INB и VIM. Распространенность этих ферментов в разных странах существенно отличается [11]. Продукция карбапенемаз в России в настоящее время отмечается у 44 % госпитальных изолятов A. baumannii. Особое опасение вызывает стремительное распространение на всей территории России штаммов A. baumannii, продуцирующих карбапенемазы группы ОХА-24/40, доля которых в 2011-2012гг составила 35,7 % [5]. ОХА-продуцирующие A. baumannii были получены из Иркутска (ОХА-23), Новосибирска (ОХА-58), Москвы (ОХА-23 и 58) [11]. Преимущественная циркуляция ОХА-40-подобных карбапенемаз (85,2 %) была отмечена в Минске [12] и Ростове-на-Дону [13]. В последнем случае ОХА-40 карбапенемазы преобладали среди онкологических больных [14, 15]. A. baumannii был выделен у 27-37 % пациентов, 78 % выделенных культур были карбапенемрезистеными, доминировала карбапенемаза ОХА-40 (97 %) [16]. Было показано, что колонизация слизистых оболочек верхних дыхательных путей возбудителями госпитальных инфекций у детей с тяжелой черепно-мозговой травмой, находящихся в ОРИТ происходила после 4 дня госпитализации [16].
В свете изложенного нам представилось интересным изучить наличие колонизации A. baumannii пациентов с онкологической патологией еще до поступления в стационар, ведь A. baumannii является фактором, оказывающим влияние на исход заболевания [12, 17]. Клиническими факторами риска колонизации и/или инфицирования карбапенемрезистеными A. baumannii являются предшествующая терапия, включая глюкокортикостероиды, «антисинегнойные» карбапенемы, проведение ИВЛ, выполнение катетеризации центральной и/или периферической вены и мочевыводящих путей, госпитализация в ОРИТ [12], а все эти факторы присутствуют у пациентов онкологических стационаров.
Целью настоящего исследования является изучение частоты колонизации слизистой оболочки кишечника и ротоглотки A. baumannii, продуцирующими ОХА-карбапенемазы, среди больных с солидными опухолями.
Материалы и методы исследования
Исследование проводили среди больных, госпитализированных в клинику ФГБУ «РНИОИ» Минздрава России в период с июля по август 2015 г. Исследовали мазки со слизистой оболочки ротоглотки и прямой кишки, полученные в первые сутки нахождения в стационаре (до проведения оперативного вмешательства).
Мазки отбирали в специальную транспортную среду, представляющую собой раствор фосфатного буфера с добавлением консерванта.
ДНК выделяли методом сорбции на частицах силики. Выявление генов ОХА-карбапенемаз (групп ОХА-23 ОХА-58 и ОХА-40) и видоспецифических β-лактамаз A. baumannii (ген ОХА-51), генов металло-β-лактамаз групп VIM, IMP, NDM осуществляли методом мультиплексной полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме «реального времени». Использовали наборы реагентов, разработанные в ФБУН ЦНИИЭ.
Всего было обследовано 230 пациентов, исследовано 368 образцов, в том числе 230 мазков из ротоглотки и 138 из прямой кишки.
Результаты исследования и их обсуждение
Молекулярный маркер A. baumannii (ген ОХА-51) был обнаружен у 39 (20,0 %) больных, в том числе у 28 (12,2 %) в мазках со слизистой ротоглотки, 11 (8,0 %) в мазках со слизистой прямой кишки. Ни у одного больного ген ОХА-51 не был обнаружен в двух локусах.
Различные гены ОХА-карбапенемаз были выявлены у 14 больных (6,1 % из числа обследованных и 35,9 % из колонизированных A. baumannii), в том числе в мазках из зева у 13 (5,7 % из обследованных и 46,4 % из колонизированных A. baumannii), в ректальных мазках у одного (0,7 % из обследованных и 25,6 % из от колонизированных A. baumannii). Гены металло-β-лактамаз групп VIM, IMP, NDM не были обнаружены ни в одном случае.
В проведенном ранее исследовании было показано, что в этиологической структуре пневмоний у онкологических больных преобладали A. baumannii (45,8 % от всех грамотрицательных возбудителей). Абсолютное большинство из них имели ген ОХА-40-подобных карбапенемаз [18]. Эти данные полностью коррелируют с полученной в настоящем исследовании информации о преимущественной колонизации A. baumannii, несущими генетические детерминанты резистентности к карбапенемам (ОХА-40), слизистой ротоглотки по сравнению со слизистой прямой кишки.
Чрезвычайно интересным представляется тот факт, что ДНК ОХА-карбапенемаз была обнаружена не только в образцах с молекулярным маркером A. baumannii (ОХА-51), но и в образцах без него. Ранее нами было показано обнаружение гена ОХА-40 в изоляте A. towneri, выделенном из внешней среды стационара [13]. Можно предположить, что штаммы Acinetobacter spp., циркулирующие во внешней среде, служат резервуаром генов ОХА-карбапенемаз. В этом случае, Acinetobacter spp., несущие гены ОХА-карбапенемаз, при определенных условиях и реализации горизонтального переноса генов карбапенемаз, могут стать источником эпидемического неблагополучия в стационаре.
В целом, с учетом всех образцов клинического материала, имеющих ген ОХА-51 и без него, различные генетические детерминанты резистентности (ОХА-23, ОХА-40 или ОХА-58) были обнаружены у 50 больных (21,7 % от числа обследованных). В материале из ротоглотки гены ОХА-карбапенемаз были обнаружены у 37 из 230 больных (16,1 %), в ректальных мазках у 10 из 138 (7,2 %), одновременно в ротоглотке и прямой кишке у 3 (2,2 %). Менее 1 % больных были носителями двух генов одновременно (ОХА-40 и 58). Всего с учетом mixt ген карбапенемазы ОХА-23 был обнаружен у 5 пациентов (2,2 %), ОХА-40 у 22 пациентов (9,6 %), ген ОХА-58 у 25 пациентов (10,9 %). Таким образом, гены ОХА-40 и ОХА-58 были распространены среди поступающих на оперативное лечение пациентов одинаково часто. При исследовании культур A. baumanii, изолированных из клинического материала при возникновении инфекционных осложнений, так же преимущественно был обнаружен ген ОХА-40 карбапенемаз [14].
При анализе частоты выявления ОХА-карбапенемаз среди больных с различной локализацией опухолевого процесса было установлено, что ОХА-40 чаще выявлялись при абдоминальной патологии (14,9 %), ОХА-58 при патологии мягких тканей/молочной железы (12,5 %) и женских репродуктивных органов (22,7 %). При этом было отмечено, что ОХА-58 чаще были обнаружены в образцах без молекулярного маркера A. baumannii, а ОХА-40 – с ним. Пока неясно, имеют ли эти данные клиническое значение или являются отражением эпидемической ситуации в конкретном стационаре.
Частота выявления генов ОХА-карбапенемаз A. baumannii (ОХА-51+) в различных локусах