adenovirus f днк что это
Роспотребнадзор (стенд)
Роспотребнадзор (стенд)
Аденовирусный энтерит
Аденовирусный энтерит
Согласно имеющимся наблюдениям, гастроэнтериты могут вызывать кишечные аденовирусы, относящиеся к серотипам 40 и 41, которые входят в группу F. Из-за недостаточности проведенных исследований на сегодняшний день трудно определить удельный вес аденовирусных гастроэнтеритов в общей структуре вирусных гастроэнтеритов. Если еще в конце 80-х годов им отводили второе место после ротавирусной инфекции в структуре гастроэнтеритов у детей, то в 90-х годах была установлена доминирующая роль калицивирусов. В ходе исследований, проводившихся в Европе, Азии, Северной и Южной Америке, было показано, что кишечные аденовирусы могут вызывать от 2 до 22% случаев гастроэнтеритов у детей в возрасте до 2 лет.
Что провоцирует Аденовирусный энтерит:
Патогенез (что происходит?) во время Аденовирусного энтерита:
Несмотря на способность кишечных аденовирусов к эпидемическому распространению, сезонность развития заболевания, тем не менее, не доказана. Как правило, кишечные аденовирусы становятся причиной заболевания детей до 2-летнего возраста, причем наиболее высок риск заболеть у детей до года. Вирусы могут иметь нозокомиальное распространение, вызывая вспышки заболевания в стационарах. Среди взрослого контингента развитие гастроэнтерита не описано, хотя вполне возможно, что при контакте с больными детьми взрослые инфицируются и переносят субклинические формы инфекции.
Симптомы Аденовирусного энтерита:
Инкубационный период составляет от 8 до 10 дней.
В отличие от других вирусных гастроэнтеритов кишечные аденовирусы вызывают более длительное заболевание (от 5 до 12 дней, а иногда и до 14 дней).
Принципиальное отличие кишечных аденовирусов от респираторных в том, что у больных не развиваются такие типичные клинические признаки, как назофарингит и кератоконъюнктивит, хотя виремия у этих больных также регистрируется.
Заболевание характеризуется умеренно выраженной интоксикацией, невысокой температурой, сохраняющейся в течение нескольких дней. В тех случаях, когда заболевание продолжается до 2 недель, у больных чаще регистрируется лихорадка неправильного типа, которая иногда носит волнообразный характер.
Диспепсические проявления в виде рвоты и диареи выражены умеренно и сохраняются 1-3 дня и более. Больные значительно чаще, чем при других вирусных гастроэнтеритов, отмечают боль в животе, которая бывает обусловлена увеличением мезентериальных лимфоузлов. Описаны случаи, когда лихорадка и боли в животе были чуть ли не единственными проявлениями аденовирусного гастроэнтерита.
В ряде случаев у больных одновременно с признаками гастроэнтерита могут выявляться изменения со стороны респираторного тракта, однако механизмы и характер формирующейся патологии изучены недостаточно.
Прогноз
Заболевание проходит самостоятельно практически без осложнений.
Диагностика Аденовирусного энтерита:
Лабораторная диагностика основана на обнаружении специфического антигена вируса в кале с помощью ИФА. Реже выделяют вирус в культуре клеток. Для определения серотипа используют реакцию нейтрализации цитопатического эффекта с соответствующей антисывороткой. Для ретроспективной диагностики в РТГА исследуют парные сыворотки, взятые на 1-5-й и 15-20-й день болезни. Также используется РСК.
Лечение Аденовирусного энтерита:
Лечение больных с аденовирусным гастроэнтеритом строится на принципах патогенетической терапии. Выбор наиболее оптимального способа лечения больных зависит от своевременной диагностики, а точнее, лабораторной верификации вирусного генеза заболевания.
Из немедикаментозных методов лечения важное место отводится диетотерапии, что определяется патофизиологическими механизмами развития диарейного синдрома. На высоте клинических проявлений заболевания следует исключить из пищи молоко и молочные продукты, ограничить прием углеводов, сахара, овощей и фруктов. По мере купирования клинических признаков заболевания диета постепенно расширяется. Учитывая, что в острый период заболевания у больных формируется ферментопатия, целесообразно назначать им комбинированные ферментные препараты, такие, как фестал, панзинорм, мезим форте и другие. Обоснованной является также терапия адсорбирующими и вяжущими препаратами, которые, в частности, способствуют оформлению кала и урежению кратности дефекации, хотя это мало влияет на развитие дегидратации. К числу таких средств относятся полифепан, смекта, препараты висмута и другие.
В литературе имеются указания на положительное влияние на течение аденовирусного гастроэнтерита различных пробиотиков. Патофизиологическим обоснованием их применения у больных с аденовирусным гастроэнтеритом служит тот факт, что штаммы, входящие в состав пробиотиков, самым непосредственным образом участвуют в процессах пищеварения, обмена веществ и детоксикации. Кроме того, у больных могут выявляться дисбиотические изменения в кишечнике.
Поскольку основным проявлением аденовирусного гастроэнтерита, определяющим тяжесть течения заболевания, является дегидратация, купирование обезвоживания составляет основу патогенетической терапии. Принципы регидратационной терапии на сегодняшний день разработаны достаточно хорошо и носят универсальный характер. В зависимости от степени дегидратации регидратацию проводят пероральным или внутривенным способом.
Пероральная регидратационная терапия проводится в том случае, если у больных отсутствуют выраженные системные проявления обезвоживания. Она проводится глюкозоэлектролитными растворами (цитроглюкосоланом, регидроном и другими), которые принимаются дробно, по 1–1,5 л в час.
Внутривенная терапия назначается больным в случае выраженных системных проявлений или при наличии неукротимой рвоты, затрудняющей оральную регидратацию. Эта терапия проводится сбалансированными полиионными кристаллоидными растворами, такими, как трисоль, квартасоль, хлосоль и другие. Объем вводимых растворов и скорость их введения определяются степенью обезвоживания. В тех случаях, когда у больных проявления интоксикации доминируют над симптомами обезвоживания, допускается введение коллоидных растворов (гемодеза, реополиглюкина и других).
Adenovirus f днк что это
Исследование для выявления серотипов 40 и 41 аденовируса, в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (ДНК) вируса в кале.
Аденовирус, серотипы F40/F41 [Полимеразная цепная реакция в режиме реального времени].
Group F adenovirus, AdV, HAd V [Real-Time Polymerase Chain Reaction, quantitative, RT-PCR, qPCR, qRT-PCR.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
Аденовирус – это безоболочечный ДНКсодержащий вирус, принадлежащий к семейству Adenoviridae. В зависимости от таких характеристик, как структура гемагглютинина, длина гена фибера и количество GC-пар в геноме, различают 68 серотипов аденовируса, объединенных в 7 групп (7 видов): A-G.
Аденовирус является возбудителем широкого спектра заболеваний человека, включая ОРВИ, конъюнктивит, геморрагический цистит и гастроэнтерит. Аденовирус – причина 4-12 % случаев вирусного гастроэнтерита. Это второе место по частоте (первое место – ротавирус). Наиболее часто аденовирусная кишечная инфекция наблюдается у детей в возрасте до 2 лет, однако также могут болеть подростки и взрослые люди. Хотя чаще заболевание имеет благоприятный прогноз, аденовирусная инфекция может принять тяжелое течение, особенно у людей с пониженным иммунитетом (состояние после трансплантации аутологичных стволовых клеток, СПИД). Разные серотипы ассоциированы с разными клиническими признаками инфекции. Так, например, серотипы C1 и B7 часто обнаруживаются при ОРВИ, тогда как серотипы F40 и F41 – при гастроэнтерите (кишечные типы вируса). Более того, показано, что разные серотипы аденовируса могут по-разному отвечать на противовирусные препараты. Учитывая эти особенности, крайне желательно идентифицировать видовую принадлежность аденовируса и его серотип.
Для диагностики аденовирусной инфекции могут быть использованы следующие методы:
РТ-ПЦР – метод молекулярной диагностики, позволяющий выявлять в биологическом материале (например, в кале) фрагменты генетического материала ДНК аденовируса. РТ-ПЦР обладает несколькими преимуществами по сравнению с другими методами диагностики аденовирусной инфекции:
Следует отметить некоторые ограничения метода РТ-ПЦР:
Результат исследования оценивается с учетом анамнестических, клинических и других лабораторных данных.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения: не обнаружено.
Что может влиять на результат?
Кто назначает исследование?
Терапевт, педиатр, врач общей практики, инфекционист, эпидемиолог.
Что такое аденовирус
Что если вам скажут, будто одна и та же группа вирусов может вызывать все на свете заболевания, – от банальной простуды до инфекций мочевого пузыря? Несколько странно, не так ли? И определенно это не та новость, которую хотелось бы услышать в преддверии гриппозно-простудного сезона (за что просим прощения).
Однако это соответствует действительности: представители группы патогенов, называемых аденовирусами, в некоторых случаях могут быть смертельно опасны. Корреспондент сайта « Health » обратился к эксперту в области инфекционных болезней за разъяснениями вопросов о том, что в сущности представляют собой аденовирусы, какие симптомы они могут вызывать и как можно вылечиться.
И вот что необходимо знать.
Согласно информационным материалам Центров по контролю и профилактике заболеваний (CDC), аденовирусами называют группу обычных вирусов, способных вызывать широкий спектр заболеваний, включая обычную простуду, желудочный грипп, ангину, бронхит, диарею, эпидемический конъюнктивит, лихорадку, – словом, все заболевания, протекающие с умеренно выраженной симптоматикой и, как правило, поддающиеся лечению в домашних условиях. Однако некоторые штаммы аденовирусов приводят к более серьезным проблемам, например, к инфекциям мочевых путей или воспалению легких.
Поскольку аденовирусы чрезвычайно разнообразны, вызываемая ими симптоматика также варьирует очень широко. В основном, развиваются респираторные заболевания и конъюнктивиты. Это означает, что именно аденовирусы «виновны» в большинстве регистрируемых случаев кашля, хрипов и зудящих красных глаз.
Отличие аденовирусов от прочих вирусов (например, от вируса гриппа) заключается в том, что первые не обязательно предпочитают холодное время года. «Аденовирусные инфекции наблюдаются круглогодично, – говорит Фрэнк Эспер, доктор медицины, педиатр, специализирующийся на инфекционных болезнях в Кливлендской клинике. – Лето нравится аденовирусу не меньше, чем зима».
Наиболее типичный путь распространения аденовирусной инфекции – через прямой контакт, например, прикосновение, кашель, чихание, рукопожатие, или же через прикосновение к зараженной поверхности с последующим касанием собственного рта, носа, глаз. Реже аденовирусы распространяются через инфицированный кал (при смене подгузника больному ребенку, например) или через воду (в общественных бассейнах и т.п.).
«Могут ли аденовирусы представлять опасность для жизни? – В некоторых случаях, да. Восемнадцатилетняя студентка колледжа при Университете Мэриленда умерла от аденовирусной инфекции во время эпидемической вспышки 2018 года, когда заболело 40 студентов и 15 из них пришлось госпитализировать».
«Как правило, – продолжает доктор Эспер, – под угрозой оказываются лица с ослабленной иммунной системой. Если у вас практически нет иммунитета, тогда аденовирус становится действительно серьезной проблемой».
Именно это случилось с погибшей девушкой, которая, как сообщает « Washington Post «, страдала и боролась с болезнью Крона, – разновидностью хронического кишечного воспаления, – постоянно принимая поддерживающие препараты в связи с данным заболеванием (определенные группы медикаментов, – используемые, в частности, для контроля болезни Крона и лечения рака, – в индивидуальных случаях могут стать причиной иммунодефицитного состояния).
Впрочем, аденовирусы могут становиться опасными даже для лиц с нормально функционирующей иммунной системой. Случится это или нет, зависит от конкретных осложнений аденовирусной инфекции. «Скажем, вирусный миокардит, т.е. воспаление сердечной мышцы, – объясняет доктор Эспер, – может развиться и у иммунокомпетентного человека, и это осложнение может стать фатальным».
«Существует ли лечение от аденовирусов? – Нет, специфическая терапия аденовирусных инфекций пока не разработана, и применяемые в этих случаях безрецептурные лекарства служат лишь для облегчения симптоматики (т.е. для устранения болей или лихорадки, снижения температуры и т.д.)».
В связи с этим приходится повторять, что лучшим средством против аденовирусных инфекций является их профилактика. Это означает частую и тщательную гигиену рук, исключение случаев употребления пищи или напитков из общей с контагиозным человеком посуды, и избегание любых людей, кто открыто кашляет или чихает (возможно, стоило бы им напомнить: хотя бы используйте локоть, пожалуйста).
В экстремальных случаях применяется препарат под названием цидофовир, но, опять же, его назначают крайне редко. По словам Ф.Эспера, «препарат очень токсичен, он сам по себе может стать причиной тяжелого состояния, например, почечной недостаточности. Обычно мы воздерживаемся от этиотропного лечения аденовирусов и прибегаем к выжидательной тактике. Больной должен быть в очень тяжелом состоянии, чтобы пришлось назначать эти медикаменты».
В общем и целом, для здорового человека аденовирусы не должны составлять особую проблему, – тем не менее, будет разумным соблюдать все меры предосторожности и, если вы все же заболели, защитить близких людей с помощью санитарно-гигиенического режима.
Аденовирусная инфекция
Аденовирусная инфекция – острый вирусный инфекционный процесс, сопровождающийся поражением дыхательных путей, глаз, лимфоидной ткани, пищеварительного тракта. Признаками аденовирусной инфекции служат умеренная интоксикация, лихорадка, ринорея, осиплость голоса, кашель, гиперемия конъюнктивы, слизистое отделяемое из глаз, нарушение функции кишечника. Кроме клинических проявлений, при постановке диагноза применяются серологические и вирусологические методы исследования. Терапия аденовирусной инфекции проводится противовирусными препаратами (внутрь и местно), иммуномодуляторами и иммуностимуляторами, симптоматическими средствами.
МКБ-10
Общие сведения
Аденовирусная инфекция – заболевание из группы ОРВИ, вызываемое аденовирусом и характеризующееся развитием ринофарингита, ларинготрахеобронхита, конъюнктивита, лимфаденопатии, диспепсического синдрома. В общей структуре острых респираторных заболеваний аденовирусная инфекция составляет около 20%.
Наибольшую восприимчивость к аденовирусам демонстрируют дети от 6 месяцев до 3-х лет. Считается, что в дошкольном возрасте практически все дети переносят один или несколько эпизодов аденовирусной инфекции. Спорадические случаи аденовирусной инфекции регистрируются круглогодично; в холодное время года заболеваемость носит характер эпидемических вспышек. Пристальное внимание к аденовирусной инфекции приковано со стороны инфекционных болезней, педиатрии, отоларингологии, офтальмологии.
Причины
В настоящее время известно более 30 сероваров вирусов семейства Adenoviridae, вызывающих заболевание человека. Наиболее частой причиной вспышек аденовирусной инфекции у взрослых выступают 3, 4, 7, 14 и 21 серотипы. Серовары типов 1, 2, 5, 6 обычно поражают детей-дошкольников. Возбудителями фарингоконъюнктивальной лихорадки и аденовирусного конъюнктивита в большинстве случаев служат серотипы 3, 4, 7.
Вирионы возбудителя содержат двухцепочечную ДНК, имеют диаметр 70-90 нм и три антигена (группоспецифический А-антиген; определяющий токсические свойства аденовируса В-антиген и типоспецифический С-антиген). Аденовирусы относительно устойчивы во внешней среде: при обычных условиях сохраняются в течение 2-х недель, хорошо переносят низкие температуры и высушивание. Вместе с тем, возбудитель аденовирусной инфекции инактивируется при воздействии ультрафиолетовых лучей и хлорсодержащих дезинфектантов.
Источником аденовирусной инфекции также могут являться вирусоносители, пациенты с бессимптомными и стертыми формами болезни. Иммунитет после перенесенной инфекции типоспецифический, поэтому возможны повторные заболевания, вызванные другим серотипом вируса. Встречается внутрибольничное инфицирование, в т. ч. при проведении парентеральных лечебных процедур.
Патогенез
Аденовирус может проникать в организм через слизистые верхних дыхательных путей, кишечника или конъюнктиву. Репродукция вируса протекает в эпителиальных клетках, регионарных лимфатических узлах и лимфоидных образованиях кишечника, что по времени совпадает с инкубационным периодом аденовирусной инфекции. После гибели пораженных клеток вирусные частицы высвобождаются и проникают в кровь, вызывая вирусемию.
Изменения развиваются в оболочке носа, миндалин, задней стенки глотки, конъюнктивы; воспаление сопровождается выраженным экссудативным компонентом, что обусловливает появление серозного отделяемого из полости носа и конъюнктивы. Вирусемия может приводить к вовлечению в патологический процесс бронхов, пищеварительного тракта, почек, печени, селезенки.
Симптомы аденовирусной инфекции
Основными клиническими синдромами, форму которых может принимать данная инфекция, служат катар дыхательных путей (ринофарингит, тонзиллофарингит, ларинготрахеобронхит), фарингоконъюнктивальная лихорадка, острый конъюнктивит и кератоконъюнктивит, диарейный синдром. Течение аденовирусной инфекции может быть легким, среднетяжелым и тяжелым; неосложненным и осложненным.
Инкубационный период при аденовирусной инфекции длится 2-12 дней (чаще 5-7 дней), вслед за чем следует манифестный период с последовательным появлением симптомов. Ранними признаками служат повышение температуры тела до 38-39 °С и умеренно выраженные симптомы интоксикации (вялость, ухудшение аппетита, мышечные и суставные боли).
Поражение дыхательных путей
Катаральные изменения в верхних дыхательных путях возникают одновременно с лихорадкой. Появляются серозные выделения из носа, которые затем становятся слизисто-гнойными; затрудняется носовое дыхание. Отмечается умеренная гиперемия и отечность слизистой оболочки задней стенки глотки, точечный белесоватый налет на миндалинах. При аденовирусной инфекции возникает реакция со стороны подчелюстных и шейных лимфоузлов. В случае развития ларинготрахеобронхита появляется осиплость голоса, сухой лающий кашель, возможна одышка, развитие ларингоспазма.
Поражение конъюнктивы
Поражение конъюнктивы при аденовирусной инфекции может протекать по типу катарального, фолликулярного или пленчатого конъюнктивита. Обычно в патологический процесс глаза вовлекаются поочередно. Беспокоит резь, жжение, слезотечение, ощущение присутствия инородного тела в глазу. При осмотре выявляется умеренное покраснение и отек кожи век, гиперемия и зернистость конъюнктивы, инъецированность склер, иногда – наличие плотной серовато-белой пленки на конъюнктиве. На второй неделе заболевания к конъюнктивиту могут присоединяться признаки кератита.
Кишечная форма
Если аденовирусная инфекция протекает в кишечной форме, возникают приступообразные боли в околопупочной и правой подвздошной области, лихорадка, диарея, рвота, мезентериальный лимфаденит. При выраженном болевом синдроме клиника напоминает острый аппендицит. Лихорадка при аденовирусной инфекции длится 1-2 недели и может носить волнообразный характер. Признаки ринита и конъюнктивита стихают через 7-14 дней, катара верхних дыхательных путей – через 14-21 день.
Осложнения
При тяжелой форме заболевания поражаются паренхиматозные органы; может возникать менингоэнцефалит. У детей первого года жизни нередко развивается аденовирусная пневмония и выраженная дыхательная недостаточность. Осложненное течение аденовирусной инфекции обычно связано с наслоением вторичной инфекции; наиболее частыми осложнениями заболевания служат синусит, средний отит, бактериальная пневмония.
Диагностика
Распознавание аденовирусной инфекции обычно производится на основании клинических данных: лихорадки, катара дыхательных путей, конъюнктивита, полиаденита, последовательного развития симптомов. Методами экспресс-диагностики аденовирусной инфекции служит реакция иммунофлюоресценции и иммунная электронная микроскопия. Ретроспективное подтверждение этиологического диагноза проводится методами ИФА, РТГА, РСК. Вирусологическая диагностика предполагает выделение аденовируса из носоглоточных смывов, соскоба с конъюнктивы и фекалий больного, однако ввиду сложности и длительности редко используется в клинической практике.
Дифференциальная диагностика
Дифференциальную диагностику различных клинических форм аденовирусной инфекции проводят с гриппом, другими ОРВИ, дифтерией глотки и глаз, инфекционным мононуклеозом, микоплазменной инфекцией, иерсиниозом. С этой целью, а также для назначения местного этиотропного лечения пациенты нуждаются в консультации офтальмолога и отоларинголога.
Лечение аденовирусной инфекции
Общая этиотропная терапия проводится препаратами антивирусного действия (умифеновир, рибавирин, препарат из антител к гамма-интерферону человека). Местная терапия аденовирусной инфекции включает: инстилляции глазных капель (раствора дезоксирибонуклеазы или сульфацила натрия), аппликации ацикловира в виде глазной мази за веко, интраназальное применение оксалиновой мази, эндоназальную и эндофарингеальную инстилляцию интерферона. Проводится симптоматическая и посиндромная терапия: ингаляции, прием жаропонижающих, противокашлевых и отхаркивающих препаратов, витаминов. При аденовирусной инфекции, отягощенной бактериальными осложнениями, назначаются антибиотики.
Прогноз и профилактика
Неосложненные формы аденовирусной инфекции оканчиваются благоприятно. Смертельные исходы могут отмечаться у детей раннего возраста в связи с возникновением тяжелых бактериальных осложнений. Профилактика аналогична предупреждению других ОРВИ. В периоды эпидемических вспышек показана изоляция больных; проведение текущей дезинфекции, проветривания и УФО помещений; назначение интерферона лицам, подвергшимся риску заражения. Специфическая вакцинация против аденовирусной инфекции пока не разработана.
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Авторы
Редакторы
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
Эта история началась в середине 1960-х, когда в препаратах аденовируса обезьян случайно было обнаружено загрязнение из маленьких неизвестных частиц [1]. Эти частицы были впоследствии названы аденоассоциированным вирусом (сокращенно ААВ, англ. adeno-associated virus, AAV). Тогда мало кто мог предположить, что именно эти крошечные вирусы дадут надежду многим неизлечимым больным. И лишь несколько исследовательских групп, движимых чисто научным любопытством, отправились изучать базовую биологию ААВ.
Прошло несколько десятков лет, и стало понятно, что ААВ обладает множеством уникальных свойств. Эти особенности позволяют использовать его в поистине революционном направлении — генной терапии. По разным оценкам, около 5% новорожденных детей страдает от различных генетических заболеваний [2]. Долгие годы такие болезни считались неизлечимыми, и для многих подобный диагноз приравнивался к приговору. К счастью, времена изменились. Мы находимся на пороге эры лекарств принципиально нового типа [3], и немаловажную роль в этом сыграл аденоассоциированный вирус [4].
Биология вируса
Какими же уникальными особенностями обладает ААВ? Чтобы ответить на этот вопрос, нужно подробнее поговорить про его жизненный цикл и строение.
Аденоассоциированный вирус принадлежит к роду Dependoparvovirus семейства Parvoviridae. Название рода отражает его необычный жизненный цикл, когда для размножения необходимо наличие вспомогательного вируса (от лат. Dependo — «зависеть»). В качестве такого вируса-помощника, как правило, выступает аденовирус (что явно следует из названия) или представители семейства герпесвирусов [5].
ААВ настолько безобиден, что помимо неспособности самостоятельно размножаться, он не вызывает никаких заболеваний человека и животных. Более того, согласно некоторым исследованиям, большинство людей (>70%) в течение жизни были заражены одним или несколькими серотипами ААВ [6]. (Серотип — вариант вируса, который отличается от других антигенами на своей белковой оболочке).
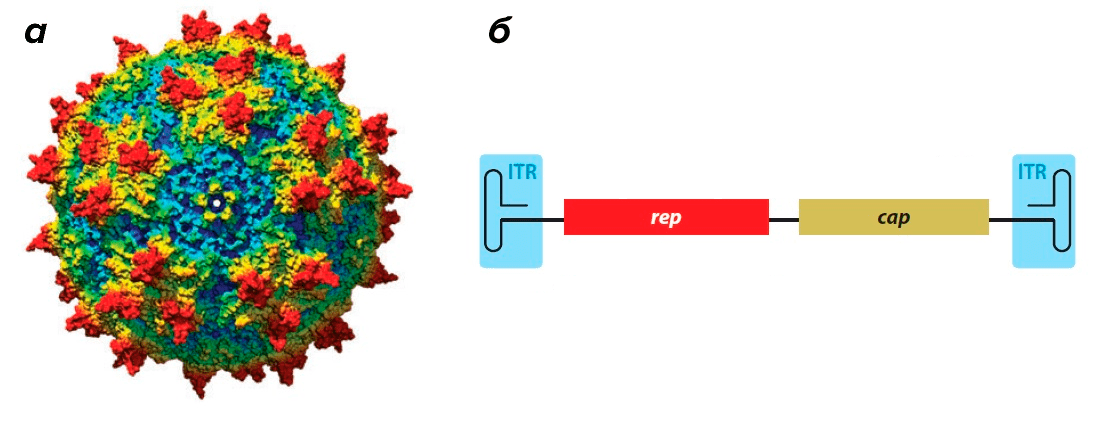
Вирус довольно мал — его икосаэдрическая белковая оболочка (капсид) в диаметре составляет всего около 25 нм (риc. 1а). Капсид необычайно стабилен: устойчив к кратковременному воздействию тепла, кислой среде и протеазам [7]. Геном, представленный одноцепочечной ДНК, по размерам также весьма скромен — всего 4,7 тысяч нуклеотидов [7].
Этот небольшой геном содержит минимальное количество генов. Ген rep (от слова replication) кодирует белки, необходимые для размножения вируса и его дальнейшей сборки внутри клетки (рис. 1б). Ген cap (от слова capsid) кодирует белки капсида (рис. 1б).
Геном ААВ обрамлен двумя Т-образными шпильками — инвертированными концевыми повторами (inverted terminal repeats, ITR) (рис. 1б).
Рисунок 1. Аденоассоциированный вирус. а — Модель капсида ААВ. б — Геном аденоассоциированного вируса. ITR (inverted terminal repeats) — инвертированные концевые повторы, образующие Т-образные шпильки; rep — ген, кодирующий белки, отвечающие за репликацию; cap — ген, кодирующий белки капсида.
Судьба вируса в клетке
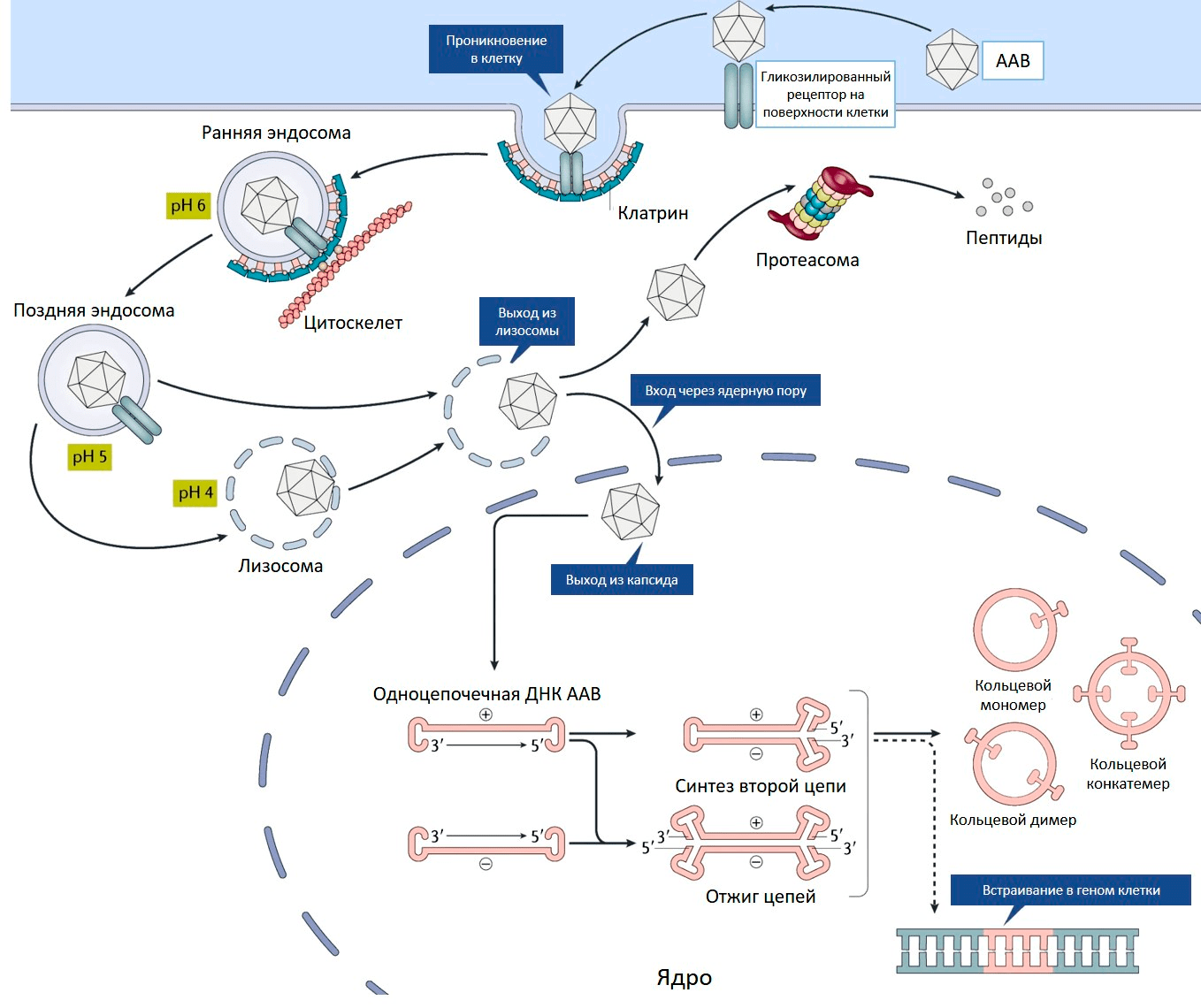
Ценное свойство ААВ — его способность проникать как в делящиеся, так и неделящиеся клетки [8]. На первом этапе аденоассоциированный вирус связывается с рецептором на поверхности клетки (рис. 2) [9]. Разные серотипы ААВ предпочтительно связываются со своими рецепторами, характерными для определенных типов клеток [10].
Рисунок 2. Проникновение ААВ внутрь клетки. Пояснения в тексте.
[9], рисунок с изменениями
И это важное свойство — определенный серотип преимущественно проникает лишь в конкретную ткань или орган, то есть обладает своим уникальным тропизмом.
Связывание вируса с рецептором запускает процесс проникновения внутрь клетки. Эндосома (мембранный пузырек, содержащий вирусную частицу) передвигается в цитоплазме по цитоскелету. Постепенно среда в эндосоме закисляется, что приводит к изменениям капсида, необходимым для дальнейшего успешного заражения клетки. После выхода из эндосомы у вируса два пути. Либо он попадает в клеточную машину по уничтожению белков (протеасому) и разрушается, либо переносится в ядро, где вирусный геном высвобождается из капсида (рис. 2) [10].
С одноцепочечного вирусного генома еще не могут нарабатываться белки, для этого необходимо достроить вторую цепь ДНК. Она синтезируется с помощью ДНК-полимеразы клетки-хозяина, используя шпильку ITR в качестве затравки для построения второй цепи.
Вирусные ITR помогают не только строить вторую цепь ДНК, но способствуют межмолекулярной и внутримолекулярной рекомбинации геномов вируса. В результате в ядре клетки образуются кольцевые молекулы ДНК — эписомы (рис. 2). В такой форме геномы ААВ могут в течение многих лет присутствовать в ядре [10].
Кроме того, геном ААВ может с низкой частотой встраиваться в определенный локус на 19 хромосоме человека [11]. Этот феномен обусловлен сходством последовательностей ДНК данного локуса и ITR вируса. У ААВ, лишенного гена rep, способность к встраиванию своего генома сильно снижена. Такие вирусные геномы присутствуют в клетках в виде эписом.
Модификация ААВ для применения в генной терапии
Если в гене человека произошла мутация, которая привела к развитию заболевания, то болезнь можно победить или облегчить, если доставить в клетки организма рабочую копию поломанного гена. Вот тут и выходит на сцену аденоассоциированный вирус.
Что же нужно было в нем изменить, чтобы он стал курьером для доставки таких терапевтических генов? Как это часто бывает в биологии, ученые просто воспользовались успешными решениями, уже созданными природой. Раз капсид ААВ сам по себе является ключом к входу в клетку и ядро, то можно смело этим воспользоваться. Остается только заменить гены самого вируса на гены, интересующие исследователя, и вирусный курьер готов!
Модификация генома ААВ
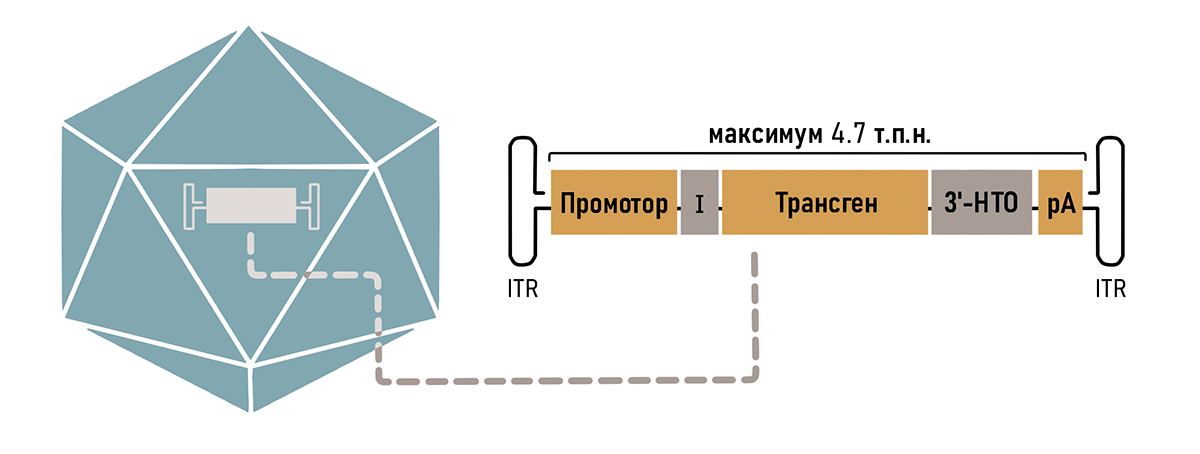
Оказалось, что от всего генома ААВ необходимо было оставить только концевые шпильки ITR, необходимые для сборки самого вируса и сохранения его генома в ядре (рис. 3) [12]. Таким образом, можно без последствий удалить до 96% генома ААВ, используя полученное пространство для кодирования нужных генов.
Так как ААВ вмещает в себя всего около 5000 пар нуклеотидов, то нужно очень тщательно продумать остальной состав кассеты. В первую очередь туда необходимо поместить рабочую копию гена (трансген), в зависимости от того генетического заболевания, на которое направлено лечение. Также обязательно наличие регуляторных последовательностей, таких как промотор и сигнал полиаденилирования (рис. 3). Разберем элементы кассеты подробнее.
Рисунок 3. Компоненты типичной кассеты ААВ вектора. Оранжевые блоки (промотор, трансген и сигнал полиаденилирования — рА) являются обязательными компонентами. Для повышения эффективности экспрессии могут быть включены необязательные регуляторные элементы, такие как интрон (I) и другие компоненты 3′-нетранслируемой области (НТО). Кассета обрамлена инвертированными терминальными повторами (ITR).
рисунок авторов статьи
Из-за ограниченной емкости вируса могут возникнуть трудности с доставкой больших терапевтических генов. Очевидное решение проблемы — разработка сокращенной версии гена, который кодирует усеченный, но функциональный белок. Создание таких укороченных генов требует глубокого понимания биологии терапевтического белка, взаимосвязи его структуры и функции. Такой подход уже успешно применяется в нескольких клинических испытаниях по лечению миодистрофии Дюшенна [13] (ссылки на клинические испытания: NCT03368742, NCT04281485, NCT03769116), в доклинических исследованиях по лечению дисферлинопатии, амавроза Лебера и многих других заболеваний.
Другим потенциально перспективным подходом для доставки слишком больших трансгенов может быть разделение гена между двумя ААВ-векторами [14]. Два этих векторных генома, попадая в одно и то же ядро клетки, могут подвергаться межмолекулярной рекомбинации с последующим восстановлением полноразмерного гена. Такой двухвекторный подход пока применяется лишь в редких клинических испытаниях (пример — NCT02710500). Низкая эффективность восстановления полноразмерного гена ограничивает более широкое применение этого приема.
Правильно выбранный промотор — во многом залог успешной генной терапии. Идеальный промотор должен запускать стабильную высокую экспрессию трансгена в пораженных органах в течение длительного периода, при этом быть неактивным в других тканях. Малая емкость ААВ также требует уменьшения размера промотора [15].
К кассету можно добавить необязательные элементы, способные улучшить экспрессию трансгена (рис. 3). Так, например, присутствие интрона повышает стабильность РНК в ядре [16], а также способствует эффективному транспорту мРНК из ядра в цитоплазму [17].
К обеспечению тканеспецифичности можно подойти с другой стороны — не только стимулируя экспрессию в целевых тканях, но и подавляя ее в нежелательных органах с помощью механизмов РНК-интерференции [18]. Для этого в 3′-НТО-кассеты добавляют сайты связывания микроРНК, присутствующих строго в нецелевых органах (рис. 3) [19]. Если трансген оказывается в нежелательном органе, то микроРНК связывается с комплементарными ей сайтами в транскрипте и запускает его деградацию.
Модификация капсида ААВ
Хотя капсид ААВ — сам по себе уже удачное изобретение природы, человечество не остановилось в своем научном поиске. Новые серотипы ААВ могут обладать рядом преимуществ:
Благодаря развитию новых методов анализа выделяют несколько основных направлений для создания или выявления новых серотипов.
К сожалению, всегда существует вероятность, что хорошо работающий in vitro модифицированный капсид в экспериментах на лабораторных животных продемонстрирует низкую эффективность или даже токсичность. Всестороннее изучение свойств разрабатываемых препаратов и строгий контроль качества призваны минимизировать риск неблагоприятного исхода исследований [23].
Применение ААВ в клинике
Целевые органы, на которые направлена терапия
К 14 декабря 2020 года 227 препаратов на основе ААВ проходят клинические испытания (по данным сайта ClinicalTrials.gov). Сегодня уже существует несколько препаратов на основе ААВ, которые получили одобрение от регулирующих органов для коммерческого использования у пациентов (подробнее про эти препараты можно почитать в [4]):
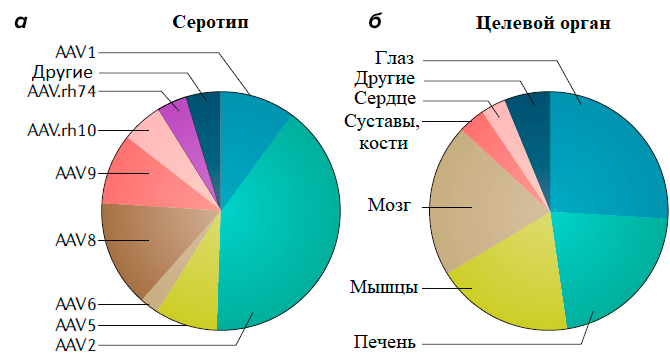
Большинство серотипов ААВ «предпочитают» проникать в такие органы, как печень, поперечно-полосатые мышцы и ЦНС, что и определило направление большинства программ генной терапии (рис. 4).
Рисунок 4. Данные с сайта ClinicalTrials.gov: на 13 ноября 2018 г. было зарегистрировано 145 клинических испытаний с использованием ААВ. а — Классифицикация клинических испытаний на основе примененного серотипа ААВ (AAV). б — Целевой орган, на который направлена терапия в указанных клинических испытаниях. Можно заметить, что спустя два года количество клинических испытаний с применением ААВ почти удвоилось (227 на сегодняшний день против 145 испытаний два года назад).
Почти все природные серотипы ААВ эффективно заражают печень после внутривенного введения. Благодаря данному свойству вируса в клинических испытаниях находятся препараты для лечения гемофилии A и B (NCT03392974, NCT03587116), семейной гиперхолестеринемии (NCT02651675), дефицита орнитинтранскарбамилазы (NCT02991144), мукополисахаридоза-IIIA (NCT03612869) и синдрома Криглера—Найяра (NCT03223194) [25].
Серотипы ААВ8 и ААВ9 могут эффективно заражать разные типы мышц по всему телу. Такое свойство делает их идеальными векторами для генной терапии множества мышечных заболеваний [26]. Так, активно исследуются в клинике препараты для лечения миодистрофии Дюшенна (NCT03375164), дисферлинопатии (NCT02710500), миотубулярной миопатии (NCT03199469), болезни Помпе (NCT03533673). Примечательно, что зараженная мышца может также служить биофабрикой для производства секретирующихся терапевтических белков для лечения немышечных заболеваний. Хотя большинство сердечных заболеваний полигенны и подвержены влиянию окружающей среды, ведется разработка препаратов генной терапии для лечения сердечной недостаточности [26].
Большой процент разрабатываемых препаратов на основе ААВ направлен на лечение неврологических и глазных болезней (рис. 4) [27], [28]. Глаз — весьма обособленный орган, обладающий уникальной иммунологической толерантностью, и легко доступный для прямого введения препарата. Нетрудно понять, почему один из первых одобренных препаратов, «Люкстурна», был направлен именно на лечение наследственной слепоты. Мозг, напротив, намного более крупный и сложно организованный орган. Прямая доставка препарата в мозг или спинномозговую жидкость позволяет локализовать вирус и снизить дозу препарата, но это инвазивная процедура, сопряженная со многими рисками. К счастью, такие серотипы, как ААВ9 или ААВrh.10, могут пересекать гематоэнцефалический барьер, что позволяет использовать рутинное внутривенное введение. В настоящий момент в клинических испытаниях уже находятся препараты для лечения болезни Паркинсона (NCT02418598), метахроматической лейкодистрофии (NCT01801709), болезни Баттена (NCT01414985), мукополисахаридоза 3 типа (NCT03300453).
Основные стратегии генной терапии на основе рААВ
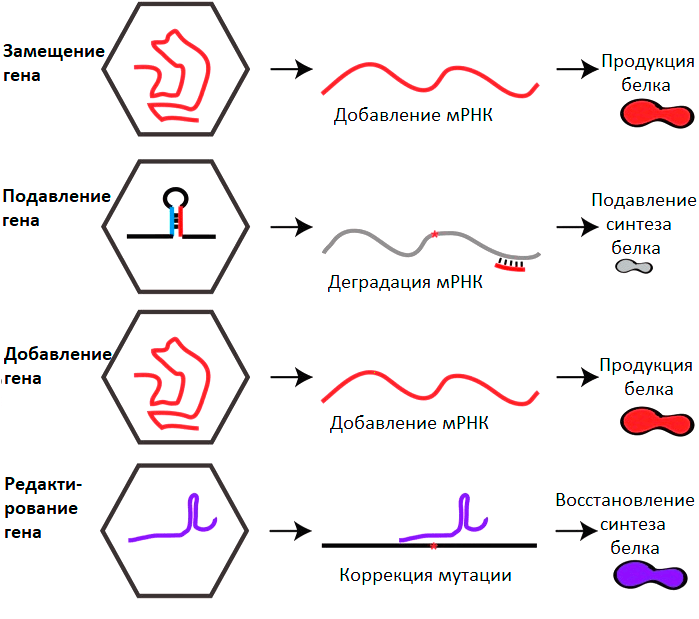
Можно выделить 4 глобальных направления генной терапии с применением ААВ (рис. 5).
Рисунок 5. Основные стратегии генной терапии на основе ААВ. Пояснения в тексте.
[29], рисунок с изменениями
Производство ААВ
Когда речь идет о клинических испытаниях, требуется очень большое количество вирусного препарата высокого качества. Его производство — весьма нетривиальная задача.
Вирусы не могут самостоятельно себя воспроизводить, им необходима помощь клеточной машинерии. Для наработки ААВ стали использовать культуры клеток. Вариантов может быть много: использование культуры дрожжей (Saccharomyces cerevisiae) [33], клеток насекомых (культура клеток Sf9 бабочки Spodoptera frugiperda) [34], человека — HEK293, HeLa. Некоторые из этих подходов, — скорее, экзотика, но использование культур клеток млекопитающих (HEK293) или насекомых (Sf9) уже прочно закрепилось на производстве.
Итак, для начала необходимо определиться с методикой производства, ведь от этого зависит, в чем будет расти сама культура. Вариантов масса: для клеток, растущих, прикрепившись к субстрату, это могут быть большие чашки Петри, специальные сосуды с множеством перегородок для увеличения площади поверхности (рис. 6а). Для культур, хорошо чувствующих себя в виде суспензии и при постоянном перемешивании, — колбы, герметичные пакеты и многое другое. При увеличении масштабов производства можно переходить на специальные биореакторы (рис. 6б). С их помощью можно следить за целой панелью важных для процесса параметров. Они делают производство более технологичным и позволяют увеличить объемы продукции до нескольких сотен литров вирус-содержащей суспензии за один цикл работы.
Рисунок 6. Производство ААВ: на культуральных чашках (а) и в биореакторе iCellis Nano (Pall corporation) (б)
фотографии авторов статьи
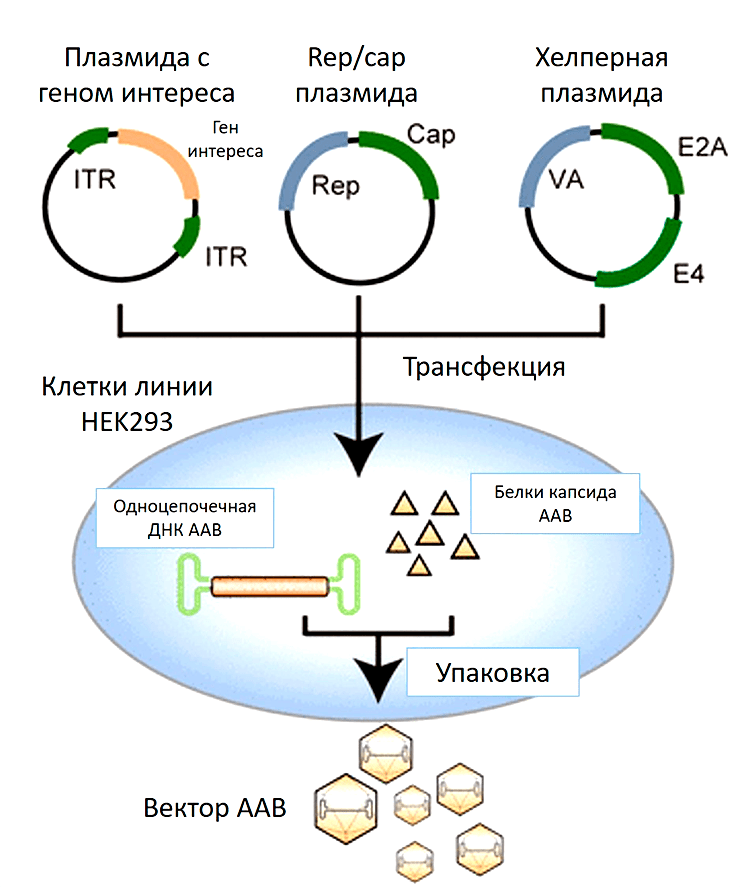
Что нужно сделать с культурой клеток, чтобы она стала биофабрикой по производству вирусных частиц? В такие клетки-производители вносят плазмидную ДНК, кодирующую необходимую для сборки вирусов информацию. Наиболее популярный протокол предполагает одновременное заражение клеток тремя плазмидами (рис. 7):
Кстати, вместо третьей плазмиды может быть добавлен сам вирус-помощник (аденовирус или герпесвирус), как это было в более ранних протоколах по производству частиц ААВ [35].
Рисунок 7. Производство ААВ, использующее в качестве клеток-производителей культуру клеток человека HEK293. Смесь трех плазмид доставляют внутрь клетки (плазмиду с терапевтическим геном, плазмиду, кодирующая гены rep/cap, и плазмиду с генами вируса помощника). Начинается наработка необходимых белков для сборки вирусных частиц. ДНК, содержащая терапевтический ген, упаковывается в готовый капсид ААВ.
Клетки начинают производить вирусные частицы, после чего их надо собрать и очистить.
Это критически важный этап, которому стоит уделить особое внимание [22], [23]. Любые примеси, которые будут содержаться в препарате, могут вызвать нежелательный иммунный ответ.
Вначале собирают сырой материал: это может быть клеточная среда, если вирусы выделяются клетками преимущественно в жидкость вокруг, а могут быть и сами клетки, если большинство вирусных частиц накапливается внутри. Как правило, это зависит от конкретного серотипа ААВ. Чтобы разрушить клеточные мембраны и высвободить вирус, клетки подвергают многочисленным циклам замораживания-оттаивания, ультразвуковой обработке или воздействию детергентов.
Теперь основная задача — очистить вирусные частицы от многочисленных примесей, находящихся в суспензии (рис. 8). В сыром материале находятся внутриклеточные свободные ДНК и РНК, белки и ферменты, крупные обломки клеточных мембран и многое другое. Способов очистки существует множество, и постоянно появляются как улучшенные версии уже применяемых методик, так и принципиально новые подходы. Все они различаются по уровням специфичности, эффективности и, разумеется, стоимости. Условно способы очистки можно разделить на серотип-специфичные и универсальные. К первой категории относится, например, аффинная хроматография [37], основанная на специфическом узнавании капсидов антителами. Ко второй — ультрацентрифугирование в градиентах плотности растворов йодиксанола или хлорида цезия, преципитация полиэтиленгликолем или сульфатом аммония, ионообменная хроматография и многие другие методы, основанные на общих физических свойствах вирусных частиц [38].
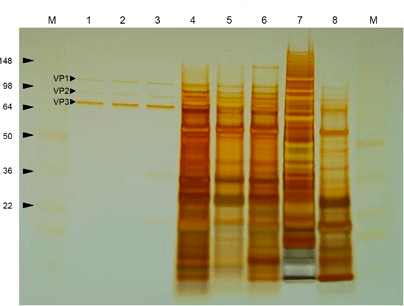
Рисунок 8. Окрашивание серебром очищенного (лунки 1–3) и загрязненного другими белками (лунки 4–8) препарата ААВ после гель-электрофореза [38].
Одна из неочевидных нежелательных примесей — так называемые пустые капсиды — вирусные частицы, не несущие в себе терапевтический ген, или содержащие внутри себя постороннюю ДНК. Дело в том, что изначально в клетке формируется пул пустых капсидов. Лишь потом ДНК связывается с пустым капсидом при помощи специальных сигналов на ITR и компактно упаковывается, формируя полноценную вирусную частицу. Но иногда пустой капсид может так и остаться пустым при нехватке вирусной ДНК или ее неэффективной упаковке. В пустой капсид может также упаковаться обрывок свободной ДНК, находящейся в клетке и содержащей последовательность, схожую с сигналом упаковки. Такие частицы (совсем пустые или несущие неправильную последовательность) не функциональны и подлежат удалению из очищаемого препарата. С определенной эффективностью их можно отделить от функциональных капсидов, используя градиенты плотности или методы хроматографии.
Основные проблемы
Наработка большого количества плазмид высокой степени очистки, поддержание культур клеток, дорогостоящие реактивы, сложный процесс очистки вирусных частиц и разработка аналитических методик для характеризации препаратов ведут к таким космическим ценам при масштабировании производства. На стоимость также влияет серьезный контроль качества вирусного препарата. Чтобы препарат вышел на рынок, проводятся исследования его токсичности, безопасности, биораспределения, эффективности. Оценивается содержание белковых примесей, бактериальных эндотоксинов, количество пустых капсидов, стерильность препарата, концентрация вирусных частиц в растворе и множество других характеристик [23]. В настоящий момент гиганты производств ААВ по всему миру работают над удешевлением препаратов, разрабатывая более эффективные протоколы сборки и очистки ААВ.
Иммунный ответ также представляет собой серьезную проблему. Потенциально иммунные реакции могут возникать на вирусный капсид, его геном, а также на белковый продукт трансгена. Препаратам на основе ААВ могут помешать нейтрализующие антитела к его капсиду [39]. Связываясь с вирусами в кровотоке, антитела препятствуют проникновению вирусных частиц в клетки, что ведет к низкой эффективности препарата. В настоящий момент обязательно проводится скрининг пациентов на наличие антител к применяемому серотипу ААВ [40]. В случае их обнаружения такой пациент исключается из клинических испытаний. Ведется разработка новых капсидов, которые не будут узнаваться нейтрализующими антителами [41]. После доставки терапевтических доз ААВ быстро развивается гуморальный иммунный ответ, который впоследствии помешает повторному введению препарата [42]. Именно поэтому большинство генотерапевтических препаратов на основе ААВ рассчитано на однократное введение. Для подавления Т-клеточного иммунного ответа у пациентов применяется фармакологическая супрессия стероидами [40].
Заключение
Генная терапия на основе ААВ — бурно развивающееся направление, и мы в данном обзоре затронули лишь небольшой кусочек этой удивительной области. Текущий экспоненциальный рост клинических испытаний с использованием ААВ предполагает, что мы находимся в самом начале эры новых генотерапевтических препаратов. Еще очень много задач предстоит решить, и для этого требуются мультидисциплинарные усилия. Дальнейшее развитие молекулярной биологии, биоинформатики, эпидемиологии, структурной биологии, иммунологии, геномики и других дисциплин, безусловно, будет способствовать совершенствованию технологии. Уже пройден длинный путь в попытке человечества победить генетические заболевания. Мы надеемся, что именно генная терапия приведет к окончательной победе!