аллогенная трансплантация костного мозга в россии
Загадки пересадки
Серьезные пробелы в официальной статистике трансплантаций костного мозга
Из ответа Министерства здравоохранения РФ на запрос Русфонда следует: в 2018 году в России провели 1696 трансплантаций костного мозга (ТКМ). Годом раньше была сделана 1481 ТКМ, а в 2016-м – 1402. Рост выглядит внушительным, но за цифрами скрываются структурные проблемы, особенно в сфере донорства.
В статистике Минздрава есть серьезный пробел. Ведь ТКМ делятся на аутологичные, то есть с использованием собственного костного мозга пациента, и аллогенные, когда пересаживают донорский костный мозг. Это важное разделение: аллогенная трансплантация дороже, сложнее, ее делают в меньшем количестве клиник, для нее нужно найти донора. Но отдельную статистику по двум видам ТКМ Минздрав начал вести только с 2018 года: тогда, сообщило нам министерство, были произведены 691 аллогенная трансплантация и 1005 аутологичных.
Минздрав оценивает результаты последних лет сдержанно, но не без позитива: «Для детского населения этот вид помощи предоставляется в основном всем, кто имеет медицинские показания к ТКМ». Статистика детских трансплантаций известна за 2017 год – тогда операции провели 378 детям. У взрослых потребность в ТКМ составляет, по оценке министерства, 4200 в год, примерно вчетверо больше реального количества операций. Но эту потребность надо «скорректировать с учетом клинических показаний и противопоказаний», потому что не больше половины пациентов достигают необходимого для ТКМ состояния ремиссии. Сколько получается после корректировки, Минздрав не сообщает и в другие статистические детали не вдается.
Ситуация в мире
Оценки министерства не бьются с мировой статистикой. Взять утверждение, что ТКМ в России осуществляется «в основном всем» детям, которым она требуется. В США, по данным Центра международных исследований трансплантации крови и костного мозга (Center for International Blood and Marrow Transplant Research), в 2018 году детям до 18 лет было произведено около 1600 аллогенных трансплантаций. То есть 49 детских аллогенных ТКМ на 10 млн американского населения. Узнать количество аллогенных детских трансплантаций в России нам не удалось. Но даже если взять общее количество аллогенных трансплантаций в нашей стране в 2018 году – 691, получится всего 47 трансплантаций на 10 млн человек. То есть в России общее количество аллогенных ТКМ меньше, чем количество детских аллогенных ТКМ в США (с учетом разницы в населении). Едва ли тут можно говорить о том, что потребность российских детей в ТКМ удовлетворена.
В целом в США в прошлом году было сделано примерно 14 600 аутологичных и 8700 аллогенных ТКМ, это чуть больше 700 трансплантаций на 10 млн населения. В Европе в 2015 году (более свежие данные очень разрозненны) провели 42 тыс. ТКМ, то есть около 600 на 10 млн. Российский результат 2018 года – 115 трансплантаций на 10 млн.
Со статистикой ТКМ проблемы не только в Европе. По данным ВОЗ, ежегодно в мире проводится примерно 50 тыс. ТКМ. Происхождение этой цифры неизвестно, но она устарела по крайней мере лет на десять. Судя по всему, общемировые данные по ТКМ в последний раз целенаправленно собирались в 2012 году – тогда в 77 странах мира было сделано в общей сложности 68 146 трансплантаций. Сейчас, помимо США и Европы, более или менее четкая статистика ведется в Японии: в 2016 году несколько десятков трансплантационных центров этой страны провели примерно 5,5 тыс. ТКМ. В Юго-Восточной Азии и Австралии в 2015 году было сделано 12 тыс. трансплантаций. Про всю Латинскую Америку известна только одна цифра – 2300 ТКМ в Бразилии в 2016 году. Если сложить все эти данные и учесть, что количество трансплантаций постоянно растет, получится примерно 100 тыс. ТКМ в год. Много это или мало?
Как говорят врачи, проблема в том, что потребность в ТКМ определить практически невозможно – она растет вместе с развитием медицины, показания к таким операциям постоянно расширяются. Чаще всего необходимость в ТКМ возникает при лейкозах, но трансплантация применяется и при первичных иммунодефицитах, и при целом ряде аутоиммунных заболеваний, например при рассеянном склерозе. Постепенно увеличивается и максимальный возраст, при котором ТКМ еще возможна. Так что количество трансплантаций продолжает расти и в развитых странах. Например, в США за последние пять лет оно выросло более чем на 15%.
ТКМ в России
В России абсолютный лидер по количеству ТКМ – петербургский НИИ детской онкологии, гематологии и трансплантологии имени Р.М. Горбачевой. В 2017 году (прошлогодних данных НИИ не предоставил) здесь было проведено 400 ТКМ, из них 270 аллогенных. На втором месте – НМИЦ имени Дмитрия Рогачева в Москве: 222 трансплантации в 2017-м, из них 170 аллогенных. Видимо, следом идет московский НМИЦ гематологии, глава которого Валерий Савченко – главный гематолог России. В 2015 году (НМИЦ отказался давать свежие данные) здесь провели 182 трансплантации, из них 59 аллогенных. НИИ онкологии имени Н.Н. Петрова в Петербурге, судя по количеству госквот на ТКМ, проводит примерно 150 трансплантаций в год. В петербургском НМИЦ имени В.А. Алмазова (это единственный центр, оперативно предоставивший Русфонду свежие подробные данные) в 2018 году было проведено 128 трансплантаций – 53 аллогенные и 75 аутологичных. Кировский НИИ гематологии после долгих колебаний сообщил лишь примерные цифры: ежегодно здесь проводится около 70 ТКМ, из них полтора десятка – аллогенные.
Важная тенденция для России – уменьшение доли аллогенных трансплантаций. В докладе главного внештатного трансфузиолога России Татьяны Гапоновой, представленном прошлой осенью на одной из конференций по ТКМ, содержались такие цифры: в 2015 году из 1042 ТКМ на аллогенные пришлось 499, то есть почти 50%. В 2018-м доля аллогенных ТКМ составила уже 41%. Ничего удивительного, говорят гематологи: в России появляется все больше новых центров, занимающихся ТКМ. Начинают такие центры с аутологичных трансплантаций как более простых. Недаром на аутологичную трансплантацию государство выделяет около 2 млн руб., а на аллогенную – более 3 млн. Аллогенные пересадки – следующая ступень развития. Например, в 2016 году впервые взялся за аллогенные трансплантации НМИЦ онкологии имени Петрова. В 2017 году госквоты на трансплантации получили в общей сложности 18 центров (документ есть в распоряжении Русфонда). И про пять из них известно, что аллогенные ТКМ там не проводятся.
Вторая тенденция связана с донорством. Костный мозг для аллогенных трансплантаций можно получать от родственных и неродственных доноров, совпадающих с реципиентом по HLA – генам гистосовместимости. Поиск донора начинают с родственников. Родные братья и сестры могут полностью совпадать по HLA, но вероятность такого совпадения – всего 25%. У родителей и детей иначе: они всегда совпадают по генам гистосовместимости примерно наполовину. Такие доноры называются гаплоидентичными. В последние годы их используют все чаще, но это не универсальное решение, так как связано с целым рядом ограничений. Во всех остальных случаях приходится искать неродственного донора. С 2015 по 2018 год включительно в России проведено больше 2 тыс. неродственных ТКМ. Причем российских доноров использовали, по данным Русфонда, менее чем в 15% случаев. В 2017 году НМИЦ гематологии использовал 19 российских и 29 зарубежных доноров, НИИ Горбачевой – 33 российских и 98 зарубежных. Костный мозг от иностранного донора обходится в 3–4 раза дороже, чем от российского, времени на активацию донора нужно больше, а прогноз выживаемости при этом оказывается хуже. Возможность использовать местный материал зависит прежде всего от количества потенциальных доноров. Сейчас в России их 94 тыс. человек, это 0,06% всего населения. Для сравнения: в Британии участниками регистров доноров стали уже 2% населения, в Германии – 9%, в Израиле – 12%. Российских доноров явно не хватает, но государство достаточных средств для увеличения их количества не выделяет: Минздрав так глубоко в тему ТКМ еще не погрузился.
Трансплантация костного мозга и стволовых клеток
Общие принципы
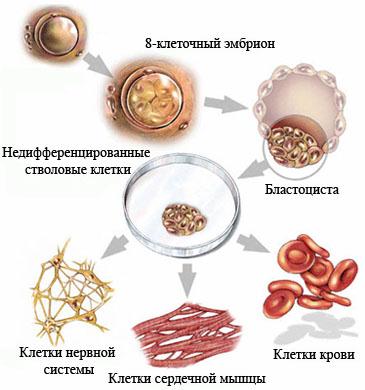
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 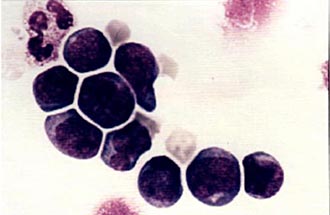 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
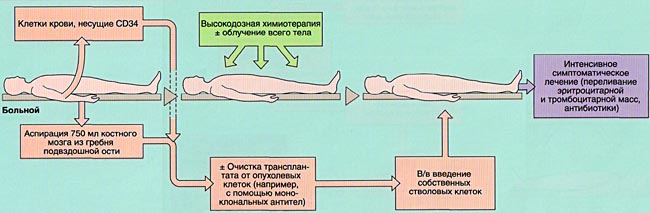
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
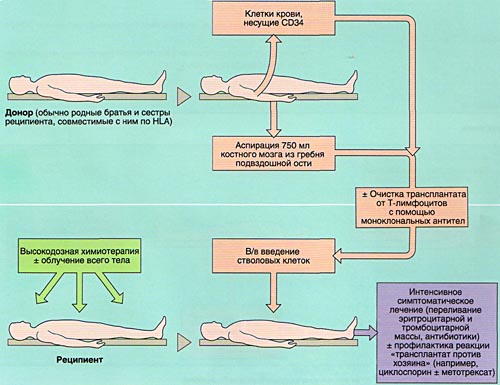
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Трансплантация костного мозга/кроветворных стволовых клеток
Трансплантация костного мозга/кроветворных стволовых клеток — эффективный метод лечения заболеваний системы крови, врожденных и приобретенных иммунодефицитов, аутоиммунных заболеваний нервной системы и соединительной ткани, а также отдельных форм злокачественных новообразований у детей и взрослых. Ежегодно в мире выполняется более 50000 трансплантаций костного мозга. Для многих пациентов трансплантация подарила шанс на избавление от страшного недуга. Трансплантация позволяет не только получить длительные и устойчивые ремиссии заболевания, когда традиционное лечение является бессильным, но при ряде заболеваний полностью излечиться от тяжелой болезни.
Технология и виды трансплантации
Технология проведения трансплантации костного мозга или кроветворных стволовых клеток периферической крови предполагает внутривенное введение в организм пациента предварительно забранной у донора или самого пациента и, специально обработанной суспензии костного мозга или стволовых кроветворных клеток периферической крови. Значительно реже, в основном у детей, применяются кроветворные стволовые клетки пуповинной крови. Как правило, проведению трансплантации предшествует интенсивная химиотерапия, основной целью которой является максимальная редукция опухолевых клеток и клеток иммунной системы.
В зависимости от источника трансплантируемых клеток выделяют:
Успех трансплантации зависит от активности самого заболевания (состояние ремиссии) и физического состояние пациента (возраст, сопутствующие заболевания, функциональное состояние основных органов и систем).
Показаниями для проведения аутологичной трансплантации являются:
Аллогенная трансплантация — вид трансплантации при котором пересаживают донорские кроветворные клетки (костный мозг, кроветворные стволовые клетки периферической крови, кроветворные клетки пуповинной крови), полностью или частично совместимые по генетическому признаку. Вероятность генетического совпадения схожести кроветворной ткани родственников составляет не более 25%. Поэтому в последнее время все чаще используется частично совместимые кроветворные клетки доноров не родственников. Поиск неродственного донора осуществляется в регистре доноров костного мозга, в котором подбирается совместимый с пациентом донор. Совместимость определяется после проведения лабораторных тестов, которые определяют генетический профиль тканей донора и пациента, это исследование называется HLA-типирование — антигены тканевой совместимости (human leucocyte antigens). Для исследования достаточно крови донора и реципиента. В Российской федерации имеются два регистра костного мозга: ФГБУ НМИЦ гематологии Минздрава России, г. Москва и ФГБУ Кировский научно-исследовательский институт гематологии и переливания крови ФМБА России, г. Киров.
Показанием для этого вида трансплантации являются:
В клинике гематологии и клеточной терапии им. А.А. Максимова ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России выполняется более 200 различных видов трансплантаций кроветворных стволовых клеток. Коллектив клиники, ежедневно заботясь о здоровье пациентов, искренне верит, что трансплантация периферических стволовых кроветворных клеток — это путь к Вашему выздоровлению.
Пересадочный узел
Как это работает: 8 важных вопросов о трансплантации костного мозга
специальный корреспондент Русфонда
Мы собрали непростые, интересные и важные вопросы, которые присылают волонтеры, помогающие нам привлекать потенциальных доноров костного мозга в Национальный регистр. Ответы будут полезны всем, кто хочет разобраться в теме донорства, пересадки костного мозга и работе регистров доноров.
Программа «Русфонд.Регистр».
Помощь в создании
Национального регистра
доноров костного мозга
1. Сколько учреждений делают в России трансплантацию костного мозга и какие из них используют базу доноров Русфонда?
В России сейчас около двух десятков центров, занимающихся трансплантацией костного мозга (ТКМ). С каждым годом их количество увеличивается. Крупнейшие среди них (больше сотни трансплантаций в год) – НИИ детской онкологии, гематологии и трансплантологии имени Р.М. Горбачевой, НМИЦ онкологии имени Н.Н. Петрова и НМИЦ имени В.А. Алмазова – в Санкт-Петербурге, НМИЦ имени Дмитрия Рогачева и НМИЦ гематологии – в Москве. Есть и маленькие центры, делающие менее десятка трансплантаций в год. Некоторые даже крупные центры занимаются не всеми видами трансплантации (подробнее об этом читайте в материале «Загадки пересадки»).
Регистр, о котором идет речь, называется не «база доноров Русфонда», а Национальный регистр доноров костного мозга имени Васи Перевощикова (Национальный РДКМ). Год назад мы предложили трансплантационным центрам пользоваться Информационной системой Национального регистра – речь шла о подключении программного обеспечения, созданного для оптимизации поиска неродственных доноров пациентам, которые нуждаются в трансплантации костного мозга. За год работы к системе подключились шесть клиник: НМИЦ имени Дмитрия Рогачева, Российский НИИ гематологии и трансфузиологии ФМБА, НМИЦ имени Алмазова, НМИЦ онкологии имени Н.Н. Блохина, Морозовская детская городская клиническая больница и Областная детская клиническая больница в Екатеринбурге. Мы рассматриваем запросы не только от этих учреждений, но и от врачей, работающих в центрах, которые еще не подключились к инфосистеме Национального РДКМ.
2. Почему Национальный РДКМ не сотрудничает с НМИЦ гематологии и другими регистрами? Какова статистика донаций и выздоровлений?
Мы предлагаем всем трансплантационным центрам подключиться к Информационной системе Национального РДКМ. За первый год существования регистра этим предложением воспользовались шесть медицинских центров, в том числе несколько самых крупных. Вопрос, почему НМИЦ гематологии и некоторые другие центры еще не начали с нами сотрудничать, надо задавать этим центрам. В начале 2019 года Минздрав РФ разослал в онкогематологические центры письмо о возможности использования инфосистемы Национального РДКМ.
По данным на 4 октября 2019 года, в Национальном РДКМ было 27 020 потенциальных доноров. За год существования регистр получил от трансплантационных центров больше сотни первичных запросов на поиск донора. По этим запросам удалось подобрать восемь доноров для четырех пациентов: обычно для каждого реципиента стараются найти как минимум двух доноров, ведь кто-то может не подойти по состоянию здоровья, кому-то не позволят приехать неожиданные обстоятельства. Всем им было сделано подтверждающее типирование – это необходимая процедура перед забором костного мозга. Реальными донорами стали три человека. Сейчас идет подбор доноров еще для троих пациентов.
Задача регистров – поиск и активация донора. Лечением занимаются трансплантационные центры, они же собирают и анализируют статистику. Судьба пациента не зависит от того, из какого конкретно регистра он получил костный мозг для пересадки.
3. Является ли Национальный РДКМ закрытым?
Любой регистр потенциальных доноров костного мозга по определению закрытый: доступ к нему могут получить только медицинские центры и врачи, которым нужен костный мозг для трансплантации. В регистрах хранятся данные о генотипе множества людей – это информация, которая не подлежит разглашению. Этим принципом руководствуются регистры доноров костного мозга во всем мире. Медицинский центр, где проводится ТКМ, не знает имени и фамилии донора, не имеет его контактных данных. При желании донора они могут быть сообщены реципиенту только через два года после трансплантации.
4. Могут ли пациенты или их родители сами искать донора в регистре?
Регистры доноров, как правило, сотрудничают с трансплантационными центрами или врачами. Пациент может обратиться к своему лечащему врачу с просьбой поискать потенциальных доноров в Национальном РДКМ. Трансплантационные центры получают специальный ключ для присоединения к Информационной системе. А отдельно взятый врач может просто написать в наш поисковый отдел med@rdkm.ru – и Национальный РДКМ сам осуществит для него поиск.
5. Есть ли шанс у Полины Коноваловой из Миасса найти донора среди протипированных в «Инвитро»?
Болезнь Полины Коноваловой побудила многих жителей Миасса сдать кровь на типирование. Но цель таких акций – не помощь конкретному человеку. Вероятность, что кто-то из сотни или даже нескольких сотен пришедших сможет стать донором именно для Полины, крайне мала. Сдавая кровь, вы помогаете тем людям, которым костный мозг понадобится в будущем: чем больше регистр, тем выше вероятность, что для них вовремя найдется подходящий донор и они будут спасены. А совместимый донор для Полины Коноваловой уже найден в одном из немецких регистров, сейчас она в НИИ имени Горбачевой.
6. Что представляет собой институт в Казани, где находится ваша лаборатория по типированию? Что это за лаборатория? Типирование проводят студенты?
Лаборатория по типированию была введена в строй в 2018 году по инициативе и на деньги Русфонда в Институте фундаментальной медицины и биологии Казанского (Приволжского) федерального университета. Это научно-исследовательская лаборатория при университетской клинике. Лабораторией заведует кандидат наук, типированием занимаются научные сотрудники. В ней используется технология NGS (next generation sequencing – секвенирование нового поколения). Этот метод позволил поднять качество и скорость исследования, вдвое сократив его цену. Стоимость включения одного донора в Национальный РДКМ – 9,6 тыс. руб.
7. Для точного подбора донора необходимо сравнить его с реципиентом по 5 парам генов. Не используют ли в вашей лаборатории в Казани для уменьшения затрат меньшее количество генов?
Все типирования в Казани проводятся по 5 парам генов в высоком разрешении. Это значит, что по данным такого типирования донора можно подобрать сразу, не прибегая к дополнительным исследованиям.
8. Второе типирование Русфонд делает самостоятельно и потом отсылает результат анализа в лечебное учреждение?
При типировании по технологии NGS все необходимые для подбора донора данные получают из первого исследования, изучать генотип более подробно не требуется. Но обязательно проводится так называемое подтверждающее типирование: ТКМ – очень серьезное и тяжелое вмешательство. Прежде чем ее проводить, данные о генотипе обязательно надо перепроверить. Подтверждающее типирование, как правило, делается в том лечебном учреждении, где будет проводиться ТКМ. Донору не приходится туда ехать: трансплантационный центр работает только с образцом его крови.