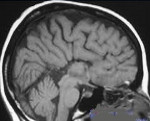
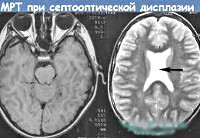
аплазия прозрачной перегородки головного мозга
Аплазия прозрачной перегородки головного мозга
Диагностика пороков развития головного мозга у новорожденных
Улезко Е.А. Минск, 7-я городская клиническая больница
За период 1990 – 2002 гг. обследовано 3750 новорожденных. Для оценки головного мозга применялись ультразвуковое исследование (НСГ), рентгеновская (КТ) и магнитно-резонансная (МРТ) компьютерная томография.
К порокам развития головного мозга, которые имеют характерные ультразвуковые признаки и диагностируются у новорожденных при НСГ без применения КТ и МРТ, мы отнесли пороки конечного мозга (агенезия, аплазия мозолистого тела; порэнцефалия; голопрозэнцефалия), мозжечка, желудочковой системы и субарахноидального пространства (порок Денди – Уокера, гидроцефалия, гидроанэнцефалия) и некоторые другие пороки развития (кисты сосудистого сплетения и полости прозрачной перегородки, сосудистые мальформации).
Агенезия мозолистого тела при НСГ определяется широко расположенными в коронарной плоскости передними рогами боковых желудочков, полость прозрачной перегородки не визуализируется, нередко наблюдается расширение желудочковой системы. В сагиттальной плоскости отмечается нарушение расположения извилин: отсутствует поясная извилина, борозды отходят веерообразно. Окончательно мозолистое тело формируется после шести месяцев жизни, поэтому говорить о гипоплазии в периоде новорожденности не корректно.
Порэнцефалические кисты при НСГ визуализируются как округлые с четкой стенкой анэхогенные структуры, сообщающиеся с желудочковой системой и субарахноидальным пространством. В ряде случаев определить сообщение с желудочком можно только при КТ или МРТ. Отличить единичную кисту от псевдокисты после ПВК IV степени практически невозможно, при этом следует оценивать данные анамнеза. К порэнцефалии относится также шизэнцефалия. Последняя характеризуется расщелинами вдоль борозд мозга.
Арахноидальные кисты развиваются при формировании дупликатуры паутинной оболочки. При НСГ эти кисты округлые или овальные, анэхогенные, с четкими ровными контурами, нередко приводят к деформации желудочковой системы и гидроцефалии. Для дифференциации порэнцефалии и арахноидальных кист используются КТ или МРТ.
Применение НСГ, КТ и МРТ позволило выделить следующие формы голопрозэнцефалии: алобарная, семилобарная, лобарная. При алобарной форме определяется единая полость вместо боковых и третьего желудочков; зрительные бугры не разделены; отсутствуют обонятельные луковицы, мозолистое тело и серповидный отросток мозговой оболочки. Алобарную форму необходимо дифференцировать с гидроанэнцефалией (отсутствие гемисфер мозга). Семилобарная форма характеризуется наличием одного желудочка, отмечается рудимент затылочных долей. Боковые желудочки сливаются в области передних рогов и тел, отсутствуют мозолистое тело и обонятельные луковицы, зрительные бугры могут быть частично разделены, третий желудочек гипоплазирован. При лобарной форме боковые желудочки соединены между собой на уровне передних рогов, отсутствует прозрачная перегородка, нижние и задние рога хорошо различимы, третий желудочек дифференцирован. Септооптическая форма голопрозэнцефалии, а также агенезия полости прозрачной перегородки при НСГ, КТ и МРТ имеют аналогичные лобарной голопрозэнцефалии характеристики.
Аплазия (гипоплазия) мозжечка, аплазия (агенезия) червя мозжечка, как правило, являются составной частью синдромов множественных пороков развития, в единичных случаях могут наблюдаться изолированно. При НСГ в области мозжечка определяется анэхогенная полость, однако для уточнения диагноза следует использовать КТ или МРТ.
Порок Денди – Уокера характеризуется агенезией или гипоплазией мозжечка, кистозным расширением IV желудочка, как правило, внутренней гидроцефалией. При НСГ в задней черепной ямке визуализируется полость больших размеров. Намет мозжечка смещается вверх, мозжечок значительно гипоплазирован, возможно расширение боковых и третьего желудочков. Для дифференциальной диагностики с ретроцеребеллярной кистой и mega cisterna magna применяется МРТ.
Врожденная гидроцефалия легко диагностируется ультразвуковым методом, однако в случаях окклюзионной формы необходимо использование МРТ. К редким порокам головного мозга, которые определяются при НСГ, можно отнести кисту полости прозрачной перегородки и кисту сосудистого сплетения.
Аневризма вены Галена при НСГ визуализируется в виде анэхогенной структуры с нечеткими контурами за третьим желудочком, при этом может отмечаться расширение желудочковой системы.
Для диагностики аномалий извилин и борозд необходимо применение КТ или МРТ. НСГ в единичных случаях выявляет данную патологию.
Точная диагностика порока Арнольда-Киари (порок спинного мозга и позвоночника) также возможна лишь при использовании МРТ.
Таким образом, для качественной диагностики патологии головного мозга у новорожденных, в частности пороков развития, необходимо разумное сочетание различных методов исследования.
Аплазия прозрачной перегородки головного мозга
а) Терминология:
1. Сокращения:
• Септооптическая дисплазия (СОД)
2. Синонимы:
• Синдром де Морсье
• Сидром Kaplan-Grumbach-Hoyt
• Супраселлярная дисгенезия
• Септооптическитипофизарная дисгенезия
3. Определение:
• Гетерогенные изменения характеризуются гипоплазией зрительного нерва (ГЗН), отсутствием прозрачной перегородки, дисфункцией гипоталамо-гипофизарной системы:
о Де Морсье (1956): описаны семь пациентов с септооптической дисплазией (СОД)
о Hoyt (1978): описано сочетание септооптической дисплазии (СОД) с гипопитуитаризмом
• Некоторые авторы считают септооптическую дисплазию (СОД) и лобарную голопрозэнцефалию «перекрывающимися» состояниями
• СОД плюс: аномалии зрительных нервов/хиазмы, прозрачной перегородки, гипофиза + кортикальные дисплазии
б) Визуализация септооптической дисплазии (СОД):
1. Общие характеристики:
• Лучший диагностический критерий:
о Отсутствие прозрачной перегородки, малые размеры хиазмы зрительных нервов
• Локализация:
о Зрительные нервы, гипофиз, прозрачная перегородка
• Размеры:
о Малые размеры зрительных нервов
о Малые размеры гипофиза в сочетании с эктопией его задней доли
о Отсутствие прозрачной перегородки
• Морфология:
о Корональные срезы:
— Уплощение крыши желудочков
— Заострение книзу передних рогов боковых желудочков
2. КТ при септооптической дисплазии (СОД):
• Бесконтрастная КТ:
о Отсутствие прозрачной перегородки
о Большие размеры боковых желудочков
о Малые размеры зрительных отверстий глазниц на аксиальных и корональных срезах
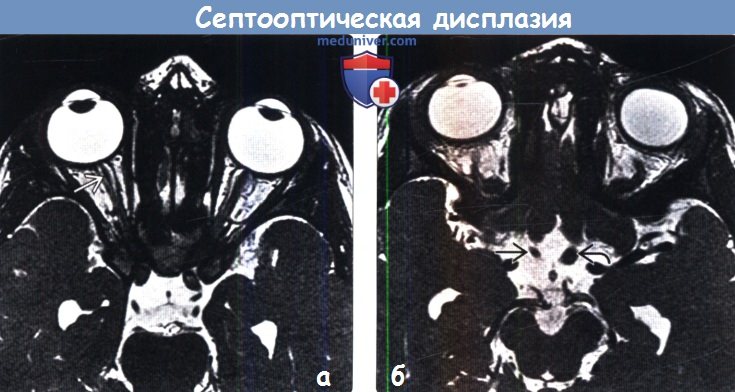
(б) МРТ, последовательность, получаемая в устойчивом состоянии (FIESTA) с толщиной среза 1 мм, аксиальный срез: у того же пациента определяются малые размеры интракраниального отдела правого зрительного нерва. Сравните его с нормальным левым зрительным нервом.
3. МРТ при септооптической дисплазии (СОД):
• Т1-ВИ:
о Исследование в трех взаимно перпендикулярных плоскостях имеет ключевое значение для выявления всех изменений:
— Отсутствие прозрачной перегородки (может быть представлена фрагментарно)
— Уплощение крыши передних рогов боковых желудочков, заострение их книзу
— Малые размеры зрительных нервов/их хиазмы (подавление сигнала от жира помогает в визуализации зрительных нервов)
— ± тонкая воронка гипофиза, малые размеры передней доли гипофиза
— ± эктопия задней доли гипофиза
— Каллозально-форникальная непрерывность или слияние по средней линии структур свода
— Тонкое мозолистое тело
— Вертикальное расположение гиппокампов
— ± гипоплазия/аплазия обонятельных нервов
— ± шизэнцефалия
— ± гетеротопия, полимикрогирия
— Средне-заднемозговые аномалии (короткий средний мозг, малые размеры моста, толстая пластинка четверохолмия, дисплазия червя) являются значительными, хотя и в недостаточной степени признанными, компонентами спектра аномалий септооптической дисплазии
• Т2-ВИ:
о Гипоплазия серпа (особенно в передних отделах) ± гипомиелинизация
• Постконтрастные Т1-ВИ:
о ± эктопия задней доли гипофиза
о Задержка контрастирования передней доли гипофиза на динамических сканах
4. Ангиография:
• Обычные
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ
• Советы по протоколу исследования:
о Корональные, сагиттальные тонкие срезы через турецкое седло/орбиты
о Используйте подавление сигнала от жира или CISS/FIESTA/SPACE для лучшей визуализации зрительных нервов
в) Дифференциальная диагностика септооптической дисплазии (СОД):
1. Синдромы, симптомы которых перекрываются с симптомами септооптической дисплазией:
• Оптико-инфундибулярная дисплазия, нормально сформированная прозрачная перегородка
• Шизэнцефалия в сочетании с отсутствием прозрачной перегородки
2. Синдром Каллмана:
• Отсутствие обонятельных нервов
• ± аномалии зрительных структур, прозрачной перегородки, гипофиза
3. Голопрозэнцефалия:
• Сходна с СОД
о Многие считают ГПЭ и СОД одной и той же патологией 4. Изолированная эктопия задней доли гипофиза:
• Нормально сформированные зрительные нервы/их хиазма, прозрачная перегородка
г) Патология септооптической дисплазии (СОД):
1. Общие характеристики:
• Этиология:
о Теории:
— Наследственный дефект срединных структур (легкая разновидность голопрозэнцефалии)
— Или вторичная дегенерация волокон зрительных нервов вследствие поражения головного мозга
— Или сосудистые нарушения (полевой дефект) во время эмбрионального развития головного мозга
— Повреждение головного мозга и зрительных нервов в период около шестой недели гестации
— Тератогены: цитомегаловирус, противосудорожные препараты, алкоголь, материнский диабет
• Генетика:
о Большинство являются спорадическими
о Некоторые имеют аутосомно-доминантное или рецессивное наследование
о В некоторых случаях наблюдаются мутации в гене HESX1:
— Гомозиготные мутации = полный синдром
— Гетерозиготные мутации = более легкие гипофизарные фенотипы
о Инактивация HESX1 (3р21,2—3р21.2) за счет Arg53Cys замены приводит к недостаточности передней доли гипофиза (не встречается при спорадической СОД)
о Также описаны мутации FGFR1, PROKR2
• Ассоциированные аномалии:
о Септооптическая дисплазия (СОД) часто сочетается с другими аномалиями развития головного мозга:
— Наиболее часто = шизэнцефалия
— Перисильвиева полимикрогирия
3. Лечение:
• Заместительная гормональная терапия
е) Диагностическая памятка:
1. Обратите внимание:
• Предполагайте септооптическую дисплазию (СОД) у детей малого роста с отсутствием прозрачной перегородки
2. Советы по интерпретации изображений:
• Малые размеры зрительных нервов в сочетании с эктопией задней доли гипофиза и отсутствием прозрачной перегородки
ж) Список литературы:
Редактор: Искандер Милевски. Дата публикации: 28.2.2019
Септооптическая дисплазия (СОД)
История и этимология:
Синонимы:
Эпидемиология.
Обычно обнаруживается у детей раннего возраста. Более часто наблюдается у детей молодых матерей и первенцев. Равнозначно встречается у мужчин и женщин. Встречаемость составляет 1:50000 (по всему миру).
Гипоплазия зрительных нервов
Септикооптическая дисплазия
Этиология
Теории:
Факторы риска:
Выявлен ряд факторов риска:
Патология
Ассоциированные аномалии
Септикооптическая дисплазия часто сочетается с другими аномалиями развития головного мозга
Симптомы септикооптической дисплазией перекрывается с таковыми при синдромах с патологией зрительных структур, прозрачной перегородки, лобных долей, срединных структур, обонятельных структур.
Стадирование и классификация:
Макроскопические и хирургические особенности
Особенности на микроскопическом уровне:
Клинические проявления:
Симптомы септикооптической дисплазией перекрывается с таковыми при синдромах с патологией зрительных структур, прозрачной перегородки, лобных долей, срединных структур, обонятельных структур.
Наиболее частые признаки и симптомы:
Общий осмотр и другие данные:
Септооптическая дисплазия
Септооптическая дисплазия – врожденное заболевание, относящееся к порокам прозэнцефалической группы, характеризуется аномалиями развития зрительного нерва, гипофиза и прозрачной перегородки. Симптомами этого состояния являются нистагм и другие зрительные нарушения, признаки эндокринных расстройств (задержка роста и полового созревания), возможно развитие умственной отсталости. Диагностика септооптической дисплазии производится на основании данных общего осмотра больного, офтальмологических исследований, компьютерной и магнитно-резонансной томографии головного мозга, а также молекулярно-генетических анализов. Специфическое лечение не разработано, симптоматические мероприятия включают в себя коррекцию зрения и заместительную гормональную терапию при эндокринных расстройствах.
Общие сведения
Септооптическая дисплазия (синдром де Морсье) – врожденное нарушение развития головного мозга и зрительного аппарата различной (в том числе и генетической) природы. Причинами этого состояния, помимо генетических мутаций, могут выступать инфекции матери во время вынашивания ребенка, молодой возраст родителей, сосудистые нарушения у женщины. Название «септооптическая дисплазия» ввел французский педиатр Де Морсье, который в 1956 году составил наиболее обширное и полное описание этого состояния. В настоящий момент под синдромом Де Морсье врачи-генетики подразумевают только наследственную форму септооптической дисплазии. На сегодняшний день общая встречаемость этого заболевания (как приобретенных, так и наследственных форм) составляет примерно 1 случай на 10 000 новорожденных, мальчики и девочки поражаются с одинаковой частотой. Выраженность септооптической дисплазии может значительно отличаться у разных больных – от практически полного отсутствия симптомов до тяжелых нарушений, осложненных ДЦП, отставанием в физическом и умственном развитии.
Причины септооптической дисплазии
Септооптическая дисплазия наследственного характера развивается по причине мутаций в гене HESX1, расположенного на 3-й хромосоме. Этот ген принадлежит к обширному классу гомеобоксных генов, принимающих активное участие в регуляции процессов эмбриогенеза. В частности, HESX1 регулирует эмбриональное развитие структур головного мозга (прозрачной перегородки, гипофиза, хиазмы, зрительного нерва), поэтому его мутации приводят к развитию септооптической дисплазии. Кроме этого, доказано участие данного гена в регуляции осевой и двухсторонне-симметричной структуры тела. На сегодняшний день выявлено четыре типа миссенс-мутаций гена HESX1, наличие которых обуславливает появление признаков септооптической дисплазии, все они наследуются по аутосомно-рецессивному типу.
Выраженность симптомов заболевания может существенно различаться – от незначительных зрительных нарушений (миопии, косоглазия) до яркой клинической картины со слепотой, гипопитуитаризмом и тяжелой умственной отсталостью. Исследователи пока не нашли взаимосвязи между типом мутации HESX1 и тяжестью симптомов септооптической дисплазии. Возможно, развитие этого заболевания является результатом совокупного влияния как внутренних (генетических), так и внешних факторов. Также остается неясным то обстоятельство, что у детей молодых матерей (в возрасте менее 23 лет) септооптическая дисплазия возникает чаще, а ее наследственная разновидность протекает намного тяжелее.
Патогенез септооптической дисплазии заключается в нарушении процесса дифференцировки эмбриональных тканей в области зачатков гипофиза, хиазмы, мозолистого тела и других структур мозга. По этой причине данное заболевание в тяжелых случаях может сопровождаться другими неврологическими симптомами – детским церебральным параличом, умственной отсталостью. Практически всегда при септооптической дисплазии выявляются те или иные нарушения зрения и эндокринные расстройства, обусловленные пороками развития гипофиза. Из-за этого возможно возникновение вторичных патологий, вызванных аномальной функцией желез внутренней секреции.
Симптомы септооптической дисплазии
Возраст появления симптомов септооптической дисплазии сильно варьирует у разных больных, в тяжелых случаях диагноз может быть поставлен в первые дни и месяцы жизни, при стертой форме заболевания – лишь в младшем или даже старшем детском возрасте. Обычно первым проявлением патологии становится развитие горизонтального нистагма, обусловленное гипоплазией зрительного нерва. Еще раньше при осмотре ребенка могут определяться признаки эндокринной недостаточности гипофиза: гипогликемия, уменьшенный размер половых органов, аномальная желтуха. В редких случаях в первые месяцы жизни при септооптической дисплазии возникают судорожные припадки, длительное сохранение транзиторных рефлексов и другие неврологические нарушения.
По мере роста ребенка, страдающего септооптической дисплазией, может выявляться отставание как в физическом, так и в интеллектуальном развитии. Патологии зрения нарастают, нередко случаются эпилептические припадки. У таких больных обычно раньше, чем у сверстников, начинается процесс полового созревания, обусловленный эндокринными расстройствами. Однако в ряде случаев эндокринные нарушения могут быть выражены довольно слабо или совсем отсутствовать. Такая же ситуация и с задержкой психического развитием больных септооптической дисплазией – она колеблется от нормального интеллекта до глубокой умственной отсталости. Последняя может указывать на наличие сопутствующих пороков развития головного мозга – голопрозэнцефалии, гипоплазии мозолистого тела. Непостоянство симптомов и различная степень их выраженности значительно осложняет диагностику септооптической дисплазии.
Диагностика и лечение септооптической дисплазии
Для определения септооптической дисплазии используются результаты общего осмотра больного, неврологические и офтальмологические исследования, магнитно-резонансная и компьютерная томография, молекулярно-генетические анализы. При осмотре может обнаруживаться отставание в физическом развитии (у детей раннего возраста), раннее наступление полового созревания (у подростков), признаки множественной гормональной недостаточности. Офтальмологическое обследование может выявить нистагм и признаки гипоплазии зрительного нерва – уменьшение размеров диска зрительного нерва, ослабление всех пиков на ЭРГ, полную слепоту. Однако по клинической картине диагностировать септооптическую дисплазию достаточно проблематично, поскольку это состояние характеризуется значительной вариабельностью симптомов.
На магнитно-резонансной томографии определяется отсутствие или выраженное недоразвитие прозрачной перегородки, аплазия или гипоплазия зрительного нерва, в ряде случаев – недоразвитие мозолистого тела. Выявляются нарушения в формировании гипофиза, в особенно тяжелых случаях септооптической дисплазии могут обнаруживаться другие пороки центральной нервной системы, например, голопрозэнцефалия. Биохимический анализ крови позволяет подтвердить наличие недостаточности гормона роста (соматотропина) и других гормонов гипофиза. Молекулярно-генетическая диагностика осуществляется врачом-генетиком, производится прямое секвенирование гена HESX1 с целью подтверждения мутаций. Отсутствие генетических дефектов не является поводом для исключения септооптической дисплазии, так как заболевание может возникать вследствие причин ненаследственного характера. «Золотым стандартом» в диагностике этого состояния являются данные МРТ и КТ.
Специфического лечения септооптической дисплазии не существует, применяют симптоматические и паллиативные лечебные мероприятия. При наличии эндокринных нарушений назначают заместительную терапию, схема которой зависит от характера гормональной дисфункции, что определяется в рамках анализа крови. В большинстве случаев септооптической дисплазии нарушения зрения практически не поддаются коррекции. Симптоматическая терапия включает в себя применение противосудорожных препаратов (при эпилептических припадках) и ноотропных средств, работу детских психологов с больным ребенком при умственной отсталости.
Прогноз и профилактика септооптической дисплазии
Прогноз септооптической дисплазии чаще всего неопределенный из-за сильной вариабельности проявлений заболевания. При наличии тяжелой гипоплазии зрительных нервов, гипофиза, прозрачной перегородки существует крайне высокий риск летального исхода в раннем детстве из-за многочисленных нарушений. Аналогично ухудшают прогноз септооптической дисплазии сопутствующие патологии – детский церебральный паралич, голопрозэнцефалия. Во многих случаях заболевание протекает достаточно благоприятно – симптомы ограничиваются незначительными нарушениями зрения, иногда наличием слабо выраженной умственной отсталости, повышенным риском судорожных припадков. Профилактика септооптической дисплазии возможна только в отношении форм заболевания, обусловленных ненаследственными причинами – инфекционными болезнями матери, ее молодым (юным) возрастом, сосудистыми нарушениями во время беременности.
Аплазия прозрачной перегородки головного мозга
Септооптическая дисплазия (Синдром de Morsier) – это заболевание характериующееся гипоплазией зрительного нерва, отсутствием прозрачной перегородки и дисфункцией гипоталамо-гипофизарной системы.
Эпидемиология
Заболеваемость оценивается в 1/10000 новорожденных.
Клиническая картина
Степень тяжести варьирует, и только 30% пациентов демонстрируют полную клиническую триаду. Гипоплазия зрительного нерва может быть односторонней или двусторонней (в 57 и 32% случаев соответственно), а у 23% пациентов наблюдается значительное нарушение зрения. Гипопитуитаризм присутствует у 62-80% пациентов, и хотя дефицит гормона роста (приводящий к низкому росту у детей) является наиболее частой эндокринной аномалией, могут развиваться дополнительные гормональные недостаточности (тиреостимулирующий, адренокортикотропный и дефицит гонадотропин-рилизинг гормона). Дефекты средней линии головного мозга включают агенезию Pellucidum Septum (60% случаев) и / или мозолистого тела. Также сообщалось о связанных пороках развития коры (иногда упоминается как синдром СОД-плюс). Интеллектуальный дефицит и неврологические проявления (задержка развития, судороги и церебральный паралич) могут присутствовать. Дополнительные результаты могут включать несахарный диабет, нарушения сна, аутизм, преждевременное половое созревание, ожирение, нарушения терморегуляции, аносмию, нейросенсорную тугоухость и сердечные и цифровые аномалии.
Этиология
Большинство случаев СОД являются спорадическими, но семейные случаи так же описаны. Наиболее часто встречаются как гомозиготные (аутосомно-рецессивный), так и гетерозиготные (аутосомно-доминантная) мутации в гене HESX1 (3p21.2-p21.1) которые были описаны в семейных случаях. Так же имеется связь с тремя дополнительными генами с ассоциированным фенотипом, которые могут рассматриваться как часть спектра СОД: мутации SOX2 (3q26.3-q27), связанные с анофтальмией / микрофтальмией и особенностями SOD; мутации / дупликации в гене SOX3 (Xq26.3), связанные с аномалиями мозга средней линии и гипопитуитаризмом (хотя глазные дефекты еще не были описаны); и мутации OTX2 (14q21-q22), связанные с гипопитуитаризмом и гипоплазией передней доли гипофиза, с дефектами глаза или без них. Мутации в этих генах обнаруживаются у