атф в головном мозге что это
Мозг, общение нейронов и энергетическая эффективность
По всей видимости, в эволюции сформировались энергетически эффективные механизмы кодирования и передачи информации в мозге. Подпись: «Усердно пытаюсь минимизировать энергозатраты».
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
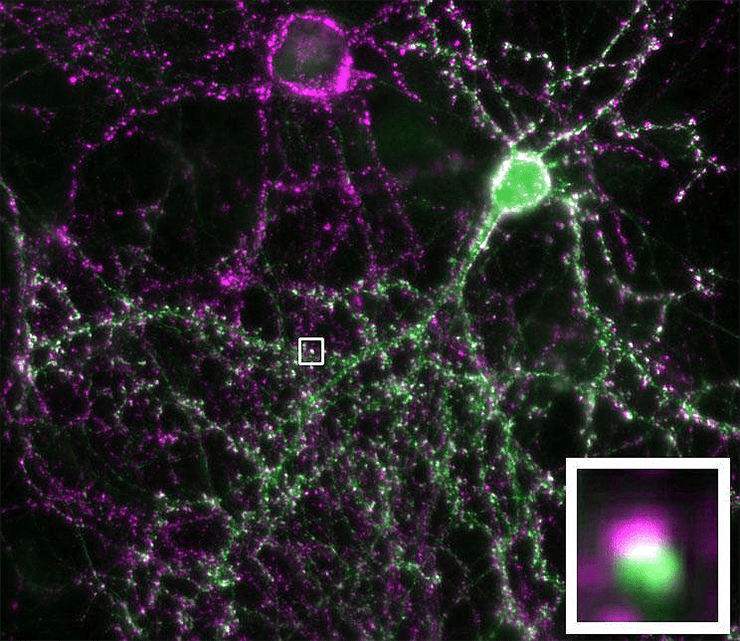
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
Интернейроны отличаются способностью генерировать значительно более высокочастотные сигналы, чем другие нейроны. Они также содержат больше митохондрий, главных органелл энергетического метаболизма, «фабрик» по производству АТФ. Последние к тому же содержат большое количество белков цитохром-с оксидазы и цитохрома-с, являющихся ключевыми для метаболизма. Так, интернейроны являются крайне важными и, в то же время, энергозатратными клетками [8], [9], [11], [16].
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Поиск оптимума
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
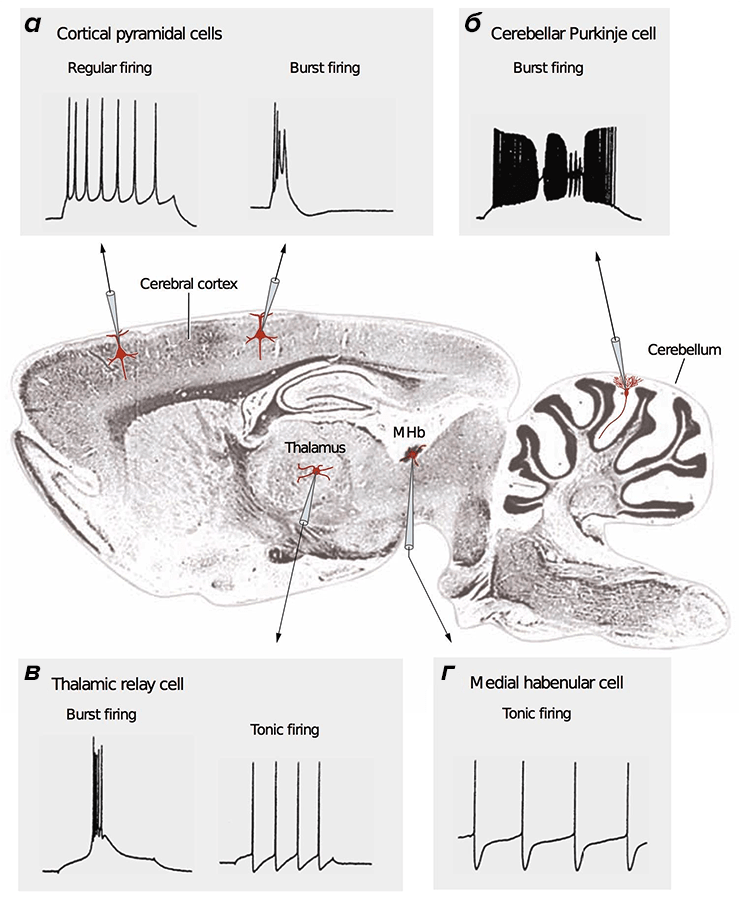
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Что такое потенциал действия?
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
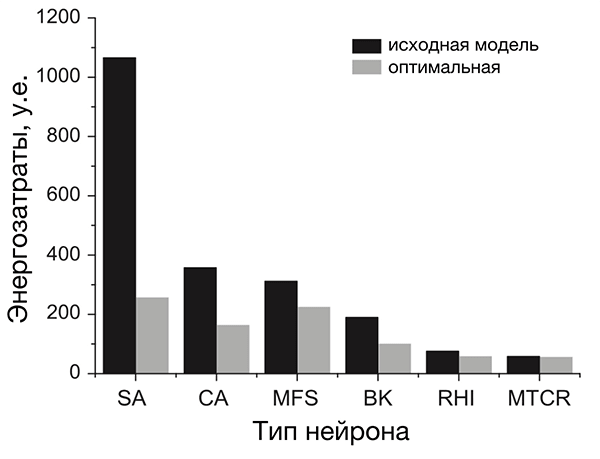
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
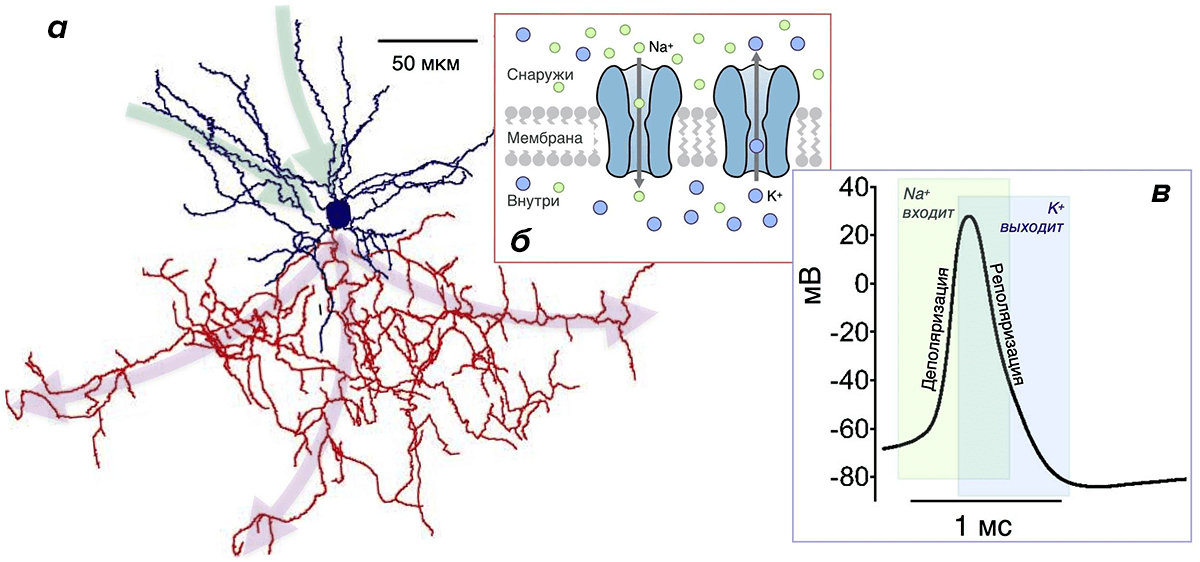
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает. «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.
Мозг и кислород: в бесконечной пляске смерти
Человеческий мозг весит в среднем 1400 г, однако расходует около 20 % от общего потребляемого организмом кислорода: это уходит на поддержку
86 млрд нейронов и их невообразимо сложного коннектома, включающего в себя триллионы синапсов [1–3], что в свою очередь обслуживается обслуживается 250–300 млрд глиальных клеток [4,5].
Такое интенсивное «дыхание» необходимо мозгу для процессов мышления, и даже транзиторная ишемия приводит к массивной нейродегенерации [6]. Без достаточного количества кислорода митохондрии будут не в состоянии использовать кислород в дыхательной цепи, обеспечивая синтез АТФ, поэтому даже 30-минутная гипоксия мозга при ишемическом инсульте приводит к катастрофическим последствиям — гибели около 1,9 млн нейронов и 14 млн синапсов ежеминутно [6,7]. Тем ни менее, как это ни парадоксально на первый взгляд, мозг так тщательно регулирует потребление кислорода по той простой причине, что молекулярный кислород в основном состоянии является бирадикалом и, следовательно, потенциально токсичным, мутагенным газом.
К счастью, окислительный потенциал кислорода сдерживается одной квантово-химической тонкостью — его два электрона имеют параллельные спины, и одновременно кислород может принять лишь один электрон [8,9]. Если это свойство ограничивает реактивность кислорода, тогда почему он считается токсичным? Ответ заключается в способности кислорода образовывать свободные радикалы и другие активные формы кислорода (АФК), а именно супероксидный анион-радикал (O2 •– ), перекись водорода (H2O2) и гидроксил-радикал (OH • ) (их биохимия рассмотрена в работах [8,10,11]). Такие соединения обычно считаются «темной стороной» биохимии кислорода — неизбежной платой за использование кислорода для дыхания [12].
Долгое время предполагалось, что их неконтролируемый и нежелательный синтез повышает чувствительность мозга к окислительному стрессу. Действительно, окислительный стресс тесно связан с нейродегенерацией [13,14]. Однако простое разделение кислорода на «хороший» — молекулярный и его «плохие» реактивные формы (к примеру, O2 •– ) не может объяснить причину и механизм высокой чувствительности мозга к окислительному стрессу, потому как такой подход неверен.
Чтобы понять, почему и как мозг восприимчив к окислительному стрессу, надо отказаться от догмы о том, что АФК априори являются лишь токсичными метаболическими продуктами, и учесть некоторые их особенности. Например, важно помнить о том, что именно высокая чувствительность мозга к гипоксии является причиной возникновения адаптивных митохондриальных сигналов в ответ на воздействие O2 •– [7]. Такой «редокс-сигналинг» вовсе не является исключением, а, напротив, широко распространен [15,16]. Окислительный стресс может возникать, когда редокс-сигналинг нарушается («двуликость» редокс-сигналинга).
Чувствительность мозга к окислительному стрессу редко подвергалась глубокому анализу, поэтому попытки устранить сложную взаимосвязь между окислительным стрессом и нейродегенерацией до сих пор не увенчались успехом. Для того чтобы лучше понять механизмы этих процессов, авторы выделили 13 биохимических причин уязвимости мозга к окислительному стрессу. Для этого они опирались на плодотворную работу Барри Холливелла и Джона Гуттериджа [17–19].
1. Редокс-сигналинг: активные формы кислорода выполняют важные биологические функции
Единственная и часто недооцененная причина, по которой мозг восприимчив к окислительному стрессу, заключается в том, что активные формы кислорода играют важную роль в функционировании организма [19,20]. Это иллюстрируют 2 примера.
Во-вторых, группа ученых под руководством Vriz установила положительное влияние генерируемой NOX H2O2 на аксональное наведение и регенерацию [26,27]. Аксональное наведение прокладывает нервные пути в развивающемся мозге частично с помощью секреции хемоаттрактантов и хемореппелентов, обеспечивающих правильную иннервацию [28]. Фармакологическое подавление активности NOX2, а значит и синтеза этим ферментом O2 • – /H2O2 замедляло рост аксонов ганглионарных клеток сетчатки у зародышей рыбок данио-рерио, что свидетельствует о выполняемой H2O2 функции эндогенного хемоаттрактанта [26].
2. Кальций
Потенциал действия вызывает увеличение количества поступающих ионов Ca 2+ в пресинаптических терминалях, на 4 порядка увеличивая их концентрацию (с 0,01 до
100 мкмоль на литр [29]). Вход ионов Ca 2+ вызывает экзоцитоз гранул нейромедиаторов [29]. Следовательно, потенциал-зависимые токи кальция контролируют синаптическую пластичность в обоих направлениях [30]. Такая двухсторонняя синаптическая пластичность является фундаментальным свойством, необходимым для функционирования мозга. В качестве хорошего примера таких функций можно привести в пример процессы обучения и памяти [31–33]. Зависимость работы мозга от сигналинга Cа 2+ [34] может вызывать окислительный стресс, природа которого, в свою очередь, зависит от условий среды ввиду сложных взаимоотношений ионов кальция с окислительно-восстановительными процессами [19]. Заинтересованному читателю рекомендуется ознакомиться с исчерпывающим обзором взаимоотношений Са 2+ /редокс [35], а авторы ограничатся тремя моментами.
Авторы предполагают, что H2O2 вызывает высвобождение Ca 2+ через рецепторы ИФ3 в соответствии с их редокс-регуляцией путем окисления цистеина [50]. Так как МАМ регулируют множество функций митохондрий (например, транспорт и биогенез [48]), можно легко представить, как нарушение регуляции внутри органелл будет вызывать аномальный синалинг Ca 2+ /H2O2, связанный с окислительным стрессом [45]. Для уверенности стоит добавить, что нарушение регуляции сигналинга МАМ связано с нейродегенерацией при болезни Альцгеймера и боковом амиотрофическом склерозе (БАС) [51]. Например, Стойка с соавт. [52] показали, что мутантный TD43 — патологический «триггер» при БАС и лобно-височной деменции [53] — уменьшает число контактов в МАМ и таким образом нарушает кальциевый гомеостаз (рис. 1–6).
3. Глутамат
Чрезмерное действие глутамата, например, через NMDA-рецепторы (NMDAR) вызывает эксайтотоксичность [72,73], которая следует за нарушением сигналинга Ca 2+ (например, вызывая устойчивое действие кальпаина) [74]. Глутаматная эксайтотоксичность приводит к перегрузке кальцием митохондрий, высвобождению ими O2 • – /H2O2, и в итоге клеточной смерти, обычно через апоптоз или некроз [17,75,76]. Приток Ca 2+ может активировать nNOS, что позволяет NO • ингибировать ЦОГ, повышая тем самым концентрацию O2 • – /H2O2/ONOO – в митохондриях. Согласно этому, фармакологическое ингибирование nNOS будет защищать от эксайтотоксичности [77]. А гибель нейронов по некротическому пути будет усиливать эксайтотоксичность, так как будет повышаться внеклеточная концентрация глутамата [78].
Кроме действия на рецепторы, глутамат может также вызывать эксайтотоксичноть, ингибируя систему транспортеров xС – [84], обменивающих внутриклеточный глутамат на внеклеточный цистин [85]. В клетке цистин восстанавливается до цистеина, который может быть использован глутамат-цистеин лигазой для синтеза глутатиона de novo [86]. Ингибирование транспорта цистина внутрь клетки вызывает истощение ресурсов глутатиона, что приводит к развитию окислительного стресса [84,87]. Снижение концентрации глутатиона также необходимо для запуска ферроптоза — варианта клеточной гибели, происходящего из-за окисления железа и перекисного окисления липидов [88], что подтверждает роль внеклеточного глутамата как сигнала запуска ферроптоза [89,90]. Однако как предостерегают Цао и Диксон [90], несмотря на общие моменты в окислительно-восстановительных процессах, глутамат-ассоциированная эксайтотоксичность, связанная с клеточной гибелью и ферроптозом, имеет различия, такие как вовлечение апоптотических сигналов в первом случае.
4. Глюкоза
Для поддержания работы нейронов человеческий мозг потребляет
25 % глюкозы крови, что соответствует
5,6 мг глюкозы на 100 г ткани мозга в минуту. Судьба глюкозы в головном мозге сложна и включает так называемое метаболическое сопряжение между нейронами и глией (рассмотрено в [3,92]). Суть его заключается в том, что сначала глия превращает глюкозу в лактат, после чего тот захватывается нейронами, превращается в пируват и окисляется в митохондриях чтобы обеспечивать клетки АТФ [3].
Это согласуется с данными, подтверждающими способность нейронов эффективно метаболизировать лактат [93,94]. Следствием этого является поддержание нейронами низкой активности фосфофруктокиназы (ФФК) — скорость-лимитирующего фермента гликолиза, чтобы использовать глюкозу преимущественно в пентозофосфатном пути (ПФП) [95]. С точки зрения окислительно-восстановительных процессов кажется, что межклеточное метаболическое сопряжение призвано компенсировать ограниченные способности нейронов метаболизировать карбонилы из-за низкой экспрессии глиоксилазы 1 (GLO1) и глиоксилазы 2 (GLO2) [96]. Обе изоформы глиоксилазы метаболизируют метилглиоксаль (МГ) [97] — потенциально токсичный дикарбонил, продукт триозофосфатизомеразы [98,99]. Скорость этого процесса регулируется количеством имеющегося глутатиона. GLO1 превращает связанный с глутатионом МГ (т. е. полутиоацеталь) в S-D-лактоилглутатион, после чего GLO2 превращает S-D-лактоилглутатион в D-лактат и глутатион. Низкое содержание изоформ GLO вкупе с относительно низкой концентрацией глутатитона делает нейроны уязвимыми к токсическим эффектам МГ: концентрации МГ в 250 µM достаточно для насыщения метаболических систем нейрона, в то время как метаболизму астроцитов для насыщения требуется 2 мM МГ [96], хотя обычно концентрация «свободного» МГ составляет 2–4 мкм [100]. Тем не менее, МГ в 50000 раз более реактивен, чем глюкоза, и может быстро приводить к образованию оснований Шиффа, способных гликировать (неферментативно гликозилировать) белки, РНК и ДНК [100].
В частности, гликирование белков приводит к формированию конечных продуктов гликирования (КПГ), которые могут вызывать окислительный стресс, активируя соответствующие рецепторы и запуская воспаление, что в итоге нарушает функции митохондрий и других белков [100–102]. КПГ могут синтезироваться и в отсутствие высокой интенсивности гликолиза, так как перекисное окисление липидов тоже может приводит к формированию МГ [101]. В итоге мозг оказывается уязвимым к окислительному стрессу, вызываемому глюкозой [97].
5. Митохондрии
Чтобы справиться с экстраординарными потребностями в АТФ, мозг потребляет несоразмерные количества O2 для поддержания окислительного фосфорилирования [3]. Нейроны тратят энергию АТФ на поддержание высоких биохимических градиентов и синаптической активности [103,104]. Чистые энергетические затраты на работу синапсов можно представить в виде затрат на высвобождение везикул с медиаторами, что составляет 1,64 × 10 5 AТФ в секунду на 1 везикулу [104,105]. Для удовлетворения таких энергетических потребностей нейронов и необходимы митохондрии, а ввиду ограниченной скорости диффузии АТФ особую важность представляют синаптические митохондрии [106]. Так как нейроны постоянно ограничивают активность ФФК, то есть скорость гликолиза [95], они очень сильно зависят от работы митохондрий, хотя синтез АТФ в синапсах могут некоторое время поддерживать гликосомы [107].
Кроме окислительного фосфорилирования, митохондрии являются важными узлами сигнальных путей, регулирующими множество жизненно важных процессов, начиная от гомеостаза Ca 2+ и синтеза кластера Fe-S и заканчивая определением судьбы клетки [55,108,109]. Митохондрии нейронов это своего рода обоюдоострый меч: снабжая нейроны АТФ и сигналосомами, они при нарушении своей функции повышают уязвимость к нейродегенерации [110].
Вместо того чтобы обсуждать прозаическую мысль о том, что O2 • – /H2O2 являются обязательными токсичными побочными продуктами митохондриального дыхания, авторы рассматривают уязвимость нейронов к окислительному стрессу, вызванному митохондриями, с точки зрения сигналинга [111]. То, каким способом митохондрии синтезируют O2 • – /H2O2 (для исчерпывающего разбора этого момента смотрите Мёрфи [68]), ставит их в поддержании нормальной функции органелл [112]. Целенаправленный синтез O2 • – /H2O2 тесно связан с адаптивным редокс сигналингом [113].
Хорошим примером являются сигнальные пути, запускаемые при гипоксии. Митохондрии реагируют на гипоксию (то есть 0,3–3 % O2), синтезируя с помощью комплексов дыхательной цепи I и III O2 • – /H2O2, которые активируют индуцируемый гипоксией фактор 1-альфа (HIF1-α), разрушая пролилгидроксилазу. HIF1-α запускает адаптивный ответ, инициируя транскрипцию ряда белков [114–118]. Так как продукция O2 • – /H2O2 в митохондриях на отдельно взятом участке зависит от концентрации кислорода, числа восстановленных участков какого-либо из комплексов и кинетики реакции [68], гипоксия приводит к восстановлению комплексов I и III и запускает синтез O2 • – (который может быть ускорен сниженной активностью COX и повышенной локальной доступностью O2). В ответ на клеточную гипоксию HIF1-α активирует транскрипцию NDUFA4L2, альтернативную субъединицу комплекса I, чтобы таким способом подавить синтез O2 • – [119].
Нарушения редокс-сигналинга могут приводить к нейродегенерации:неспособность клетки остановить митохондриальную продукцию O2 • – может запустить редокс-зависимый апоптоз по внутреннему пути [120,121]. Кроме того, рассогласованность дыхательной цепи вследствие нарушения взаимодействия митохондрий и ядра может запускать сигнал (т. е. O2 • – /H2O2) без какого-либо стимула (т. е. гипоксии), приводя к неадекватному ответу [111]. Если возникает накопление мутантных митохондрий, они могут привести к дисфункции клетки путем клонального повышения своей численности, так как O2 • – /H2O2 регулируют биогенез митохондрий [111,122,123].
6. Эндогенный метаболизм нейромедиаторов приводит к образованию пероксида водорода
Метаболизм эндогенных моноаминных нейромедиаторов (например, дофамина) приводит к образованию H2O2 при участии моноаминоксидаз. Моноаминоксидазы А и B катализируют реакцию дезаминирования: амин + O2 + H2O → альдегид + H2O2 + NH3. Обе изоформы фермента дезаминируют дофамин, тирамин, триптамин и норадреналин, МАО-А более избирательна к 5-гидрокситриптамину, МАО-B — к 2-фенилэтиламину [124,125]. В ходе катализа окисление амина до имина восстанавливает простетическую группу флавина, который затем вступает в реакцию с O2 с образованием H2O2 [126,127]. После восстановления флавина интенсивность синтеза H2O2 контролируется скоростью связывания O2, учитывая, что O2 влияет на ферментативную активность. Аффинность каждой из изоформ МАО к O2 составляет 10 и 240 µМ для МАО-А и МАО-B соответственно [127].
Несмотря на это, электрофильные альдегиды могут связываться с макромолекулами, вызывая их повреждение [142]. Например, 3,4-дигидроксифенилацетальдегид, производное дофамина, может быстро конъюгировать с белками и оказывать токсическое действие на нейроны [143], для гибели клетки достаточно повышения его концентрации с 2–3 до 6 мкм [144]. Поэтому активность изоформы МАО должна уравновешиваться активностью альдегиддегидрогеназы (АлДГ), чтобы предотвращать токсическое действие конечных продуктов. Но так как АлДГ-2 находится в матриксе митохондрий [145], MIS оказывается лишенным способности нейтрализовывать альдегиды ферментативным путем, это может способствовать формированию конъюгатов макромолекул, особенно если электрический заряд препятствует их пассивной диффузии. Возможно, в основе окислительного стресса, вызываемого МАО, лежат электрофильные альдегиды (в противоположность H2O2). Обсуждается, может ли H2O2 выступать в роли сигнальной молекулы, информирующей ядро о формировании альдегидов. Было показано, что ингибирование АлДГ способствует развитию БП [146] — это подчеркивает важность наличия активности, балансирующей работу МАО. Таким образом изоформы МАО могут вызывать окислительный стресс в головном мозге.
7. Аутоокисление нейромедиаторов
Продукты окисления дофамина могут участвовать в циклах окисления-восстановления [152]. Например, 6-гидроксидофамин может восстанавливаться до семихинон-радикала и H2O2. Часть H2O2 может реагировать с ионами металлов с переходной валентностью [11] и создавать условия для синтеза O2 • – [139] и • OH. Повсеместно распространенные изоформы супероксиддисмутазы (СОД) [153–155] быстро нейтрализуют O2 • – (k
Важно то, что способность к аутоокислению также имеется у серотонина и адреналина, более того, реакция аутоокисления адреналина используется для оценки активности СОД [157]. Поэтому нейромедиаторы с катехольной группой делают мозг особенно чувствительным к окислительному стрессу [17,18]. Например, циклы окисления-восстановления метаболитов дофамина, в частности, 6-гидроксидофамина, участвуют в развитии БП [158,159]. Окисление дофамина при БП [160] нарушает работу митохондрий и лизосом частично через формирование хинонов дофамина, изменяющих активность глюкоцереброзидазы — фермента лизосом, вовлеченного в патогенез БП [161], а также повышения концентрации H2O2 в митохондриях.
8. Скромные ресурсы антиоксидантной защиты
Как подробно рассматривается у Halliwell [17,18], относительно небольшие ресурсы антиоксидантной защиты повышают уязвимость мозга к окислительному стрессу. Другими словами, низкие способности эндогенной антиоксидантной защиты относительно других тканей (например, печени) делают мозг чувствительным к нарушениям редокс-гомеостаза. Известным примером является низкое содержание каталазы [163]: нейроны имеют в распоряжении в 50 раз меньшее количество фермента по сравнению с гепатоцитами [162], однако значение каталазы в инактивации H2O2 остается под вопросом.
Кроме того, что локализация каталазы ограничена пероксисомами, а механизм ее работы подразумевает реакцию одновременно с двумя молекулами H2O2 [164], что ограничивает активность фермента относительно наномолярных количеств H2O2 [164].
Более убедительным примером является глутатион. По сравнению с другими клетками цитозоль нейронов содержит вдвое меньшее количество глутатиона (например,
5 мМ в нейронах против 10–11 мМ в гепатоцитах). Низкое содержание глутатиона, в свою очередь, является следствием ограниченных способностей нейронов его синтеза ввиду малых количеств γ-GCL (γ-глутамилцистеинлигазы), причиной чего, в свою очередь, является низкие содержание и активность Nrf-2 [81,166]. Сравнительно малые ресурсы цитозольного глутатиона могут ограничивать активность GPX4 [130], что может объяснять повышенную уязвимость нейронов к ферроптозу [167]. Малые количества глутатиона могут также ограничивать способность нейронов метаболизировать электрофилы, в частности электрофильные альдегиды.
Из того, что уже обсуждалось выше, может показаться, что данный дефект связан с метаболизмом H2O2 [18,19] ввиду стандартного содержания и активности изоформ СОД (то есть при отсутствии нарушений в метаболизме O2• –). Поддержание нормальной инактивации O2 • – (например, при помощи СОД) жизненно необходимо для нейронов: при делеции гена MnSOD (митохондриальной изоформы СОД) нервные клетки погибают [168–170]. В итоге ферментные системы нейронов, связанные с глутатионом, являются недостаточными.
В 1994 году группа под руководством Су Гу Ри обнаружили семейство ферментов PRDX — повсеместно распространенных цистеин-зависимых пероксидаз [171]. Изоформы PRDX восстанавливаются ферментом TRDX (тиоредоксин), а окисленный TRDX, в свою очередь, восстанавливается тиоредоксин-редуктазой за счет НАДФH [172–176]. Это открытие оказало важное влияние на понимание того, как нейроны нейтрализуют H2O2, так как нервные клетки экспрессируют изоформы PRDX-TRDX [162,177]. В норме система PRDX-TRDX позволяет нейронам нейтрализовывать H2O2, особенно если учесть что изоформы PRDX обильно распространены и распределены внутри клеток [171,175,178]. Авторы не знают ни одного отчета о слабой активности нейрональной системы PRDX-TRDX. Напротив, нейроны могут обладать относительно высокой активностью PRDX, так как метаболизм глюкозы нервных клеток идет преимущественно через ПФП, в котором генерируется НАДФH [95]. Однако есть ферменты, которые могут использовать НАДФH для синтеза O2 • – и NO • (например, NOS) [179,180], поэтому будет опрометчиво считать, что НАДФH находится исключительно на стороне «антиоксидантов» [181]. Тем не менее, PRDX6 в качестве восстановителя предпочитает глутатион [182], поэтому относительно низкое содержание последнего может ограничивать активность и этого фермента. Не стоит считать, что система PRDX-TRDX занимается только нейтрализацией H2O2, так как есть убедительные биохимические доказательства участия PRDX-TRDX в передаче редокс-сигналов [16,172,183–187].
Как элегантно сформулировали Флоэ с соавт. [188], вряд ли природе понадобилось бы создавать 10 пероксидаз, чтобы просто обезвреживать H2O2. Лу, Хольмгрен с соавт. [162] предположили, что наличие PRDX-TRDX дает нейронам способность обуздать их относительную склонность к окислительному стрессу и направить его на передачу редокс-сигналов. Если это так, то подобное положение дел опасно, потому что при увеличении содержания H2O2 до высоких наномолярных концентраций будет происходить переокисление изоформ PRDX, что является признаком гибели клетки [45,180]. Это становится особенно актуальным, если учесть слабую активность глутатион-зависимых ферментных систем нейронов [81,166]. Тандем PRDX-TRDX дает возможность как нейтрализовывать H2O2, так и направлять H2O2 на потребности клеточного сигналинга, однако это остается возможным до тех пор, пока концентрация H2O2 остается ниже критического порога, после которого уже развивается окислительный стресс.
9. Микроглия
Микроглия представлена специализированными резидентными иммунными клетками [189,190], постоянно «патрулирующими» свою нишу на предмет угроз для гомеостаза [191,192]. Микроглиоциты образуют обширные отростки для оценки состояния синапсов и отслеживания активности нейронов [193]. Осуществляя мониторинг нейрональной активности, микроглия выполняет важную функцию по элиминации нездоровых нейронов, формировании межнейронных связей на стадиях развития организма и синаптической пластичности, зависящей от активности синапсов [194–197].
Группы под руководством Niethammer и Amaya показали, что при заживлении ран и регенерации конечностей H2O2 действует как хемоаттрактант [201,202]. Глия, патрулирующая свою территорию, может «чувствовать» H2O2 и отвечать на это активацией и пролиферацией [203], что объясняет, почему высвобождение H2O2 из нейронов привлекает микроглию.
Кроме того, тирозин-киназа Lyn детектирует нейрональную H2O2 и запускает хемотаксис микроглии через F-актин [204]. Каким образом Lyn обнаруживает H2O2, остается неясным, однако этот механизм может включать инактивацию H2O2-связанной фосфатазы [15,16]. Процесс воспаления может усиливаться благодаря цитокинам и активности микроглии, поддерживающей перекисное окисление липидов (ПОЛ) [205,206]. Хотя микроглия необходима для нормального функционирования и развития мозга, нарушение ее активности может провоцировать окислительный стресс [206]. Например, при БА микроглия способствует нейродегенерации, избыточно активируя прунинг синапсов [207,208]. Требует ли избыточный прунинг запуска окислительного стресса — неизвестно. Возможно, метаболиты ПОЛ (например, 4-гидроксиноненаль) [209] привлекают микроглию путем модификации цистеиновых остатков белков через реакцию Михаэля [210,211].
10. Металлы с переходной валентностью
Редокс-активные металлы с переходной валентностью (такие как Fe 2+ и Cu + ) присутствуют в головном мозге в значительных количествах [17,18]. Относительный избыток подобных металлов выражается в том, что их концентрация в 10000 раз превышает содержание нейромедиаторов [212,213]. Одна только концентрация связанного Fe 2+ может достигать уровня миллимолей. Большой биохимический потенциал Fe 2+ и Cu + используется для катализирования химических реакций. Например, Fe 2+ может связываться с электронно-плотными группами O и N органических молекул [214]. Соответственно, ионы Fe 2+ (и Fe 3+ ) необходимы для обеспечения каталитической активности ряда ферментов, например: аконитазы, фумаразы и цитохромов P450 [214]. Кроме того, Fe 2+ принимают участие в синтезе миелина [215,216] в качестве кофактора ферментов, осуществляющих синтез липидов de novo [215,216]. Нейроны также содержат малосвязанный пул Fe, называемый лабильным пулом железа (ЛПЖ), который поддерживается поступлением с пищей и в большинстве тканей составляет около 20 мкм [167,217].
20 мин ввиду хорошей кинетики реакции (k
Особенно интересно то, что Fe 2+ управляет реализацией ферроптоза — относительно недавно открытой формы клеточной смерти, зависимой от Fe 2+ и ПОЛ [88,167]. Fe 2+ запускает ферроптоз, катализируя реакцию образования пероксил- и алоксил-радикалов из ROOH. Кинетически эти реакции протекают легче (k
1,3 × 10 3 M-1 s-1), чем реакция Фентона (k
11. Высокое содержание ПНЖК
Головной мозг является большим депо омега-3 ПНЖК (полиненасыщенных жирных кислот) [240], особенно докозагексаеновой кислоты (ДГК). Учитывая энергетические потребности мозга, можно ожидать, что нейроны будут заниматься окислением жирных кислот для получения АТФ, особенное учитывая его большие концентрации: 106 АТФ на одну молекулу пальмитиновой кислоты, 32 АТФ на одну молекулу глюкозы [241], и только 14–17 АТФ на молекулу лактата [3]. Однако скорость бета-окисления в мозге существенно ниже [241] по сравнению с другими метаболически активными тканями (например, скелетной мускулатурой [242]). Возможно, в свете низкой активности каталазы [163] становится выгодным ограничивать использование кислорода на окисление пальмитиновой кислоты (ее окисление требует на 15 % больше O2), и таким образом снизить синтез H2O2 в пероксисомах [243,244]. Подобный отказ от окисления липидов для получения АТФ может быть обусловлен использованием липидных пероксидов в качестве сигнальных молекул [19]. Например, ДГК может быть превращена в резольвины, обладающие противовоспалительными эффектами [245]. Кроме этого, жирные кислоты и холестерин востребованы для синтеза миелина. Важность последнего для мозга подчеркивается тем, что он содержит около 20 % всего холестерина организма [19].
Для наглядности были опущены некоторые этапы (например, перестройки углеродных радикалов).
Холестерин может аутоокисляться свободными радикалами или же через нерадикальные механизмы [246]. Высокое содержание липидов с ПНЖК определяет высокий риск развития окислительного стресса, так как ПНЖК очень чувствительны к ПОЛ — это может оказаться биологической расплатой за использование липидных пероксидов в качестве сигнальных молекул [89]. Перекисное окисление липидов (подробнее рассмотрено в [43,247–250]) включает начальную генерацию углеродного радикала, после чего может следовать реакция присоединения или отщепления при участии АФК достаточной активности (например, • OH) по метиленовой группе. К слову, наличие •OH может быть необязательным для инициации процессов ПОЛ, в качестве запускающего фактора могут выступать гипервалентные формы железа (например Fe IV =O) [222].
Такой феномен как ферроптоз [90, 252] объясняет, почему делеция по гену GPX4 приводит к гибели эмбрионов [253,254], так как GPX4, нейтрализуя ROOH, выступает в роли важного регулятора ферроптоза [223,255] — наличие и отсутствие активности GPX будет, соответственно, останавливать или запускать ферроптоз [256]. Низкие концентрации GSH повышают уязвимость нейронов к ферроптозу, что подтверждается гибелью нейронов при условном «выключении» GPX4 [257–259]. Это согласуется с вкладом ПОЛ в патогенез нейродегенеративных заболеваний (например, БА [209,211]).
12. Мозг использует NOS и NOX для передачи сигналов
Вторая группа ферментов, изоформы NOX, используют простетические редокс группы для окисления НАДФH и восстановления O2 до O2 •- [22,23]. Наличие изоформ NOX важно для мозга (подробнее в [266]), например для ДВП и работы микроглии [24].
13. Окисление РНК
Окисление РНК редко рассматривается как причина повышенной чувствительности мозга к окислительному стрессу [268]. Кроме основной матричной РНК мозг в значительной мере полагается на некодирующую РНК, особенно на длинные некодирующие РНК и микроРНК (подробнее в [269–271]). С биохимической точки зрения РНК также уязвима для окисления и подвергается аналогичным реакциям, что и ДНК [272]. Например, 8-оксогуанин является результатом окисления как РНК, так и ДНК [273]. Но ввиду своей одноцепочечной структуры РНК уязвима не только к окислению, но и к алкилированию [274] по местам образования водородных связей. Кроме того, РНК лишена защитного эффекта гистонов, а также не компарментализована (ДНК находится за ядерной мембраной), например, при нахождении в аксонах и синапсах. Хотя для функционирования синапсов очень важен локальный синтез белка [275,276], пока не изучено, будет ли окисление РНК как-то нарушать этот процесс.
Окисление РНК приводит к появлению ошибок в ее коде, что, в свою очередь, останавливает синтез белка на рибосомах [277], и при отсутствии вмешательства систем репарации могут образовываться неполные, мутантные или неправильно сложенные белки [278]. Близкое расположение мРНК к митохондриям и временная динамика окисления РНК (секунды) по сравнению с с трансляцией (часы) делают окисление РНК высоко вероятным, особенно в нейронах, где присутствуют металлы с переходной валентностью, способные участвовать в реакции Фентона [279–281].
Подход в рассмотрении окисления мРНК как причины окислительного стресса, связанного с нейродегенерацией, подтвеждается наблюдением, что окисленная мРНК Cu,Zn-СОД является ранним доклиническим признаком БАС [282].
Согласно ряду отличных обзоров [268,272], необходима дальнейшая работа для понимания распознавания, оборота и восстановления окисленной РНК [283]. Только с лучшим пониманием каждого из этих процессов можно будет оценить чувствительность нейронов, так как концентрация окисленной РНК является функцией от процессов ее образования и элиминации по времени.
Перспективы
Авторы хотят предложить всеохватывающий подход для выяснения причин, почему редокс-сигналинг приводит к развитию окислительного стресса в головном мозге. Конечной расплатой за использование редокс-сигналинга является неотъемлемая уязвимость головного мозга к окислительному стрессу в случаях, когда сигналы идут не так, как им следует, что, кажется, как раз и происходит при заболеваниях. Некоторые нейрофизиологи могли бы отрицать центральное значение нейрональной активности в этом вопросе. Но учитывая то, как митохондрия синтезирует O2 •- /H2O2 [68], активность нейронов должна опосредованно регулировать митохондриальный синтез O2 •- /H2O2. В активном синапсе потребности АТФ, если они могут быть обеспечены, должны снижать суммарный синтез O2 •- /H2O2 в митохондриях. В это же время в неактивном синапсе низкие потребности в АТФ и ослабленная работы цепи переноса электронов должны благоприятствовать синтезу O2 •- /H2O2, что потенциально ставит митохондриальные O2 •- /H2O2 на роль своеобразных часовых синаптической активности. Если это так, то можно объяснить, каким образом высвобождение митохондриального O2 •- /H2O2 в условиях неактивности синапса запускает долговременную депотенциацию (ДВДП) и даже синаптический прунинг — особенно, если постоянно используется один и тот же путь передачи сигнала [284].
Митохондриальный апоптоз управляет ДВДП и прунингом [285–287]. Активность митохондрий, связанная с высвобождением O2 •- /H2O2, может провоцировать локальный сублетальный внутренний апоптоз и вызывать ДВДП и прунинг синапсов. Возможно, такой редокс-управляемый апоптоз является механизмом регуляции прунинга в развивающемся мозге — важного этапа, предшествующего формированию сложного коннектома, а также обязательного условия для коррекции нервных связей во взрослом возрасте [284]. Расположение митохондрий в синаптических окончаниях повышает риск потери синапсов. В случаях, когда митохондрии не могут обеспечить потребности в АТФ или же в условиях дефицита кислорода происходит высвобождение O2 •- /H2O2, которые могут воспроизводить сигнал прунинга и вызывать нежелательное сокращение числа синапсов.
Имеется биологический прецедент: нежелательная реактивация сигналов прунинга, которые в норме действуют на этапах развития, способствует утрате синапсов при БА [207]. В биохимически оправданных 13 причинах уязвимости мозга к окислительному стрессу авторы умышленно приняли глобальную точку зрения, фокусируясь на «нейронах» как коллективе, работающем над общей задачей. Существуют параллели между общепринятыми терминами нейронов и активных форм кислорода [20]. Активные формы подразумевает химически гетерогенную совокупность соединений, которые могут на порядки различаться по скорости реакций с отдельно взятым субстратом (например, с гуанином • OH реагирует по мере диффузии, в то время как O2 •- оставляет гуанин нетронутым ввиду низкой реактивности).
Аналогично активным формам кислорода, нейроны имеют гетерогенную природу, которая не укладывается в широкие определения, так как они могут сильно различаться по множеству ключевых параметров, включая функцию, расположение, связи, миелинизацию и длину аксона. Разнообразие нейронов определяет и различную чувствительность к окислительному стрессу как в пределах нейрона (т. е. тело или синапс), компартмента (т. е. синаптическая митохондрия или синаптическая мембрана), так и между нейрональным популяциями.
Дофаминергические нейроны pars compacta черной субстанции имеют разную чувствительность: они испытывают фоновый (то есть без дополнительных колебаний гомеостаза) окислительный стресс, так как их автономная пейсмекерная активность контролируется кальциевыми каналами L-типа, определяющими митохондриальный уровень O2•-/H2O2 [288]. При таком балансировании на грани окислительного стресса даже малейший неожиданный сдвиг во внутриклеточной редокс среде, возможно, связанный с метаболизмом дофамина [160], будет достаточным для того, чтобы привести к гибели.
«Прошлое» нейрона также влияет на его чувствительность к редокс-стрессу, и это усложняет ситуацию. Например, синаптическая активность, связанная сублетальными изменииями в редокс-статусе, определяет адаптивную координированную нейроглиальную реакцию, способствующую повышению внутриклеточного содержания GSH (подробнее в [81]).
В нашем примере адаптированный нейрон способен лучше нейтрализовывать ксенобиотики и препятствовать росту содержания ROO • и окисленных липидов, необходимых для осуществления ферроптоза [89]. Для предостережения стоит сказать, что адаптация требует частой стимуляции, так как концентрация GSH зависит от транскрипции на многих уровнях. В качестве интересной параллели можно привести аксиому физиологии упражнений «используй или потеряй»: при постоянной активности возникает комплекс адаптивных реакций к редокс-стрессу, однако при неактивности сопротивляемость прогрессивно снижается.
С трансляционной (трансляции в смысле переноса опыта доклинических исследований в клинические — прим. перев.) точки зрения высокая сложность редокс-гомеостаза нервных клеток помогает объяснять неуспешность попыток использования пищевых антиоксидантов для лечения нейродегенеративных заболеваний [289]. Кроме проблемы биодоступности, их неудача связана еще с кинетическими и пространственными ограничениями (подробнее в [181,290–293]). Вероятность существования соединения, обладающего достаточной биохимической универсальностью, чтобы одновременно и значительно влиять на каждый из обсуждаемых факторов, крайне мала. Прежде всего, неудачи пищевых антиоксидантов неотъемлемо связаны с их биохимическими ограничениями, однако этого недостаточно для отрицания причинной роли окислительного стресса. Многое в редокс-гомеостазе в норме и патологии головного мозга остается непонятным. Рациональная терапия нейродегенеративных заболеваний, направленная на процессы окисления-восстановления, может быть разработана только тогда, когда фундаментальные исследования раскроют новые детали механизмов регуляции редокс-гомеостаза.