аутотрансплантация костного мозга что это
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
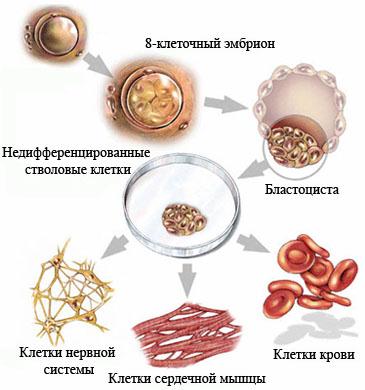
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 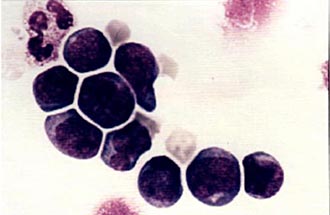 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
ВЫБОР ДОНОРА
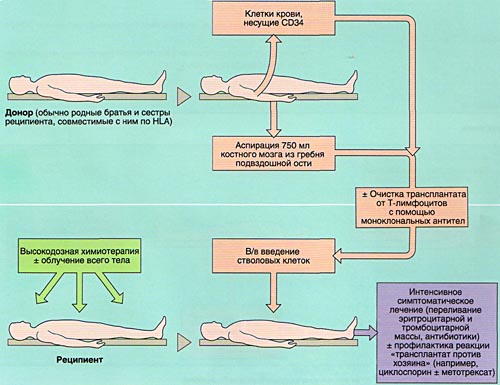
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Высокодозная химиотерапия и трансплантация костного мозга у взрослых больных
Трансплантация стволовых гемопоэтических клеток нашла применение в различных областях онкологии.
Эти клетки используются после высокодозной химиотерапии для снижения длительности депрессии (угнетения) костного мозга и сокращения риска инфекционных осложнений и кровотечений.
Стволовые клетки для трансплантации получают как от самого пациента (аутологичная трансплантация), так и от иммунологически совместимого родственного или неродственного донора (аллогенная трансплантация). Непосредственным источником стволовых гемопоэтических стволовых клеток может быть костный мозг, периферическая или пуповинная кровь.
Одним из наиболее частых показаний для применения стволовых клеток в онкологии является уменьшении длительности периода угнетения кроветворения после противоопухолевой терапии.
Применение современных противоопухолевых препаратов позволяет излечить или продлить жизнь значительному количеству больных со злокачественными новообразованиями.
Однако в ряде случаев проведение стандартной химиотерапии не приводит к длительному противоопухолевому эффекту, что связано с исходной или приобретенной резистентностью (устойчивостью) опухоли к цитостатикам.
Одним из путей ее преодоления является увеличение дозы препаратов. Это увеличивает проникновение противоопухолевых препаратов в раковую клетку и позволяет преодолеть устойчивость к химиотерапии.
Резкое увеличение дозы препаратов приводит к значительному повреждению кроветворных клеток костного мозга и выключению функции кроветворения на много месяцев, что требует применения методик защиты кроветворения.
Основным методом, позволяющим преодолеть токсичность химиотерапии на кроветворение, является трансплантация кроветворной ткани. При этом стволовые клетки, полученные от донора или у самого больного, вводят после окончания химиотерапии, когда препараты полностью вывелись из организма или разрушились, что позволяет быстро восстановить кроветворение.
При пересадке аллогенного костного мозга возможно длительное приживление трансплантата только при совпадении донора и реципиента по антигенам главного комплекса гистосовместимости (иммунологической совместимости).
В противном случае развивается выраженная иммунологическая реакция «трансплантат против хозяина» (РТПХ), способная привести к гибели больного.
Наименьшее количество осложнений встречается у совместимых сибсов (родных братьев и сестер).
В то же время сибсы имеют вероятность совпасть иммунологически только в 25% случаев, что указывает на серьезную проблему подбора доноров для пересадки костного мозга. Последние годы отмечены крупные успехи в подборе неродственных доноров.
Следует отметить, что даже полная совместимость не дает абсолютной гарантии отсутствия развития РТПХ, и до 25% больных погибает от осложнений, связанных с трансплантацией.
Важно иметь в виду, что РТПХ способна оказывать и лечебное действие, когда иммунная система донора начинает распознавать опухолевые клетки хозяина и бороться с ними, т.е. проявляется реакция трансплантат против опухоли (РТПО).
При ряде заболеваний (хронический миелолейкоз, острый нелимфобластный лейкоз и др.) наличие этой реакции в значительной степени определяет общий успех лечения.
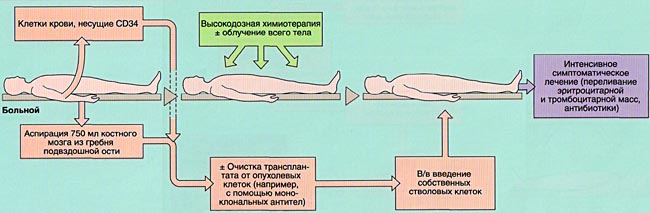
Трансплантация аутологичной (своей собственной) гемопоэтической ткани позволяет избежать возникновения РТПХ и технических сложностей, связанных с подбором донора. С другой стороны, аутологичная трансплантация не сопровождается РТПО и несет чисто вспомогательную функцию поддержки кроветворения после высокодозной химиотерапии.
В настоящее время имеется возможность сохранять собственные кроветворные клетки в жизнеспособном состоянии при низких температурах (замораживании) в течение длительного периода времени.
Долгие годы основным источником стволовых кроветворных клеток был костный мозг. Метод его получения состоит в многократных пункциях плоских костей (в основном тазовых) и получении 1-1,5 литров костно-мозговой взвеси. Такая процедура требует, как правило, общего обезболивания (наркоза).
Нужно отметить, что при опухолевом и лучевом поражении костей таза забор костного мозга может оказаться неудачным.
Костный мозг не является единственным источником кроветворных клеток.
Во взрослом организме небольшая часть стволовых клеток, как и зрелые клетки, выходит в периферическое сосудистое русло. Эти стволовые клетки способны восстанавливать полноценное кроветворение после повреждения его химиотерапией и облучением. Современная аппаратура (сепараторы крови) позволяет эффективно собирать клетки кроветворения из периферической крови даже при их низком содержании. При этом необходимость наркоза отпадает.
В условиях нормального кроветворения для получения достаточного количества стволовых клеток необходимо, как правило, 6 процедур. При каждой такой процедуре обрабатывается 10-12 литров крови.
Проблема низкого количества клеток кроветворения в периферической крови оставалась главным ограничением при использовании данного вида трансплантата. Затем было показано, что после однократного введения некоторых противоопухолевых препаратов (циклофосфамид, этопозид, фторурацил) отмечается значительное увеличение числа стволовых клеток в периферической крови. К недостаткам данного метода относятся: снижение числа лейкоцитов и тромбоцитов, значительные различия в сроках начала роста содержания стволовых клеток в периферической крови у различных больных.
Введение некоторых гемопоэтических факторов роста (нейпоген, лейкомакс и др.) вызывает значительно увеличение поступления клеток кроветворения из костного мозга в периферическую кровь.
Применение аллогенной трансплантации костного мозга
В настоящее время основными показаниями для аллогенной трансплантации стволовых клеток являются
Изучаются возможности применения данного метода у больных
Острые нелимфобластные лейкозы (ОНЛЛ)
Применение стандартной химиотерапии в первой полной ремиссии позволяет добиться длительной выживаемости в 25-35% случаев по сравнению с 45-60% при использовании аллогенной трансплантации стволовых клеток. Применение трансплантации во второй ремиссии сопровождается длительной ремиссией лишь в 20-30% случаев.
Использование аллогенной трансплантации стволовых клеток с первично резистентным (устойчивым к лечению) течением ОНЛЛ позволяет добиться длительной ремиссии в 10-20% случаев.
Острые лимфобластные лейкозы (олл)
Проведение аллогенной трансплантации стволовых клеток в первой полной ремиссии у пациентов с неблагоприятными прогностическими факторами (возраст старше 60 лет, высокий лейкоцитоз и т.д.) позволяет достичь длительной безрецидивной выживаемости в 40-60% случаев.
При отсутствии неблагоприятных факторов аллогенная трансплантация стволовых клеток обычно рекомендуется во второй полной ремиссии.
Хронический миелолейкоз
ХМЛ характеризуется несколькими фазами развития. В ранней (хронической) фазе, длящейся несколько лет, состояние больного может сохраняться относительно удовлетворительным. В фазе акселерации (обострения) в течение нескольких месяцев нарастают гематологические изменения (увеличение числа лейкоцитов, малокровие), и она переходит в фатальную (смертельную) фазу бластного криза.
Стандартные методы лечения могут вызывать длительные ремиссии у части больных, однако единственным излечивающим методом лечения в настоящее время является аллогенная трансплантация стволовых клеток. Эффективность ее зависит от возраста больного, фазы заболевания, периода времени от момента диагноза до трансплантации. Множественные курсы предшествующего лечения значительно улучшают результаты высокодозной химиотерапии и трансплантации.
Наилучшие шансы на достижение длительной ремиссии имеют молодые больные, получившие трансплантацию в хронической фазе в течение 1 года от момента диагноза. Длительная выживаемость у них составляет 75-80% по сравнению с 10-20% у больных, которым трансплантация выполнена в фазе аскселерации.
Миелодиспластический синдром
Аллогенная трансплантация стволовых клеток является единственным методом, излечивающим больных МДС. Применение этого метода позволяет добиться длительной выживаемости в 30-50% случаев. Эти результаты зависят от возраста больных, длительности заболевания и количества опухолевых клеток в костном мозге перед трансплантацией.
Аллогенная минитрансплантация
Аллогенная минитрансплантация, или трансплантация после миелоаблативных (не разрушающих костномозговое кроветворение) режимов получила распространение лишь недавно. Ее применение связано с выявлением лечебной роли РТПО и появлением новых препаратов (флударабин, антитимоцитарный иммуноглобулин), вызывающих глубокую депрессию (угнетение) иммунной системы, но не вызывающих глубокой цитопении (снижение числа клеток крови).
Применение их в комбинации с умеренными дозами бусульфана или мелфалана позволяет эффективно пересаживать донорский костный мозг. При этом РТПО полностью сохраняется. Следует отметить, что эффективность этого метода зависит от массы остаточной опухоли, которая должна быть по возможности минимальной.
Предварительные результаты применения данной методики свидетельствуют о высокой эффективности минитрансплантации при значительно меньшей токсичности в сравнении с классическим методом.
Применение аутологичной трансплантации костного мозга
Основной ролью аутологичной трансплантации костного мозга является восстановление кроветворения после химиотерапии, что позволяет многократно увеличивать разовые дозы некоторых противоопухолевых препаратов. Это дает возможность усиливать противоопухолевый эффект и достигать более высокой безрецидивной выживаемости в сравнении с результатами стандартной химиотерапии.
Наиболее часто данный метод применяется при лечении больных с прогностически неблагоприятными вариантами течения неходжкинских лимфом (лимфосарком), болезни Ходжкина (лимфогранулематоза), множественной миеломы, рака молочной железы, рака яичка и пр.
Неходжкинские лимфомы (нхл)
Применение стандартной химиотерапии у больных с НХЛ высокой и промежуточной степени злокачественности позволяет достичь 40-60% полных ремиссий. Однако у 20-30% больных этой группы отмечаются рецидивы (возврат) болезни. Применение высокодозной химиотерапии в сочетании с аутологичной трансплантацией костного мозга дало возможность значительно улучшить показатели длительной выживаемости у таких больных.
Болезнь ходжкина
У 10-30% больных с распространенными стадиями болезни Ходжкина первичная химиотерапия оказывается неэффективной, а у 40% пациентов возникает рецидив заболевания. Результаты лечения больных, малочувствительных к первичной химиотерапии и с первым ранним рецидивом (в течение первого года), неудовлетворительные.
Применение других схем стандартной химиотерапии позволяет достичь полных ремиссий не более чем у 40-45% больных, однако при этом ремиссии бывают короткими, а выживаемость низкая.
Применение высокодозной химиотерапии в сочетании с аутологичной трансплантацией стволовых клеток позволяет почти в 2 раза увеличить частоту полных ремиссий, а значит, и надежду на увеличение выживаемости.
Множественная миелома
По данным Европейской организации по аутологичным трансплантациям костного мозга, безрецидивная и общая выживаемость 5500 больных множественной миеломой, получавших высокодозную химиотерапию в сочетании с аутологичной трансплантацией стволовых клеток, составила соответственно 28 и 48 месяцев, что превышает результаты стандартной химиотерапии.
Наилучший прогноз (исход) имеют больные моложе 60 лет с I-II стадиями заболевания и уровнем бета-2 микроглобулина менее 4.
Использование высокодозной химиотерапии при других опухолях (рак молочной железы, яичка и др.) находится на этапе изучения. При этом получены обнадеживающие результаты.
Таким образом, высокодозная химиотерапия с трансплантацией аутологичных или аллогенных стволовых кроветворных клеток за последние годы стала эффективным методом лечения многих опухолей. Прогресс в биологии и иммунологии клеток кроветворения позволяет надеяться на еще более эффективное применение этого метода в будущем, в том числе и при распространенных новообразованиях, резистентных (устойчивых) к химиотерапии.
Мероприятия 2021/2022 года
Архив мероприятий
Противораковое общество РОССИИ создано по инициативе ученых-онкологов и главных врачей онкологических диспансеров, представляющих более 50 регионов России, с целью претворения в жизнь программы профилактики рака в России
Аутотрансплантация костного мозга
Важно знать о наших сайтах
Аутотрансплантация или трансплантация собственного костного мозга пациенту – сложная процедура, которая требует высокого профессионализма медицинского персонала и идеальных условий в клинике. В Центре онкологии клиники Сураски (Ихилов) подобное лечение проводится по самым высоким международным стандартам с неизменно качественным результатом.
Что такое гемопоэтические клетки?
Костный мозг состоит, в том числе, и из гемопоэтических клеток, которые при необходимости берут на себя функцию любой клетки организма человека.
Зачем пересаживать гемопоэтические клетки?
Если пациент имеет онкологическое заболевание или ослаблен высокодозными химио- и радиотерапией, очень важно дать организму возможность восстановится за счет гемопоэтических клеток. Для этого и используют собственные гемопоэтические клетки пациента, сохраненные до начала лечения.
Как проходит подготовка к пересадке?
Материал для пересадки изготавливается из периферических гемопоэтических клеток крови, которые извлекаются в незрелом состоянии из крови пациента. Клетки фильтруют в специальном аппарате, а кровь снова переливают пациенту. У взрослых сбор нужных клеток ведется только из крови, а у детей из крови и костного мозга.
Трансплантация помогает организму бороться с раковыми клетками и быстрее восстановиться после лечения.
Как проходит трансплантация?
Во время трансплантации на грудь пациента устанавливают катетер, через который в организм поступают гемопоэтические клетки. Удачной ли была трансплантация, станет ясно через несколько недель, в течение которых пациент находится в специальной стерильной палате с фильтром воздуха, чтобы избежать любых инфекций. Иммунитет пациента подавлен, организм не способен бороться с бактериями и вирусами. Врачи следят за состоянием пациента при помощи частых анализов крови. В случае надобности трансплантацию могут повторить.
Реабилитация после трансплантации
Если трансплантация прошла удачно, то пациент может выписываться из больницы. Полный эффект терапии сможет почувствовать в течение нескольких лет. Весь этот период пациент будет периодически наблюдаться у своего лечащего врача.
Каковы шансы на успех?
Насколько удачной будет трансплантация, сразу не может сказать ни один врач, но чаще всего у пациентов с неагрессивными формами рака, без сопутствующих заболеваний и младше 70 лет трансплантация проходит хорошо.
В клинике Сураски (Ихилов) созданы особые условия для пациентов, которые готовятся пройти трансплантацию. Чаще всего к этой процедуре прибегают при различных лимфомах, лейкозах, миеломах и других видах рака кроветворной системы.
Воспользуйтесь контактами, указанными на нашем сайте, чтобы напрямую связаться с международным отделом клиники Ихилов (Сураски). Специалисты клиники владеют всей информацией и помогут вам отправиться на лечение без посредников.
Трансплантация костного мозга
Под процедурой трансплантации костного мозга подразумевают манипуляцию пересадки пациенту стволовых (кровеобразующих) клеток, которые могут быть получены тремя базовыми методами:
Методика носит обобщенное название «трансплантация костного мозга» исключительно по той причине, что первые эксперименты проводились именно с получением клеток из полости тазовых костей донора. Ныне активно применяется и методика получения гемопоэтического материала из периферической крови, как наиболее простой способ, не причиняющий дискомфорта донору.
Показаниями к пересадке стволовых клеток кроветворения служат:
В экспериментальных целях трансплантация костного мозга за рубежом проводится при аутоиммунных и сердечно-сосудистых заболеваниях. Методика показала высокие результаты в лечении ревматизма, рассеянного склероза и псориаза.
Наиболее сложным вопросом трансплантации остается подбор донора. Вероятность развития осложнений возрастает пропорционально чужеродности вводимых в организм реципиента клеток, поэтому наиболее подходящими на эту роль становятся близкие родственники. Вероятность антигенной совместимости братьев и сестер достигает 25%. При отсутствии подходящих доноров в семье ведется поиск по базам.
Почти в каждой стране мира собрана информация о людях, которые желают подарить шанс онкологическим больным и стать для них донором стволовых клеток. Чтобы попасть в клиническую базу, человек сдает кровь. В лаборатории ее подвергают исследованиям, позволяющим определить антигенный набор лейкоцитарных белков. Именно в сравнении двух наборов – донора и реципиента определяется их гистологическая совместимость.
Наиболее широкий выбор доноров предоставляется в Германии, где процедуру HLA-типирования (определения антигенного набора) прошло более 5000 человек
Виды процедуры
Ныне активно применяются две методики пересадки стволовых клеток гемопоэза, принципиально разных по направленности действия – аутологичная и аллогенная. При первой в роли донора и реципиента выступает один и тот же человек, а главным условием становится отсутствие поражения костного мозга. При второй происходит тщательный подбор человека, наиболее близкого пациенту по аллелям – парным генам.
Подготовка к трансплантации костного мозга
В Германии подготовку реципиента к трансплантации начинают только при полной убежденности соответствия донорского материала. Для этого человек, отдающий свои стволовые клетки, должен дважды сдать по 10 мл крови из вены – первая порция необходима для HLA-типирования, вторая – для подтверждения совместимости тканей.
При аллогенной трансплантации пациент подвергается процедуре уничтожения собственного костного мозга – кондиционированию. Это необходимо для устранения факторов, продуцирующих клетки крови с измененным генотипом, онкологические и поврежденные. Подготовка к трансплантации костного мозга включает и подавление иммунитета.
Проведение пересадки костного мозга
Вопреки сложности названия, технически процедура пересадки является достаточно простой и выглядит практически так же, как переливание крови.
Донор
Чаще всего, забор клеток производится из вены. Накануне манипуляции донор получает медикаменты, стимулирующие выход стволовых клеток из костного мозга в сосуды. Для получения стволовых клеток достаточно двух часов.
Редко трансплантация донорского костного мозга требует забора стволовых клеток из тазовых костей при помощи тонких игл. При этом донор госпитализируется на сутки, а сама биопсия проходит под спинальной или общей анестезией.
Реципиент
Клетки гемопоэза вводятся реципиенту путем обычной внутривенной инфузии. По сосудам они самостоятельно достигают полостей кости, где имплантируются и начинают продуцировать клетки крови и антитела.
Эффективность
Трансплантация костного мозга в Германии имеет высокую результативность в лечении онкологических заболеваний и патологий крови. В ряде случаев она становится единственным средством спасения детей, больных лейкозом и апластической анемией.
Реабилитация
Несмотря на техническую простоту трансплантации, пациент остается в клинике около двух недель, потому как строгий врачебный контроль и стерильность среды являются необходимыми условиями благополучной реабилитации. В процессе подготовки полностью подавляется иммунитет и больной имеет повышенную восприимчивость к вирусам и микробам, окружающим его в обычной жизни.
После благополучного приживления трансплантированных клеток пациент быстро идет на поправку – нормализуются показатели крови, уменьшаются опухоли и исчезают метастазы. Для лейкозов пересадка является наиболее эффективным методом терапии.
DMU: помощь в лечении за рубежом
Вряд ли Вы задумаетесь над тем, сколько стоит трансплантация костного мозга, если от этой процедуры зависит здоровье и врачи реально могут помочь. Специалисты DMU готовы с максимальной скоростью организовать для Вас консультацию немецких врачей, подобрать клинику и согласовать время визита. Цена станет известна в кратчайшие сроки, и Вы сможете своевременно организовать сбор средств на лечение.
Мы решим вопросы оформления документов и подберем лучшую клинику, организуем перелет даже для пациентов в тяжелом состоянии. Специалисты медицинского центра сопровождают пациентов на протяжении всего курса лечения и отстаивают их интересы, в том числе, может быть снижена и цена услуг, в соответствии с законодательством Минздрава Германии.