авторами первого атомистического учения были
Атомистическое учение, характеристики молекул, температура
Лекция № 6 История атомистических учений. Масса и размеры молекул. Тепловое движение. Абсолютная температура
История атомистических учений
Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения, силы взаимодействия между частицами, образующими тела и характеры теплового движения этих частиц.
Молекулярная физика исходит из того, что любое тело – твердое, жидкое или газообразное – состоит из громадного числа молекул, которые находятся в беспорядочном движении, интенсивность которого зависит от температуры. При изучении молекулярной физики Вы познакомитесь со строением, структурой и свойствами некоторых материалов, с особенностями агрегатных изменений, рассмотрите зависимости количественных характеристик от физико-механических свойств веществ и их строения.
Молекулярная физика служит научной основой современного материаловедения, вакуумной технологии, порошковой металлургии, холодильной техники.
Атомизм — натурфилософская и физическая теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. Возникла в древнегреческой философии. Дальнейшее развитие получила в философии и науке Средних веков и Нового времени.
Термин атомизм употребляется в двух смыслах. В широком смысле атомизмом называется любое учение об атомах. Понимание в узком смысле — древнегреческая философская школа V-IV веков до н. э., учение которой является самой ранней исторической формой атомизма. В обоих случаях употребляется также термин атомистика. Термин атомистический материализм является более узким, так как некоторые сторонники учения об атомах считали атомы идеальными.
В индийской философии атомизм разрабатывался независимо от европейской философии. Примером этого может служить школа вайшешика. Европейская атомистика возникла в Древней Греции.
Школа атомистов
Атомизм был создан представителями до сократовского периода развития древнегреческой философии Левкиппоми его учеником Демокритом Абдерским. Согласно их учению, существуют только атомы и пустота. Атомы – мельчайшие, неделимые, не возникающие и не исчезающие частицы. Качественно однородные, непроницаемые (не содержащие в себе пустоты) сущности (частицы), обладающие определённой формой.
Атомы бесчисленны, так как пустота бесконечна. Форма атомов бесконечно разнообразна. Атомы являются первоначалом всего сущего, всех чувственных вещей, свойства которых определяются формой составляющих их атомов. Демокрит предложил продуманный вариант механистического объяснения мира: целое у него представляет собой сумму частей, а беспорядочное движение атомов, их случайные столкновения оказываются причиной всего сущего.
В атомизме отвергается положение элеатов о неподвижности бытия, поскольку это положение не дает возможности объяснить движение и изменение, происходящее в чувственном мире. Стремясь найти причину движения, Демокрит «раздробляет» единое бытие Парменида на множество отдельных «бытий»-атомов, мысля их как материальные, телесные частицы.
Платон
Сторонником атомизма был Платон, который считал, что атомы имеют форму идеальных Платоновских тел (правильных многогранников).
Эпикурейство
Эпикур, основатель эпикурейства, воспринял от атомистов учение об атомах.
В поэме древнеримского эпикурейца Лукреция «О природе вещей» атомы характеризуются как телесные («тельца» — корпускулы) и состоящие из материи.
В IV веке до н.э. появилось учение, основоположником которого является Аристотель, которое позднее будет поддержано христианской церковью: «Любое тело может делиться до бесконечности».
В 18 веке М.В. Ломоносов предполагал, что:
В этом же столетие член Петербургской академии наук Даниил Бернулли впервые применил понятие молекулы для объяснения давления газов.
В 19 веке Д.К. Максвелл первым высказал утверждение о статистическом характере законов природы. В 1866 году им открыт первый статистический закон — закон распределения молекул по скоростям.
Эрнст Резерфорд предложил в 1911 году планетарную модель атома. Осуществил в 1919 первую искусственную ядерную реакцию.
Атомистика первой половины XX в.
Исследования по радиоактивности стали проводиться в России почти сразу после открытия Беккереля. Ученые И. И. Боргман (1900 г.) и А. П. Афанасьев исследовали свойства радиоактивного излучения, в частности лечебные свойства целебных грязей. В. К. Лебединский (1902 г.) и И. А. Леонтьев (1903 г.) изучали влияние радиоактивности на искровые разряды и определили одними из первых природу гамма-лучей.
Н. А. Орлов исследовал действие радия на металлы, парафин, легкоплавкие органические вещества. Кроме Петербургского университета такого рода работы велись в Медицинской академии, в университетах Новороссийска, Харькова и других городов. Важные результаты в этой области были получены В. А. Бородовским, Г. Н. Антоновым, Л. С. Коловрат-Червинским.
В 1900 г. немецкий физик-теоретик М. Планк (1858-1947) ввел новую универсальную постоянную, названную им элементарным квантом действия. Введя понятие кванта энергии, он сформулировал квантовую гипотезу, положив тем самым начало квантовой теории, или, коротко, атомизации действия. Впервые годы эта теория не имела «шумного успеха», пока ее не применил А. Эйнштейн и не показал ее незаменимость для понимания явлений, происходящих в микромире.
В 1911 г. Э. Резерфорд (1871-1937) сделал в Манчестере доклад «Рассеяние альфа- и бета-лучей и строение атома». X. Гейгер и Э. Марсден провели экспериментальную проверку идеи Резерфорда о строении атома. Они подтвердили существование ядра атома как устойчивой его части, несущей в себе почти всю массу атома и обладающей положительным зарядом.
В 1913 г. Н. Бор (1885-1962) опубликовал серию статей «О строении атомов и молекул», открывших путь к атомной квантовой механике.
Многочисленные исследования, проведенные этими учеными, позволили сформулировать основные положения молекулярно-кинетической теории – МКТ.
МКТ объясняет строение и свойства тел на основе закономерностей движения и взаимодействия молекул, из которых состоят тела.
В основе МКТ лежат три важных положения, подтвержденные экспериментально и теоретически.
1.Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят еще более мелкие элементарные частицы (электроны, протоны, нейтроны). Строение любого вещества дискретно (прерывисто).
2.Атомы и молекулы вещества всегда находятся в непрерывном хаотическом движении.
3.Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Эти положения подтверждаются опытным путем.
Межмолекулярное взаимодействие – это взаимодействие электрически нейтральных молекул и атомов.
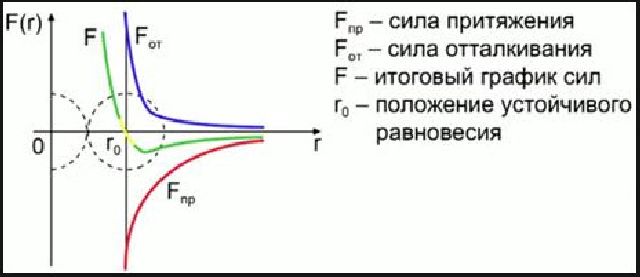
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
Зависимости результирующей силы F и потенциальной энергии Ep взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис.1. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы.
Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
Между электронами одной молекулы и ядрами другой действуют силы притяжения, которые условно принято считать отрицательными (нижняя часть графика). Одновременно между электронами молекул и их ядрами действуют силы отталкивания, которые условно считают положительными (верхняя часть графика).
На расстоянии равном размеру молекул результирующая сила равна нулю, т.е. силы притяжения, уравновешивают силы отталкивания. Это наиболее устойчивое расположение молекул. При увеличении расстояния притяжение превосходит силу отталкивания, при уменьшении расстояния между молекулами – наоборот.
Атомы и молекулы взаимодействуют, и значит, обладают потенциальной энергией.
Атомы и молекулы находятся в постоянном движении, и значит, обладают кинетической энергией.
Масса и размеры молекул
Большинство веществ состоит из молекул, поэтому для объяснения свойств макроскопических объектов, объяснения и предсказания явлений важно знать основные характеристики молекул.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Атомом называют наименьшую частицу данного химического элемента.
Размеры молекул очень малы.
О том, что размеры молекул малы, можно судить и из опыта. В 1 л (м3) чистой воды разведем 1 м3 зеленых чернил, тете разбавим чернила в 1 000 000 раз. Увидим, что раствор имеет зеленую окраску и вместе с тем однороден. Это говорит о том, что даже при разбавлении в 1 000 000 раз в воде находится большое количество молекул красящего вещества. Этот опыт показывает, как малы размеры молекул.
В молекулярной физике принято характеризовать массы атомов и молекул не их абсолютными значениями (в кг), а относительными безразмерными величинами относительной атомной массой и относительной молекулярной массой.
По международному соглашению в качестве единичной атомной массы m0 принимается 1/12 массы изотопа углерода 12 С (m0С):
Относительную молекулярную массу можно определить, если абсолютное значение массы молекулы (mмол в кг) разделить на единичную атомную массу.
Относительная молекулярная (атомарная) масса вещества (из таблицы Менделеева)
Относительное число атомов или молекул, содержащихся в веществе характеризуется физической величиной, называемой количеством вещества.
Количество вещества ע – это отношение числа молекул (атомов) N в данном макроскопическом теле к числу молекул в 0,012 кг углерода NA
Количество вещества выражают в молях
Один моль – это количество вещества, в котором столько же молекул (атомов), сколько атомов содержится в 0,012 кг углерода.
Моль любого вещества содержит одинаковое число молекул.
Масса одного моля вещества называется молярной массой.
Число молекул в данной массе вещества:
Масса вещества (любого количества вещества):
Определение молярной массы:
Тепловое движение. Температура. Абсолютная температура
Температура, измерение температуры
Температура — физическая величина, характеризующая тепловое состояние тел.
В окружающем мире происходят различные физические явления, которые связаны с нагреванием и охлаждением тел, поэтому часто встречаемся с понятиями «холодно», «горячо».
Однако ощущение тепла и холода является субъективным фактором, к примеру, если коснуться левой рукой деревянного тела, а правой – металлического тела, то левая рука ощущает тепло, правая – холод, хотя предметы находятся в одной комнате.
Отсюда вывод: с помощью ощущений судить о температуре невозможно.
Для количественной оценки состояния температуры тела используют приборы.
Первый прибор для объективной оценки температуры служил термоскоп,
изобретенный Галилеем в 1592 г. За счет изменения объема воздуха в шаре уровень воды в открытой трубке как поднимался, так и опускался. Таким образом, выясняли изменение температуры.
Но данное изобретение было несовершенным, во-первых, конец трубки не запаян, поэтому на изменение уровня воды в трубке влияло атмосферное давление, во-вторых, отсутствие числового значения температуры.
В дальнейшем в изобретении приборов для измерения температуры стали вносить изменения: концы трубок должны быть запаяны, вместо воды использовать ртуть или подкрашенный спирт, но и показания температуры должны быть представлены в виде числа, что способствовало изобретению термометра с определенной шкалой.
Ученые того времени располагали числа на шкале измерительного прибора по-разному, указав верхнюю и нижнюю опорные точки:
1.Г. Фаренгейт принял за опорные точки температуру таяния льда (32 °F) и среднюю температуру тела здорового человека (100 °F).
2.Р. Реомюр предложил один градус приравнять 1/80 разности температур кипения воды и таяния льда при нормальном атмосферном давлении.
3.Шведский физик А. Цельсий в качестве опорных точек использовал температуру замерзания воды и таяния льда (0 °С) и температуру кипения воды (100 °С) при нормальном атмосферном давлении.
Всеми названными температурными шкалами до сих пор пользуются в разных странах. Зная соотношение между ними, всегда можно сделать соответствующий перевод и представить температуру в знакомой шкале.
Тепловое движение
Известно, что диффузия или самопроизвольное взаимное проникновение молекул одного вещества в промежутки между молекулами другого при более высокой температуре происходит быстрее. Из этого следует, что скорость перемещения молекул и температура взаимосвязаны между собой.
Если увеличить температуру, то скорость движения молекул увеличится, если уменьшить – понизится, так как движение частиц связано с кинетической энергией, поэтому температура — мера средней кинетической энергии движения структурных частиц тела. Чем больше эта энергия, чем выше температура тела.
Если рассмотреть движение частиц газа с большими скоростями в сосуде и в разных направлениях, то частицы начинают сталкиваться друг с другом и со стенками сосуда, что приводит к изменению направления и скорости движения частиц.
Беспорядочное движение структурных частиц, из которого состоят тела, называют тепловым движением.
Это движение никогда не прекращается. В тепловом движении участвуют все частицы тела, поэтому при изменении характера теплового движения меняется состояние самого тела и происходит переход из одного агрегатного состояния в другое.
К примеру, если повысить температуру льда, то частицы, находясь в строго определенном порядке, начинают отдаляться друг от друга, нарушая порядок в расположении частиц, и вещество переходит в жидкое состояние. Если же, наоборот, понижать температуру, к примеру, ртути, то она изменит свои свойства, и из жидкого состояния перейдет в твердое.
Указанные явления такие, как таяние льда, кристаллизация жидкости, относят к тепловым явлениям.
Итоги по теме урока
Таким образом, тепловые явления – это явления, связанные с нагреванием или охлаждением тел, а также с изменением их агрегатного состояния. Все тепловые явления связаны с температурой, которая является главной характеристикой состояния тела.
Температура – это мера нагретости тел и к тому же физическая величина, для измерения которой используется такой прибор, как термометр. На сегодняшний день сохранились три основные шкалы: шкала Цельсия, Фаренгейта, Кельвина. Наибольшее распространение получила шкала Цельсия.
Как сказал.
Человек, который никогда не ошибался, никогда не пробовал сделать что-нибудь новое.
Альберт Эйнштейн
Вопросы к экзамену
Для всех групп технического профиля

Я учу детей тому, как надо учиться
Часто сталкиваюсь с тем, что дети не верят в то, что могут учиться и научиться, считают, что учиться очень трудно.
Урок 14. (дополнительный материал). История атомистических учений.
Молекулярная физика исходит из того, что любое тело – твердое, жидкое или газообразное – состоит из громадного числа молекул, которые находятся в беспорядочном движении, интенсивность которого зависит от температуры. При изучении молекулярной физики Вы познакомитесь со строением, структурой и свойствами некоторых материалов, с особенностями агрегатных изменений, рассмотрите зависимости количественных характеристик от физико-механических свойств веществ и их строения.
Молекулярная физика служит научной основой современного материаловедения, вакуумной технологии, порошковой металлургии, холодильной техники.
Учение о том, что все тела состоят из отдельных частиц – атомов, возникло в Древней Греции в IV в. до н.э. Основоположником атомистической теории был философ Демокрит.
Атомистическая теория (по-гречески atomos – неделимый) – вещество имеет дискретное строение, состоит из отдельных, разделенных пространственными промежутками частиц
Греческая форма атомизма плодотворно повлияла на развитие науки. Наиболее полно и в ясном изложении дошли до нас изустные и письменные работы древних греков.
Атомистика философов Древней Греции и Рима.
Характерные черты естествознания того времени – это накопление эмпирического материала, попытки объяснить мир с помощью общих умозрительных гипотез и теорий, в которых предсказывалось, предвосхищалось немало позднейших научных открытий. К примеру, в ту эпоху зародились идеи об атомарном, дискретном строении материи.
Древние греки создали учение о материальной первооснове всех вещей, родоначальниками которого были Фалес Милетский (625-547 до н. э.), Анаксимандр (610-547 до н. э.), Анаксимен (585-525 до н. э.) и другие античные философы.
Непосредственными предшественниками атомистов были Эмпедокл (490-430 до н. э.) и Анаксагор (500-428 до н. э.), они выдвинули концепцию элементов, из которых построена Вселенная.
По учению Эмпедокла такими материальными элементами являются огонь, воздух, вода и земля. Они вечны, неразрушимы, хотя и изменяются по числу и величине путем соединения и разделения. Эмпедокл утверждал: «Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться».
Анаксагор считал, что мир состоит из бесконечного множества частиц («семян») веществ и в результате их совокупного движения темный холодный воздух отделяется от светлого горячего эфира, а частицы соединяются с себе подобными. Так образуются материальные тела.
Философы Левкипп и его ученик Демокрит (460-370 до н. э.) стали основателями атомистической теории. По учению Левкиппа материя состоит из отдельных частиц – атомов, находящихся в пустом пространстве, и слишком мелких, чтобы их можно было увидеть в отдельности. Атомы непрерывно движутся в пространстве и воздействуют друг на друга при помощи толчков и давления.
Более полно и стройно атомистическая теория была изложена великим древнегреческим философом-материалистом Демокритом.
Приведем некоторые принципиальные положения Демокрита, имеющие отношение к атомистической теории:
1. Ничто не возникает из ничего и ничего не переходит в ничто.
2. Материя состоит из бесконечного числа мельчайших, неделимых частиц – атомов.
3. Атомы вечны и неизменны, а все сложные тела, из них состоящие, изменчивы и преходящи.
4. Не существует ничего, кроме атомов и «чистого» пространства.
5. Атомы вечно движутся. Движение всегда присуще атомам и происходит в силу господства во Вселенной закона универсальной необходимости.
6. Атомы бесконечны по числу и бесконечно разнообразны по форме.
7. Во Вселенной существует бесконечное множество миров. Наш мир один из них.
8. Различие между вещами связано с различием их атомов по числу, величине, форме.
В Древнем Риме поэт и философ Тит Лукреций Кар (99-55 до н. э.) в своей знаменитой поэме «О природе вещей» изложил атомистическое учение греческого философа Эпикура. Представитель афинской школы Эпикур (341-270 до н. э.), а за ним Лукреций пытались существованием атомов объяснить все естественные и социальные явления. Лукреций рисует модель движения атомов, уподобляя его движению пылинок в солнечном луче в темной комнате. Это по существу одно из первых в истории естественных наук описание молекулярного движения.
Естественнонаучное мировоззрение древних получило свое развитие в трудах знаменитого философа того времени Аристотеля (384-322 до н. э.). В своем творчестве он охватил почти все существовавшие тогда отрасли знаний. Хотя Аристотель критиковал своего учителя философа-идеалиста Платона (427-347 до н. э.), он не был материалистом. Он признавал объективное существование материального мира и его познаваемость, но противопоставлял земной и небесный миры, верил и учил верить в существование божественных сил. Аристотель резко отвергал атомистическую теорию.
Бытие — живая субстанция, характеризующаяся специальными принципами или четырьмя началами (условиями) бытия:
Аристотель считал, что все космические тела состоят из эфира, основного элемента природы, в котором изначально заложено совершенное движение по кругу. Естественный путь познания природы, учил Аристотель, идет от менее известного и явного для нас к более явному и известному с точки зрения природы вещей. Он рассматривал такие общие понятия, как материя и движение, пространство и время, конечное и бесконечное. В своей работе «Физика» Аристотель подробно разобрал взгляды своих предшественников – Анаксагора, Левкиппа, Демокрита и др. Он резко критиковал воззрения атомистов, признающих существование бесчисленного множества атомов и миров. По Аристотелю реальный мир конечен, ограничен и построен из «конечного числа» элементов. Понятие пустоты по Аристотелю противоречит действительности. Бесконечное разреженное пустое пространство ведет к бесконечному движению, а это, по мнению Аристотеля, невозможно.
«Канонизированное» учение Аристотеля в средние века надолго задержало развитие атомистических воззрений. И все же учение об атомах, атомистика, пройдя через многие века, выдержало ожесточенную борьбу и дошло до наших дней с более глубокими представлениями об атоме, полученными в результате огромного числа физико-химических экспериментов и исследований по физике атома.
В середине XV в. в экономическом, политическом и культурном развитии Европы начинают отчетливо проступать новые, самобытные черты.
Николай Коперник (1473-1543) сломал общепризнанную до того концепцию мироздания, по которой Земля считалась неподвижной по отношению к Солнцу. Коперник отбросил геоцентрическую систему Птолемея и создал гелиоцентрическую систему мироздания. Возникнув в астрономии, она распространилась и на физику, дав новый импульс развитию атомистических идей. Атомы неощутимы, считал Коперник, несколько атомов не составляют видимого тела. И все же число этих частиц можно так умножить, что их будет достаточно для слияния в заметное тело. Коперник вплотную подошел к материалистической атомистике. В эпоху Возрождения физические наблюдения и опыты еще не носили систематического характера, хотя и были достаточно широко развиты.
Началу использования в физике экспериментального метода положил Галилео Галилей (1564-1642), итальянский физик, механик, астроном, один из основателей естествознания. Галилей считал, что мир бесконечен, материя вечна. Материя состоит из абсолютно неделимых атомов, ее движение – единственное, универсальное механическое перемещение. Галилей экспериментально подтвердил ряд гипотез древних философов об атомах. В своих трудах он поддержал гелиоцентрическую систему мироздания, за что жестоко пострадал от католической инквизиции.
В XVIII и XIX вв. классическая физика вступила в период, когда многие ее положения стали подвергаться серьезному переосмыслению.
Михаил Ломоносов – первый русский профессор химии, автор первого русского курса физической химии.
Самый характер соединения Ломоносов мыслил не как простое сложение составных элементов. Он подчеркивал, что природа новых образований зависит не только от того, какие элементы входят в эти образования (корпускулы), но и от того, каков характер связи между элементами. Ломоносов, приняв гипотезу о вращательном движении молекул-корпускул, вывел ряд следствий:
Ломоносов критиковал теорию теплорода (или флогистона – не имеющей массы невесомой жидкости), которую он считал возвратом к представлениям древних об элементарном огне. По мысли Ломоносова, упругость газов (воздуха) является свойством коллектива атомов. Сами атомы «должны быть телесными и иметь продолжение», форма их «весьма близка» к шарообразной. Воззрения на теплоту как форму движения мельчайших «нечувствительных» частиц высказывались еще в XVI в. Бэконом, Декартом, Ньютоном, Гуком. Эту же идею разрабатывал и М. Ломоносов, однако он оставался почти в одиночестве, так как многие его современники были сторонниками концепции «теплорода». И только позднее Дэви и затем Юнг и Мор доказали, что теплота является формой движения и что следует рассматривать теплоту как колебательное движение частиц материи. Последующими работами Майера, Джоуля, Гельмгольца был установлен закон сохранения и превращения энергии.
Атомно-молекулярное учение о материи лежало в основе многих физических и химических исследований на всем протяжении истории науки. Со времени Бойля оно стало служить химии и было положено Ломоносовым в основу учения о химических превращениях.
Итальянский ученый Э. Торричелли (1608-1647) доказал существование атмосферного давления. Французский математик и физик Б. Паскаль (1623-1662) открыл закон: давление, производимое на поверхность жидкости внешними силами, передается жидкостью одинаково во всех направлениях.
Вместе с Г. Галилеем и С. Стевиным Блез Паскаль считается основоположником классической гидростатики. Он указал на общность основных законов равновесия жидкостей и газов. В 1703 г. немецкий ученый Г. Шталь (1659-1734) сформулировал теорию, точнее, гипотезу о природе горючести в веществах.
Английский ученый Р. Бойль (1627-1691) ввел в химию атомистику, это дало основание Ф. Энгельсу сказать о работах Бойля: «Бойль делает из химии науку». Голландец X. Гюйгенс (1629-1695) вошел в историю науки как создатель подтвержденного экспериментами первого научного труда по волновой оптике – «Трактата о свете»; он был первым физиком, исследовавшим поляризацию света.
Наука о тепле потребовала точных температурных измерений. Появились термометры с постоянными точками отсчета: Фаренгейта, Делиля, Ломоносова, Реомюра, Цельсия.
А. Лавуазье (1743-1794) разработал в 1780 г. кислородную теорию, выявил сложный состав воздуха. Объяснил горение, тем самым доказав несостоятельность теории флогистона, который и М. В. Ломоносов исключал из числа химических элементов.
Работавший в Петербургской академии наук Л. Эйлер (1707-1783) установил закон сохранения момента количества движения, развил волновую теорию света, определил уравнения вращательного движения твердого тела.
Американский ученый Б. Франклин (1706-1790) разработал теорию положительного и отрицательного электричества, доказал электрическую природу молнии.
Английский физик Г. Кавендиш (1731-1810) и независимо от него французский физик Ш. Кулон (1736-1806) открыли закон электрических взаимодействий.
Итальянский ученый А. Вольта (1745-1827) сконструировал первый источник постоянного тока («вольтов столб») и установил связь между количеством электричества, емкостью и напряжением. Одним из первых трудов, посвященных описанию нового источника постоянного тока, была выпущенная в 1803 г. книга русского ученого В. Петрова «Сообщение о гальвано-вольтовых опытах».
Начало практическим исследованиям электромагнетизма положили работы датчанина X. Эрстеда, француза А. Ампера, русских ученых Д. М. Велланского и Э. Ленца, англичанина М. Фарадея, немецкого физика Г. Ома и др.
Крупнейший немецкий ученый Г. Гельмгольц (1821-1894) распространил закон сохранения энергии с механических и тепловых процессов на явления электрические, магнитные и оптические. Им был установлен ряд законов, касающихся газов, заложены основы кинетической теории газов, термодинамики, открыты инфракрасные и ультрафиолетовые лучи.
В 1803 г. английский физик и химик Дж. Дальтон (1766-1844) опубликовал основополагающие работы по химической атомистике, вывел закон кратных отношений.
В XVII–XIX вв. атомы считались абсолютно неделимыми и неизменными частицами материи. Атомистика в значительной мере носила все еще абстрактный характер. В XIX в. большой вклад в разработку научной базы атомистики внесли такие ученые, как Максвелл, Клаузиус, Больцман, Гиббс и др.
В недрах химической науки родилась гипотеза о строении всех атомов из атомов водорода. Именно химико-физики ближе всех подошли к пониманию физического смысла идей атомистики. Они постепенно приближались к выяснению природы атомизма, а последующие поколения ученых – к пониманию действительного строения атома и его ядра.
Предыстория познания атомного ядра начинается в 1869 г. с гениального открытия Д. И. Менделеевым периодического закона химических элементов.
Д. И. Менделеев (1834-1907) был первым, кто попытался классифицировать все элементы, и именно ему мы обязаны нынешним видом Периодической системы. Периодическая система элементов стала в конце прошлого века памятником упорству, труду и аккуратности в экспериментальной работе.
В Периодической системе Менделеева нашли отражение сложность структуры атома и значимость ранее неизвестных основных характеристик атомного ядра – его массового числа А и порядкового номера 2. В течение всей последующей истории ядерной физики периодический закон Менделеева, обогащенный новыми открытиями, служил путеводной нитью исследований. Именно с конца XIX в. подход к изучению атома стал действительно научным, имеющим экспериментальную основу. Никто из естествоиспытателей той эпохи не проник так глубоко в понимание взаимосвязи между атомами и молекулами, как Д. И. Менделеев. В 1894 г., когда еще не была ясна модель не только атома, но и молекулы, Менделеев выдвинул гипотезу о строении атома и молекулы. Положив в основу признание существования атомов и молекул, связи между материей и движением, он высказал мысль, что атомы можно представить себе как бесконечно малую Солнечную систему, находящуюся в непрерывном движении. Неизменность атомов, подчеркивал Менделеев, не дает исследователю никакого основания считать их «неподвижными» и «недеятельными в их внутренней сущности», атомы подвижны.
Менделеев показал, что развитие науки невозможно, если отказаться от признания объективной реальности атомов. Он подчеркивал глубокую внутреннюю связь между атомистическими воззрениями древних (Демокрита) и материалистической философией. Развитие классического учения Демокрита составило, по Менделееву, основу материализма.
Атомистика конца XIX – начала XX в.
Гениальные догадки древних ученых о том. что все вещества состоят из атомов, к концу XIX в. полностью подтвердились. К тому времени также было установлено, что атом как единица любого вещества неделим (само слово «атом» по-гречески означает «неделимый»).
Немецкий физик В. Рентген (1845-1923) открыл в 1895 г. излучение, названное им Х-лучами (впоследствии они получили название рентгеновских лучей, или рентгеновского излучения). Он создал первые рентгеновские трубки и сделал анализ некоторых свойств открытого им излучения. Это открытие и последующие исследования сыграли важную роль в изучении строения атома, структуры вещества. Рентгеновское излучение нашло широкое применение в медицине, технике, в различных областях науки.
Успехи физики XIX в. позволили существенно продвинуться в создании целостной системы, объединяющей механику Ньютона и электродинамику Максвелла и Лоренца. Теория электромагнитного поля, созданная Максвеллом, вошла в историю науки наряду с такими фундаментальными обобщениями, как ньютонова механика, квантовая механика. Процесс коренного преобразования физики подготавливался научными открытиями конца XIX в., сделанными В. Рентгеном (рентгеновские лучи, 1895 г.), А. Беккерелем (естественная радиоактивность урана, 1896 г.), Дж. Томсоном (открытие электрона, 1897 г., первая модель строения атома), М. Склодовской-Кюри (радиоактивные элементы – полоний и радий, 1898 г.), М. Планком (теория квантов, 1900 г.) и др. Выполненные к началу XX в. работы химиков и физиков, теоретиков и экспериментаторов, вплотную приблизили науку об атоме к проблеме высвобождения ядерной энергии атома.
Атомистика первой половины XX в.
Исследования по радиоактивности стали проводиться в России почти сразу после открытия Беккереля. Ученые И. И. Боргман (1900 г.) и А. П. Афанасьев исследовали свойства радиоактивного излучения, в частности лечебные свойства целебных грязей. В. К. Лебединский (1902 г.) и И. А. Леонтьев (1903 г.) изучали влияние радиоактивности на искровые разряды и определили одними из первых природу гамма-лучей. Н. А. Орлов исследовал действие радия на металлы, парафин, легкоплавкие органические вещества. Кроме Петербургского университета такого рода работы велись в Медицинской академии, в университетах Новороссийска, Харькова и других городов. Важные результаты в этой области были получены В. А. Бородовским, Г. Н. Антоновым, Л. С. Коловрат-Червинским.
В 1900 г. немецкий физик-теоретик М. Планк (1858-1947) ввел новую универсальную постоянную, названную им элементарным квантом действия. Введя понятие кванта энергии, он сформулировал квантовую гипотезу, положив тем самым начало квантовой теории, или, коротко, атомизации действия. Впервые годы эта теория не имела «шумного успеха», пока ее не применил А. Эйнштейн и не показал ее незаменимость для понимания явлений, происходящих в микромире.
В 1911 г. Э. Резерфорд (1871-1937) сделал в Манчестере доклад «Рассеяние альфа- и бета-лучей и строение атома». X. Гейгер и Э. Марсден провели экспериментальную проверку идеи Резерфорда о строении атома. Они подтвердили существование ядра атома как устойчивой его части, несущей в себе почти всю массу атома и обладающей положительным зарядом.
В 1913 г. Н. Бор (1885-1962) опубликовал серию статей «О строении атомов и молекул», открывших путь к атомной квантовой механике.