болезнь паркинсона на мрт головного мозга как выглядит
Паркинсонизм и его основные нозологические формы
Болезнь Паркинсона (БП) – хроническое, неуклонно прогрессирующее заболевание центральной нервной системы.
Болезнь Паркинсона (БП) – хроническое, неуклонно прогрессирующее заболевание центральной нервной системы с дегенерацией нигростриарных нейронов и нарушением функции базальных ганглиев. Она относится к одним из наиболее частых нейродегенеративных заболеваний, которые стоят на третьем месте среди причин смертности после сердечно-сосудистых и онкологических заболеваний.
Паркинсонизм известен давно, первые сообщения о лечении похожих расстройств были сделаны 1000-2500 лет до н.э.
Первое клиническое описание принадлежит английскому врачу Джеймсу Паркинсону, который опубликовал в 1817 году «Эссе о дрожательном параличе».
Подробный клинический анализ комплекса патологии был сделан в 1879 г. знаменитым французским неврологом Жаном Мартеном Шарко.
В настоящее время в классификации паркинсонизма выделяют:
I. Болезнь Паркинсона (она составляет около 70-80% всех регистрируемых случаев).
II. Вторичный (симптоматический) паркинсонизм (около 15%) включает следующие варианты: лекарственный, токсический, постгипоксический, энцефалитический, травматический, при объемных процессах, при гидроцефалии, сосудистый.
III. Паркинсонизм при различных дегенеративных заболеваниях с поражением экстрапирамидной системы («паркинсонизм-плюс», около 10%): мультисистемные атрофии (стриатонигральная дегенерация, оливопонтоцеребеллярная дегенерация), прогрессирующий надъядерный паралич (болезнь Стила-Ричардсона-Ольшевского), кортикобазальная дегенерация, деменция с тельцами Леви, паркинсонизм-БАС-деменция, болезнь Вильсона-Коновалова, болезнь Гентингтона (ювенильный вариант Вестфаля), болезнь Фара (идиопатическая кальцификация базальных ганглиев), болезнь Альцгеймера, другие.
Основной нозологической формой паркинсонизма является болезнь Паркинсона.
Этиология БП неизвестна. В основе ее патогенеза лежит дегенерация так называемых дофаминергических нейронов. БП носит преимущественно спорадический характер, однако при наличии БП у ближайших родственников риск ее развития возрастает.
Клинические проявления БП возникают при уменьшении количества дофамина в хвостатом ядре и скорлупе не менее чем на 70%. Симптомы БП развиваются постепенно, вовлекая сперва конечности на одной стороне. Для клинической картины БП характерно сочетание гипокинезии, ригидности, тремора покоя, и постуральных нарушений.
Гипокинезия проявляется снижением двигательной активности, замедленностью движений, уменьшением амплитуды действий.
Тремор покоя в классических случаях начинается с дистальных отделов верхней или нижней конечности и напоминает движения рук «при счете монет или скатывании пилюль». В дальнейшем в тремор вовлекается гомолатеральная конечность, нижняя челюсть, противоположные конечности. Иногда отмечается постуральное дрожание рук.
Кроме двигательных нарушений, при БП части развиваются недвигательные проявления: нервно-психические расстройства; нарушения сна; вегетативные нарушения; чувствительные нарушения.
В зависимости от преобладания того или иного симптома в клинической картине БП принято выделять следующие клинические формы заболевания: дрожательную, акинетическую, а также смешанные формы — акинетико-ригидную и ригидно-дрожательную.
На поздних стадиях БП клиническая картина видоизменяется, появляются дополнительные моторные (двигательные флуктуации, лекарственные дискинезии, нарушения ходьбы, падения, застывания и акинетические кризы) и немоторные (вегетативные, когнитивные, нейропсихические) синдромы.
У больных могут возникать длительные периоды декомпенсаций — от нескольких дней до нескольких недель, а также акинетические кризы — тяжелые эпизоды акинезии, сопровождающиеся дисфагией, вегетативными нарушениями, гипертермией, олигурией, спутанностью сознания. Причинами этого могут являться: нарушение схемы приема противопаркинсонических средств, их полная отмена («лекарственные каникулы»); прием препаратов, блокирующих ДА-рецепторы (прежде всего нейролептики); обострение сопутствующих соматических заболеваний, стресс; операции, травмы, дегидратация организма.
Диагностировать БП с уверенностью можно только с помощью аутопсии. Клиническая диагностика синдрома паркинсонизма требует обязательного наличия гипокинезии и не менее одного из трех основных симптомов паркинсонизма: тремора покоя, ригидности и постуральной неустойчивости.
Проведение МРТ головного мозга является обязательным при наличии у больного синдрома паркинсонизма. Данное исследование прежде всего необходимо для дифференцирования идиопатической болезни Паркинсона и вторичного паркинсонизма, а также «паркинсонизма-плюс».
Основными направлениями лечения БП являются:
1. Фармакотерапия.
2. Медико-социальная реабилитация.
3. Лечебная физическая культура (ЛФК).
4. Нейрохирургическое лечение.
Фармакотерапия при БП направлена на нормализацию биохимического дисбаланса и требует постоянного приема лекарственных средств, так как при прекращении лечения симптомы БП возвращаются к исходному уровню.
На ранней стадии лечение БП заключается в назначении монотерапии с последующим переходом на комбинированное лечение.
На ранних стадиях заболевания общепринятым является назначение больным в возрасте до 70 лет агонистов ДА-рецепторов и ингибиторов МАО-В в виде монотерапии или сочетания.
У пациентов старше 70 лет, когда ожидаемая продолжительность жизни больного меньше, а также имеются когнитивные нарушения, терапию можно сразу начинать с ДОФА-содержащих препаратов в минимальной эффективной дозе, которую подбирают постепенно.
Холинолитики (Циклодол, Акинетон) назначаются преимущественно на ранней стадии БП — в виде монотерапии или в комбинации с другими противопаркинсоническими средствами; они преимущественно влияют на тремор покоя.
В настоящее время их назначают лишь молодым пациентам, с выраженным тремором покоя и сохранными когнитивными функциями. Высокая частота побочных эффектов и низкая эффективность по сравнению с другими группами существенно ограничивают их применение.
Препараты амантадина (Мидантан, ПК-Мерц).
Амантадины могут назначаться как при начальной стадии в виде монотерапии, так и в комбинации с другими противопаркинсоническими средствами на поздних стадиях БП. Препараты эффективны и для уменьшении степени выраженности дискинезий, вызванных приемом леводопы. Инфузионная форма амантадина сульфата (ПК-Мерц) применяется при лечении декомпенсаций и акинетических кризов при БП.
Агонисты дофаминовых рецепторов обладают способностью непосредственно стимулировать ДА рецепторы в головном мозге. Неэрголиновые агонисты ДА-рецепторов (Проноран, Мирапекс, Реквип Модутаб, Ньюпро) широко применяются на всех стадиях БП. Помимо контроля двигательных нарушений, у них выявлен антидепрессивный эффект, что очень важно, так как частота депрессивного синдрома при БП достаточно высока.
Монотерапия АДАР на ранних стадиях заболевания позволяет отсрочить назначение препаратов леводопы, а также развитие моторных флюктуаций и лекарственных дискинезий.
Ингибиторы МАО типа В (Разагилин). Назначение препаратов этой группы приводит к увеличению количества дофамина в нейронах. Также предполагается наличие у них нейропротекторного действия. Могут назначаться на ранних стадиях в виде монотерапии, а также в комбинации с леводопой.
Ингибиторы КОМТ. Ингибиторы КОМТ увеличивают биодоступность леводопы, уменьшая уровень ее неактивных метаболитов.
Ингибиторы КОМТ периферического действия не проходят ГЭБ и препятствуют метилированию леводопы в желудочно-кишечном тракте и кровеносном русле. Благодаря этому они сохраняют концентрацию леводопы на определенном уровне. К таким препаратам относится энтакапон.
Комбинация энтакапона с препаратами леводопы позволяет снизить суточную дозу ДОФА-содержащего препарата на 15–30%.
Он назначается только в комбинации с препаратами леводопы (Сталево), так как при назначении в виде монотерапии самостоятельным противопаркинсоническим эффектом не обладает.
Препараты леводопы (Мадопар, Наком, Тремонорм, Тидомет-форте, Дуэллин, Синдопа). Дофамин не проходит ГЭБ, поэтому в качестве лекарственного препарата был предложен метаболический предшественник дофамина — леводопа, которая проходит через ГЭБ и в головном мозге метаболизируется в дофамин. На сегодняшний день препараты леводопы являются наиболее эффективными лекарственными средствами, «золотым стандартом», применяющимися для лечения БП. Однако они не останавливают прогрессирование БП. Более того, в среднем после 5 лет применения ДОФА-содержащих средств у больных БП снижается их эффект, появляются двигательные флюктуации и лекарственные дискинезии.
Сроки назначения терапии препаратами леводопы зависят от степени выраженности и темпа прогрессирования заболевания, профессиональной деятельности больного, семейно-бытового статуса. В целом назначать препараты этой группы необходимо, когда имеются выраженные двигательные нарушения, которые не удается купировать другими противопаркинсоническими средствами.
Нейрохирургическое лечение.
Снижение эффективности фармакотерапии, появление моторных флюктуаций и лекарственных дискинезий являются показанием к применению нейрохирургического лечения, которое в течение последних двух десятилетий прочно заняло свое место в алгоритме ведения пациентов с БП.
В настоящее время используются три типа нейрохирургических вмешательств при БП: стереотаксические деструктивные методы (вентролатеральная таламотомия, паллидотомия, субталамотомия и их комбинация), стимуляционные методы (имплантация электродов в подкорковые структуры с последующей их хронической электростимуляцией) и внутримозговая трансплантация дофаминергических нейронов мезенцефалона эмбриона человека, эффективность которой продолжает изучаться.
Наиболее современный метод хирургического лечения БП – глубокая электростимуляция головного мозга. Процедура ГСМ состоит в имплантации электродов с 4 контактами в зоны-мишени в пределах подкорковых образований головного мозга; электроды соединяются с имплантируемым под кожу стимулятором, подающим высокочастотные электрические импульсы в стимулируемое ядро.
Медико-социальная реабилитация.
Высокая степень инвалидизации при неуклонно прогрессирующей БП, социально-экономические потери, которые несет общество обусловливают необходимость создания системы медико-социальной реабилитации, которая должна включать в себя диспансерное наблюдение больных; создание школ для пациентов и их родственников ведение обучающих программ и психотерапевтических занятий, создание общественных организаций, групп поддержки.
Большое значение имеет ЛФК, которая может подбираться индивидуально в зависимости от степени тяжести болезни у конкретного больного, занятия ЛФК в группах, танцевальная терапия, а также трудотерапия, физиотерапия.
Болезнь паркинсона на мрт головного мозга как выглядит
а) Терминология:
• Болезнь Паркинсона (БП):
о Прогрессирующее нейродегенеративное заболевание
о В первую очередь поражается компактная часть черной субстанции (ЧСкч)
б) Визуализация болезни Паркинсона:
• МРТ:
о Истончение, слабая выраженность ЧСкч (Т2-ВИ)
о Прогрессирующая потеря нормального гиперинтенсивного сигнала от ЧСкч (в латеро-медиальном направлении)
о Размытость границы между ЧСкч и красным ядром о ↑ скорости релаксации R2′ при MPT ЗТ в ЧСкч, каудальных отделов скорлупы (отражает ↑ содержания железа)
о С помощью ДВИ возможно отличить БП от ПНП, МСА-П
о МР-спектроскопия: неспецифические изменения, ↓ отношений NAA/креатин и NAA/холин в базальных ганглиях
• ПЭТ/ОФЭКТ помогают отличить БП от синдромов «паркинсон-плюс»
• ↑ ИКД в скорлупе и хвостатом ядре
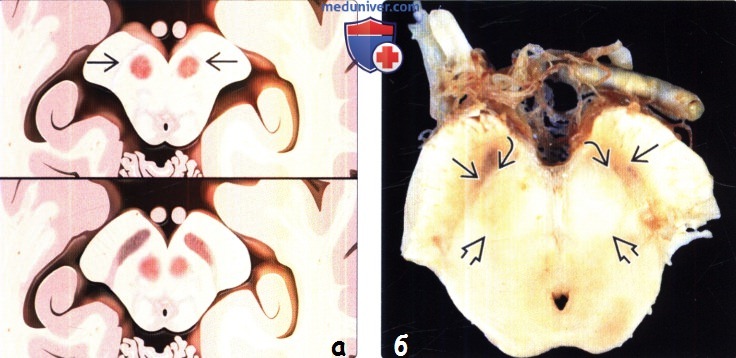
(б) Аксиальный срез через средний мозг пациента с тяжелой болезнью Паркинсона: определяются макроскопические патологические изменения. Обратите внимание на значительное сужение и депигментацию сетчатой части черной субстанции. Компактная часть, которая расположена между сетчатой частью и красным ядром, заметно сужена. 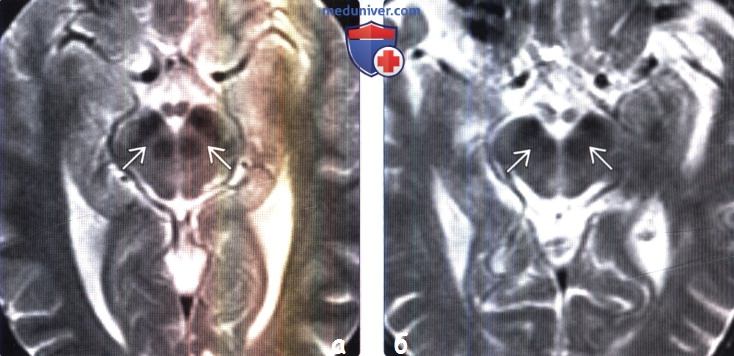
(б) МРТ, Т2-ВИ, аксиальный срез: у пациента с болезнью Паркинсона определяется классическая картина изменений среднего мозга. Обратите внимание на «размытие» и истончение компактной части, расположенной между двумя гипоинтенсивными структурами (сетчатой частью черной субстанции и красным ядром). В результате, красное ядро и черная субстанция практически соприкасаются друг с другом.
в) Дифференциальная диагностика:
• Множественная системная атрофия (MCA):
о Паркинсонический тип MCA (МСА-П)
• Прогрессирующий надъядерный паралич
• Кортикобазальная ганглионарная дегенерация
• Деменция с тельцами Леви
г) Патология:
• Тельца Леви (эозинофильные внутрицитоплазматические включения с периферическими ореолами и плотными ядрами), глиоз
д) Клиническая картина болезни Паркинсона:
• Тремор покоя
• Ригидность по типу «зубчатого колеса»
• Брадикинезия
• Шаркающая походка
• «Застывшее» выражение лица
Редактор: Искандер Милевски. Дата публикации: 4.5.2019
Значение магнитно-резонансной томографии при болезни Паркинсона
СТРУКТУРНЫЕ И МЕТАБОЛИЧЕСКИЕ ОСОБЕННОСТИ ГОЛОВНОГО МОЗГА ПРИ БОЛЕЗНИ ПАРКИНСОНА ПО РЕЗУЛЬТАТАМ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ И МАГНИТНО-РЕЗОНАНСНОЙ СПЕКТРОСКОПИИ IN VIVO
Резюме. Обсуждаются возможности использования данных, получаемых методами магнитно-резонансной томографии (МРТ головного мозга) и магнитно-резонансной спектроскопии как маркеров, чувствительных к структурным и метаболическим изменениям при болезни Паркинсона (БП). Описаны методы магнитно-резонансной томографии и ‘H ядерно-магнитно-резонансной спектроскопии, позволяющие оценивать морфологические и метаболические изменения в черной субстанции, связанные с БП, и сравнивать радиологические показатели с клиническими признаками заболевания. Показано, что метод магнитно-резонансной спектроскопии чувствителен к метаболическим изменениям даже на ранней доклинической стадии заболевания, а данные магнитно-резонансной томографии и in vivo магнитно-резонансной спектроскопии являются биологическими маркерами, объективно характеризующими стадию БП.
ВВЕДЕНИЕ
Болезнь Паркинсона (БП) характеризуется неуклонным прогрессированием, неизбежно приводит к инвалидизации и значительным социально-экономическим потерям общества. Согласно современным данным БП считают болезнью нейромедиаторного обмена. Специфическими биохимическими особенностями заболевания являются недостаточность продукции дофамина в базальных ганглиях и развитие ДОФА-дефици-тарного нейромедиаторного дисбаланса (Homykiewicz O., 1988; Jankovic J., 1993; Крыжа-новский Г.Н. и соавт., 2002; Rao J., 2003).
Манифестации симптомов БП может предшествовать длительный, не менее 5-10 лет, период удовлетворительной компенсации недостаточности функций дофаминергической нигростриарной системы (Wolters E.C. et al., 2000). От момента появления первых признаков заболевания до установления достоверного диагноза, как правило, проходит от 2 до 5 лет. Длительность этого периода, получившего определение как «диагностическая фаза» заболевания (Kemp P.M., 2005), является одним из факторов, лимитирующих своевременное назначение патогенетической терапии. Можно полагать, что на ранних стадиях БП скрытые, субклинические признаки нарушения функционального состояния экстрапирамидной нервной системы могут быть выявлены лишь при помощи специальных диагностических методик. Современные методы нейровизуализации позволяют прижизненно изучать не только структурные изменения головного мозга с помощью МРТ головного мозга, но также оценивать с помощью магнитно-резонансной спектроскопии (МРС) такие функциональные параметры, как метаболизм и перфузия ткани в любой области головного мозга. Поскольку метаболические изменения нередко опережают во времени появление структурных признаков патологии, методам МРТ и in vivo МРС следует отвести особую роль как реально позволяющим сократить длительность «диагностической фазы».
В данной работе анализируются возможности методов МРТ и in vivo МРС для нахождения специфических структурных и метаболических отличий БП от паркинсонических синдромов (ПС) при других нейродегенеративных заболеваниях.
МЕТОДЫ МРТ ДЛЯ ВЫЯВЛЕНИЯ СТРУКТУРНЫХ ОСОБЕННОСТЕЙ ГОЛОВНОГО МОЗГА ПРИ БП, ПС ПРИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ ИНОЙ ПРИРОДЫ
При магнитно-резонансной томографии головного мозга пациентов с подозрением на БП обычно используют импульсные последовательности, чувствительные к изменению времени спин-спиновой релаксации Т2 и эффективного времени спин-спиновой релаксации Т2* (Braffman B.H. et al., 1989; Stern M.B. et al., 1989; Mauricio J.C. et al., 1990; Moriwaka F. et al., 1992; Ordidge R.J. et al., 1994; Gorell J.M. et al., 1995). По степени повышения интенсивности МР-сигнала в черной субстанции и в области субталамического ядра оценивают уменьшение Т2 и Т2*, связывая этот факт с накоплением в этих структурах избыточного количества свободных парамагнитных ионов железа (Antonini A. et al., 1993). Однако поскольку у людей пожилого возраста без признаков выраженных неврологических расстройств в этих участках головного мозга также отмечается избыточное, по сравнению со здоровыми людьми молодого возраста, накопление ионов железа (Antonini A. et al., 1993), уменьшение значений Т2 и Т2* нельзя отнести к специфическим признакам БП.
МР-изображения, взвешенные по времени спин-решеточной релаксации Т1, получаемые с помощью импульсных последовательностей инверсия — восстановление, наиболее эффективны для визуализации отдельных структур головного мозга, в частности, они используются для четкого отображения границы между серым и белым веществом головного мозга (СВГМ и БВГМ) (Hutchinson M., RaffU., 1999). Предположение о том, что времена Т1, в первую очередь отражающие свойства внеклеточного пространства, изменяются под влиянием процессов обмена содержащихся в интерстиции молекул, было высказано A. Antonini и соавторами (1993), а также M. Hutchinson, U. Raff (1999). Измерения Т1 in vivo показали, что несмотря на то что во внеклеточном пространстве содержится большое количество воды, имеющей структуру кристаллической решетки (решетки Дебая), на значение Т1 протонов метаболитов ткани головного мозга в большей степени, чем состояние воды, влияет пространственная структура белков и липидов, наиболее подверженная изменениям, обусловленным хронической нейродегенерацией (Antonini A. et al.,1993).
Для нахождения структурных особенностей ткани головного мозга при БП сравнивали изображения, получаемые с помощью двух импульсных последовательностей: с подавлением сигнала от СВГМ и БВГМ соответственно (Antonini A. et al., 1993; Hutchinson M., RaffU., 1999; 2000). Было выявлено, что на изображениях с подавлением сигнала от СВГМ у здоровых людей удается полностью подавить сигнал от компактной зоны черной субстанции, в то время как у пациентов с БП интенсивность МР-сигнала в этой области повышается с увеличением тяжести заболевания. Это зачастую затрудняет определение границы между черной субстанцией и смежными с ней структурами. Импульсная последовательность инверсия — восстановление с подавлением сигнала от БВГМ позволяет получать МР-изображения, нечувствительные к дегенеративным изменениям в СВГМ, благодаря чему даже при тяжелой форме БП отчетливо видны границы отдельных структур головного мозга. Таким образом, по отношению интенсивностей сигнала в компактной зоне черной субстанции на МРТ головного мозга, полученных с помощью этих двух последовательностей, была найдена корреляция между разностью интенсивности сигнала от латеральных и медиальных структур и степенью выраженности клинических симптомов, характерных для БП (Antonini A. et al., 1993; Hutchinson M., RaffU., 1999; 2000).
В настоящее время разработан метод количественной оценки структурных особенностей ткани головного мозга при БП, позволивший по МР-томограммам отличать БП от нейродегенеративных заболеваний иной природы (Hutchinson M., Raff U., 2000). По зависимости интенсивности МР-сигнала от TE в СВГМ рассчитывали значения Т1 и выявили корреляцию между Т1 в компактной зоне черной субстанции и выраженностью неврологических симптомов, специфичных для БП (Hutchinson M., RaffU., 2000).
МРТ при болезни Паркинсона
Болезнь Паркинсона является неизлечимой, однако возможности современной медицины могут значительно облегчить течение болезни, если вовремя диагностировать ее и начать терапию. Своевременно проведенная МРТ-диагностика способна выявить мельчайшие, казалось бы, незначительные изменения в головном мозге пациента, которые могут стать причиной развития болезни Паркинсона. По этой причине МРТ предпочтительнее среди других методов диагностики, т.к. определяет структурные изменения в головном мозге на ранней стадии, до появления выраженных симптомов болезни Паркинсона (одним из которых является тремор конечностей).
МРТ-диагностика болезни Паркинсона
Стоит отметить, что на первой стадии симптомы паркинсонизма напоминают ряд других заболеваний нервной системы, одним из проявлений которых является психическое расстройство. При подозрении на него лечащий врач назначает пациенту МРТ в числе первых необходимых методов диагностики. МР-исследование позволяет подтвердить или исключить структурные изменения в головном мозге, характерные для данного заболевания, и назначить пациенту дальнейшее обследование. Важное преимущество магнитно-резонансной томографии заключается в ее способности выявлять болезнь Паркинсона до появления выраженных симптомов.
Что показывает МРТ при болезни Паркинсона?
Болезнь Паркинсона связана с нейродегенеративными нарушениями центральной нервной системы и вызывает изменения отдельных структур головного мозга: атрофию черной субстанции, бледного шара и хвостатого ядра. По результатам МРТ-диагностики лечащий врач способен дифференцировать болезнь Паркинсона от ряда других расстройств неврологического или психического характера.
МРТ при болезни Паркинсона является тем методом диагностики, который выявит любые структурные изменения в головном мозге, характерные для паркинсонизма, что позволит своевременно начать терапию и существенно облегчить течение заболевания.
Болезнь паркинсона на мрт головного мозга как выглядит
1. Сокращения:
• Идиопатическая болезнь Паркинсона (БП), дрожательный паралич
2. Определение:
• Прогрессирующее нейродегенеративное заболевание, преимущественно обусловленное первичной дезорганизацией компактной части черной субстанции (ЧСкч)
• Паркинсонизм: синдром, характеризующийся ригидностью, тремором, брадикинезией и постуральным дисбалансом:
о Идиопатическая болезнь Паркинсона (БП) (характерен ответ на терапию препаратом L-допа)
о Синдром «паркинсон-плюс»: паркинсонизм в сочетании с другими клиническими признаками:
— Например, деменция с тельцами Леви, множественная системная атрофия, прогрессирующий надъядерный паралич, кортикобазальная дегенерация
б) Визуализация болезни Паркинсона:
1. Общие характеристики:
• Лучший диагностический критерий:
о Истончение компактной части черной субстанции
• Локализация:
о Черная субстанция (ЧС), хвостатое ядро и скорлупа
• Размеры:
о Уменьшение (атрофия)
2. КТ признаки болезни Паркинсона:
• Бесконтрастная КТ:
о Неспецифическая атрофия больших полушарий
3. МРТ признаки болезни Паркинсона:
• Т1-ВИ:
о Наиболее часто встречаются неспецифические признаки: распространенное расширение борозд, желудочков
о Воксел-базированная морфометрия:
— Неспецифическая потеря нейронов серого вещества (СВ) лимбической, паралимбической и префронтальной коры
• Т2-ВИ:
о У здоровых людей ЧС в верхних отделах среднего мозга представляет собой двухслойную структуру из СВ:
— Гипоинтенсивная зона в задних отделах ножек мозга = сетчатая часть черной субстанции (ЧСсч)
— Относительно гиперинтенсивная зона между ЧСсч и красным ядром (КЯ) = ЧСкч:
Некоторые авторы утверждают, что данные структуры лучше всего видны не на Т2-ВИ, а на PD-взвешенных изображениях
— Гипоинтенсивная зона, в норме наблюдаемая на аксиальных Т2-ВИ, соответствует передне-верхнему отделу ЧС, смежной ножке мозга (верхние отделы среднего мозга) и передне-медиальной части волокон ножки мозга (нижние отделы среднего мозга)
о При БП наблюдается сужение ЧСкч, трудно дифференцируемой от смежных ЧСсч и КЯ
о У некоторых пациентов с БП могут наблюдаться гиперинтенсивные на Т2-ВИ очаги в скорлупе и бледном шаре (БШ), а также уменьшение объема скорлупы
о При МРТ на ЗТ томографе у пациентов с БП в ЧСкч и каудальной части скорлупы наблюдается повышение скоростей релаксации R2, что указывает на увеличение содержания железа в них
• PD-ВИ:
о Аксиальные средневзвешенные SE-изображения у пациентов в норме: точная анатомическая локализация ЧС может быть точно определена:
— ЧС выглядит как зона гиперинтенсивного СВ, окруженного гипоинтенсивным КЯ и волокнами ножек мозга на уровне верхних отделов среднего мозга
— ЧСrx и ЧСсч неразличимы
о Аксиальные изображения со средним значением ТЕ у пациентов с БП:
— Прогрессирующая потеря нормального сигнала от ЧСкч в латеро-медиальном направлении; ЧСкч больше не определяется гиперинтенсивной
— Нечеткая граница между ЧСсч и КЯ, отражающая потерю нейронов и отложение железа
• STIR:
о «Быстрый» STIR-режим: такие же изменения, как и на PD-взве-шенных изображениях
• ДВИ:
о Значительное ↑ ИКД в скорлупе при паркинсоническом типе множественной системной атрофии (МСА-П) по сравнению с БП
о ↑ ИКД в скорлупе и хвостатом ядре:
— По сравнению с прогрессирующим надъядерным параличом (ПНП) и паркинсоническим типом множественной системной атрофии (МСА-П), при которых также определяется возрастание ИКД
о ↑ ИКД в обонятельных путях при БП по сравнению со здоровой контрольной группой
• МР-спектроскопия:
о Неспецифические изменения, ↓ отношений NAA/креатин и NAA/холин в базальных ганглиях
• DTI:
о ↓ ФА в ЧС и по ходу нигростриарного пути
— Значения ФА обратно коррелируют стяжестью клинического течения БП
о ↓ ФА в лобной доле (дополнительная моторная область (ДМО), преДМо, поясная извилина)
• Т2 или Т2*-картирование:
о Чувствительный к содержанию железа в мозговой ткани метод; ↑ ↑ скорости релаксации R2′ коррелирует с наличием двигательных симптомов у пациента, а не с тяжестью протекания заболевания
4. УЗИ признаки болезни Паркинсона:
• УЗИ паренхимы мозга: гиперэхогенность ЧС при БП:
о В отличие от БП при синдромах «паркинсон-плюс» (ПНП, MCA) определяется снижение интенсивности сигнала от скорлупы (накопление железа)
5. Радионуклидная диагностика болезни Паркинсона:
• ПЭТ:
о Может использоваться для изучения функционального статуса допаминергических нейронов в ЧС, допаминовых Э2-рецепторов в базальных ганглиях или опиоидных рецепторов в базальных ганглиях
о Допаминергические нейроны в ЧС:
— ПЭТ с 18F-флюородопой: ↓ поглощения в полосатых телах пропорционально уменьшению количества допаминергических нейронов; коррелирует с тяжестью клинического течения заболевания:
Более выраженное уменьшение в скорлупе, чем в хвостатом ядре
Позволяет диагностировать раннюю/относительно бессимптомную стадию БП
о Допаминовые D2-рецепторы в базальных ганглиях
— ПЭТ с 11С-раклопрайдом; на ранних стадиях БП количество допаминергических терминалей скорлупы нормальное или повышенное, но нормализуется при прогрессировании БП, уменьшается при MCA
о Опиоидные рецепторы в базальных ганглиях:
— 11С-дипренорфин; уменьшение поглощения в скорлупе, таламусе и передних отделах поясной извилины у пациентов с дискинезиями при БП; нормальное поглощение у пациентов с БП без дискинезии
• ОФЭКТ: изменения аналогичны таковым при ПЭТ; может быть использована для изучения допаминергических нейронов ЧС или допаминовых D2-рецепторов в базальных ганглиях:
о Допаминергические нейроны черной субстанции:
— Изменения со стороны скорлупы по данным ОФЭКТ с I-123-ФП-КИФ сходны с таковыми по данным ПЭТ с 18F-флюородопой
о Допаминергические D2-рецепторы в базальных ганглиях:
— Изменения поданным ОФЭКТ с И 23-ФП-КИФ сходны с таковыми по данным ПЭТ с 11С-раклопрайдом
6. Рекомендации по визуализации:
• Лучший метод визуализации:
о МРТ с получением PD-взвешенных SE изображений и ПЭТ/ОФЭКТ
• Совет по протоколу исследования:
о PD-взвешенные SE изображения, «быстрый» STIR-режим позволяют отчетливо визуализировать ЧС как структуру из серого вещества
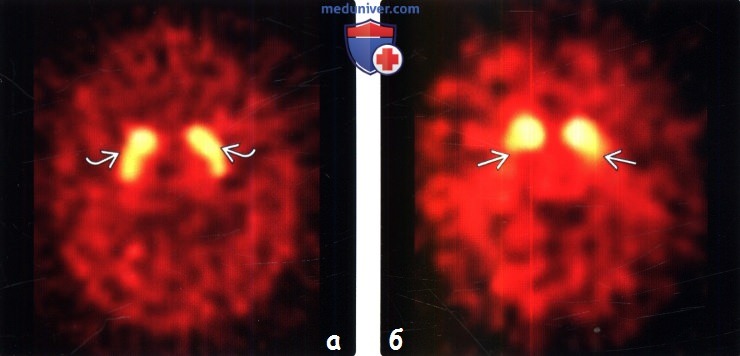
(б) ДТ-ОФЭКТ с 123-ФП-КИФ, аксиальный срез: у пациента с идиопатической болезнью Паркинсона определяется асимметричное уменьшение накопления в скорлупе, больше справа. Обратите внимание на нормальное поглощение радиофармпрепарата в хвостатых ядрах.
в) Дифференциальная диагностика болезни Паркинсона:
1. Множественная системная атрофия (MCA):
• МСА-П: повышение интенсивности сигнала на Т2-ВИ от скорлупы и хвостатого ядра (патологическое отложение железа), в скорлупе может определяться гиперинтенсивный на Т2-ВИ ободок
• МСА-м (мозжечковый тип): t интенсивности сигнала на Т2-ВИ от средних ножек мозжечка, поперечных волокон моста (симптом «крестовой булочки»)
2. Прогрессирующий надъядерный паралич (ПНП):
• МРТ, сагиттальные Т1-ВИ: атрофия крыши среднего мозга с появлением структуры по типу «колибри»
• Вогнутость заднебоковых границ атрофированного среднего мозга с появлением структуры по типу «цветка ипомеи»
3. Кортикобазальная дегенерация:
• Истончение пред-/постцентральных извилин с расширением центральной борозды с заметным преобладанием изменений в парасагиттальных отделах
4. Деменция с тельцами Леви:
• Тельца Леви диффузно расположенные в веществе головного мозга
• Атрофия ствола мозга, ЧС и коры
5. Комплекс «паркинсонизм-деменция-боковой амиотрофический склероз»:
• Изменения со стороны кортикоспинальных трактов
1. Общие характеристики болезни Паркинсона:
• Этиология:
о Изучаются различные генетические маркеры, которые увеличивают склонность к развитию БП
о Воздействие факторов окружающей среды: МФТИ (1-метил-4-фенил-1,2,3,6-тетрагидропиридин); вероятно, воздействие пестицидов
о Старение: процесс нормального старения связан с уменьшением количества нейронов в ЧСкч
• Генетика:
о Спорадический характер (в 3-5% случаев-семейный характер)
• Ассоциированные патологии:
о Увеличение содержания железа в ЧСкч
2. Макроскопические и хирургические особенности:
• Потеря пигментации ЧС и голубого пятна
3. Микроскопия:
• Потеря допаминергических нейронов в ЧС (особенно ЧСкс), голубом пятне, дорсальном ядре блуждающего нерва и безымянном веществе
• Патология Леви: дезорганизованные α-синуклеиновые конгломераты, которые формируют цитоплазматические включения внутри тел (тельца Леви) и отростков нейронов (нейриты Леви)
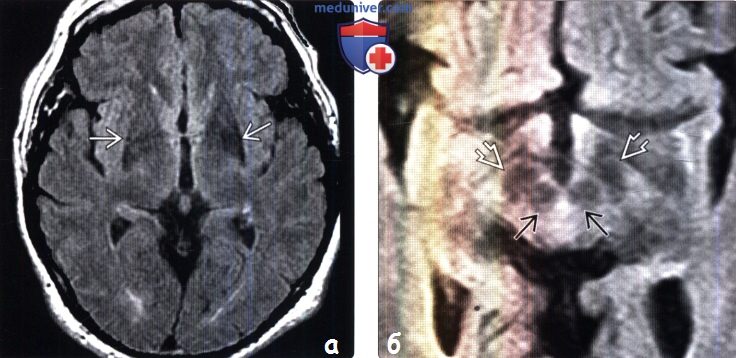
(б) MPT FLAIR, аксиальный срез: у того же пациента: красное ядро и сетчатая часть практически соприкасаются друге другом, что говорит об истончении компактной части.
д) Клиническая картина:
1. Проявления болезни Паркинсона:
• Наиболее частые признаки/симптомы:
о Тремор покоя с частотой 3-5 Гц (тремор по типу «перекатывания пилюль»), ригидность по типу «зубчатого колеса», брадикинезия, шаркающая походка, «застывшее» лицо, позднее начало деменции в 40% случаев
• Другие признаки/симптомы:
о Автономная дисфункция, депрессия, нарушение сна
2. Демография:
• Возраст:
о Характерно начало заболевания между 50-60 годами
• Пол:
о М:Ж= 1,5:1
• Эпидемиология:
о Идиопатическая БП является наиболее частым двигательным расстройством
о БП является вторым по частоте встречаемости нейродегенеративным расстройством после болезни Альцгеймера
о Частота встречаемости: 1 % среди населения старше 50 лет
3. Течение и прогноз:
• Начальные проявления БП обычно асимметричны
• Медленное прогрессирование брадикинезии, мышечной ригидности и нарушений походки → в конечном итоге, инвалидность через несколько лет
4. Лечение болезни Паркинсона:
• Медикаментозное (преимущественно для молодых пациентов): леводопа, бромокриптин, амантадин, селегилин
• Хирургическое (рефрактерные к медикаментозному лечению случаи): стереотаксическая паллидотомия или глубокая стимуляция субталамического ядра, таламуса, бледного шара
е) Диагностическая памятка:
1. Обратите внимание:
• Существуют синдромы «паркинсон-плюс»
2. Советы по интерпретации изображений:
• Роль диагностической визуализации в паркинсонизме: исключить излечимую причину брадикинезии (опухоль, гематома, гидроцефалия)
• Минимальная взаимосвязь между гипоинтенсивными на Т2-ВИ зонами и отделами ЧС в патологических препаратах/на PD-взвешенных изображениях/на «быстрых» STIR-изображениях
ж) Список литературы:
1. Booth ТС et al: The role of functional dopamine-transporter SPECT imaging in parkinsonian syndromes, part 2. AJNR Am J Neuroradiol. 36(2):236—44, 2015
2. Goveas J et al: Diffusion-MRI in neurodegenerative disorders. Magn Reson Imaging. ePub, 2015
3. Kalia LV et al: Parkinson’s disease. Lancet. ePub, 2015
4. Broski SM et al: Structural and functional imaging in parkinsonian syndromes. Radiographics. 34(5): 1273-92, 2014
5. Cosottini M et al: MR imaging of the substantia nigra at 7T enables diagnosis of Parkinson disease. Radiology. 271 (3):831 —8, 2014
6. Brooks DJ et al: Imaging biomarkers in Parkinson’s disease. Prog Neurobiol. 95(4):614-28, 2011
Редактор: Искандер Милевски. Дата публикации: 4.5.2019
