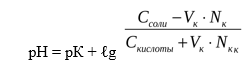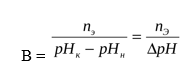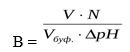буферные растворы в медицинской практике используют
Буферные растворы в организме человека
Буферные растворы − это растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Протолитические буферные растворы представляют собой смеси электролитов, содержащие одноимённые ионы.
Существует два типа протолитических буферных растворов:
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
С – молярная или эквивалентная концентрация электролита (C = V N)
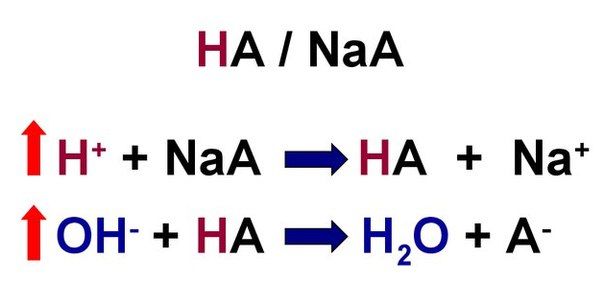
Механизм действия буферных растворов можно рассмотреть на примере ацетатного буфера: СН3СООН + СН3СООNa [1].
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
Из уравнения видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н + в буфере увеличивается, но очень незначительно, при этом рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
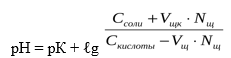
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н + практически не изменяется, и рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
Таким образом, рН буфера зависит от константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. Стоит отметить, что рН буфера будет наибольшим при соотношении компонентов равным единице [2].
Буферная ёмкость − это способность буферной системы противодействовать изменению рН среды.
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
где В – буферная ёмкость, nЭ– количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи), рНК– конечное значение рН (после добавления кислоты или щелочи), ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
где V – объём кислоты или щелочи, N – эквивалентная концентрация кислоты или щелочи, Vбуф.— объём буферного раствора, Δ рН – изменение рН.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице [3].
В организме человека действуют следующие буферные системы:
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Взаимодействие буферных систем в организме по стадиям:
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер):
Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др. [5].
2. Бончев П. Р. Введение в аналитическую химию. Л.: Химия, 1978.-
4. Крешков А.Н. «Основы аналитической химии» 1-2 том. М.:Химия, 1965.-285 с.
5. Лурье Ю. Ю. Справочник по аналитической химии. М.:Химия, 1989.- 297 с.
6. Янсон Э. Ю., Путнинь Я. К. Теоретические основы аналитической химии. М.: Высшая школа, 1980.
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЕ РАСТВОРЫ (буферные смеси, буферы) — растворы, содержащие буферные системы и обладающие вследствие этого способностью поддерживать pH на постоянном уровне. Б. р. применяются для сохранения активной реакции среды (см.) на определенном неизменном уровне, если тот или иной процесс (напр., выращивание культуры бактерий, проведение ферментативной реакции и т. п.) должен быть проведен при постоянном pH; для определения водородного показателя (см.) — в качестве стандартных растворов с известными и устойчивыми значениями pH и в других случаях лабораторной практики.
Б. р. обычно готовят путем растворения в воде взятых в соответствующих пропорциях слабой кислоты и ее соли, образованной щелочным металлом, частичной нейтрализацией слабой кислоты сильной щелочью или слабого основания сильной кислотой, растворением смеси солей многоосновной кислоты. Величины pH приготовленных таким образом Б. р. незначительно меняются с температурой. Б. р., представляющие собой смеси слабых оснований с их солями, образованными сильными кислотами, ввиду значительной зависимости их pH от температуры, как правило, применяются на практике редко. Общая концентрация компонентов Б. р., употребляемых для практических целей, в большинстве случаев находится в пределах 0,05— 0,2 н. Такого рода Б. р. проявляют буферное действие, если отношение концентраций составляющих их слабых кислот к концентрациям соответствующих солей не меньше 0,1 и не больше 10. Интервал значений pH, в к-ром Б. р. обладает устойчивыми буферными свойствами, лежит в пределах рК±1 (рК — отрицательный десятичный логарифм константы диссоциации слабой кислоты, входящей в состав Б. р., т. е. рК= —lgK). Т. о., для приготовления Б. р., проявляющего буферное действие, напр, в области pH=3—5, следует взять кислоту с рК=4.
СОСТАВ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ БУФЕРНЫХ РАСТВОРОВ, ПРИМЕНЯЕМЫХ В ЛАБОРАТОРНОЙ ПРАКТИКЕ
1. Глициновый буфер Серенсена
Соляная кислота — у
2. Ацетатный буфер Вальполя
Уксусная кислота — х
3. Фосфатный буфер Серенсен
4. Боратный буфер Палича
5. Вероналовый буфер Михаэлиса
Соляная кислота — y
6. Карбонатный буфер Кольтгоффа
Соляная кислота — х
7. Универсальный вероналовый буфер Михаэлиса
Соляная кислота — х
Соляная кислота — х
Количества компонентов, необходимых для приготовления определенного Б. р., рассчитывают по уравнению соответствующей буферной системы или находят с помощью специальной таблицы (см. выше).
При пользовании таблицей следует иметь в виду: В левом вертикальном столбце перечислены наименования Б. р. и их составных частей (x, y).
Во всех горизонтальных рядах, соответствующих тому или иному Б. р., верхняя цифра обозначает искомые значения pH, нижние цифры (или цифра) — объем (в мл) составных частей (части) Б. р. (z, у). Значения х и у соответствуют объемам (в мл) каждого из компонентов Б. р. Напр., для получения Б. р. с pH 1,15 (второй цифровой столбец вверху) следует взять 1,0 мл раствора глицина и 9,0 мл HCl (из расчета приготовления 10,0 мл смеси).
Глициновый буфер Серенсена представляет смесь соответствующих объемов 0,1 М раствора глицина в 0,1 М растворе NaCl и 0,1М раствора HCl. Ацетатный буфер Вальполя — это смесь 0,2 М раствора уксусной к-ты и 0,2М раствора ее натриевой соли. Фосфатный буфер Серенсена готовят смешиванием М/15 растворов NaH2PO4 и Na2HPO4. Боратный буфер Палича — смесь соответствующих объемов 0,2 М раствора борной к-ты и 0,05 М раствора буры. Для приготовления вероналового буфера Михаэлиса используют 0,1 М раствор Na-веронала и 0,1 М раствор HCl.
Для приготовления карбонатного буфера Кольтгофа на каждые 50 мл 0,1 М раствора углекислого натрия берут х мл 0,1 М раствора HCl и доводят объем полученной смеси до 100 мл.
Для приготовления универсального вероналового буфера Михаэлиса растворяют в воде 9,714 г ацетата натрия (CH3COONa-3H2O) и 14,714 г диэтил барбитурата натрия. Объем раствора доводят дистиллированной водой до 500 мл. На каждые 5 мл раствора добавляют 2 мл 8,5% раствора хлорида натрия, х мл 0,1 М соляной к-ты и (18—х) мл дистиллированной воды.
Для приготовления трис-буфера используют раствор а — 24,3 г трис-(гидроксиметил)-аминометана в 1 л дистиллированной воды и раствор б — 0,1 н. HCl.
При приготовлении любых Б. р. следует употреблять очень чистые исходные вещества. Способность Б. р. сопротивляться изменению pH определяется его буферной емкостью, измеряемой количеством грамм-эквивалентов сильной кислоты или сильной щелочи, к-рое необходимо добавить к 1 л Б. р., чтобы изменить его pH на единицу. При неизменной величине отношения концентраций компонентов Б. р. его буферная емкость возрастает с увеличением концентрации этих компонентов.
Значение Б. р. для мед. практики — см. Буферные системы.
Библиография: Калинин Ф. Л., Лобов В. П. и Жидков В. А. Справочник по биохимии, с. 882, Киев, 1971; Швабе К. Основы техники измерения pH, пер. с нем., М., 1962.
Буферные растворы в медицинской практике используют
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
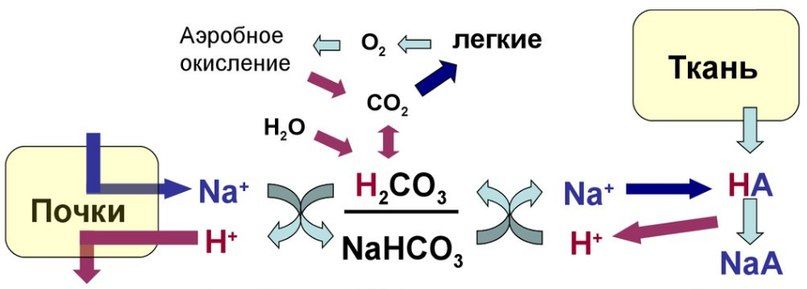
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
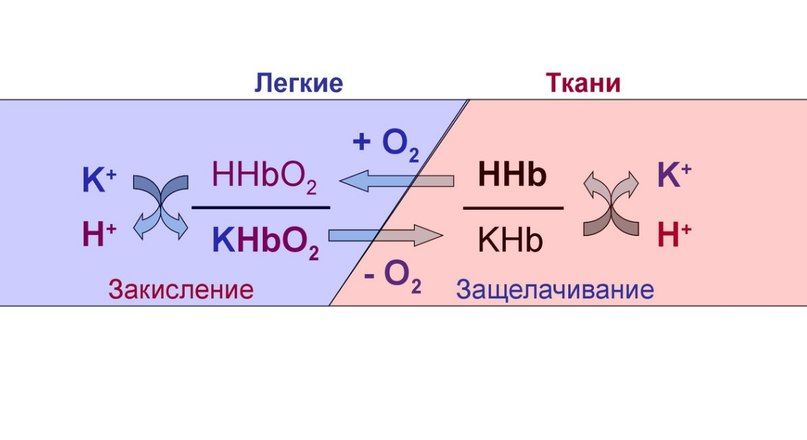
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Буферные системы крови
Во избежание недопонимания между читателями и автором в начале поста хотелось бы дать ряд определений, которые мы собираемся использовать в дальнейшем.
Первое — это определения кислот и оснований. Здесь стоит сделать оговорку, что существует несколько теорий кислот и оснований, охватывающих все множество кислотно-основных взаимодействий и рассматривающих кислотные и основные свойства с различных позиций для различных условий, но — для буферных систем крови мы воспользуемся протолитической теорией Бренстеда-Лоури, с разъяснения которой мы и начнем свой рассказ.
Согласно Бренстеду-Лоури, кислоты представляют собой вещества, отдающие протон (ион водорода, или H + ), а основания — вещества, присоединяющие протон. Сила кислоты зависит от ее способности отдать протон, а сила основания — от способности протон связать. Например, в растворе серной кислоты происходит следующее:
Серная кислота (H2SO4) передает протон основанию (H2O), при этом образуется новая кислота (H3О + ) и новое основание (HSO4 – ).
Подобным же образом может происходить реакция между соляной кислотой и аммиаком:
Соляная кислота (HCl) передает протон основанию (NH3), при этом образуется новая кислота (NH4 + ) и новое основание (Cl – ).
Как было сказано выше, кислоты и основания бывают сильными и слабыми. Например, H2SO4 и HCl представляют собой сильные кислоты, так как они очень легко отдают протон в раствор; таким образом, сильные кислоты диссоциируют быстро и полностью. И наоборот, HSO4 – и Cl – являются слабыми основаниями, так как слабо удерживают протон. В описанных выше реакциях равновесие сдвинуто в сторону образования более слабой кислоты (H3О + и NH4 + ) и более слабого основания (HSO4 – и Cl – ) соответственно. Слабые кислоты (например, H2CO3) диссоциируют не полностью, а значит, концентрация протонов в растворах этих кислот будет ниже. Сильные основания (например, OH – ) активно взаимодействуют с протонами в растворе, связывая их, а слабые основания (HCO3 – ) делают это менее активно.
Второе — единица рН — логарифмическая единица, выражающая концентрацию ионов водорода в растворе в эквивалентах на литр; обратно пропорциональна количеству протонов в растворе, т. е. при высоком содержании протонов рН понижается, при низком, соответственно, повышается.
Рассмотрим пример. Пусть есть 0,1 М (читается как децимолярный) раствор соляной кислоты. Попробуем рассчитать для него значение pH. Мы знаем, что pH = –lg[H + ]. Соляная кислота является сильной и в водном растворе будет диссоциировать полностью. Значит, количество моль/л, или М, [H + ] будет равно [HCl], то есть 0,1 М. Дальше нам нужно просто подставить это значение в формулу:
Таким образом, раствор 0,1 М соляной кислоты имеет pH, равную 1, что соответствует очень кислой среде.
Тут же стоит вспомнить, что нейтральный раствор характеризуется следующей особенностью — значение концентрации ионов водорода [H + ] равно значению концентрации гидроксильных ионов [OH–] = 10 –7 моль/л, или pH = pOH = 7,0.
Третье — кислотно-основное равновесие (КОР) — последнее и самое главное. Буферные системы — это системы, состоящие из компонентов (например, слабой кислота и ее соль с сильным основанием или кислотно-основная пара), поддерживающих определенную концентрацию протонов в растворе, то есть определенный pH среды. Кислотность буферных растворов почти не меняется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований. Так, буферная система способна обратимо связывать протон (ион водорода). При связывании ионов водорода в условиях их повышенного количества в растворе получается слабая кислота и соль сильной кислоты, например:
И наоборот, при защелачивании среды происходит диссоциация вещества, выделяется слабое основание и вода:
В обоих случаях буферные системы препятствуют резкому изменению pH. С помощью буферных систем и осуществляется регуляция КОР в организме. Однако, при работе буферной системы один из ее компонентов расходуется и требует восстановления.
Рисунок 1 | Общий вид буферной системы
Значения рН в жидких средах организма в норме:
Диапазон патологических значений рН, при которых человек может жить в течение нескольких часов, варьируется от 6,8 до 8,0.
Выделяют 2 типа расстройств КОР: ацидозы и алкалозы.
Ацидоз — это типовой патологический процесс, характеризующийся относительным или абсолютным понижением pH. Алкалоз — это типовой патологический процесс, характеризующийся относительным или абсолютным увеличением pH. Ацидозы и алкалозы могут быть компенсированными, субкомпенсированными и декомпенсированными.
Компенсированные формы связаны с сохранением жизнедеятельности клетки, в то время как некомпенсированные формы вызывают нарушения функции клетки. Показателем компенсации является величина рН артериальной крови. В норме, как уже было сказано выше, рН = 7,4 ± 0,05. Если величина рН снижается до 7,24 или увеличивается до 7,56 (колебания составляют ± 0,16), то можно говорить о развитии субкомпенсированных форм. В том случае, если эта величина превышает ± 0,16, можно говорить о развитии декомпенсированных форм ацидоза или алкалоза. По происхождению ацидозы и алкалозы бывают газовые (дыхательные) и негазовые (метаболические), которые в свою очередь делятся на подтипы. Наряду с газовыми и негазовыми формами ацидозов и алкалозов встречаются смешанные формы. Кроме того, ацидозы и алкалозы могут быть острыми и хроническими.
Регуляция содержания ионов водорода в жидких средах
Существует три основные системы, регулирующие содержание протонов и препятствующих возникновению ацидоза и алкалоза:
1) Буферные системы организма — моментально регулируют содержание протонов в растворе путем их связывания, но они не способны вывести избыток протонов из организма. Работа буферных систем поддерживает рН крови в пределах 7,35–7,45, а сдвиг рН более чем на 0,4 в любую сторону ведет к гибели. В жидких средах организма существует несколько буферных систем:
— Бикарбонатная буферная система [H2CO3 / HCO3 – ] является основным буфером крови (до 53 % емкости от всех буферных систем);
— Гемоглобиновый буфер [HHb / Hb – ] — до 35 % буферной емкости от всех буферных систем, является внутриклеточным буфером;
— Белковый буфер [HPr / Pr – ] — до 7 % буферной емкости от всех буферных систем;
— Фосфатный буфер [H2PO4 – / HPO4 2– ] — до 5 % буферной емкости от всех буферных систем; действует преимущественно в костной ткани, моче и внутриклеточной жидкости;
— Аммонийный буфер [NH3 / NH4 + ] — действует преимущественно в моче.
2) Дыхательная система — регулирует КОР путем выведения избытка СО2, а следовательно и H2CO3, из внеклеточной жидкости.
3) Выделительная система — почки устраняют изменения КОР путем выведения избытка кислот или оснований с мочой; эта система работает гораздо медленнее, чем предыдущие, однако значительно эффективнее.
В первую очередь рассмотрим наиболее мощную систему из выше перечисленных, берущую на себя основную роль в регуляции КОР — бикарбонатную.
Бикарбонатная буферная система состоит из водного раствора, содержащего слабую угольную кислоту (H2CO3) и слабое основание — бикарбонат-ион (HCO3 – ), который во внеклеточной жидкости чаще всего находится в виде натриевой соли (NaHCO3). Вначале стоит разобрать такое понятие, как диапазон буферного действия — диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK.
Для бикарбонатного буфера pK будет равно 6,1 ± 1 — это далеко от среднего значения pH в организме, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Во-первых, концентрация бикарбоната во внеклеточной жидкости довольно высока, во-вторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3 – ) системами.
Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3 / NaHCO3 (CO2 / HCO3 – ). Бикарбонатный буфер является самым чувствительным и связывает до 40 % «лишних» ионов водорода. Он поддерживает pH=7,4. В связи с вышеперечисленными фактами бикарбонатный буфер является индикатором нарушения КОР и определение компонентов этого буфера — основа диагностики нарушения КОР.
Рисунок 2 | Схема работы бикарбонатной буферной системы
При добавлении сильной кислоты в буферный раствор протоны, образовавшиеся при ее диссоциации, нейтрализуются путем взаимодействия с ионом бикарбоната, в результате формируется угольная кислота, которая разлагается на воду и углекислый газ под воздействием фермента карбоангидразы. Избыток углекислого газа, стимулирует барорецепторы в области бифуркации аорты и каротидного синуса, усиливает вентиляцию легких и таким образом выводится из организма. В норме отношение HCO3 – / H2CO3 = 20/1. При этом, как уже упоминалось, работа этой системы неразрывно связана с легкими. Рассмотрим реакцию подробней. При поступлении в кровь кислоты более сильной, чем угольная, происходит реакция обмена и образуется новая соль и угольная кислота. В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
Обратная реакция происходит при добавлении к раствору сильного основания: гидроксид-ион взаимодействует с угольной кислотой с выделением иона бикарбоната, в результате чего концентрация угольной кислоты и, как следствие, углекислого газа в растворе снижается, что тормозит дыхательный центр, снижает вентиляцию легких и задерживает углекислый газ в организме. При этом повышается количество бикарбонат-ионов в плазме крови, что впоследствии компенсируется почками путем выделения их избытка с мочой. Рассмотрим реакцию подробней. При поступлении оснований они реагируют с угольной кислотой в результате чего образуются соль угольной кислоты. (К — катион)
Рисунок 3 | Схема работы фосфатной буферной системы
Фосфатная буферная система играет важную роль в регуляции КОР в просвете почечных канальцев в связи с тем, что концентрация фосфатов в канальцах растет. Кроме того рН мочи ниже рН других жидкостей организма и близок к значению константы диссоциации фосфатного буфера (pH = 6,8 = pK для фосфатного буфера), что позволяет ему работать на максимальных мощностях. По тем же причинам фосфатный буфер имеет большое значение в регуляции КОР во внутриклеточной жидкости.
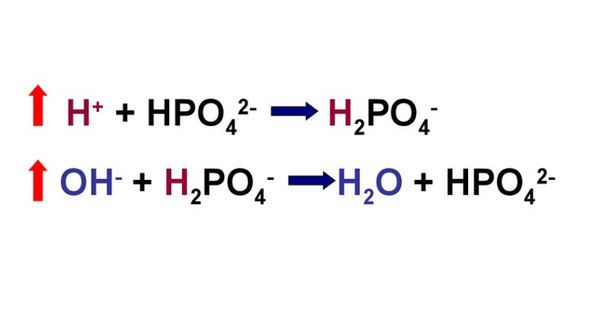
Рассмотрим устройство фосфатной буферной системы подробней. Емкость фосфатной системы составляет около 1–2 % от всей буферной емкости крови и до 50 % буферной емкости мочи. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение (NaH2PO4) слабо диссоциирует и ведет себя как слабая кислота, второе (Na2HPO4) обладает щелочными свойствами. В норме отношение HРO4 2– к H2РO4 — равно 4 : 1.
При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4 (К — катион)
Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и моче. Как уже было отмечено выше в моче его роль состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4.
Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т. к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система играет основную роль в регуляции КОР внутри клетки в связи с их богатым содержанием во внутриклеточной жидкости.
Несмотря на разницу между значениями рН внутри клетки и вне ее, колебания внутриклеточного КОР находится в зависимости от внеклеточного. Компоненты бикарбонатной буферной системы медленно диффундируют через клеточную мембрану. Соответственно работа внутриклеточных буферных систем может оказывать посильную помощь в регуляции внеклеточного КОР, однако занимает этот процесс значительно большее время. Около 60–70 % буферной емкости всего организма приходится на белковые внутриклеточные системы, однако в связи с низкой скоростью переноса компонентов буфера через мембраны, коррекция КОР за счёт них может значительно опаздывать.
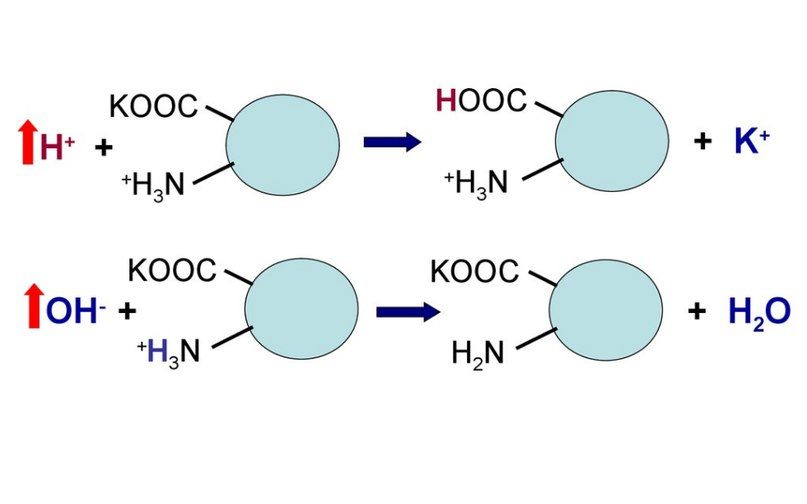
Сама по себе белковая буферная система состоит как из белков внутриклеточных, так и внеклеточных. Белки и их главные структурные компоненты, аминокислоты, являются амфолитами и потому в зависимости от величины pH среды способны принимать или отдавать ион водорода. Таким образом, кислые группы (например, COOH) могут отдавать ион водорода, при повышении pH, а аминогруппы (например, NH2) могут принимать ион водорода при падении pH. Пределы действия белковых кислотно-основных буферных систем ограничиваются количеством групп, способных отдавать или связывать ионы водорода. Жидкости организма, на основе их локализации, можно разделить на внеклеточные и внутриклеточные жидкости.
Рисунок 4 | Схема работы белковой буферной системы
К внеклеточным жидкостям тканей относятся межклеточные жидкости. Разновидностью межклеточных жидкостей является плазма крови. Плазма крови содержит белки, которые могут составляют одну буферных систем крови. Межклеточная жидкость в тканях содержит волокна внеклеточного белка и растворенные аминокислоты. Все эти компоненты составляют буферную систему межклеточных жидкостей в тканях. Основным белковым буфером в случае крови является гемоглобиновый буфер.
Гемоглобин осуществляет буферирование за счет имидазольных групп гистидиновых остатков и имеет pKa = 6,8. Величина pH крови остаётся постоянной благодаря тому, что гемоглобин способен связывать углекислый газ и ионы водорода, тут гемоглобин играет роль основания. В легких находится окисленная форма гемоглобина HHbO2, которая является более сильной кислотой (при этом кислотность HHbO2 в 70 раз выше, чем у HHb), чем угольная кислота (H2CO3), в результате чего подавляется диссоциация последней. HHbO2 отдает свои ионы Н + в среду, предотвращая повышение рН. В целом если говорить о крови, то ее буферные системы более устойчивы к действию кислот, чем оснований.
Рисунок 5 | Схема работы гемоглобиновой буферной системы
Изогидрическое правило
Поскольку в организме все буферные системы в том или ином соотношении представлены во всех жидкостных средах, они действуют сообща. Смысл изогидрического правила заключается в том, что изменение равновесия в одной буферной системе в растворе ведет за собой изменение и в других системах за счёт перераспределения между ними ионов водорода.
Регуляция кислотно-основного состояния в организме
Дыхательная система — регулирует концентрацию СО2 во внеклеточной жидкости. При повышении вентиляции СО2 активно выводится из организма, что вызывает снижение концентрации углекислоты и приводит к снижению количества протонов в крови. Снижение вентиляции вызывает повышение количества СО2 в крови, и концентрация ионов водорода в крови растет.
В клинической практике удобно использовать показатель парциального давления углекислого газа — рСО2, в норме равный 40 мм рт.ст. При повышении интенсивности метаболических процессов или уменьшении вентиляции легких рСО2 растет, накапливается углекислота и соответственно ионы водорода, приводя к снижению рН — ацидозу. Замедление метаболических процессов или рост вентиляции вызывает снижение СО2 в крови, количества протонов и приводит к алкалозу, что проявляется повышением рН.
Уровень рН в жидких средах организма очень чувствителен к изменению вентиляции. Так, увеличение вентиляции в 2 раза от нормы приводит к повышению рН на 0,23 единиц, при этом снижение альвеолярной вентиляции на ¼ ниже нормы влечет за собой снижение уровня рН на 0,45 единиц. Таким образом, становится понятно значение дыхательной системы в регуляции КОР.
В свою очередь деятельность дыхательной системы зависит от концентрации протонов в крови, то есть изменение рН во внеклеточной жидкости ведёт за собой изменение вентиляции, что является ярким примером принципа отрицательной обратной связи в системе (при работе такой связи, усилия системы направлены на возвращение к исходному состоянию организма). Рост концентрации протонов и сопутствующее ему повышение рН вызывает компенсаторное увеличение вентиляции вследствие стимуляции дыхательного центра. Напротив, уменьшение количества ионов водорода и повышение рН тормозят дыхательный центр. Таким образом, довольно быстро регулируется содержание протонов в системе.
Дыхательная система как физиологический буфер действует медленнее, чем любой из химических буферов, однако ее буферная емкость в 2 раза выше всех вместе взятых буферов внеклеточной жидкости. У нее довольно низкий коэффициент эффективности обратной связи, поэтому коррекция значений рН осуществляется в очень малых пределах, тем не менее, это позволяет выиграть время для стабилизации КОР с помощью выделительной системы.
При нарушениях функций дыхательной системы также происходит изменение уровня ионов водорода и соответственно показателя рН. При нарушении процесса нормальной вентиляции легких (например, при эмфиземе легких), снижается способность выведения СО2, в результате чего развивается дыхательный ацидоз. В такой ситуации коррекция КОР полностью перекладывается на выделительную систему.
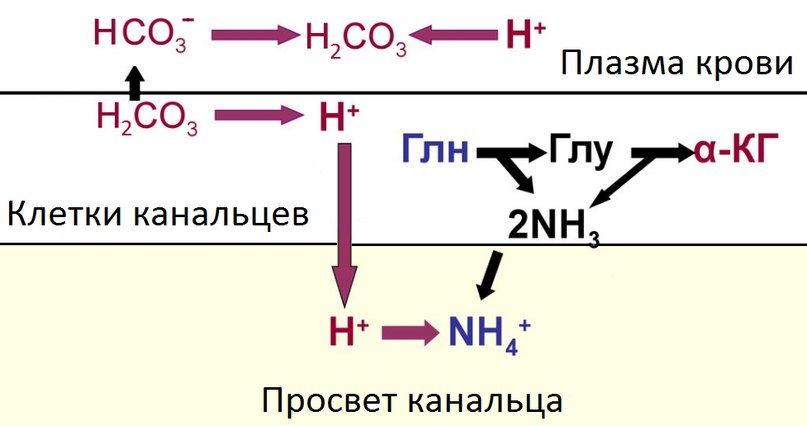
Выделительная система почек — осуществляют регуляцию КОР путем выделения кислых и основных продуктов обмена с мочой. В целом, принцип работы системы заключается в следующем: бикарбонат-ионы попадают в просвет канальцев с первичной мочой путем фильтрации, ионы водорода секретируются эпителиоцитами в просвет канальцев, где они связываются ионами бикарбоната и реабсорбируются обратно в кровь в форме угольной кислоты. Таким образом, осуществляется восполнение компонентов бикарбонатного буфера. Если количество протонов во внутриканальцевой жидкости превышает количество бикарбонат-ионов (при ацидозе), их избыток выводится с мочой, закисляя ее, и наоборот, избыток оснований способствует их выведению (при алкалозе). Эти процессы происходят во всех отделах канальцевой системы, исключая тонкий отдел петли Генле, при этом 80–90 % реабсорбции бикарбонатов и секреции протонов приходится на проксимальный каналец. В различных сегментах эти процессы осуществляются разными механизмами. Кроме того, с мочой выводятся нелетучие кислоты (те, которые не могут выделяться через дыхательную систему), полученные в ходе метаболических процессов, что в свою очередь увеличивает количество протонов в моче. Немаловажным механизмом регуляции КОР почками является образование новых ионов бикарбоната, опять же при участии карбоангидразы.
При выделении в мочу избытка протонов лишь небольшая их часть выводится в свободном виде, остальные связываются с буферными системами в просвете канальцев, способствуя выработке недостающего количества бикарбонатов внутри клеток канальцев с последующей их реабсорбцией в кровь при ацидозе. Наибольшее значение имеют фосфатная и аммонийная системы, меньшую роль играют цитратная и уратная.
Рисунок 6 | Схема работы аммонийной буферной системы
В заключение, приведенная в данной статье информация далеко не полная и не включает в себя многие нюансы, однако, прочитав данную информацию, можно получить общее представление о регуляции кислотно-основного равновесия в организме.