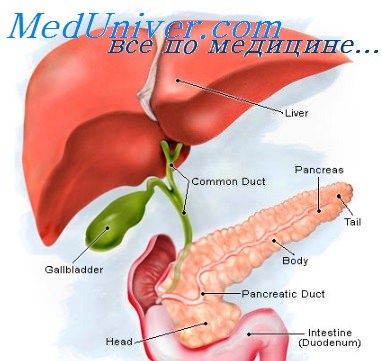
Что капать при остром панкреатите
Что капать при остром панкреатите
Опыт показывает, что острый панкреатит — одно из самых коварных, нередко почти неуправляемых заболеваний, часто с непредсказуемым прогнозом.
Один из существенных факторов неудовлетворительных исходов и большого числа осложнений при лечении деструктивных форм панкреатита — неадекватная комплексная консервативная терапия этого заболевания с первых часов лечения.
Хотя проблеме консервативной терапии острого панкреатита посвящено очень много публикаций, подробно разработаны различные схемы лечения, на практике отмечается игнорирование многих основополагающих принципов лечения, не учитывается многоликость заболевания.
Только комплексный подход с первоначальной интенсивной консервативной терапией может дать удовлетворительные результаты при лечении осложненных деструктивных форм панкреатита.
Эти больные с момента поступления, независимо от клинических проявлений, должны рассматриваться как реанимационный контингент, и консервативная терапия должна быть начата незамедлительно. Проведение обследования этих больных не должно прерывать интенсивного лечения.
При деструктивном панкреатите в первый же день поступления необходимо установить подключичный катетер для внутривенных инфузий. Целесообразно установление назоэнтерального зонда с проведением его за связку Трейтца. Зонд необходим не сколько для парентерального питания, сколько для дезинтоксикационной терапии и вымывания химуса, так как панкреатит всегда сопровождается парезом ЖКТ или динамическим илеусом.
Для иммобилизации активной липазы при установленной или ожидаемой гиперлипаземии необходимы внутривенные вливания жировых эмульсий (интралипида, липофундина). Введение жировых эмульсий сочетают с одновременным вливанием 20% раствора глюкозы, что необходимо для исключения использования организмом жировых эмульсий в качестве основного энергетического компонента.
С противоотечной целью и для форсирования диуреза 1 —2 раза в сутки вводят 40—60 мг фуросемида (лазикса). В последующем переходят на калийсберегающие диуретики (верошпирон, триампур).
Чем раньше в острой стадии заболевания (обычно на 2—3-й день) больные начинают принимать пищу через рот, тем медленнее у них отмечается регресс деструктивных очагов. Поэтому голод и сохранение «пустого желудка» традиционно считаются одним из кардинальных условий предоставления функционального покоя ПЖ, необходимого для оптимального течения процессов реституции паренхимы.
Искусственная локальная гипотермия как компонент интенсивной терапии создает новые проблемы при ведении таких больных, так как необходимо поддерживать устойчивость зонального охлаждения, предупреждать реакции организма на холодовой фактор. Кроме того, больные этой категории уже имеют расстройства кровообращения, и часто при деструкции ПЖ отмечаются рассеянные дисковидные ателектазы в легких, что резко повышает риск присоединения пневмонии при гипотермии. Поэтому целесообразно ограничиться наружной гипотермией живота, используя резиновые емкости со льдом.
В целях борьбы с болью применяют анальгин, баралгин в сочетании со спазмолитическими препаратами (но-шпа, папаверин), а также ненаркотические анальгетики (кетонал, трамал).
Учитывая существенную роль в патогенезе острого панкреатита и, в частности, боли гистамина и гистаминоподобных веществ, проводимую терапию всегда дополняют антигистаминными препаратами (димедрол, супрастин).
Основными препаратами для выключения секретинового механизма стимуляции панкреатической секреции служат блокаторы Н2-гистаминовых рецепторов или M1-холинорецепторов. Ранитидин и его аналоги применяют в дозе 150 мг 2 раза в сутки, гастроцепин в дозе 50 мг 2 раза в сутки. Угнетение секреции желудка всегда дополняют применением антацидов.
Часто рекомендуемый в предыдущие годы раствор атропина в связи с его сложной фармакодинамикой, центральным эффектом и неселективностью действия на холинорецепторы в настоящее время практически не используют.
В качестве селективного миметика, расслабляющего сфинктер Одди, применяют одестон, дицетел.
Очень важна в лечении острого панкреатита регуляция моторики желудочно-кишечного тракта. С этой целью применяют метоклопрамид (реглан, церукал), однако последний в 3—5% наблюдений может сопровождаться центральным действием в виде гиперкинето-дистонических явлений. Поэтому преимущество следует отдавать препаратам, не оказывающим центрального действия (мотилиум).
К применению антипротеаз следует относиться очень осторожно. Помимо повышения при необоснованном применении чувствительности к ним и возможности тяжелых аллергических реакций рутинное их использование в рекомендуемых дозировках внутривенно капельно малоэффективно.
Следует учитывать, что антиферментные препараты эффективны в самом начале заболевания только на фоне так называемого «кининового взрыва» при выраженной гиперферментемии и очень быстро (в течение нескольких минут) связываются и инактивируются белками крови, поэтому при внутривенном капельном их введении не успевает создаваться необходимая для лечебного эффекта концентрация в крови. Поэтому целесообразность их использования в обычных дозах сомнительна, и в случаях их применения они должны вводиться в больших дозах медленно струйно внутривенно в первые двое суток от начала заболевания.
Учитывая избирательное накопление цитостатиков-антиметаболитов (в основном производных пиримидина) в активированных панкреоцитах и угнетение ими синтеза белков, в комплексную терапию включают 5-фторурацил в дозе 10—15 мг/кг/сутки.
Немаловажную роль в лечении панкреатита играют регуляторные полипептиды — даларгин в суточной дозе 0,002—0,005г. Даларгин вводят внутривенно капельно в максимальной дозе 0, 005 г при тяжелом панкреонекрозе либо применяют его внутримышечно в дозе по 0, 002 г 2—3 раза в сутки.
Хорошо зарекомендовал себя в последние годы пролонгированный аналог соматостатина — сандостатин (октреотид) в дозе 300—1000 мг/сут. Кроме того, сандостатин служит также блокатором желудочной секреции (преимущественно за счет гастриновых рецепторов).
При проведении заместительной ферментативной терапии следует учитывать, что в остром периоде для обеспечения более полного функционального покоя ПЖ нецелесообразно назначать препараты, в состав которых входят экстракты желчи. Заместительную ферментативную терапию проводят с началом приема пищи через рот препаратами типа креона, панкреатина, панцитрата.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Новые возможности в противоболевой и заместительной терапии хронического панкреатита.
Елена Александровна Полуэктова, врач, кандидат медицинских наук:
– Мы возвращаемся к гастроэнтерологии, и сообщение сделает доктор медицинских наук, профессор Олег Самуилович Шифрин «Новые возможности в противоболевой и заместительной терапии хронического панкреатита».
Олег Самуилович Шифрин, профессор, доктор медицинских наук:
– Глубокоуважаемые коллеги, рабочей группой Российской гастроэнтерологической ассоциации были разработаны рекомендации по ведению пациентов с хроническим панкреатитом. Обратите внимание, красным цветом обозначены очень важные принципиальные положения, которые должен учитывать врач в ведении подобного рода пациентов. Это определение причины боли, абдоминальной боли при хроническом панкреатите и ее лечение. Вторым важным направлением выступает лечение внешнесекреторной недостаточности поджелудочной железы. Вот эти вопросы и положены в основу моего сообщения.
Итак, при дебюте хронического панкреатита абдоминальная боль занимает очень важное место, это кардинальный признак. Она встречается гораздо чаще, чем проявления внешнесекреторной недостаточности, симптомы панкреатогенного диабета, желтуха и прочее. Почти у 90% больных при различных формах панкреатита, независимо от этиологии, боль занимает центральное ведущее место при дебюте заболевания. При развернутой стадии заболевания на первый план может выступать внешнесекреторная недостаточность, и это важно учитывать.
Клинический пример. К нам в клинику обратился мужчина 54 лет с жалобой на выраженные абдоминальные боли в верхних отделах живота полуопоясывающего характера, чаще возникающие где-то через 30-40 минут после еды, на выраженное мучительное вздутие живота и на появившуюся диарею (неоформленный стул где-то 2-3 раза в день). Следует отметить, что пациент в течение 2-3 десятков лет злоупотреблял алкоголем, выпивал где-то 2-3 бутылки крепких спиртных напитков в неделю, много курил. Индекс курильщика 240 баллов. Мы остановимся чуть позже на взаимодействии этих двух крайне важных панкреотоксических факторов: алкоголь и курение.
Итак, в анализах мочи у пациента выявлялся 2-3-кратный уровень гиперамилазурии. Терапия дротаверином, блокаторами секреции, фесталом оказалась неэффективна.
Какие вопросы следует поставить, берясь лечить данного пациента? Во-первых, следует уточнить диагноз: панкреатит ли это. Не секрет, что панкреатит, к сожалению, очень часто как недодиагностируется, так и гипердиагностируется. Далее, при подтверждении диагноза надо поставить вопрос: какой это панкреатит? Очень важно определить этиологию и морфологическую форму заболевания. Необходимо выявить, выделить основные клинические синдромы заболевания. И, наконец, при наличии абдоминальной боли, а у нашего пациента выраженная абдоминальная боль, следует установить ее характер. Это принципиально важно в дальнейшем при назначении оптимальной терапии.
Следует сказать, что по Хайдельбергской классификации, так называемой классификации M-ANNHEIM, немецкие коллеги выделяют полиэтиологичную чаще всего причину развития панкреатита. То есть различные факторы сочетаются в разной пропорции, и очень редко мы сталкиваемся с моноэтиологичной формой заболевания.
У нашего пациента четко (уже при расспросе его) выделяются два панкреотоксических фактора: это злоупотребление алкоголем и курение. При взаимодействии эти факторы взаимно усиливают друг друга, вызывают быстрое развитие и прогрессирование заболевания.
При объективном статусе отмечалась болезненность в проекции поджелудочной железы, вздутие живота. В остальном каких-то выраженных изменений найдено не было. В анализах обращало внимание двукратное повышение уровня амилазы мочи. Обратите внимание, что, несмотря на явные проявления внешнесекреторной недостаточности, фекальная эластаза в пределах нормы.
При компьютерной томографии обращает внимание неоднородная структура поджелудочной железы, но каких-то выраженных локальных изменений типа псевдокист выявлено не было.
Говоря о причинах боли у пациента, следует выделить боль, связанную с собственно воспалением ткани поджелудочной железы, неважно преобладают ли процессы экссудации, когда воспалительный отек сдавливает нервные ганглии, или при преобладании в воспалительном субстрате альтеративных процессов, когда биологически активные вещества воздействуют на оболочку нервных ганглиев и разрушают ее. В этих случаях ведущее значение в генезе боли имеет собственно воспаление. Это боль типа А, на ней мы остановимся чуть позже.
В случае же осложнений собственно воспаления ткани поджелудочной железы при развитии псевдокист, в которых агрессивный панкреатический сок воздействует на обнаженные нервные окончания, при сдавлении увеличенной вследствие воспаления головкой поджелудочной железы желчных протоков или 12-перстной кишки или вследствие сдавления вирсунгового протока участками фиброза, возникает боль В-типа.
В чем же их отличие? Боль А-типа, то есть боль, вызванная собственно воспалением ткани поджелудочной железы, отличает относительно недлительная продолжительность, обычно где-то менее двух недель, длительные светлые промежутки по нескольку месяцев. И эффект наступает от консервативной терапии, неважно, будь то назначение нескольких таблеток парацетамола или госпитализация пациента в отделении интенсивной терапии с проведением комплекса мероприятий по лечению тяжелого обострения панкреатита. Но исцеление, улучшение состояния в данном случае приносит консервативная тактика, то есть такие пациенты находятся в ведении гастроэнтерологов и терапевтов.
Боль В-типа. Клинически ее отличает длительный период обострения, обычно не менее двух месяцев, короткие светлые промежутки и эффект наступает или от хирургических, или эндоскопических методов лечения.
Иной механизм абдоминальной боли при хроническом панкреатите. Уже на относительно ранних этапах заболевания уменьшается выработка поджелудочной железой (поджелудочная железа, напомню, весит где-то всего лишь 60-80 грамм) раствора бикарбоната. А здоровая поджелудочная железа производит в сутки полтора-два литра раствора бикарбоната. Вследствие уменьшения выработки раствора бикарбоната происходит ацидификация начальных отделов 12-перстной кишки, вследствие закисления среды в кишке инактивируются ферменты, возникают проявления экзокринной недостаточности. И все это сопровождается тяжелыми нарушениями моторики и развития метеоризма, которые подчас пациенты не могут отличить от чувства абдоминальной боли. Напомню, что у нашего пациента выраженный метеоризм, резко снижающий качество его жизни.
Вот обратите внимание, ингибиторы секреции, которые мы очень часто используем в лечении абдоминальной боли при хроническом панкреатите, а также сандостатин, не показывают свою эффективность при лечении болевого панкреатита при контролируемых исследованиях. Очевидно, это связано с тем, что в исследуемую группу попадают пациенты как с А-болью, так и с В-болью, то есть происходит смешение разных типов боли. И соответственно при обработке статистических данных не удается получить достоверных результатов. Хотя все мы, клиницисты, прекрасно знаем, что лечить абдоминальную боль мы начинаем, прежде всего, комбинацией ферментных препаратов и ингибиторов секреции.
Итак, остановимся на ферментных препаратах. Классическими работами конца прошлого века было показано, что традиционные таблетки панкреатина обладают большей эффективностью в лечении абдоминальной боли А-типа при хроническом панкреатите, а также они достоверно снижают давление в протоках поджелудочной железы. В то же время капсулированные, микрогранулированные препараты панкреатина не уменьшают достоверно уровень абдоминальной боли А-типа и не уменьшают достоверно повышенное давление в протоковой системе панкреас.
За неимением времени я не буду останавливаться на патогенезе действия таблетированных и микрогранулированных препаратов. Но суть в том, что таблетированные препараты в большей степени задействуют рилизинг-систему, механизм обратной связи, потому что панкреатин, который содержится в таблетках, протеазы начинают действовать раньше в начальных отделах 12-перстной кишки, где, собственно, и осуществляется механизм обратной связи, где функционирует рилизинг-система.
Вернемся к нашему пациенту. Хронический панкреатит в стадии обострения, обусловленный токсическими факторами (алкоголь и курение), первая стадия по Кембриджской классификации. Синдром избыточного микробного роста в тонкой кишке. Экзогенно-конституциональное ожирение первой степени, это тоже нередко встречается при панкреатите. Не надо обязательно думать, что эти все пациенты должны быть обязательно крайне исхудавшими.
Какие направления лечебной тактики? Мы убедили пациента, воздействовав, в том числе, и на его родственников, что ему полностью необходимо отказаться от алкоголя и курения. Пациенту проводилась дезинтоксикационная терапия в достаточном объеме. Мы назначили ему препарат мезим 20000 по две таблетки 3 раза в день до улучшения его состояния, в дальнейшем мы несколько уменьшили эту дозировку, и омепразол. Добавлю, что коротким курсом с учетом синдрома избыточного микробного роста было назначено также семидневное лечение рифаксимином, антибактериальным препаратом.
В нашей клинике было проведено исследование, сравнивали анальгезирующее воздействие классических таблеток панкреатина мезима 10000 и капсулированного панкреатина в виде микросфер, содержащего такое же количество липазы – 10000 в одной капсуле. Отмечено, что мезим 10000 чаще эффективно уменьшал уровень боли и даже совсем ее прекращал, мезим 10000 реже вызывал развитие запоров и достаточно эффективно мезим 10000 снижал уровень метеоризма, часто беспокоящего наших пациентов. Таким образом, мезим 10000 и вновь появившийся где-то около года назад на рынке мезим 20000 позволяют эффективно купировать абдоминальную боль А-типа, и они обеспечивают при умеренно выраженной внешнесекреторной недостаточности ее эффективное нивелирование. Кроме того, следует отметить, что на фоне таблетированных препаратов панкреатина в виде мезима 10000 и мезима 20000 реже возникает такое осложнение ферментативной терапии как запоры.
Еще раз вернемся к основным направлениям лечения хронического панкреатита. Помимо устранения токсических факторов мы должны назначать ферментные препараты в адекватной дозе, это при лечении абдоминальной боли, прежде всего, таблетированными препаратами. Если же абдоминальная боль сочетается с тяжелой степенью экзокринной недостаточности, присоединяются уже капсулированные препараты.
Я хочу сказать, что вот сейчас на нашем рынке появляется новый препарат панкреатина – микротаблетки панкреатина заключенные в капсулы – пангрол препарат. Он будет представлен 10000-ми капсулами панкреатина по содержанию липазы и, соответственно, пангрол 25000 единиц, которые содержат липазу в 2,5 раза больше. Мы остановимся чуть позже более подробно на этом препарате.
Кроме того, обязательно используются блокаторы протонной помпы. Здесь следует учитывать, что при наличии, скажем, билиарного панкреатита октреотид, который вызывает сгущение желчи, должен использоваться с осторожностью, но тем не менее он обладает хорошим антисекреторным воздействием в плане самой поджелудочной железы.
При лечении спастических расстройств (они чаще всего имеют место при панкреатите) безусловно нужно использовать спазмолитики, лекарственные денервации поджелудочной железы, назначаем трициклические антидепрессанты. И обязательное лечение трофологической недостаточности, синдрома избыточного микробного роста, который очень часто сочетается с хроническим панкреатитом, и, наконец, антиоксидантная терапия.
Каково преимущество препарата мезим 20000? Он содержит более эффективный ферментативный комплекс по сравнению с мезимом 10000, позволяет уменьшить количество таблеток, которое мы назначаем пациенту, а это очень важно, поскольку в данном случае у пациента повышается желание следовать указаниям врача. Пациенты не любят принимать большое количество таблеток, повышается комплаентность пациентов, настроенность их на лечение.
Препарат пангрол представляет, как я уже сказал, капсулы наполненные минитаблетками. Каждая минитаблетка содержит 500 единиц липазы. Две формы выпуска – это капсулы 10000 единиц и капсулы 25000 единиц. Очень важно, что минитаблетки покрыты не только кишечнорастворимой оболочкой, устойчивой к воздействию кислого желудочного сока, но и функциональной мембраной. Вот эта функциональная мембрана, выполненная на основе дериватов метакриловой кислоты, позволяет выделяться препарату в тонкой кишке равномерно. То есть вы видите, проводилось сравнение, как выделяются ферменты, в частности липаза, из минитаблеток и из минимикросфер. Оказалось, что из минитаблеток ферменты выделяются более равномерно, что очень важно в отношении лечения внешнесекреторной недостаточности поджелудочной железы.
Кроме того, минитаблетки обеспечивают равномерное перемешивание с пищей, и происходит оптимальная активация ферментов в разных участках тонкого кишечника.
Оказалось, что пангрол достоверно снижает стеаторею уже на 5 день лечения, причем у пациентов с тяжелой формой внешнесекреторной недостаточности поджелудочной железы.
Очень важно, что на фоне терапии у большинства пациентов к шестому месяцу лечения нормализуется масса тела, нормализуется уровень сывороточного альбумина.
И заключить свое выступление я хотел тем, что, несмотря на то, что появились новые современные препараты в лечении хронических панкреатитов, в частности ферментативные препараты, работа гастроэнтеролога, работа терапевта не стала менее трудной. Но то, что появились новые эффективные препараты, позволяет сделать ее более эффективной, то есть помочь большему количеству наших пациентов.
Антисекреторные препараты в комплексном лечении острого панкреатита
Острый панкреатит – острое асептическое воспаление ткани поджелудочной железы демаркационного типа, в основе которого лежат острая дистрофия, ферментная аутоагрессия с некробиозом панкреатоцитов и последующим исходом в некроз ткани железы и окружающих структур с присоединением эндогенной вторичной гнойной инфекции или в склероз поджелудочной железы с атрофией ее железистого аппарата.
В современной клинике ургентной хирургии острый панкреатит занимает третье место по числу экстренно госпитализированных больных, уступая лишь острому аппендициту и острому холециститу. Несмотря на постоянное совершенствование лечебной тактики и внедрение новых диагностических и лечебных технологий, на протяжении последнего десятилетия летальность при остром панкреатите колеблется в пределах 7-15%, а при деструктивных формах панкреатита достигает 40-80%.
На сегодняшний день опубликовано колоссальное количество работ, посвященных проблеме острого панкреатита. Однако до сих пор большинство положений относительно этиологии, патогенеза, классификации и лечебной тактики при данной патологии остаются весьма дискутабельными. Принято считать, что острый панкреатит является полиэтиологическим заболеванием. При этом американские авторы основной его причиной считают злоупотребление алкоголем, немецкие – желчнокаменную болезнь, китайские и вьетнамские авторы – аскаридоз. Тем не менее, традиционно выделяют две группы этиологических факторов данного заболевания. К первой группе относятся факторы, определяющие нарушение оттока панкреатического секрета из ацинусов по внутридольковым протокам в главный панкреатический проток и далее в ДПК, что приводит к резкому повышению давления в протоковой системе поджелудочной железы (гипертензионно-протоковые факторы). Внутрипротоковая гипертензия возникает при спазме, воспалительных, рубцовых и неопластических стенозах большого дуоденального сосочка, том числе и сфинктера Одди, холедохолитиазе. Спазм сфинктера Одди может быть следствием как различных нервно-рефлекторных влияний с рецепторов гепатогастродуоденальной зоны, так и непосредственного раздражения симпатического и парасимпатического отделов нервной системы. Возбуждение блуждающего нерва обуславливает гиперсекрецию панкреатического сока, спазм сфинктера Одди, возникновение стаза и гипертензии в системе панкреатических протоков. Установлено, что длительный прием алкоголя в относительно больших дозах непосредственно вызывает повышение давления в мелких протоках поджелудочной железы. Этиологические факторы, относящиеся ко второй группе, приводят к первичному поражению ацинарных клеток в условиях нормального внутрипротокового давления (первично ацинарные факторы). Известно, что первичное поражение ацинарных клеток поджелудочной железы может возникать при локальных расстройствах гемоперфузии, аллергических реакциях, метаболических нарушениях, гормональном дисбалансе, токсических воздействиях, инфекциях, травме поджелудочной железы. Роль алиментарного этиологического фактора острого панкреатита может быть сведена к следующему. Пища, богатая белками и жирами, алкоголь вызывают выраженную секрецию панкреатического сока, богатого белком и бедного бикарбонатами, что при неадекватном оттоке может служить причиной развития алиментарного панкреатита.. Усиленная секреторная деятельность ацинарных клеток при чрезмерных пищевых раздражениях или при употреблении бедной белком пищи сопровождается необратимыми внутриклеточными повреждениями ацинарного аппарата и развитием метаболического панкреатита. Отмечено, что чрезмерное употребление богатой белками пищи может приводить к сенсибилизации организма белковыми метаболитами, что приводит к развитию аллергического панкреатита.. Таким образом, основными этиологическими факторами острого панкреатита можно назвать следующие: желчнокаменная болезнь, патология терминального отдела общего желчного протока и БДС, злоупотребление алкоголем, травмы (в т. ч. и операционные) поджелудочной железы, сосудистые заболевания, нарушения обмена веществ, инфекции, интоксикации, аутоаллергические состояния. Экспериментально показано и подтверждено клинически, что наиболее тяжелые формы острого панкреатита развиваются при сочетании трех этиологических факторов:
острой внутрипротоковой гипертензии;
внутриканальцевой активации панкреатических ферментов.
Патогенез острого панкреатита в настоящее время также остается предметом острых дискуссий. Считается, что к развитию острого панкреатита приводит нарушение внутриклеточного образования и транспорта ферментов поджелудочной железы, а также интраацинарная активация проферментов гидролазами. Пусковым механизмом патологических реакций, являющихся основой воспалительно-некротического поражения поджелудочной железы, служит высвобождение из ацинарных клеток активированных панкреатических ферментов, в норме присутствующих в виде неактивных проферментов. При этом сегодня принято считать, что процессы аутолиза первично обусловлены действием именно липолитических ферментов. Активация липаз происходит при контакте проферментов последних с желчными кислотами и энтерокиназами. Данная ситуация возникает при гидравлической деструкции ацинусов вследствие внутрипротоковой гипертензии, которая является, в основном, следствием гиперсекреции поджелудочной железы и билиарно-панкреатического или дуодено-панкреатического рефлюкса при стенозе или недостаточности сфинктера Одди и дуоденальной гипертензии. Предполагается, что алкоголь оказывает не только непосредственный токсический эффект на панкреатоциты, но также вызывает образование белковых микроконгломератов, окклюзирующих мелкие панкреатические протоки. Заметим, что липаза поджелудочной железы не повреждает здоровую клетку. Повреждение обусловлено действием фосфолипазы А, приводящим к деструкции клеточных мембран, что делает возможным проникновение в клетку липазы. При реализации данного механизма формируются локусы жирового панкреонекробиоза с перифокальным демаркационным валом. Если патобиохимический процесс ограничивается этим, то формируется жировой панкреонекроз. В том случае, если при чрезмерном накоплении в ткани железы жирных кислот рН достигает 3, 4-4, 3, происходит трансформация внутриклеточного трипсиногена в трипсин. При этом трипсин активирует проферменты лизосом, а также другие протеиназы, вызывающие протеолиз панкреатоцитов. Активированная эластаза лизирует стенки сосудов, междольковые соединительнотканные перемычки, что способствует быстрому распространению ферментного аутолиза в поджелудочной железе и в окружающих структурах. Под действием трипсина активизируются все проферменты поджелудочной железы (эластазы, карбоксипептидазы, профермент химотрипсина), проферменты калликреин-кининовой системы, фибринолитические ферменты и профакторы гемокоагуляции, что, в конечном счете, приводит к местным и общим патобиохимическим расстройствам с возможным финалом в виде синдрома полиорганной недостаточности. Принято выделять доинфекционную стадию заболевания, при которой формируются асептические воспалительные и некротические очаги, и фазу инфекционных осложнений – инфицированный панкреонекроз, инфицированный панкреонекроз с панкреатогенным абсцессом, забрюшинная флегмона.
Таким образом, одним из основополагающих моментов комплекса патологических реакций, объединяемых понятием «острый панкреатит», служит внутрипротоковая гипертензия в поджелудочной железе. При этом основной составляющей повышения внутрипротокового давления является секреция (в ряде ситуаций – гиперсекреция) панкреатического сока.
Традиционной классификацией острого панкреатита, принятой практическими хирургами, является клинико-морфологическая классификация, выделяющая острый отечный панкреатит и деструктивные формы панкреатита – жировой панкреонекроз, геморрагический панкреонекроз, а также предусматривающая возможное развитие ранних и поздних осложнений. С. Ф. Багненко, А. Д. Толстой, А. А. Курыгин (2004) выделяют следующие клинические формы острого панкреатита, соответствующие патофизиологической фазности его течения:
I фаза – ферментативная, составляет первые пять суток заболевания. В этот период происходит формирование панкреонекроза различной протяжённости, развитие эндотоксикоза (средняя длительность гиперферментемии составляет 5 суток), а у части пациентов – полиорганной недостаточности и эндотоксинового шока. Максимальный срок формирования панкреонекроза составляет трое суток, после этого срока он в дальнейшем не прогрессирует. Однако при тяжёлом панкреатите период формирования панкреонекроза гораздо меньше (24-36 часов). Целесообразно выделять две клинические формы: тяжёлый и нетяжёлый острый панкреатит.
II фаза – реактивная (2-я неделя заболевания), характеризуется реакцией организма на сформировавшиеся очаги некроза (как в поджелудочной железе, так и в парапанкреальной клетчатке). Клинической формой данной фазы является перипанкреатический инфильтрат.
III фаза – расплавления и секвестрации (начинается с 3-ей недели заболевания, может длиться несколько месяцев). Секвестры в поджелудочной железе и в забрюшинной клетчатке начинают формироваться с 14-х суток от начала заболевания. Возможно два варианта течения этой фазы:
Следует заметить, что далеко не все авторы разделяют точку зрения об эволюции патоморфологических изменений при остром панкреатите и предполагают возможность возникновения первично-деструктивного процесса (геморрагический панкреонекроз) без предшествующего острого отечного панкреатита и жирового панкреонекроза. Возможно, это связано с тем, что пациенты вследствие известной социальной подоплеки госпитализируются уже на стадии геморрагического панкреонекроза или при наличии гнойных осложнений. Тем не менее, большинством исследователей поддерживается мнение о преемственности морфологических фаз острого панкреатита. Так, M. Schein (2004) называет панкреатит «болезнью четырех недель». И это вполне объяснимо, как с точки зрения патоморфологии, так и с прагматичной точки зрения практикующего американского хирурга. Действительно, первые две недели – настойчивое комплексное консервативное лечение, в последующем периоде – оперативные вмешательства от малоинвазивных (лапароскопия, транспариетальные пункции) до весьма агрессивных (некрсеквестрэктомия, оментопанкреатобурсостомия, вскрытие панкреатогенных абсцессов и флегмоны забрюшинного пространства). Поскольку в рамках настоящего раздела автор не ставил своей целью продолжение дискуссии о лечебной тактике при остром панкреатите (прежде всего – о показаниях, сроках и объеме оперативного пособия), основное внимание уделено вопросу консервативного лечения пациентов с данной патологией. Следует отметить, что, по мнению целого ряда авторов (А. Д. Толстой, 2003, M. Schein, 2004), именно патогенетически обоснованная комплексная консервативная терапия при остром панкреатите имеет решающее значение для исхода заболевания. Это особенно актуально при остром отечном панкреатите, поскольку предотвращает переход данной формы панкреатита в панкреонекроз. Не менее актуальной является интенсивная консервативная терапия при уже сформировавшихся очагах жировой или геморрагической деструкции, предупреждающая в данном случае распространение воспалительно-некротических очагов на ранее интактную ткань. Кроме того, учитывая первичную асептичность процесса при остром панкреатите в начальный период заболевания с позиций здравого смысла целесообразно именно активное терапевтическое лечение, направленное на купирование патологических процессов в самой поджелудочной железе, предупреждение и лечение синдрома панкреатогенной токсемии, профилактику гнойно-септических осложнений.
В настоящее время принципиальные положения консервативного лечения острого панкреатита изложены во всех руководствах по неотложной абдоминальной хирургии. Позволим напомнить их читателю с некоторыми комментариями. Итак, при остром панкреатите показаны:
В работах различных авторов за последние пять-десять лет отчетливо прослеживается эволюция лечебной тактики у больных с острым панкреатитом от агрессивной хирургической до консервативной выжидательной. Современный подход к лечению больных острым панкреатитом диктует необходимость выбора конкретного варианта проводимой терапии с учетом стадийности течения панкреатита, принимая во внимание динамику лабораторных показателей и данных инструментальных исследований – ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография.
Следует отметить, что непременным условием лечения пациентов с любой клинико-морфологической формой острого панкреатита является соблюдение главного условия – создания покоя для поджелудочной железы. Это достигается путем подавления продукции ферментов панкреатоцитами, вследствие чего значительно уменьшается выделение ферментов, лизирующих белки (трипсин, химотрипсин, эластаза) и фосфолипидные мембраны клеток (фосфолипазы, холестеролэстераза). Таким образом, состояние покоя панкреатоцита способствует регрессу аутолиза и предупреждает некротические изменения тканей. В этой связи в комплексной терапии острого панкреатита ведущее место занимают препараты, прямо или косвенно угнетающие экзокринную функцию поджелудочной железы. Максимальный лечебный эффект достигается при синергичном подавлении синтеза ферментов на уровне поджелудочной железы, выведении и инактивации уже циркулирующих в крови энзимов.
Исторически первым классом соединений, используемым с этой целью при остром панкреатите, явились цитостатики – 5-фторурацил, тегафур. Недостатком этих препаратов является угнетение лейкопоэза, нарушение иммуногенеза, возникновение гипо- и диспротеинемии. Применение данных препаратов оправдано при верифицированном панкреонекрозе с целью максимального подавления секреторной функции поджелудочной железы и тем самым снижения уровня панкреатических ферментов в плазме. Ранее для ингибирования секреции поджелудочной железы широко применялись препараты класса ингибиторов протеаз, но в настоящее время установлено, что препараты ингибиторов протеаз активны лишь в крови. Ингибиторы протеаз в ткань поджелудочной железы, как правило, не попадают в достаточных концентрациях и не могут эффективно осуществлять свою функцию по отношению к ферментам поджелудочного сока. Кроме того, ингибиторы протеаз обладают аутоиммунизирующим действием. Для угнетения экзокринной функции поджелудочной железы оправдано применение агонистов опиоидных рецепторов (даларгин), избирательно накапливающихся в панкреатоцитах и угнетающих синтез панкреатических проферментов. Близким по механизму действием обладает панкреатическая рибонуклеаза, разрушающая матричную РНК клеток, за счет чего ингибируется синтез белков панкреатоцитами. К препаратам выбора при остром панкреатите относится синтетический аналог гормона соматостатина – октреотид, оказывающий выраженное ингибирующее действие на экзокринную функцию поджелудочной железы за счет активации специфических D-рецепторов панкреатоцитов. Основными направлениями его действия являются ингибирование базальной и стимулированной секреции поджелудочной железы, желудка, тонкой кишки, регуляция активности иммунной системы, выработки цитокинов, цитопротективный эффект. Кроме того, октреотид таким же образом действует на париетальные и главные клетки желудка, способствуя снижению кислотообразования. Обычный режим дозирования октреотида 300-600 мкг/сут. при трехкратном внутривенном или подкожном введении.
Патогенетически обоснованным методом ингибирования секреции поджелудочной железы является применение средств, снижающих желудочную секрецию – антисекреторных препаратов. Для понимания механизма действия антисекреторных препаратов при остром панкреатите следует коротко остановиться на регуляции секреции поджелудочной железы. Регуляция секреции сока поджелудочной железы осуществляется нейрогуморальными механизмами, причем основное значение отводится гуморальным факторам – гастроинтестинальным гормонам (секретин, холецистокинин-панкреозимин), активизирующихся с участием рилизинг-пептидов, секретируемых в слизистой оболочке двенадцатиперстной кишки. Секретин усиливает продукцию жидкой части сока, а холецистокинин-панкреозимин стимулирует ферментативную активность поджелудочной железы. Инсулин, гастрин, бомбензин, соли желчных кислот, серотонин также усиливают секреторную активность железы. Выделение панкреатического сока тормозят: глюкагон, кальцитонин, соматостатин. Процесс панкреатической секреции включает в себя три фазы. Цефалическая (сложнорефлекторная) фаза обусловлена преимущественно рефлекторным возбуждением блуждающего нерва. Желудочная фаза связана с эффектами блуждающего нерва и гастрина, секретируемого антральными железами при поступлении пищи в желудок. Во время кишечной (интестинальной) фазы, когда кислый химус начинает поступать в тонкий кишечник, скорость панкреатической секреции становится максимальной, что, в первую очередь, связано с выделением клетками слизистой кишечника секретина и холецистокинина. Таким образом, имеется прямая связь между секрецией соляной кислоты париетальными клетками желудка, снижением интрадуоденального рН, выработкой секретина слизистой двенадцатиперстной кишки и увеличением секреции панкреатического сока. Именно поэтому для ингибирования секреции панкреатического сока, снижения внутрипротокового давления в поджелудочной железе и, в конечном счете, для уменьшения внутрипанкреатической активации ферментов используют меры, направление на подавление секреции соляной кислоты в желудке – физиологического стимулятора секреции поджелудочной железы. Снижение кислотности желудочного сока обусловливает менее выраженное закисление двенадцатиперстной кишки, вследствие чего уменьшается выделение секретина – основного гормона, стимулирующего экскреторную функцию поджелудочной железы.
Следует отметить, что, несмотря на широкое (а в ряде клиник – облигатное) использование антисекреторных препаратов для терапии больных с острым панкреатитом, систематические исследования по данному вопросу ни в России, ни за рубежом не проводились. Из отдельных сообщений известно, что:
Учитывая тот факт, что для исключения ацидификации двенадцатиперстной кишки интрагастральный рН должен быть не ниже 4, оптимальным режимом применения парентеральной формы омепразола (Лосек) при остром панкреатите следует считать болюсное введение 80 мг препарата с последующей непрерывной инфузией со скоростью 4 мг/ч.
Необходимость применения антисекреторных препаратов при остром панкреатите обусловлена еще двумя обстоятельствами. Очень часто (не менее чем в 20% случаев) острые панкреатиты сочетаются с язвенной болезнью. При этом очевидно наличие как минимум одной причинно-следственной связи: язвообразование – острый панкреатит. Во-первых, возможно развитие воспалительно-некротического процесса в поджелудочной железе вследствие пенетрации язв в головку и тело железы. Во-вторых, язвенная болезнь, как правило, сочетается с выраженными нарушениями моторики двенадцатиперстной кишки, что, реализуясь посредством дуоденальной гипертензии, приводит к формированию дуоденально-панкреатического рефлюкса. В этих сложных клинических ситуациях контроль над кислотообразованием в желудке является одной из основных задач лечения. Поэтому в данном случае применение антисекреторных препаратов, в том числе и длительное, имеет абсолютные показания. Наконец, еще одним показанием для назначения антисекреторных препаратов при остром панкреатите является профилактика стрессового эрозивно-язвенного повреждения, необходимость которой особенно актуальна при тяжелом течении острого панкреатита с развитием крупноочагового панкреонекроза, гнойно-септических осложнений и синдрома полиорганной недостаточности.
В заключение хотим еще раз подчеркнуть, что применение комплекса современных мероприятий интенсивной терапии (антисекреторная терапия, другие ингибиторы секреции поджелудочной железы и протеолитических ферментов, средства детоксикации) у пациентов с острым панкреатитом, с учетом стадийности и индивидуальной динамики заболевания, как и своевременная профилактика гнойных осложнений панкреонекрозов несомненно позволят улучшить результаты лечения больных с острым панкреатитом, сократить пребывание больных в стационаре, уменьшить потребность в проведении инвазивных методов лечения и, самое главное, снизить летальность.
Статья добавлена 29 марта 2016 г.