Что кодирует митохондриальный геном
Что кодирует митохондриальный геном
Некоторые родословные наследственных болезней не могут объясняться типичным менделирующим наследованием ядерных генов. Теперь известно, что они вызваны мутациями митохондриального генома и проявляют материнское наследование. Болезни, вызываемые мутациями в митДНК, демонстрируют множество необычных особенностей, происходящих из уникальных характеристик биологии и функции митохондрий.
Митохондриальный геном
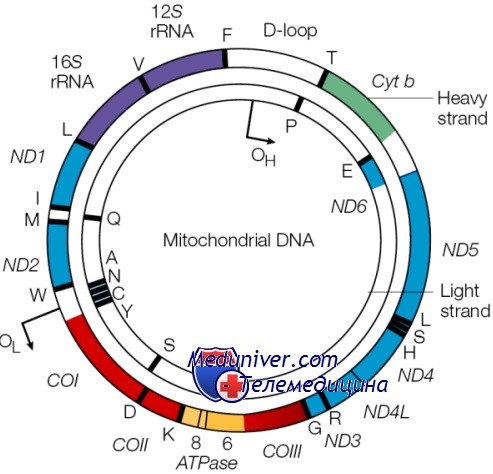
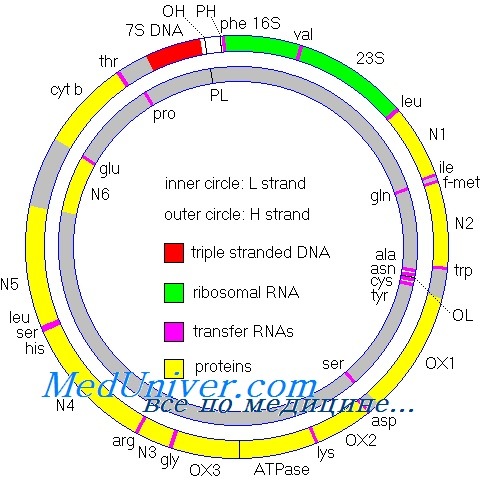
Не вся РНК и белок, синтезируемые в клетке, кодируются ДНК ядра; небольшая, но важная доля кодируется в генах митохондриального генома. Этот геном состоит из кольцевой хромосомы размером 16,5 килобазы, располагающейся в органеллах митохондриях, а не в ядре. Большинство клеток содержит по крайней мере 1000 молекул митДНК, распределенных по сотням отдельных митохондрий. Важное исключение — зрелый овоцит, имеющий более 100 000 копий митДНК, формирующих до одной трети общего содержания ДНК в этих клетках.
Митохондриальная хромосома содержит 37 генов. Они кодируют 13 полипептидов — компонентов ферментов окислительного фосфорилирования, два типа рРНК и 22 тРНК, необходимых для трансляции транскриптов генов митохондрий. Остальные полипептиды комплекса окислительного фосфорилирования кодируются ядерным геномом.
В митДНК обнаружено более 100 различных перестроек и 100 разных точковых мутаций, вызывающих болезни у человека, часто поражающие ЦНС и мышечно-скелетную систему (например, миоклонус-эпилепсия с «рваными» красными волокнами — MERRF). Болезни, вызванные этими мутациями, имеют отличающийся тип наследования из-за трех необычных характеристик митохондрий: репликативной сегрегации, гомоплазмии и гетероплазмии, а также материнского наследования.
Репликативная сегрегация митохондриальной хромосомы
Первая уникальная характеристика митохондриальной хромосомы — отсутствие управляемой сегрегации, наблюдаемой в митозе и мейозе 46 ядерных хромосом. При делении клетки многочисленные копии митДНК в каждой митохондрии клетки копируются и произвольно расходятся во вновь синтезированные митохондрии. Митохондрии, в свою очередь, случайно распределяются между дочерними клетками. Этот процесс известен как репликативная сегрегация.
Гомоплазмия и гетероплазмия митохондриальной хромосомы
Вторая уникальная характеристика генетики митДНК возникает из-за того, что большинство клеток содержат много копий молекул митДНК. Когда мутация возникает в митДНК, она сначала присутствует только в одной из молекул в митохондрии. В ходе репликативной сегрегации митохондрия, содержащая мутантную митДНК, производит многочисленные копии мутантнои молекулы.
При делении клетка, содержащая смесь нормальных и мутантных митохондриальных ДНК, может передавать в дочерние клетки весьма различающиеся пропорции мутантнои и дикой митДНК. Одна дочерняя клетка может случайно получить митохондрии, содержащие чистую популяцию нормальных или чистую популяцию мутантных митохондриальных ДНК (ситуация, известная как гомоплазмия). Кроме того, дочерняя клетка может получить смесь митохондрий с мутацией и без нее (гетероплазмия).
Поскольку фенотипическая экспрессия мутации в митДНК зависит от относительных пропорций нормальной и мутантнои митДНК в клетках, формирующих различные ткани, неполная пенетрантность, переменная экспрессивность и плейотропия — типичные характеристики митохондриальных болезней.
Материнское наследование митохондриальной ДНК
Результат, определенный характеристиками генетики митДНК, называется материнским наследованием. Митохондрии сперматозоидов обычно отсутствуют в эмбрионе, поэтому митДНК наследуется от матери. Таким образом, все дети женщины, гомоплазмической по мутации митДНК, унаследуют мутацию, тогда как ни один из потомства мужчины, несущего ту же мутацию, не унаследует дефектную ДНК.
Материнское наследование гомоплазмической мутации митДНК, вызывающей наследственную нейропатию зрительного нерва Лебера.
Особенности материнского наследования при гетероплазмии у матери выявляют дополнительные характеристики генетики митДНК, имеющие медицинское значение. Во-первых, небольшое число молекул митДНК в развивающихся овоцитах впоследствии увеличивается до огромного количества, наблюдаемого в зрелых овоцитах. Это ограничение с последующим умножением митДНК в ходе овогенеза характеризуют так называемое «бутылочное горлышко» генетики митохондрий.
Именно поэтому вариабельность процентного содержания мутантных молекул митДНК, обнаруживаемая в потомстве матери с гетероплазмией, возникает, по крайней мере частично, вследствие увеличения только части митохондриальных хромосом в овогенезе. Можно ожидать, что мать с высокой пропорцией мутантных молекул митДНК более вероятно произведет яйцеклетки с высокой пропорцией мутантных молекул митДНК, и, следовательно, более клинически пораженное потомство, чем мать с более низкой пропорцией. Есть одно исключение из материнского наследования, когда у матери имеется гетероплазмия по делеции в митДНК; по неизвестным причинам делеционная молекула митДНК обычно не передается от клинически больных матерей их детям.
Хотя митохондрии почти всегда наследуются исключительно через мать, существует, по крайней мере, один пример отцовского наследования митДНК у пациентов с митохондриальной миопатией. Следовательно, у пациентов с наблюдаемыми спорадическими мутациями митДНК должна учитываться редкая возможность отцовского наследования митДНК.
Точное определение семейной родословной — важная часть работы с каждым пациентом. Родословные могут демонстрировать как типичные менделирующие варианты наследования, так и более редкие, вызванные митохондриальными мутациями и половым мозаицизмом; или сложные варианты семейных случаев, не соответствующие ни одному из типов наследования. Определение типа наследования важно не только для установления диагноза у пробанда, это также идентифицирует других индивидуумов в семье, находящихся в группе риска и нуждающихся в обследовании и консультировании.
Несмотря на сложные цитогенетические и молекулярные анализы, используемые генетиками, точная семейная история, включая родословную семьи, остается фундаментальным средством для всех врачей и генетических консультантов, используемым при планировании индивидуального лечения пациентов.
Характеристика митохондриального наследования:
• Женщины, гомоплазматические по мутации, передают эту мутацию всем детям; мужчины с аналогичной мутацией — нет.
• Женщины, гетероплазматические по точко-вым мутациям и дупликациям, передают их всем детям. Доля мутантных митохондрий у потомков и, следовательно, риск развития и тяжесть болезни могут значительно меняться в зависимости от доли мутантных митохондрий у матери, а также случайно, вследствие небольшого числа митохондрий в «бутылочном горлышке» при созревании овоцитов. Гетероплазматические делеции обычно не наследуются.
• Доля мутантных митохондрий в разных тканях гетероплазматических по мутации пациентов может значительно меняться, вызывая различные проявления болезни в одной семье с гетероплазмией митохондриальной мутации. Часто наблюдаются плейотропизм и вариабельная экспрессивность у разных больных в одной семье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что кодирует митохондриальный геном
Первые патогенные мутации в митохондриальной ДНК (мтДНК) обнаружены в начале 1990-х годов. Неожиданным и до сих пор необъяснимым оказалось то, что геном митохондриальной ДНК (мтДНК) мутирует с частотой в 10 раз больше, чем ядерной ДНК. Спектр клинических проявлений, вызванных мутациями мтДНК, разнообразен, хотя преобладает нервно-мышечная патология.
В митохондриальной ДНК (мтДНК) обнаружено более 100 различных перестроек и около 100 разных точковых мутаций, вызывающих заболевания. Распространенность мутаций митохондриальной ДНК (мтДНК), в по крайней мере в одной европейской популяции, приблизительно 1 на 8000. В мтДНК обнаружены три типа мутаций:
(1) миссенс-мутации в кодирующих регионах генов, изменяющие активность белков окислительного фосфорилирования;
(2) точковые мутации в тРНК или генах рРНК, нарушающие белковый синтез в митохондриях; и
(3) перестройки, вызывающие делеции или дупликации молекулы мтДНК.
Связанные с болезнью делеции в митохондриальной ДНК (мтДНК) обычно сначала появляются как соматические мутации, хотя небольшая их часть наследуется при некоторых болезнях.
Гетероплазмия вызывает три других характеристики генетических нарушений митохондриальной ДНК (мтДНК), важные для их патогенеза. Во-первых, риск передачи потомству делетированных молекул митохондриальной ДНК (мтДНК), частого класса мутаций мтДНК, низкий; механизм обсуждается позже.
В отличие от этого, женщины-носители гетероплазматической митохондриальной ДНК (мтДНК) с точковыми мутациями или дупликациями обычно передают некоторое количество мутантной митохондриальной ДНК (мтДНК) потомству. Во-вторых, число молекул мтДНК в пределах каждого овоцита сначала уменьшается, а затем резко увеличивается до огромных количеств, наблюдаемых в зрелых овоцитах. Это уменьшение и последующее увеличение мтДНК в овогенезе образует генетическое «бутылочное горлышко».
Следовательно, изменчивость в части мутантных молекул митохондриальной ДНК (мтДНК), наблюдаемая в потомстве матери, несущей мутацию митохондриальной ДНК (мтДНК), возникает, по крайней мере частично, вследствие увеличения в течение овогенеза только небольшого подмножества митохондриальной ДНК (мтДНК).
В-третьих, несмотря на изменчивость степени гетероплазмии, возникающей из-за «бутылочного горлышка», мать с высоким содержанием мутантных молекул митохондриальной ДНК (мтДНК) имеет большую вероятность родить клинически больного ребенка, чем мать с более низким содержанием, что следует из случайного разделения молекул митохондриальной ДНК (мтДНК).
Тем не менее даже женщины, несущие очень малое количество патогенных молекул митохондриальной ДНК (мтДНК), имеют определенный риск родить больного ребенка, поскольку «бутылочное горлышко» может случайно привести к выделению и последующему клональному накоплению даже редкого вида мутантной мтДНК.
Делеции митохондриальной ДНК (мтДНК) и патология
В отличие от материнского наследования большинства болезней митохондриальной ДНК (мтДНК), большинство случаев синдрома Кирнса-Сейра и синдрома Пирсона — следствие спорадических соматических мутаций; только около 5% случаев вызвано передачей делеции матерью. Причина низкой частоты передачи неизвестна, но это может просто отражать то, что женщины с высокой долей делетированных молекул митохондриальной ДНК (мтДНК) в половых клетках имеют выраженный фенотип (синдром Кирнса-Сейра) и редко участвуют в воспроизводстве.
Значение делеции митохондриальной ДНК (мтДНК) как причины болезней недавно было подчеркнуто открытием, что соматические делеции митохондриальной ДНК (мтДНК) часто встречаются в допаминергических нейронах черного вещества среднего мозга (substantia nigra), как у здоровых стареющих людей, так и, возможно, более часто, у лиц с болезнью Паркинсона. Делеции, происходящие в отдельных нейронах стареющих здоровых лиц и при болезни Паркинсона, оказались уникальными для каждого нейрона.
Это указывает, что увеличение разных делеции митохондриальной ДНК (мтДНК) происходило в каждой клетке. Значит, соматические делеции митохондриальной ДНК (мтДНК) — важная причина гибели допаминергических нейронов в стареющем черном веществе. Эти данные увеличивают возможность того, что частая спорадическая форма болезни Паркинсона может быть вызвана накоплением делетированных молекул митохондриальной ДНК (мтДНК) в черном веществе и, следовательно, ухудшением окислительного фосфорилирования. В настоящее время механизмы, ведущие к делециям и клональному накоплению, до конца не поняты.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что кодирует митохондриальный геном
Окислительное фосфорилирование и болезни митохондриальной ДНК (мтДНК). Митохондриальные мутации обычно поражают ткани, зависящие от окислительного фосфорилирования, удовлетворяющего высокие потребности в энергии. Такая фенотипическая направленность отражает центральную роль комплекса окислительного фосфорилирования в производстве энергии клетки.
Следовательно, для большинства болезней митохондриальной ДНК (мтДНК) характерно снижение синтеза АТФ, которое, вероятно, лежит в основе дисфункции и смерти клеток. Это подтверждается и тем, что другие механизмы, кроме снижения производства энергии, лишь косвенно и слабо содействуют патогенезу болезней митохондриальной ДНК (мтДНК), однако также происходящий синтез активного кислорода как побочного продукта окислительного фосфорилирования может содействовать патологическим процессам при нарушениях митохондриальной ДНК (мтДНК).
Имеется достоверное подтверждение того, что пороговый фенотипический эффект связан с гетероплазмией митохондриальной ДНК (мтДНК); прежде чем болезнь становится клинически очевидной, в клетках пораженной ткани должен быть превышен критический порог доли молекул митохондриальной ДНК (мтДНК), несущих мутацию. Этот порог составляет почти 60% для болезней, вызванных делециями митохондриальной ДНК (мтДНК), и около 90% для болезней из-за других типов мутаций.
Наиболее часто при мутациях в митохондриальной ДНК (мтДНК) поражается нервно-мышечная система; последствия включают энцефалопатию, миопатию, атаксию, дегенерацию сетчатки и снижение функции наружных мышц глаза. Митохондриальная миопатия характеризуется так называемыми «рваными» красными волокнами (мышц) — гистологическим симптомом, вызванным распространением структурно и биохимически аномальных митохондрий в мышечных волокнах.
Спектр митохондриальных болезней широк и может включать дисфункцию печени, костного мозга, островкового аппарата поджелудочной железы с проявлениями сахарного диабета, глухоту и другие нарушения.
Необъяснимые и неожиданные стенотипические изменения при болезнях митохондриальной ДНК (мтДНК)
Гетероплазмия, как правило, встречается почти при всех болезнях митохондриальной ДНК (мтДНК), за исключением обычно гомоплазмической наследственной атрофии зрительного нерва Лебера (LHON). Гетероплазмия, приводящая к непредсказуемой и изменчивой доле мутантной митохондриальной ДНК (мтДНК) в любой конкретной ткани, несомненно, ответственна за плейотропность и переменную экспрессивность большинства мутаций митохондриальной ДНК (мтДНК).
Таким образом, в одной семье одна и та же мутация митохондриальной ДНК (мтДНК) может вызывать сахарный диабет и глухоту у одних и тяжелую энцефалопатию с судорогами у других. Другой пример — самая частая мутация мтДНК, замена 3243A>G в гене тРНК лейцина tRNA [номенклатура указывает позицию и код нормального нуклеотида — аденин в позиции 3243 — в молекуле митохондриальной ДНК (мтДНК), и нуклеотид замены (гуанин)].
Замена 3243A>G — самая частая при фенотипе MELAS, акроним для митохондриальной энцефаломиопатии с молочным ацидозом и инсультоподобными эпизодами. В некоторых семьях эта мутация приводит преимущественно к сахарному диабету и глухоте, а в других вызывает хроническую прогрессирующую наружную офтальмоплегию; и наконец, в-третьих, — кардиомиопатию или миопатию. Кроме того, мутации 3243A>G приписывается небольшая доля (
Мутации в генах тРНК и рРНК митохондриального генома
Мутации в не кодирующих белок генах тРНК и рРНК митохондриальной ДНК (мтДНК) имеют глобальное значение, поскольку они позволили понять, что не все патогенные мутации у человека происходят в генах, кодирующих белки. Более 90 патогенных мутаций обнаружено в 20 из 22 генов тРНК митохондриальной ДНК (мтДНК), и они оказались наиболее частой причиной аномалий окислительного фосфорилирования у человека.
Результирующие фенотипы обычно совпадают со связанными с другими дефектами митохондриальной ДНК (мтДНК). В набор разнообразных мутаций тРНК входит 18 нуклеотидных замен в гене tRNA, некоторые из них вызывают MELAS, подобно мутации 3243A>G, другие преимущественно связаны с миопатией. Аналогично некоторые замены в гене 12S рРНК в гомоплазмическом состоянии приводят к нейросенсорной глухоте после применения антибиотиков группы аминогликозидов.
Выяснение разных эффектов мутаций в гене tRNA, связанных с синдромом MELAS, в сравнении с мутациями, вызывающими только миопатии, привело к одному из первых объяснений соотношения между генотипом и фенотипом при болезнях митохондриальной ДНК (мтДНК). Многие мутации гена tRNA, вызывающие синдром MELAS, неизвестным способом нарушают важную биохимическую модификацию неоднозначно соответствующего азотистого основания урацила (U) в тРНК, тогда как замены, вызывающие только миопатию, не нарушают модификацию этого основания.
Неоднозначно соответствующее основание присутствует в третьей позиции многих кодонов и называется так, поскольку допускает неполное совпадение кода. Неоднозначно соответствующее основание важно для опознавания кодона и связи кодон-антикодон; при отсутствии биохимической модификации нарушается способность антикодона, содержащего немодифицированное неоднозначно соответствующее основание, декодировать некоторые кодоны.
Взаимодействие между митохондриальным и ядерным геномами
Поскольку как ядерный, так и митохондриальный геномы кодируют полипептиды окислительного фосфорилирования, неудивительно, что фенотипы, вызванные мутациями в ядерных генах, часто неотличимы от вызванных мутациями мтДНК. Кроме того, мтДНК называют «служанкой» ядерной ДНК, поскольку мтДНК зависит от множества белков ядерного генома для репликации и работы. Генетические исследования показали прямую зависимость между ядерным и митохондриальным геномами.
Первое указание данного взаимодействия было обнаружено на примере синдрома аутосомно передающихся делений в мтДНК с фенотипом, имеющим сходство с хронической прогрессирующей наружной офтальмоплегией. С этим фенотипом связаны мутации по крайней мере в двух генах. Белок, кодируемый одним из этих генов, так называемый твинкл-белок (от англ. twinkle — мерцание; назван по необычной точке приложения) оказался ДНК-праймазой или хеликазой.
Продукт второго гена — специфическая мтДНК-полимераза у, с потерей функции которой связаны как доминантные, так и рецессивные синдромы множественных делеций.
Второе аутосомное заболевание — синдром уменьшения митохондриальной ДНК (мтДНК), результат мутаций в одном из шести ядерных генов (только у небольшой части больных), ведущих к снижению числа копий мтДНК (как на митохондрию, так и на клетку в целом) в различных тканях. Большинство пораженных генов кодируют белки, необходимые для поддержки пула нуклеотидов или их метаболизма в митохондриях. Например, миопатические и гепатоцеребральные фенотипы вызваны мутациями в генах митохондриальной тимидинкиназы и дезоксигуанозинкиназы.
Другое заболевание, митохондриальная желудочно-кишечная энцефаломиопатия, — результат мутаций в гене тимидинфосфорилазы, хотя и не митохондриального белка, но особенно важной для использования митохондриальных нуклеотидов. Кроме понимания биологии митохондрий, идентификация патологических генов при таких редких нарушениях облегчает генетическое консультирование и пренатальную диагностику в некоторых семьях и способствует поиску путей лечения. Например, при недостаточности тимидинфосфорилазы уровень тимидина крови заметно повышается, что позволяет предположить терапевтическую пользу более низких уровней тимидина.
Ядерные гены могут модифицировать фенотип болезней мтДНК
Хотя основной источник фенотипической изменчивости при болезнях митохондриальной ДНК (мтДНК) — гетероплазмия, играют роль также дополнительные факторы, включая гены ядерных локусов. Надежным подтверждением существования таких факторов оказались семьи, несущие мутации, связанные с леберовской атрофией зрительного нерва; при этом заболевании мутации обычно гомоплазмические (и, следовательно, фенотипические изменения не могут объясняться гетероплазмией).
Атрофия зрительного нерва Лебера фенотипически проявляется как быстрая, безболезненная двусторонняя потеря центрального зрения из-за атрофии зрительного нерва у молодых. В зависимости от мутации часто возможно некоторое восстановление зрения, но патогенетические механизмы поражения зрительного нерва неясны.
Болеть могут как мужчины, так и женщины, но существует поразительное и необъяснимое увеличение пенетрантности болезни у мужчин; примерно у 50% носителей-мужчин и только около 10% женщин развивается симптоматика леберовской атрофии. Изменение пенетрантности и преобладание мужчин в фенотипе определяются гаплотипом в коротком плече Х-хромосомы. Гены-модификаторы в этом ядерном локусе еще не определены, но содержатся в общей популяции в частом и, вероятно, древнем гаплотипе Х-хромосомы. Если этот вариант передается человеку, унаследовавшему мутацию леберовской атрофии зрительного нерва в мтДНК от обычно здоровой матери, фенотип в значительной степени модифицируется.
Например, у мужчин, несущих аллели (кроме связанных с самым тяжелым фенотипом) леберовской атрофии зрительного нерва, нарушения зрения развиваются в 35 раз чаще, если они имеют гаплотип X, сцепленный с высоким риском. Эти наблюдения также показывают, что на самом деле локусы генов-модификаторов при моногенных болезнях возможно идентифицировать, этот Х-сцепленный локус — один из нескольких таких модификаторов, подтвержденных к настоящему времени в геноме человека.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Научная электронная библиотека
Юров И. Ю., Ворсанова С. Г., Воинова В. Ю., Чурносов М. И., Юров Ю. Б.,
5.3. Митохондриальное наследование
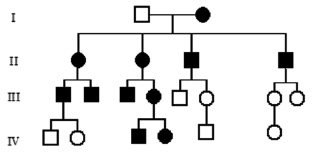
Митохондриальное (цитоплазматическое) наследование характерно для особого класса наследственной патологии – митохондриальных болезней. Каждая клетка содержит тысячи копий митохондриальной ДНК. Ряд редких болезней с необычной комбинацией неврологических и миопатических признаков, кардиомиопатии, диабет, как оказалось, возникают вследствие мутаций митохондриальных генов. Неудивительно, что головной мозг, мышцы и сердце поражаются в большей степени, поскольку эти органы наиболее энергозависимы. Митохондриальные болезни поражают оба пола, но передаются только через женщин (рис. 15). У большинства людей митохондриальная ДНК идентична во всех митохондриях (гомоплазмия). В случае мутаций ДНК в части митохондрий, у индивидуума будет две популяции митохондрий – нормальные и мутантные, т. е. гетероплазмия. Доля митохондрий с мутантной ДНК варьирует между клетками и тканями. Это является объяснением различной тяжести течения заболевания у людей с митохондриальными болезнями. Ряд митохондриальных белков кодируется ядерными генами, а мутации в них нарушают функцию митохондрий. Напрмер, мутации генов белков комплекса цитохрома С наследуются аутосомно-рецессивно, а мутации Х-сцепленного гена G4.5 (TAZ) вызывают синдром Барта (кардиоскелетную миопатию с нейтропенией и аномальными митохондриями) у мальчиков.
Рис. 15. Родословная при митохондриальном типе наследования
Множественные аллели и комплексные признаки
Выше рассмотрены признаки, с которыми связаны только два аллеля – нормальный и мутантный. Некоторые гены имеют более двух аллельных форм, т. е. множественные аллели. Некоторые из них могут быть доминантными, другие – рецессивными по отношению к нормальному аллелю. Пример множественных аллелей – наследование групп крови человека.
Развитие генетики сделало возможным исследование комплексных признаков, которые формируются при взаимодействии нескольких генов. На этой основе возникла концепция олигогенного (дигенного и триаллельного) наследования.
При дигенном наследовании наблюдается аддитивный эффект гетерозиготных мутаций в двух различных локусах. Например, одна из форм пигментного ретинита, приводящая к потере зрения, вызвана гетерозиготностью по мутациям двух генов (ROM1 и PRPH). Оба эти гена кодируют белки, присутствующие в фоторецепторах сетчатки глаза. Индивидуумы, гетерозиготные по мутации только одного из этих двух генов, не имеют клинических проявлений.
Триаллельное наследование можно рассмотреть на примере синдрома Барде-Бидля – редкого заболевания, характеризующегося ожирением, полидактилией, аномалиями почек, пигментным ретинитом и когнитивными нарушениями. Семь различных генных локусов, мутации в которых ведут к синдрому Барде–Бидля, были идентифицированы. До недавнего времени считалось, что заболевание наследуется аутосомно-рецессивно. Однако, сейчас известно, что есть одна форма синдрома, когда индивидуум, гомозиготный по мутациям одного локуса, является также гетерозиготным по мутации другого локуса. Таким образом, для того, чтобы заболевание проявлялось, необходимо три мутантных аллеля.
Антиципация. При некоторых аутосомно-доминантных болезнях манифестация симптомов более ранняя и течение болезни более тяжелое у потомков по сравнению с их родителями, также страдающими этим заболеванием. Феномен увеличения тяжести болезни из поколения в поколение называют антиципацией. Одним из объяснений антиципации является экспансия нестабильных триплетных повторов. В качестве примеров можно привести такие болезни экспансии триплетных повторов, как миотоническая дистрофия, хорея Гентингтона, болезнь Кеннеди.