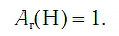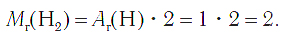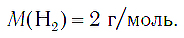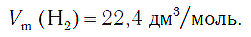Что легче водород или воздух
Урок 21. Водород — самый лёгкий газ
В уроке 21 «Водород — самый лёгкий газ» из курса «Химия для чайников» рассмотрим водород как простое вещество и химический элемент; узнаем об истории открытия водорода и о его физических свойствах.
Название водорода происходит от латинского слова Hydrohenium, что означает «воду родящий». Химический символ (знак) Н — это первая буква латинского названия. И действительно, атомы водорода входят в состав молекулы воды Н2О.
Атомы водорода образуют двухатомные молекулы простого вещества водорода, формула которого Н2. Рассмотрим, что имеют в виду, когда говорят о химическом элементе водороде.
Водород как химический элемент
Атом водорода самый легкий, самый простой по строению и один из самых маленьких по размерам. Относительная атомная масса водорода равна:
Сравните ее с относительной атомной массой кислорода и убедитесь, что атомы водорода во много раз легче.
Атомы водорода соединяются с атомами других химических элементов, образуя сложные вещества. Как химический элемент водород входит в состав воды, кислот, природного газа, нефти, глюкозы и многих других веществ. В растительных и животных организмах, включая и человеческий, химический элемент водород содержится главным образом в составе воды и самых разнообразных органических веществ.
Водород как простое вещество
Молекулы водорода образованы двумя атомами химического элемента водорода. Формула его Н2. Относительная молекулярная масса простого вещества водорода равна:
Следовательно, молярная масса водорода равна:
Молярный объем водорода, как кислорода и других газов при нормальных условиях, равен:
В виде простого вещества водород встречается на Земле лишь в небольшом количестве в вулканических и некоторых других природных газах. Молекулы водорода Н2 обнаружены в верхних слоях земной атмосферы. В Солнечной системе простое вещество водород входит в состав атмосферы планет — Юпитера, Сатурна, Урана.
На заметку: Недавние исследования Юпитера, самой большой планеты Солнечной системы, позволили ученым высказать предположение, что под водородной атмосферой этой планеты находится океан жидкого водорода. Глубина этого океана — десятки тысяч километров. Ядро планеты составляет оболочка, состоящая из твердого водорода.
История открытия водорода
Еще в XVI в. Парацельсом было замечено, что при действии кислот на железо и другие металлы выделяется газ. Первоначально его назвали «горючим воздухом». Спустя примерно 100 лет горение водорода на воздухе описал Р. Бойль и этот газ научились собирать. Во второй половине XVIII в. английский ученый Г. Кавендиш подробно исследовал свойства «горючего воздуха». Он установил, что этот газ при сгорании на воздухе образует воду. Г. Кавендиша считают первооткрывателем водорода (1766).
Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 г. французским химиком А. Лавуазье. Он и дал этому веществу латинское название, которое происходило от греческих слов «хюдор» — вода и «геннао» — рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у простого вещества Н2.
Физические свойства водорода
Водород при нормальных условиях находится в газообразном состоянии. Это бесцветный газ, у которого нет запаха и вкуса.
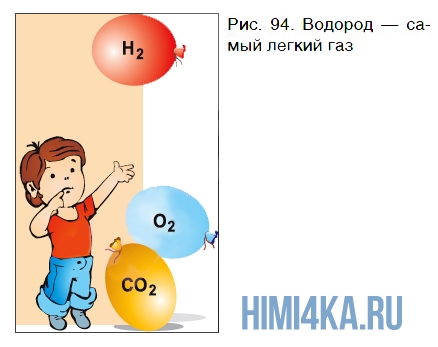
Молекула водорода самая легкая из молекул всех веществ. Поэтому газообразный водород по плотности значительно уступает воздуху и кислороду — он в 14,5 раза легче воздуха и в 16 раз легче кислорода. В этом легко убедиться на опыте.
Если наполнить три одинаковых резиновых шарика водородом, углекислым газом и кислородом, крепко завязать их ниткой и выпустить из рук одновременно, то они поведут себя по-разному (рис. 94). Шарик с водородом быстро поднимется к потолку, а шарики с углекислым газом и кислородом опустятся на пол. Быстрее окажется на полу шарик с
углекислым газом.
На заметку: Поскольку водород, как мы знаем, в 14,5 раза легче воздуха, им заполняли воздушные шары и дирижабли. Первыми поднялись на воздушном шаре французские физики Ф. Робер и Ж. Шарль (1783). В августе 1887 г. полет на воздушном шаре, наполненном водородом, с научной целью совершил Д. И. Менделеев.
Из-за своей малой массы и размеров молекулы водорода способны проникать через стенки сосуда, в котором содержится этот газ. Убедимся в этом на примере того же шарика с водородом. Даже если тщательно завязать его ниткой, спустя некоторое время шарик «сдуется». При повышенной температуре и давлении водород способен проникать и через стенки металлических сосудов.
При нормальных условиях растворимость водорода в воде меньше, чем кислорода, — 0,0016 г водорода на 1 дм 3 воды. Поскольку водород малорастворим, в лаборатории его собирают методом вытеснения воды или воздуха.
У водорода самые низкие после благородного газа гелия температуры кипения (−252,8 °С) и плавления (−259,2 °С).
Краткие выводы урока:
Надеюсь урок 21 «Водород — самый лёгкий газ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Водород
В трудах химиков XVI-XVIII вв. упоминался «горючий» или «воспламеняемый воздух», который в сочетании с обычным давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот – серной и соляной. Первым ученым, описавшим свойства этого газа, был Г.Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов. Кавендиш принял «горючий воздух» (водород) за чистый флогистон – невидимую субстанцию, которую тела теряют при горении или при растворении в кислотах. Тогда металлы считали сложными веществами, содержащими флогистон, его-то они якобы и выделяют под действием кислоты.
Дальнейшее развитие химии показало ошибочность этой теории. Теперь общеизвестно, что водород входит в состав кислот, а металлы являются простыми веществами. Однако способ получения водорода, открытый в те времена, используется в лабораториях до сих пор. Для этого в аппарат Киппа загружают палочки, отлитые из цинка, и заливают 20-процентную серную кислоту:
А.Л.Лавуазье в 1779 г. получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку с железными опилками. При температуре красного каления железо вступает в реакцию с водяным паром, и выделяется водород: 3Fe + 4H2O = Fe3O4 + 4H2↑

Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды – Н2О. Название элемента – Hydrogenium – Лавуазье и его коллеги образовали от греческих слов «гидор» — «вода» и «геннао» — «рождаю». Русское слово «водород», т.е. «рождающий воду», является точным переводом латинского названия.
Водород относится к числу наиболее распространенных химических элементов. В земной коре он встречается почти исключительно в виде соединений: входит в состав нефти, природного газа, каменного угля, некоторых минералов. В свободном состоянии он обнаружен в незначительном количестве в вулканических газах, а также среди продуктов разложения органических веществ микроорганизмами. Но конечно, самое известное соединение водорода – это его оксид, вода. По оценкам ученых, на Земле 1,4∙10 18 т поверхностных вод, и еще около 1,3∙10 13 т – в виде пара в атмосфере. Обширны также запасы подземных вод.
Кроме того, водород самый распространенный элемент во Вселенной. Энергия, излучаемая Солнцем и другими звездами, выделяется в результате ядерных реакций с участием его ядер.
Элемент образует несколько изотопов: наряду с обычным водородом с относительной атомной массой 1 (его называют протием, 1 Н), на Земле встречаются два тяжелых изотопа – дейтерий( 2 Н или D) и тритий ( 3 Н или Т). Содержание дейтерия в природном водороде очень незначительно: лишь один из 100 тыс. атомов водорода является атом дейтерия. Этот изотоп был выделен в 1931 г. при испарении жидкого водорода. Радиоактивного трития еще меньше – примерно один атом на каждые 10 18 атомов 1 Н. Недавно зафиксировано образование сверхтяжелых изотопов водорода – 4 Н и 5 Н.
Водород – бесцветный газ без вкуса и запаха, слаборастворимый в воде. Он в 14,5 раз легче воздуха – самый легкий из газов. Поэтому водородом раньше наполняли аэростаты и дирижабли.
Молекулы Н2 настолько малы, что способны легко проходить не только через мелкие поры, но и сквозь металлы. Некоторые из них, например никель и палладий, могут поглощать большое количество водорода и удерживать его в атомарном виде в пустотах кристаллической решетки. Нагретая до 250 о С палладиевая фольга свободно пропускает водород: этим пользуются для тщательной очистки его от других газов.
Подобно Н2, дейтерий при нормальных условиях – газ, состоящий из молекул D2. Однако по сравнению с обычным водородом он имеет более высокую температуру кипения (-249 о С ).
Химические свойства водорода
В химических реакциях водород может быть как восстановителем (что для него более характерно), так и окислителем.
Водород взаимодействует как восстановитель:
Смесь 2 объемов Н2 и 1 объема О2 при поджигании взрывается (так называемый «гремучий газ»);
б) с серой при нагревании:
в) с хлором при поджигании и облучении смеси газов УФ-светом:
г) с фтором при обычных условиях:
д) с азотом при повышенном давлении и нагревании в присутствии катализаторов(реакция необратима):
Как окислитель водород взаимодействует только с активными (щелочными и щелочноземельными) металлами. В результате образуются гидриды металлов, представляющие собой солеобразные ионные соединения, которые содержат гидрид-ионы Н — :
Гидриды металлов – нестойкие кристаллические вещества белого цвета. Они являются сильными восстановителями, так как степень окисления – 1 малохарактерна для водорода. Так, при действии воды гидриды разлагаются, восстанавливая при этом воду до водорода:
а) При высокой температуре водород может восстанавливать большинство оксидов металлов; например:
в) Водород способен присоединяться ко многим органическим молекулам. Такие реакции называются гидрированием и будут подробно рассмотрены в разделе «Органическая химия».
Получение водорода
Существует достаточно много способов получения водорода. Рассмотрим наиболее широко используемые лабораторные (первые три) и промышленные способы.
Применение водорода
В химической промышленности водород служит сырьем для получения аммиака NH3, хлороводорода НСl, метанола СН3ОН и других органических веществ. В пищевой промышленности водород используют для выработки твердых жиров путем гидрогенизации растительных масел. В металлургии водород используется для восстановления некоторых цветных металлов из их оксидов. Как уже отмечалось выше, водород – очень легкий газ, поэтому им заполняют воздушные шары, зонды и другие летательные аппараты. Высокая экзотермичность реакции горения водорода в кислороде обусловливает использование «водородной» горелки для сварки и резки металлов (температура водородного пламени достигает 2600 о С ). Жидкий водород является одним из наиболее эффективных видов ракетного топлива.
В последние годы все больше внимание уделяется водородной энергетике, т.е. использованию водорода в качестве топлива, в частности для двигателей внутреннего сгорания. Это представляет особый интерес с экологической точки зрения, так как при горении водорода в выделяющихся газах не содержится вредных веществ (продукт горения – вода!).
Пероксид водорода (Н2О2)
Раствор пероксида водорода имеет кислую реакцию среды, что обусловлено диссоциацией его молекул по типу слабой кислоты:
Как кислота пероксид водорода взаимодействует с основаниями:
Некоторые пероксиды металлов, например Na2O2, BaO2, можно рассматривать как соли слабой кислоты пероксида водорода. Из них можно получать Н2О2 действием более сильных кислот:
Графическая формула пероксида водорода: Н – О – О – Н. «Пероксидный мостик» из двух атомов кислорода обусловливает неустойчивость молекулы. При хранении на свету, нагревании, в присутствии катализатора пероксид водорода разлагается на воду и кислород:
Данная реакция относится к типу реакций диспропорционирования. Способность пероксида водорода к самоокислению-самовосстановлению объясняется тем, что атомы кислорода в его молекуле находятся в промежуточной степени окисления – 1. Этим же обусловлено участие Н2О2 в различных реакциях в роли окислителя или в роли восстановителя. В реакциях с типичными восстановителями пероксид водорода проявляет свойства окислителя и восстанавливается до воды или гидроксид-ионов; например:
При взаимодействии с сильными окислителями Н2О2 проявляет восстановительные свойства и окисляется до свободного кислорода; например:
Пероксид водорода применяют как дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство в виде 3%-ного раствора.
Скачать:
Скачать бесплатно реферат на тему: «Водород» Водород.docx (240 Загрузок)
Скачать бесплатно реферат на тему: «Водород и Вселенная» Водород-и-Вселенная.docx (223 Загрузки)
Скачать бесплатно реферат на тему: «Вода» Вода.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Водородная связь» Водородная-связь.docx (254 Загрузки)
Скачать бесплатно реферат на тему: «Вода и ее свойства» Вода-и-её-свойства.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Водные ресурсы» ВОДНЫЕ-РЕСУРСЫ.docx (216 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Водород – рождающий воду
Содержание
При горении водорода в кислороде образуется чистое, некоптящее и не имеющее четких границ пламя температурой до 2800°С.
Теоретически для полного сгорания 1 мг водорода требуется 0,5 мг кислорода. Практически в горелку на 1 мг водорода подается 0,25 мг кислорода.
История открытия водорода
Доподлино установить кто открыл водорода невозможно, поскольку он известен с XVI века. Алхимики заметили, что при взаимодействии железных опилок с соляной или серной кислотой выделяется «горючий воздух», или «искусственный воздух». Однако его все-таки считали воздухом, получившим почему-то способность гореть.
Но вот сторонник точных измерений Генри Кавендиш (Henry Cavendish) выделил водород из серной и соляной кислот железом, цинком, оловом. Он собирал его в газометре и узнал, что при горении «горючего воздуха» образуется чистая вода. Поэтому считается, что лавры открытия водорода принадлежат именно ему.
Интересны первые русские наименования водорода: «водотворный газ», «водотвор». Легкость водорода, пожалуй, поразила первых наблюдателей больше, чем остальные его свойства. Думали даже, что он и есть тот таинственный с «отрицательным весом» флогистон, который, проникая в тела, сообщает им способность гореть.
Избыток водяных паров, непрерывно поступающих в трубу, проходил через холодильник, а водород по трубам направлялся в аэростат и надувал его.
Когда железо израсходуется, его опять можно получить из накаленной окалины, если через трубу пропустить светильный газ. Уравнение показывает, что 3?56=168 г железа могут вытеснить 8 г водорода, или 4?22,4=89,6 л водорода.
Аэростаты, наполненные водородом, применили впервые революционные войска Франции в битве при Флёрюсе в 1794 г.
В войнах 1904-1905 и 1914-1918 гг. привязанные канатами аэростаты служили главным образом для наблюдения за прицельностью артиллерийского огня, за передвижением войск. Во время Великой Отечественной войны 1941-1945 гг. они защищали военные объекты от авиации противника. Летчики, опасаясь столкновений с аэростатом и канатами, летали на большой высоте, поэтому их бомбовые удары в значительной мере теряли прицельность.
Первый в мире полет на аэростате с научной целью совершил ученый Захаров Яков Дмитриевич в 1804 г. А в 1887 г. для наблюдения солнечного затмения и изучения воздуха поднялся в воздух Менделеев Дмитрий Иванович.
Получение водорода
В промышленности технический водород получают:
Получение водорода из кислот
Вместо цинка можно взять железо в виде стружек или алюминий. Водород получается, загрязненный побочными продуктами разложения серной кислоты, и, если это требуется, его приходится очищать.
Добыча водорода из промышленных газов
При переработке каменного угля на кокс дополнительно получается деготь и коксовый газ. В состав газа входит до 50-60% водорода (H2), 20-25% метана (СН4), окись углерода (СО), азот (N) и др.
В статье о свойствах гелия и способах его производства описан процесс получения гелия методом фракционной конденсации. Так же поступают и с коксовым газом. Но чтобы отделить водород от других составных частей, требуется очень глубокое охлаждение из-за низкой критической температуры водорода.
Производство водорода из воды
Единственным исходным сырьем для добычи водорода электролитическим методом служит вода. Чистая, дистиллированная вода обладает огромным сопротивлением и почти совершенно не проводит электрический ток. Вот почему для того чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
В результате получения 2 м 3 водорода, как побочный продукт получается 1 м 3 кислорода.
Большой расход электроэнергии является главным недостатком данного способа, поэтому применение водорода полученного при помощи электролиза целесообразно при одновременном использовании вместе с кислородом. В связи с этим в последнее время портативные водородные сварочные аппараты для газовой сварки и пайки пользуются все большей популярностью.
Применение водорода
Основными направлениями применения водорода являются:
Применение водорода в сварке
Водород использовался в качестве защитного газа еще при первых попытках защиты дугового пространства от воздуха. Однако водород может оказать в ряде случаев вредное воздействие. Это объясняется тем, что при применении водорода в металле сварных швов образуются дефекты в виде пор, а также является одним из главных факторов образования холодных трещин. С увеличением толщины свариваемых элементов пористость в металле сварных швов становится значительной. Поэтому его использование в дальнейшем было значительно ограничено. В чистом виде (и в виде водородно-азотных смесей, получаемых при диссоциации аммиака) он в настоящее время применяется при атомно-водородной сварке (хотя и сам этот способ заменен теперь другими, в частности сваркой неплавящимся электродом).
Если струю водорода пропускать через пламя вольтовой дуги, то водород диссоциирует на атомы с поглощением значительного количество тепла (103,6 ккал/моль) что приводит к значительному увеличению напряжения дуги. Она становится устойчивой только при повышении напряжения источника тока. Так, например, при режимах атомно-водородной сварки наиболее эффективной «звенящей» дугой при вольфрамовых электродах и силе тока 10-20 А напряжение дуги составляет около 100 А, напряжение холостого хода питающего источника должно быть не менее 200-220 В (обычно около 300 В). В этом случае водород является не только защитным газом, но и переносит тепловую энергию из дуги на поверхность не включенного в цепь тока изделия.
Образовавшийся атомный водород направляют на твердую свариваемую поверхность, где происходит нагревание и расплавление металла за счет поглощения тепла, которое выделяется при рекомбинации атомов до молекулярного водорода. Ассоциация атомарного водорода на холодной поверхности металла (в том числе и расплавленной, так как температура плавления большинства металлов ниже температуры возможного существования заметных количеств атомарного водорода) приводит к выделению тепла, потребленного в дуге на диссоциацию. За счет выделяющегося тепла температура свариваемой поверхности металла повышается до 3528-4028°С. Такая атомно-водородная сварка позволяет обрабатывать и сваривать самые тугоплавкие металлы, высококачественные стали, коррозионно-устойчивые материалы, цветные металлы.
Несмотря на то, что атмосфера, окружающая металл, при атомно-водородной сварке представляет собой смесь молекулярного и атомарного водорода, при отсутствии на металле значительного количества окислов швы получаются достаточно плотными и применительно к низкоуглеродистой стали не имеют большого количества диффузионно-подвижного и остаточного водорода.
При струйной защите иногда используется водяной пар. Однако в этом случае получается значительно меньшая стабильность качества сварных швов, чем при сварке с защитой дуги углекислым газом. В связи с этим такой процесс широкого распространения не получил.
При TIG сварке аустенитной нержавеющей стали с целью увеличения напряжения дуги, увеличения теплоэффективности и снижения оксидирования используют аргоно-водородные смеси газов (15% Н2). Более высокая температуру и сжатие дуги, в свою очередь увеличивает глубину проплавления металла. Однако при этом необходимо учитывать возможность вредного влияния растворяющегося в металле водорода. Более широко водород применяют в специальных областях сварки и металлургии, например в порошковой металлургии при спекании изделий из порошковых материалов.
В других случаях применение водорода и водородосодержащих газов, как защитных при дуговой сварке, нецелесообразно.
Применяют водород для составления плазмообразующих смесей при плазменной сварке и резке. Так, для защиты сварочной ванны от окисления при плазменной сварке легированной стали, меди, никеля и сплавов на его основе используют смесь аргона с 5-8% водорода.
Аргоно-водородную смесь, имеющую до 20% Н2, применяют при микроплазменной сварке. Наличие водорода в смеси обеспечивает сжатие столба плазмы, делает его более сконцентрированным. Кроме того, водород создает необходимую в ряде случаев восстановительную атмосферу.
Взрывоопасность водорода
При работе с водородом особое внимание следует обращать на герметичность аппаратуры и газовых коммуникаций, так как водород способен проникать через мельчайшие неплотности, образовывать с воздухом взрывоопасные концентрации. В смеси с кислородом (2:1) образует взрывчатую смесь, называемую гремучим газом.
Температура самовоспламенения 510°С. Водород физиологически инертен, при высоких концентрациях вызывает удушье. При высоком давлении проявляется наркотическое действие. При работе в среде водорода необходимо пользоваться изолирующим противогазом (кислородным или шланговым).
Хранение и транспортировка водорода
Водород технический поставляют по ГОСТ 3022. Хранят и транспортируют водород в стальных баллонах вместимостью 40 и 50 дм 3 по ГОСТ 949 под давлением 15 МПа. Баллон окрашивается в темно-зеленый цвет с красной надписью «ВОДОРОД».
Характеристика водорода
Характеристики H2 представлены в таблицах ниже:
Коэффициенты перевода объема и массы H2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,0841 | 1 | 1,188 |
| 0,0708 | 0,842 | 1 |
| 1 | 11,891 | 14,126 |
Коэффициенты перевода объема и массы H2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,09 | 1 | 1,258 |
| 0,0708 | 0,975 | 1 |
| 1 | 11,124 | 14,126 |
Водород в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м 3 ) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| H2 | 40 | 0,54 | 6,0 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
Рекомендуем к просмотру видео об открытии водорода, его характеристиках и производстве.