Что лучше анаболические стероиды или гормон роста
Гормон роста и стероиды
Эту мысль как-то высказывал Ли Прист, который не единожды входил в десятку лучших на Олимпии и занимал призовые места в соревнованиях по гонкам. Ли говорил, что все упирается в генетику, и, если бы он захотел стать профессиональным баскетболистом, то при своем росте 163см он смог бы разве что отлично кидать мяч в корзину. Да, если приложить усилия, можно стать великолепным любителем, но для профессионала одного желания мало. Точно так же не всем дано иметь пиковый бицепс, узкую талию, широкую спину и шарообразные сеченные дельты. Поймите правильно, мы не отговариваем Вас от занятий спортом, или от профессионального бодибилдинга, пауэрлифтинга или чего-либо ещё, мы призываем Вас здраво оценивать свои шансы. А, исходя из здравой оценки своих возможностей, принимать решения о применении фармакологии.
С абсцессами и гипогликемией, в общем-то, все понятно, первое бывает от неправильных инъекций, второе от чрезмерных доз инсулина, а вот рак и инфаркт миокарда – это следствие совместного приема гормона роста и стероидов. Между прочим, сюда можно так же отнести применение и всех остальных пептидов, которые, по сути, являются фрагментами соматотропина. Дело в том, что гормон роста стимулирует рост всех органических тканей, и в том числе опухолей. Риск заболеть раком при использовании пептидных гормонов возрастает в разы. Если уж Вы решитесь применять этот вид допинга, тогда обязательно проконсультируйтесь с врачом, и выясните, есть ли у Вас предрасположенность к раку. Если такая предрасположенность есть, то применение пептидных гормонов строго запрещено!
Если же у Вас такой предрасположенности нет, Вы решили, что будете ставить гормон роста и стероиды, тогда Вам стоит озаботиться проблемой сердечнососудистых заболеваний, а именно инфарктом миокарда. Дело в том, что интенсивные занятия в тренажерном зале ведут к гипертрофии сердечной мышцы. Само собой, что гипертрофия всегда происходит по наиболее легкому из доступных путей, поэтому сердечная мышца увеличивается вовнутрь, уменьшая размер левого желудочка. Совместное применение стероидов и гормона роста приводит ещё и к гиперплазии, то есть, сердце растет быстрее. В конце концов, маленький левый желудочек и мощная мышца, в совокупности с потребностью в интенсивном кровообращении, ведут к учащению пульса, снижению давления и износу сердца.
10 веществ, улучшающие производительность, которые не относятся к стероидам
Ланс Армстронг, Хосе Кансеко, Рашард Льюис, Шон Мерриман — это список спортсменов-суперзвезд, обвиняемых или признавшихся, что они использовали допинг для улучшения спортивных результатов.
Допинг используют не только занимающиеся тяжёлой атлетикой, бейсболом и ездой на велосипеде спортсмены. Допинг-скандалы были также среди футболистов, легкоатлетов, пловцов и баскетболистов. И его используют не только мужчины или звёзды спорта.
Ланс Армстронг завершает гонку Power of Four Mountain Bike на горе Аспен 25 августа 2012 года. Армстронг признался в приёме допинга
Многие спортсмены могут начать принимать анаболические стероиды, синтетические стероидные гормоны, тестостерон, андростендиол, андростендион, нандролон и станозолол, которые увеличивают мышечную массу и силу, но тесты могут легко обнаружить их в организме.
Однако в 1980-х и 90-х годах стали появляться альтернативы. В настоящее время существует множество препаратов для улучшения спортивных результатов, которые не классифицируются как стероиды. Их эффекты весьма разнообразны, и некоторые приносят пользу только определённым спортсменам, занимающимся определёнными видами спорта.
10. Эритропоэтин
Строение эритропоэтина — гормона, ответственного за образование эритроцитов
Эритроциты переносят кислород по всему телу, поэтому, если спортсмен сможет увеличить количество эритроцитов в крови, будет доставлено больше кислорода в мышцы. Переливание крови — сохранение запаса крови спортсмена, которую нужно перелить прямо перед соревнованиями, — это неплохой способ, но проблематичный и долгий. Приём эритропоэтина (ЭПО) увеличивает выработку эритроцитов без переливания. Почки вырабатывают гормон естественным путём, хотя в случае людей с тяжёлыми заболеваниями почек картина может быть иной. К 1990-м годам велосипедисты и другие спортсмены обнаружили, что они могут тренироваться дольше и интенсивнее, если регулярно принимают этот препарат.
Неудивительно, что приём ЭПО сопряжён со значительным риском. Исследования показали, что увеличивается риск инсульта, сердечного приступа и отёка лёгких. Одна теория предполагает, что препарат очень сильно сгущает кровь. Такие осложнения, возможно, погубили, по меньшей мере, 20 велосипедистов к 2000 году, что привело к необходимости разработки надежного теста для выявления ЭПО.
9. Гормон роста
Энди Петтитт из «Нью-Йорк Янкиз» рассказывает о применении гормона роста 18 февраля 2008 года на Legends Field, штат Флорид
Как и ЭПО, cоматотропин (СТГ, соматотропный гормон, соматропин, гормон роста) естественным образом синтезируется в организме. Фактически гипофиз, орган размером с горошину, расположенный в основании мозга, производит СТГ, чтобы стимулировать рост у детей и подростков и увеличивать мышечную массу у взрослых.
Как только синтетический гормон роста стал доступным в качестве лекарства в 1985 году — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило его применение для ряда заболеваний, которые замедляют рост или вызывают дистрофию мышц, — спортсмены стали рассматривать его как допинг.
Полагалось, что СТГ может имитировать действие анаболических стероидов. Поначалу из-за высокой стоимости лекарства оно не широко использовалось, но, как говорится, кто хочет победить, тот найдёт способ это сделать. Олимпийские игры 1996 года были названы «СТГ играми» из-за безудержного употребления его среди участников.
Сегодня гормон роста можно получить из различных источников: врачи готовы выписать рецепты для использования не по прямому назначению, интернет-аптеки, незаконные веб-сайты и клиники, которые используют гормон роста, чтобы обратить старение вспять. Это довольно рискованно, особенно учитывая отсутствие научных доказательств того, что гормон роста действительно улучшает спортивные результаты.
И не забывайте про побочные эффекты. Использование СТГ было связано с различными заболеваниями, включая боль в суставах, мышечную слабость, задержку жидкости в организме, синдром запястного канала, кардиомиопатию и гиперлипидемию (Mayo Clinic).
8. Бромантан
На Олимпийских играх 1996 года несколько российских спортсменов были дисквалифицированы после положительного результата теста на бромантан. Одним из спортсменов был Зафар Гулиев, который затем был лишён бронзовой медали по греко-римской борьбе
Бромантан — это своего рода и стимулятор и маскирующий агент. У нескольких россиян был положительный результат на препарат, который в то время не был включён в список запрещённых веществ Международного олимпийского комитета (МОК). Это не помешало МОК дисквалифицировать нескольких российских спортсменов, и занести в чёрный список бромантан, ссылаясь на его эффекты.
Бромантан был разработан советскими военными врачами как стимулятор, который мог быть дан солдатам и космонавтам, чтобы чувствовать себя бодрее и лучше бороться с усталостью. Вскоре препарат стал использоваться российскими спортсменами.
Некоторые сотрудники антидопинговых комитетов считают, что бромантан может скрывать злоупотребление более серьёзными допингами, например, стероидами. И такие случаи существуют: пробенецид может уменьшить концентрацию стероидов в моче. Но точный механизм работы бромантана остаётся неясным. Однако это не уменьшает привлекательность препарата для спортсменов.
7. Эфедрин
Стив Бехлер, скончавшийся 17 февраля 2003 года от осложнений после термоплегии, принимал по три таблетки ксенадрина RFA-1, препарата для похудения, который содержит эфедрин
Спортсмены принимают стимуляторы для повышения выносливости и снижения утомляемости. И тот, кто пытается «влезть» в меньшую весовую категорию, может использовать стимуляторы для подавления аппетита.
Сначала можно подумать об амфетаминах, таблетках «только по рецепту», но не все стимуляторы продаются так. Эфедрин, например, доступен без рецепта во многих применениях (в Росиии он запрещён, как и другие многочисленные стимуляторы), кроме пищевых добавок (пищевые добавки, содержащие эфедрин, в США запрещены).
Эфедрин используют в качестве противоотёчного средства или, например, при низком кровяном давлении, связанном с анестезией. Спортсмены используют эфедрин для дополнительной энергии, несмотря на предупреждения о том, что препарат может вызвать высокое кровяное давление, головокружение, одышку и сердечную аритмию.
6. Диуретики
Наряду с бромантаном, диуретики долгое время служили способом скрыть использования стероидов. Мочегонное средство — это любое лекарство, которое влияет на функцию почек, что приводит к увеличению выделения мочи. Хлорталидон, например, мочегонное средство, предотвращает реабсорбцию жидкостей и солей в почечные канальцы и их возврат в кровь, в результате чего из организма выходит больше воды. Ацетазоламид работает, блокируя поглощение бикарбоната натрия в почечных канальцах.
У пациентов с болезнями сердца диуретики могут помочь контролировать высокое кровяное давление и задержку жидкости. Но атлеты, которые принимают анаболические стероиды, используют диуретики для того, чтобы снизить концентрацию стероидов, что значительно затрудняет их обнаружение. Конечно, атлеты также могут быть проверены на наличие диуретиков.
Тяжелоатлеты и боксёры также могут пить диуретики, чтобы выступать в более легкой весовой категории. Затем, прямо перед матчем, они прекращают принимать диуретики, что даёт им преимущество перед соперниками. Диуретики могут вызвать головокружение, обезвоживание или сильное падение кровяного давления.
5. Альбутерол
Знаменитый британский марафонец Паула Рэдклифф (на фото во время Олимпийских игр 2008 года) страдает астмой, вызванной физическими упражнениями. Многие такие атлеты полагаются на вдыхаемый альбутерол, чтобы справиться с астмой
Иногда влияние препарата на спортивные результаты зависит от способа его введения. В качестве примера возьмём агониста бета2-адренорецепторов, альбутерол. Это известное лекарство от астмы действует за счёт расслабления тканей, выстилающих бронхи, позволяя большему количеству воздуха поступать в лёгкие. Как показывает статистика, многие элитные спортсмены имеют астму и используют альбутерол в ингаляторе для устранения симптомов, что позволяет им соревноваться без одышки (Kindermann).
Но что насчёт спортсменов, у которых нет астмы? Могут ли они использовать альбутерол и немного увеличить объём лёгких? В обзорной статье, опубликованной в 2007 году в Sports Medicine, авторы обнаружили, что в 17 из 19 клинических исследований, в которых участвуют спортсмены без астмы, не отмечается значительного улучшения показателей при вдыхании бета2-агонистов.
Однако, когда спортсмен принимает альбутерол перорально или в виде инъекций, это уже другой разговор. Было обнаружено, что введённый такими способами альбутерол обладает анаболическими свойствами, что означает, что он может помочь в наборе мышечной массы подобно стероидам.
4. Ингибиторы ЦОГ-2
Принимали ли вы когда-нибудь ибупрофен для снижения температуры, боли или воспаления? Если да, то вам помог нестероидный противовоспалительный препарат (НПВП). НПВП действуют путём ингибирования синтеза простагландинов, химических веществ, которые способствуют воспалению, расширяя кровеносные сосуды и позволяя крови попадать в ткани организма.
Простагландины вырабатываются двумя ферментами, которые функционируют одинаково, но имеют разные химические характеристики: циклооксигеназой-1 (ЦОГ-1) и циклооксигеназой-2 (ЦОГ-2). Некоторые НПВП блокируют действие ЦОГ-1 или ЦОГ-2. Ибупрофен относится к последней категории.
Спортсмены годами принимали ибупрофен, чтобы лучше восстановиться после тренировок. И некоторые исследования в настоящее время указывают на то, что хроническое использование препарата действительно может улучшить спортивные показатели. Исследовательская группа в Human Performance Laboratory в Университете Болл обнаружила, что мужчины и женщины, которые ежедневно принимали ибупрофен, смогли улучшить прирост мышц по сравнению с теми, кто принимал плацебо.
Остаётся вопрос, как действует ибупрофен: улучшает рост мышечной массы или просто уменьшает боль, позволяя людям тренироваться дольше и быстрее восстанавливаться. В любом случае, использование ибупрофена или других НПВП может быть рискованным шагом, так как они могут повредить слизистую оболочку желудочно-кишечного тракта.
3. Бета-адреноблокаторы
Jin Jong-oh из Южной Кореи участвует в соревнованиях по стрельбе из пневматического пистолета на 50 метров среди мужчин на Олимпийских играх 2004 года в Афинах
Легко понять, почему бейсболисты, велосипедисты, боксёры, пловцы и бегуны иногда обращаются к фармацевтическим препаратам для улучшения своих результатов на соревнованиях. В этих видах спорта нужна мышечная сила и выносливость. А что насчёт стрельбы из винтовки или из лука?
Эти виды спорта, безусловно, требуют острого зрения, твёрдой руки и хорошей концентрации, но сила в данном случае не ключевой фактор. Тем не менее спортсмены данных видов спорта принимают допинг. У 2 северокорейских стрелков, участвовавших в Олимпийских играх 1998 года в Сеуле, в крови был обнаружен пропранолол.
Оказывается, пропранолол относится к классу лекарств, известных как бета- адреноблокаторы, которые используют для борьбы с гипертонией. Они работают, снижая действие адреналина, гормона, вырабатываемого надпочечниками, который усиливает кровообращение. У людей, которые принимают бета-адреноблокаторы, немного замедляется сердечный ритм и снижается кровяное давление.
Препарат также уменьшает беспокойство, потоотделение и дрожь, именно поэтому стрелков привлекают к ответственности за использование данного препарата. Если рука не дрожит, показатели на соревнованиях лучше. К бета-адреноблокаторам также относятся: атенолол, ацебутолол, алпренолол, бисопролол и метопролол. Все они запрещены для использования во время соревнований.
2. Тамоксифен
2 мая 2012 года, Марлон Бёрд незадолго до того, как его отстранили на 50 игр за приём тамоксифена
В июне 2012 года Марлона Бёрда отстранили на 50 игр после положительного результата теста на тамоксифен — вещество, запрещённое в Высшей лиге бейсбола и многих других видах спорта. Почему спортсмен принимал препарат, обычно используемый пациентами с раком молочной железы? Ответ скрывается в биохимии.
Многие виды рака молочной железы имеют рецепторы для приёма эстрогена, «женского гормона». Когда молекулы эстрогена попадают в эти рецепторы, злокачественные клетки активируются. Тамоксифен блокирует эти рецепторы, препятствуя росту и развитию рака.
Некоторые спортсмены принимают стероиды, обычно синтетический тестостерон, для наращивания мышц. Большие дозы мужского гормона заставляют организм вырабатывать дополнительный эстроген. Это, в свою очередь, может привести к увеличению груди (особенность, которую большинство находят непривлекательной). Чтобы противодействовать эффектам эстрогена и скрыть использование стероидов, спортсмены принимают тамоксифен.
1. Креатин
Тяжелоатлеты, в числе других атлетов, могут использовать безрецептурный креатин. Претендентка на победу в олимпийских играх 2012 года Жак Пейн выглядит так, словно у неё просто заняты руки
Есть один популярный препарат для улучшения результатов спортсмена, который не связан с допинговыми скандалами. Это креатин, и он совсем не относится к допингу, по крайней мере, по данным Управления по контролю за продуктами и лекарствами США (FDA). Креатин является безрецептурной добавкой.
Креатин остаётся одной из наиболее широко используемых добавок среди спортсменов, особенно футболистов, спринтеров и штангистов. Почему? Растущее число фактических данных свидетельствует о том, что данное вещество действительно приносит пользу, повышая уровень аденозинтрифосфата (АТФ) в мышечной ткани. АТФ стимулирует мышечные сокращения, поэтому повышение уровня АТФ, безусловно, помогает спортсмену. Но ограничивается всё короткими, высокоэнергетическими всплесками мышечной активности.
Печень вырабатывает креатин каждый день, поэтому приём дополнительного креатина не сильно сказывается на результатах в целом. Избыток креатина выводится из организма через почки, так что приём большого количества дополнительного креатина не имеет смысла.
Дополнительно: посмотреть подробный разбор Бориса Цацулина о креатине можно тут.
Курс гормона роста
Содержание
Курсы гормона роста [ править | править код ]
Данный курс гормона роста человека составлен в помощь начинающим атлетам для получения рельефной фигуры. Дозировки и комбинации взяты из научной литературы, они систематически используются атлетами различных видов спорта на практике и признаны наиболее эффективными и рациональными.
Кому подходят эти курсы гормона роста?
Гормон роста может применяться как мужчинами, так и женщинами в возрасте старше 20 лет (у более молодых людей может наблюдаться несимметричное развитие костей) для усиления рельефности мускулатуры. Общая масса увеличивается незначительно, это происходит в результате крупных потерь жира.
Побочные эффекты в ходе и после курса практически не наблюдаются, все они как правило носят обратимый характер.
Сертифицированные в РФ препараты гормона роста: (в порядке снижения популярности)
Прочие препараты гормона роста:
Курс №1: Гормон роста [ править | править код ]
Цель: Достижение рельефа, при наличии достаточной мышечной массы. Эффект омоложения, повышение упругости мышц, улучшение свойств кожи.
Курс: Гормон роста + Стероиды [ править | править код ]
Цель: Достижение рельефа и набор мышечной массы. Эффект омоложения, повышение упругости мышц, улучшение свойств кожи.
Альтернативным решением является применение гормона роста сразу после курса анаболических стероидов (как на массу, так и на сушку). Это позволяет максимально сохранить мышечную массу и дополнительно повысить рельефность.
Курс: Гормон роста + Жиросжигатели [ править | править код ]
Эффект: Сжигание жира, с получением рельефной фигуры. Эффект омоложения, повышение упругости мышц, улучшение свойств кожи.
Как разводить гормон роста [ править | править код ]
Гормон роста может быть только в виде сублимированного порошка. Количество порошка должно быть указано на ампуле. Количество может быть указано либо в единицах (ед.) или в миллиграммах (мг). Если количество указано в миллиграммах, то его можно перевести в единицы по формуле 1мг =
3 ед. (более точно 1мг=2,7ед.). Мы же в наших описаниях будем пользоваться формулой 1мг = 3 ед., потому что именно эта формула используется большинством производителей препарата.
Разведение [ править | править код ]
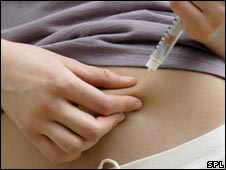
Как делать инъекции гормона роста [ править | править код ]

Предупреждение [ править код ]

Что лучше анаболические стероиды или гормон роста
НИИ детской эндокринологии Эндокринологического научного центра, Москва
Журнал: Проблемы эндокринологии. 2011;57(1): 71-79
НИИ детской эндокринологии Эндокринологического научного центра, Москва
НИИ детской эндокринологии Эндокринологического научного центра, Москва
Человеческий гипофизарный гормон роста (ГР) как терапевтическое средство был впервые получен в 1958 г., и применялся только у детей, имевших наиболее тяжелые формы СТГ-дефицита. В 1985 г. на фармацевтическом рынке появился рГР, синтезируемый методом рекомбинантной ДНК. Данное обстоятельство многократно расширило использование рГР во всем мире, дало мощный толчок интенсивному изучению эффективности терапии рГР, совершенствованию дозирования и методов его введения и, как следствие, — улучшению конечного роста и качества жизни пациентов, расширению показаний для назначения рГР.
СТГ-дефицит
СТГ-дефицит у детей. СТГ-дефицит у детей является первым и безусловным показанием для заместительной терапии рГР. Частота СТГ-дефицита у детей колеблется от 1:4000 до 1:10 000 новорожденных. Согласно данным Национального регистра, который ведется в ФГУ ЭНЦ с 1990 г., в настоящее время маленьких пациентов с данным заболеванием — 1932 человека, мальчики составляют 75%, с приобретенным СТГ-дефицитом — 54 больных. Без заместительной терапии рГР такие пациенты обречены на карликовость: конечный рост нелеченых женщин составляет 129,8 см, мужчин — 139,2 см [1]. До эры рГР среди больных с гипофизарным нанизмом был крайне высок процент лиц (74,3%), закончивших лишь 8–10 классов общеобразовательной школы. Профессионально были заняты в цирковом жанре, создавая коллективы маленьких людей, 60,8% пациентов [1]. В условиях дефицита ГР в организме, начиная с детства и постепенно усугубляясь с возрастом, развиваются многообразные метаболические нарушения, которые значительно ухудшают состояние здоровья и являются причиной преждевременной смертности пациентов.
При адекватной и рано начатой терапии рГР возможно достижение абсолютно нормального конечного роста, соответствующего значениям для здоровой популяции. В настоящее время на основе результатов многочисленных исследований выработана оптимальная схема дозирования и введения рГР, которая принята во всем мире. Стандартная доза рГР, используемая в настоящее время у детей с СТГ-дефицитом, составляет 0,025—0,050 мг/кг в сутки ежедневно подкожно. Основываясь на отечественном и зарубежном опыте («Консенсусе 1999 г. по диагностике и лечению дефицита гормона роста у детей и подростков», «Заключении научного общества по изучению гормона роста 2000 г.», «Рекомендациях американской ассоциации клинических эндокринологов по использованию гормона роста у взрослых и детей, 2003») в 2005 г. в России был принят «Национальный Консенсус по диагностике и лечению соматотропной недостаточности у детей» [2]. В соответствии с Консенсусом в Российской Федерации рекомендуемая доза рГР составляет 0,033 мг/кг в сутки, рГР вводится подкожно ежедневно перед сном.
Целями лечения рГР при СТГ-дефиците являются:
— нормализация роста и достижение конечного роста в пределах или выше генетически прогнозируемого;
— нормализация состава тела;
— повышение минеральной плотности костей и уменьшение риска возникновения переломов;
— нормализация метаболических процессов;
— снижение факторов риска развития сердечно-сосудистых осложнений;
— нормализация репродуктивной функции;
— нормализация психологического состояния и жизненного тонуса.
За 20 лет применения в мире накоплен значительный опыт лечения рГР детей с СТГ-дефицитом, на основании которого установлена его безопасность. Побочные эффекты у детей на фоне терапии рГР крайне редки. Они включают: доброкачественную внутричерепную гипертензию, препубертатную гинекомастию, артралгии, отеки. Как правило, купирование данных состояний происходит при временном снижении дозы или временном прекращении лечения. Связь таких состояний, как соскальзывание головки бедренной кости, ишемический некроз головки бедренной кости и сколиоз, с терапией рГР однозначно не установлена.
С 2000 г. Министерством здравоохранения РФ и Академией медицинских наук осуществлялись крупные закупки рГР для лечения детей с СТГ-дефицитом, а с 2008 г. заботу о непрерывном обеспечении данной категории маленьких пациентов взяло на себя государство в рамках специально принятого распоряжения Правительства РФ.
В 2006 г. был зарегистрирован первый отечественный рГР Растан, по эффективности и безопасности не уступающий зарубежным аналогам. С 2011 г. стало возможным введение Растана с помощью удобного дозатора — шприц-ручки.
Усилия, совместно предпринимаемые Правительством, МЗСР, ФГУ ЭНЦ и региональными эндокринологическими службами, позволяют надеяться, что в России такое явление, как «гипофизарная карликовость», будет полностью ликвидировано.
СТГ-дефицит у взрослых. СТГ-дефицит у взрослых характеризуется изменением состава тела, углеводного и липидного обмена, снижением минеральной плотности костей [3], повышенным риском возникновения переломов и сердечно-сосудистых заболеваний и сниженным качеством жизни.
Целью заместительной терапии рГР у взрослых является достижение нормализации метаболических, функциональных и психологических последствий гипопитуитаризма или СТГ-дефицита.
Положительное влияние заместительной терапии рГР на состав тела, заключающееся в достоверном увеличении мышечной массы и уменьшении жировой, а также на липидный профиль, было отмечено еще в первых небольших исследованиях [4] и подтверждено в последующих. Терапия рГР в течение 2—5 лет вызывает нормализацию мышечной силы [5]. При большой продолжительности лечения рГР наблюдаются изменения минеральной массы (ММК) и минеральной плотности (МПК) костей, причем как у пациентов с врожденным [6], так и с приобретенным СТГ-дефицитом [7]. Мужчины отвечают на лечение рГР бо`льшим (примерно на 9%) увеличением BMC, чем женщины. Поскольку увеличивается не только BMC, но и размер кости (ее площадь), увеличение BMD менее выражено, однако ее нормализация отмечена у большинства пациентов [7].
рГР оказывает комплексный эффект на липиды сыворотки крови. Его суммарное влияние заключается в снижении уровней общего холестерина, ЛПНП и апопротеина B. В некоторых работах [8] выявлено повышение концентрации ЛПВП. Базальное состояние липидного профиля отчасти является отражением общего сердечно-сосудистого риска пациентов. В связи с этим концентрации липопротеидов обычно регулярно мониторируются, особенно у пациентов, имевших до терапии рГР гипер-/дислипопротеидемию или другие факторы сердечно-сосудистого риска.
В настоящее время нет данных, напрямую демонстрирующих снижение сердечно-сосудистой заболеваемости и смертности у взрослых с СТГ-дефицитом, длительно получающих заместительную терапию рГР. Один из наиболее используемых косвенных показателей атеросклероза — толщина интима-медиа (ТИМ). У взрослых с СТГ-дефицитом ТИМ увеличена, и некоторые исследования продемонстрировали ее уменьшение на фоне заместительной терапии рГР [9]. Более того, есть сообщения, свидетельствующие о том, что смертность на фоне длительной заместительной терапии рГР у взрослых с СТГ-дефицитом не превышает смертность в общей популяции. Однако чтобы это утверждать, требуется более длительный период наблюдений.
На фоне длительно проводимой заместительной терапии рГР у взрослых с СТГ-дефицитом не отмечено изменений инсулиновой чувствительности, равно как и увеличения частоты сахарного диабета 2-го типа по сравнению с частотой, наблюдаемой в общей популяции.
Митогенный и ростостимулирующий эффект ГР и ИФР1 и их влияние на развитие неопластических процессов заложили теоретическую основу предположений о том, что и терапия рГР может увеличить риск развития опухолей и влиять на их продолженный рост. Оценивая риск развития онкологических заболеваний, необходимо учитывать тот факт, что для пациентов с гипопитуитаризмом вследствие генетических или опухолевых причин может быть присущ более высокий риск развития неоплазий по сравнению со здоровыми людьми. Кроме того, само лечение опухолей, включая лучевую терапию, является фактором риска развития вторичной неоплазии.
Известно, что уровни ИФР1 в сыворотке, превышающие нормальные значения, являются предикторами опухолевых процессов. Проведенный метаанализ гормональных предикторов рака предстательной железы показал, что двукратно повышенный риск развития рака предстательной железы имеют те мужчины, у которых концентрации тестостерона или ИФР1 соответствуют верхней границе референсных значений [10]. Среди женщин в пременопаузе риск развития рака молочных желез в 4,5 раза повышен у тех, чьи концентрации ИФР1 соответствовали верхней границе референсных значений по сравнению с теми, у кого ИФР1 находился на нижней границе нормы [11]. Схожие результаты выявлены в отношении рака прямой кишки у мужчин [12]. Эти исследования также продемонстрировали отрицательную корреляцию между риском развития рака и концентрацией ИФРСБ-3 (повышенный риск наблюдается у тех, кто имеет высокие концентрации ИФР1 и низкие — ИФРСБ-3. Значимость этих данных для пациентов с гипопитуитаризмом не ясна, поскольку лечение рГР вызывает увеличение значений как ИФР1, так и ИФРСБ-3. В контексте заместительной терапии рГР тем не менее целесообразно поддерживать уровень ИФР1 в нормальных значениях, своевременно титруя дозу, которая зависит от возраста и пола пациента, а также от параллельно проводимой заместительной терапии другими гормонами.
Пациенты с СТГ-дефицитом, получавшие лечение рГР в связи с новообразованием в анамнезе, имеют риск развития вторичной опухоли, тем не менее данных, указывающих на то, что лечение рГР повышает риск ее развития, нет. Сведения о том, что частота возникновения de novo рака и лейкемии у пациентов, получавших рГР, также отсутствуют.
Активный опухолевый процесс является стандартным противопоказанием для рГР как у детей, так и у взрослых. Относительные противопоказания — пролиферирующая диабетическая ретинопатия и доброкачественная внутричерепная гипертензия. В настоящее время считается, что пациенты с гипопитуитаризмом и сахарным диабетом могут получать лечение рГР, но начальные дозы должны быть более низкими и титроваться медленнее на фоне частого и регулярного мониторинга гликемии.
20-летний опыт применения рГР показал, что заместительная терапия рГР у взрослых при правильно диагностированном СТГ-дефиците, адекватной титрации дозы и мониторинге лечения посредством контроля ИФР1 и клинической эффективности является безопасной. Вместе с тем общепризнанным считается мнение о том, что необходимо проводить дальнейшие наблюдения с целью получения сведений об отдаленных последствиях лечения рГР.
Заболевания роста без СТГ-дефицита
В настоящее время спектр заболеваний, при которых применяется рГР, значительно расширен и не ограничен только соматотропной недостаточностью. Уже в 1983 г. Международная конференция по применению ГР провозгласила необходимость проведения исследований у «низкорослых детей, не имеющих СТГ-дефицита» [13]. Доступность рГР дала возможность активного изучения эффективности терапии рГР при низкорослости, обусловленной различными негипофизарными причинами. Низкорослые дети без СТГ-дефицита могут иметь тонкие дефекты в одном из многих участков оси СТГ–ИФР1. Учитывая различный генез ростовых проблем при этих заболеваниях, первичной целью терапии низкорослых детей без СТГ-недостаточности являются увеличение скорости роста и нормализация линейного роста без воздействия на лежащие в их основе причины. Поэтому для состояний, не обусловленных СТГ-дефицитом, рГР скорее используется в качестве фармакологического средства, чем как физиологический заместитель. Для терапии рГР низкорослых детей без СТГ-дефицита, характерен дозозависимый характер эффективности.
В наши дни рГР применяется при синдромальной низкорослости (синдром Шерешевского—Тернера, Сильвера—Рассела, Прадера—Вилли, Нунан, Секкля и др.), внутриутробной задержке роста, идиопатической низкорослости, хронической почечной недостаточности, ювенильном идиопатическом артрите, заболеваниях кроветворной системы (лейкозы, лимфома, анемия Фанкони), нейрофиброматозе, муковисцидозе и др. Все эти заболевания объединяет одна особенность: сопровождающая их низкорослость не вызвана СТГ-дефицитом.
Считается, что действие экзогенного рГР осуществляется посредством взаимодействия с рецепторами СТГ и он, как и эндогенный СТГ, вызывает тот же внутриклеточный сигналинговый ответ независимо от лежащего в основе заболевания специфического дефекта.
Терапия рГР эффективна в большинстве случаев низкорослости, ассоциированных с повышенным содержанием в сыворотке белков, связывающих СТГ и ИФР1. Однако как у мышей [14], так и у людей ряд ростовых эффектов ГР, очевидно, нечетко зависит от печеночной продукции ИФР1. В большинстве проведенных работ при различных вариантах низкорослости [15] корреляция между ростовым ответом на терапию рГР и увеличением циркулирующего ИФР1 (стандартизованного по возрасту и полу) только отчасти объясняла эффект лечения.
Кроме изменения концентрации ИФР1, факторами, влияющими на результаты терапии рГР, являются полиморфизм рецептора СТГ [16], полноценность питания, возраст начала терапии, доза рГР и длительность лечения рГР.
Синдром Шерешевского—Тернера (СШТ). Применение рГР при низкорослости, ассоциированной с СШТ, было одобрено во Франции в 1990 г., в остальных странах Европы — в 1993 г., в США — в 1996 г.
Взрослые женщины с СШТ в среднем на 20 см ниже женщин здоровой женской популяции в соответствующей стране [17] и примерно на 20 см ниже своего целевого роста. Однако существует строгая корреляционная зависимость между конечным ростом без лечения и целевым ростом, свидетельствующая о том, что несмотря на патологию Х-хромосомы, значительный компонент линейного роста при СШТ моделируется не Х-хромосомными генами.
Большой клинический материал, накопленный за последние 20 лет, свидетельствует об эффективности рГР в увеличении скорости роста и конечного роста у пациенток с СШТ. Уже первые результаты, продемонстрировавшие увеличение скорости роста у девочек с данной патологией, вселили оптимизм и явились основанием того, что данная терапия широко применялась еще до получения официального одобрения. В течение более двух десятилетий после начала применения рГР опубликованы результаты лечения рГР при СШТ при различном дозировании и схемах лечения, одного рГР или в комбинации с неароматизированным анаболическим стероидом оксандролоном, или половыми стероидами.
В целом, по данным зарегистрированных исследований, пациентки, получавшие лечение рГР в течение 5—7 лет до достижения конечного или околоконечного роста, улучшают свой рост на 5–8 см. Этот результат свидетельствует о том, что прогноз влияния длительной терапии рГР на конечный рост у пациенток с СШТ составляет в среднем 1 см в год лечения.
Было показано, что эффект терапии на конечный рост коррелируется с длительностью лечения рГР без эстрогенов. Поэтому для того, чтобы отсрочить эстрогенобусловленное костное созревание и, таким образом, максимально увеличить длительность лечения рГР, в общей клинической практике появилась тенденция намеренного переноса начала заместительной терапии эстрогенами на значительный временной интервал от обычного возраста физиологического телархе. Однако более поздние работы с применением терапии ультранизкими дозами эстрадиола, начатого в физиологические сроки (близко 12-летнему возрасту), продемонстрировали содружественный эффект рГР и эстрогенов на увеличение конечного роста [19]. Более того, значительная отсрочка начала заместительной терапии половыми стероидами негативно влияет на психосоциальное развитие, накопление минеральной костной массы, развитие матки, сексуальное созревание, уровень самооценки и, возможно, риск развития сердечно-сосудистых заболеваний [20]. Подходы, позволяющие избежать необходимости отсрочки феминизации (такие как раннее начало терапии рГР или — для тех, у кого терапия рГР была начата не столь рано, — комбинирование ее с оксандролоном) могут в большинстве случаев оказаться успешными, если критериями успешности считать не только ростовые показатели [20].
Лечение рГР, начатое в раннем возрасте (в среднем в 9 мес), предотвращает замедление темпов роста, характерное для девочек с СШТ первых лет жизни, и восстанавливает показатели линейного роста почти до средних нормальных значений [21]. Данные результаты обосновывают правомерность раннего начала терапии рГР при СШТ. Таким образом, модернизированные принципы ведения девочек с СШТ в настоящее время таковы: необходимость терапии рГР может рассматриваться, как только снижаются темпы роста; начальная доза рГР составляет 0,05 мг/кг в сутки с последующим индивидуальным подбором дозы в зависимости от ростового ответа; до 9–12 лет терапия проводится только одним рГР, в дальнейшем — в комбинации с половыми стероидами, отдавая предпочтение трансдермальным формам.
При ранней диагностике и раннем начале лечения рГР конечный рост может быть улучшен у большинства и нормализован у ряда пациенток (83% девочек с СШТ достигают нормального конечного роста, 63% — целевого роста) [22]. В настоящее время конечный рост 150 см является достижимой целью для большинства девочек с СШТ.
Пациенткам с СШТ свойствен повышенный риск нарушений углеводного обмена [23], поэтому этому аспекту безопасности всегда уделялось пристальное внимание. Хотя большинство долгосрочных результатов, касающихся усугубления этих проблем у пациентов с СШТ на фоне лечения рГР, выглядят оптимистичными [24], такие девочки должны регулярно наблюдаться эндокринологом с целью выявления признаков и симптомов сахарного диабета 2-го типа.
Пациентки с СШТ имеют повышенный риск развития сколиоза и кифоза по сравнению с девочками в общей популяции. Эти заболевания встречаются примерно у 10—20% девочек и женщин с СШТ [25]. Обе проблемы могут усугубляться на фоне ускоренных темпов линейного роста, обусловленных лечением рГР. Другие проблемы, наблюдающиеся при СШТ с повышенной частотой, включают: соскальзывание головки бедренной кости [26] и увеличенное количество пигментных невусов [27]. Хотя имеется гипотетическое предположение о том, что терапия рГР увеличивает размер и количество таких невусов, доказательств, его подтверждающих, нет.
В целом нежелательные явления терапии рГР при СШТ встречаются редко. Тем не менее при данном синдроме у молодых пациенток нередки фатальные случаи аневризмы аорты, ее расслоения или разрыва, обычно ассоциированные с такими факторами риска, как двустворчатый аортальный клапан, коарктация или дилатация аорты, артериальная гипертензия [28]. В то же время нет данных о побочных эффектах терапии рГР на диаметр аорты (по результатам МРТ) [20].
Задержка внутриутробного развития. Применение рГР у низкорослых детей с задержкой внутриутробного развития (ЗВУР) в анамнезе получило одобрение как в Европе, так и в США. Нарушения постнатального роста низкорослых детей с ЗВУР, вероятно, многофакторны. Обусловливающие ЗВУР факторы могут включать клеточную гипоплазию [30], повреждения оси ИФР1–СТГ, влияние полиморфизма гена рецептора ГР (наличие или отсутствие d3GHR аллеля, влияющего, как предполагается, на чувствительность к ГР).
Эра рГР ознаменовалась многочисленными исследованиями, в которых предпринимались попытки оптимизировать результаты терапии, используя различные способы дозирования и стратегии назначения рГР [30—32]. В настоящее время применяемая при ЗВУР доза рГР колеблется в диапазоне 0,033—0,067 мг/кг в сутки. Опыт применения рГР у данной категории детей, накопленный в ФГУ ЭНЦ, свидетельствует об эффективности и безопасности данного лечения. В первые 2—3 года терапии наблюдаются ускоренные (догоняющие) темпы роста, позволяющие ребенку вернуться на свою генетически детерминированную ростовую кривую [30]. В этот период особенно наглядно проявляется дозозависимый эффект рГР. Последующее лечение рГР обеспечивает пациенту нормальную для соответствующего возраста и пола скорость роста, прекращение терапии рГР ведет к значительному снижению темпов роста. Эти данные свидетельствуют о необходимости длительной терапии рГР, несмотря на нормализацию ростовых показателей, по крайней мере, до периода пубертата.
Хотя результаты лечения в различных исследованиях и у разных пациентов вариабельны, в среднем 1 год терапии рГР может увеличить конечный рост на 1 см. К факторам, улучшающим эффективность лечения, относят значительный дефицит роста ребенка относительно его целевого роста; большую дозу рГР (менее важна в поддерживающей фазе лечения), малый возраст на момент начала терапии, значительную продолжительность и непрерывность терапии и, возможно, присутствие d3GHR аллеля [32], хотя эта точка зрения остается дискутабельной.
При длительной терапии рГР 85% пациентов с ЗВУР достигают нормального конечного роста и 98% — целевого роста [31]. Вследствие изначально имеющейся у детей с ЗВУР склонности к развитию инсулинорезистентности высказывается определенная настороженность относительно влияния экзогенного рГР у этих пациентов на метаболизм глюкозы. На фоне терапии рГР у детей с ЗВУР наблюдается некоторое увеличение инсулиновой резистентности, которая обычно исчезает после прекращения лечения [33]. В связи с этим в инструкции по применению рГР у детей с ЗВУР прописано, что лечение данных больных должно проводиться под регулярным внимательным контролем показателей углеводного обмена [32].
Кроме инсулиновой резистентности, пациенты, рожденные с синдромом ЗВУР, в зрелые годы жизни имеют повышенный риск развития метаболических нарушений, таких как дислипидемия, гипертензия и метаболический синдром. Однако в настоящее время нет информации о том, увеличивает ли терапия рГР в детстве этот риск в зрелые годы, в связи с чем требуются дальнейшие длительные наблюдения.
Идиопатическая низкорослость. Состояния, сопровождающиеся низкорослостью, не обусловленной СТГ-дефицитом, при которых исключены все известные причины низкорослости, принято объединять общим термином «идиопатическая низкорослость» (ИН). Имеющиеся к настоящему времени данные об эффективности применения рГР у детей с ИН несколько противоречивы.
В течение 20 лет после внедрения рГР проведено более 40 исследований с участием детей с ИН. Было продемонстрировано, что среднее увеличение конечного роста на фоне рГР при ИН составляет около 1 см/1 год лечения рГР, аналогично тому, что наблюдается при СШТ и ЗВУР. Вместе с тем во всех исследованиях было отмечено: ответ на терапию рГР среди пациентов с ИН крайне вариабелен [34]. Точный прогноз результатов лечения на основе параметров до лечения в настоящее время невозможен. Концентрация ИФР1 на момент начала лечения рГР не имеет независимой корреляционной связи с прибавкой роста и, как свидетельствуют данные регрессионного анализа, играет относительно малую роль в прогнозировании результатов длительного лечения [35]. Более значимыми факторами, влияющими на результаты длительного роста, являются возраст на момент начала лечения, доза рГР, длительность терапии рГР и целевой рост [35].
Поскольку пациенты с ИН практически здоровы, они имеют относительно низкий риск развития нежелательных явлений на фоне терапии рГР. Данные больших длительных постмаркетинговых исследований действительно показывают, что частота нежелательных явлений у этих пациентов ниже, чем в других группах детей с болезнями роста. Так, частота средних отитов, сколиоза, соскальзывания головки бедренной кости, гипотиреоза, нарушений углеводного обмена и артериальной гипертензии у пациентов с ИН идентична и даже ниже, чем частота этих состояний при СТГ-дефиците и СШТ [36]. У детей с ИН не отмечено случаев развития внутричерепной гипертензии, отеков или препубертатной гинекомастии. Терапия рГР не вызывала развитие скелетных изменений или ускорение пубертатного развития [35, 37], схожие результаты были опубликованы в большой постмаркетинговой базе данных [38]. Частота малигнизации, как и сахарного диабета у детей с ИН, получавших рГР, идентична частоте в общей популяции [39].
В настоящее время показанием для терапии рГР при ХПН является не отставание в росте (рост ниже определенного значения), а скорее снижение скорости роста (субнормальная скорость роста). Рекомендуемая доза рГР при ХПН составляет 0,035—0,040 мг/кг в сутки.
Метаанализ рандомизированных контролируемых исследований терапии рГР у детей с ХПН показал, что ускорение темпов роста наблюдается на 1-м году лечения, в последующем темпы роста снижаются и в дальнейшем ускоренных темпов роста не наблюдается [45]. Продолжение терапии рГР способствует поддержанию нормальной скорости роста и предотвращает ее прогрессивное снижение, которое развивается при прекращении лечения рГР. Имеющиеся в ограниченном количестве собственные и зарубежные данные свидетельствуют о том, что конечный рост может быть улучшен на 1—1,5 SDS (на 7—11 см) [46, 47]. Длительное голландское исследование [48] продемонстрировало прогрессивное улучшение SDS роста в небольшой группе детей, где через 6 лет лечения средний SDS роста приблизился к SDS целевого роста (т.е. генетически детерминированному).
Считается, что положительный эффект терапии рГР на фоне повышенных концентраций эндогенного СТГ развивается, по крайней мере, отчасти в результате достижения на фоне лечения значительного повышения ИФР1, повышения соотношения ИФР1/ИФРСБ и вследствие этого увеличения концентрации свободного ИФР1.
Настороженность относительно безопасности терапии рГР у детей с ХПН касается двух аспектов: нарушения функции почек и углеводного обмена. 20 лет исследований терапии рГР доказали, что при условии регулярного мониторинга за состоянием и гормонально-биохимическими показателями пациента она безопасна у этой категории больных. Показано отсутствие увеличения частоты нежелательных явлений у леченных рГР детей по сравнению с нелечеными [48]. Хотя терапия рГР одобрена для применения при ХПН только до трансплантации почки, появляется все больше сообщений о лечении детей и после трансплантации, свидетельствующих о схожей частоте отторжения трансплантата у леченных и нелеченных рГР пациентах [49]. Вместе с тем эффективность лечения рГР после трансплантации ниже, что объясняется необходимостью применения терапии цитостатиками и глюкокортикоидами. Несмотря на общее впечатление о безопасности терапии рГР у детей с ХПН, тщательный мониторинг функции почек на фоне лечения обязателен.
Поскольку дети с ХПН могут иметь частично нарушенную толерантность к глюкозе даже при отсутствии экзогенного ГР, углеводный обмен у леченных рГР детей изучается особо. В ранних клинических исследованиях и в обзорах не сообщалось о случаях увеличения заболеваемости сахарным диабетом у леченных рГР детей по сравнению с нелечеными, анализ большого многоцентрового постмаркетингового исследования показал, что сахарный диабет или нарушенная толерантность к глюкозе наблюдаются у леченных рГР детей с ХПН примерно с той же частотой, что и в здоровой популяции.
Поскольку терапия рГР у детей с ХПН способна увеличить концентрацию инсулина натощак, в плане безопасности обязателен мониторинг показателей углеводного обмена, особенно у детей с отягощенным по сахарному диабету анамнезом и у тех, кто получает терапию глюкокортикоидами.
Ревматоидный артрит. У детей с активным ювенильным идиопатическим артритом (ЮИА) синтез и секреция ИФР1 нарушены. Это обусловлено как самим заболеванием, так и необходимостью применения больших доз глюкокортикоидов. Терапия рГР оказывает положительный ростостимулирующий эффект у детей с выраженными формами ЮИА. Лечение рГР может восстановить дефицит ИФР1, однако выраженность эффекта во многом зависит от активности патологического процесса, количества и тяжести обострений.
У детей с выраженной низкорослостью с ЮИА длительная (в течение 4 лет) терапия рГР в дозе 0,028–0,045 мг/кг в сутки обеспечивает прибавку роста в 1 SD, тогда как пациенты без лечения рГР теряют 0,7 SD [50]. Маркеры активности заболеваемости отрицательно коррелируют с SDS скорости роста, вследствие чего лечение рГР эффективно лишь при отмене глюкокортикоидов или при дозе преднизолона не выше 10 мг/сут.
На фоне лечения рГР при ЮИА нежелательных явлений не отмечается, рГР не оказывает клинически значимого эффекта на течение артрита и активность воспалительного процесса. Учитывая липолитический эффект ГР, при его введении возможно уменьшение избыточной жировой массы, которая является следствием как основного заболевания, так и приема глюкокортикоидов.
Применение рГР при заболеваниях, не сопровождающихся низкорослостью
Остеопороз. Поскольку снижение секреции СТГ рассматривается в качестве патогенетического механизма остеопороза, для снижения потери костной массы предпринимаются попытки назначения рГР здоровым людям с остеопорозом. Показано, что у мужчин уже через 6 мес лечения рГР повышаются показатели костного формирования и резорбции, небольшое повышение минеральной плотности костей (МПК) наблюдалось только в позвоночнике. У женщин повышение МПК в позвоночнике наблюдается при совместном применении рГР и кальцитонина [51]. При более длительном (2-летнем) лечении рГР и кальцитонином у женщин с остеопорозом наблюдается, хотя и менее выраженное, чем при применении эстрогенов или бисфосфонатов, увеличение МПК в позвоночнике и бедренной кости.
Инфаркт миокарда и сердечная недостаточность. В настоящее время рГР рассматривается как потенциально новый терапевтический препарат для лечения инфаркта миокарда (ИМ) и застойной сердечной недостаточности (ЗСН). рГР пролонгирует выживаемость крыс с постинфарктной ЗСН, этот эффект сопровождается значительным подавлением апоптоза кардиомиоцитов [52]. Кроме того, рГР уменьшает патологическое интерстициальное ремоделирование в миокарде и улучшает релаксацию левого желудочка. Клинические исследования у пациентов с ЗСН показывают, что рГР повышает массу левого желудочка, улучшает сердечную функцию, гемодинамические параметры, снижает легочную сосудистую резистентность [53]. Вместе с тем, учитывая значительную вариабельность ответов, увеличение объема внеклеточной жидкости, возможность развития отеков на фоне данной терапии, необходимо проведение крупных рандомизированных исследований в дальнейшем.
Катаболические состояния. Анаболические эффекты рГР способствуют попыткам его применения при катаболических состояниях, таких как хирургические вмешательства, ожоговые травмы. Отрицательный азотистый баланс при критических состояниях отчасти объясняется резистентностью к СТГ и снижением продукции ИФР1. Восстановление после операций сопровождается избыточными катаболическими процессами. рГР, вводимый пациентам после хирургических вмешательств, приводит к положительному азотистому балансу. Положительный эффект рГР у больных с обширными ожогами наблюдается как у детей, так и у взрослых.
Спорт. Этические вопросы применения рГР у спортсменов в настоящее время являются весьма актуальными. Изолированно или в комбинации с анаболическими стероидами рГР сегодня используется многими атлетами для увеличения мышечной массы. Вместе с тем длительное использование рГР в супрафизиологических дозах у атлетов может привести к побочным эффектам, наблюдаемым при акромегалии, которые в свою очередь снижают физическую выносливость [54].
Таким образом, в течение последних 20 лет собран большой объем данных относительно эффективности терапии рГР при различных заболеваниях как у детей, так и у взрослых, имеются впечатляющие результаты лечения рГР детей с некоторыми заболеваниями, сопровождающимися нарушениями роста. Тем не менее многие вопросы лечения остаются открытыми, в связи с чем необходим дальнейший сбор отдаленных результатов терапии.
Эпидемиологические исследования свидетельствуют о возможных ассоциациях между концентрациями ИФР1 на верхней границе нормы (особенно на фоне сниженных концентраций ИФРСБ-3) и раком груди, предстательной железы, прямой кишки и легких. Сложность оценки заключается в том, что ИФР1 и ИФРСБ-3, увеличивающиеся на фоне терапии рГР, оказывают непосредственный противоположный эффект на растущие клетки: ИФР1 — антиапоптотический, ИФРСБ-3 — проапоптотический. Показано, что ИФР1 и ИФРСБ-3 имеют противоположное влияние на риск развития рака прямой кишки. Интерпретация сложных взаимосвязей между ИФР1, его связывающими белками и неоплазией подлежит глубокому изучению. Несмотря на оптимистичные данные о многих тысячах пролеченных больных, наличие потенциальной связи ГР–ИФР1, неоплазия требует тщательного наблюдения за проводимым лечением на фоне обязательного контроля ИФР1 и ИФРСБ-3 и последующего длительного наблюдения за получавшими рГР пациентами.