Что лучше эглонил или этаперазин
ТАБЛЕТКИ ОТ ПАНИЧЕСКИХ АТАК
Существует несколько способов борьбы с паническими атаками. Все их можно разделить на три вида:
Все лекарственные средства, помогающие при панических атаках делятся на две группы:
Средства быстрой помощи при панической атаке
Бензодиазепиновые транквилизаторы
Самые эффективные и быстродействующие лекарства при панических атаках это группа бензодиазепиновых транквилизаторов. К ним относятся:
Это сильнодействующие средства и поэтому в свободной продаже их нет. Приобрести их можно по специальным рецептам, которые могут выписывать только сертифицированные врачи в лицензированных клиниках.
Действие бензодиазепиновых транквилизаторов обеспечивает быстрое снятие тревоги, вегетативных проявлений (учащенный пульс и дыхание, потливость, дрожь, ознобы и волны жара, головокружения и др.), нормализацию сна и аппетита.
Так как в основе любой панической атаки находится тревога и чрезмерная активизация структур мозга, отвечающих за защитный тревожный рефлекс, то, независимо от причин, механизма развития и проявления паники транквилизаторы всегда оказывают быстрый эффект. Либо предотвратят развитие панического приступа, либо (если он уже начался) купируют его.
Указанные препараты часто применяются в таблетированной форме. Как правило прием одной таблетки транквилизатора обеспечивает развитие лечебного эффекта через 20-40 минут.
Плюсы бензодиазепиновых транквилизаторов: выраженный противотревожный эффект, быстрое наступление действия, хорошо переносится.
Небензодиазепиновые транквилизаторы
По силе действия они уступают препаратам предыдущей группы. Но и имеют свои преимущества: хорошо переносятся, не вызывают сонливости, не развивается зависимость, проще приобрести в аптеках (не нужны специальные рецепты).
Нейролептики
Нейролептики с седативным действием. Это следующая группа препаратов, обладающая успокоительным действием и позволяющая снять приступ панической атаки. Наиболее рапространенные таблетированные средства:
Антидепрессанты с седативным действием
В отличие от нейролептиков и транквилизаторов, эффект у антидепрессантов развивается не так быстро, но носит более продолжительный характер.
Прочие препараты для быстрого снятия приступа
Лекарства для постоянного приема от панических атак
Постоянный прием фармакотерапии позволяет стабилизировать биохимические и физиологические процессы в нервной системе, отвечающие за развитие приступов паники.
В основном, такие лекарства воздействуют на специфические рецепторы в головном мозге и восстанавливают нормальную активность нейромедиаторов: дофамин, серотонин, норадреналин, адреналин, ацетилхолин и другие.
Антидепрессанты
Преимущественно воздействуют на серотониновые рецепторы нервной системы. Применяются курсами по несколько месяцев (от трех до более года). Наиболее «популярные» и распространенные антидепрессанты для предотвращения панических атак:
Нейролептики
Воздействуют преимущественно на дофаминовые рецепторы мозга. Назначаются в случаях когда панические атаки являются проявлением эндогенного заболевания. Как и антидепрессанты принимаются длительно от нескольких месяцев до нескольких лет.
Вопреки распространенному среди болеющих тревожными расстройствами лиц мнению не вызывают зависимости. Самые часто применяемые при длительном лечении панических атак нейролептики:
Нормотимические препараты
Их механизм действия это нормализация соотношения процессов возбуждения и торможения в головном мозге. Наиболее эффективны при панических атаках на фоне энцефалопатии, последствий черепно-мозговых травм, инсультов, гипоксии.
Самые распространенные представители нормотимиков:
Подводя итог, можно отметить, что среди выше перечисленных лекарств есть несколько препаратов с универсальным действием: они подходят как и для однократного приема для быстрого снятия приступа панической атаки, так и для длительного приема. Это антидепрессант амитриптилин и нейролептики кветиапин, тиоридазин и сульпирид.
Комплексное лечение панического расстройства
Паническое расстройство — крайне распространенное, склонное к хронизации заболевание, манифестирующее в молодом, социально активном возрасте. Распространенность его, по данным эпидемиологических исследований, составляет 1,9–3,6%. В 2–3 раза чаще оно набл
Паническое расстройство — крайне распространенное, склонное к хронизации заболевание, манифестирующее в молодом, социально активном возрасте. Распространенность его, по данным эпидемиологических исследований, составляет 1,9–3,6%. В 2–3 раза чаще оно наблюдается у женщин в возрасте 20–30 лет. В современной американской классификации DSM-IV паническое расстройство включено в класс «Тревожные расстройства» и подразделяется на две самостоятельные рубрики: «Паническое расстройство без агорафобии» и «Паническое расстройство с агорафобией». Вслед за DSM-IV в Международную классификацию психических болезней 10-го пересмотра (МКБ-10) были включены панические расстройства в рубрику «Невротические, связанные со стрессом, и соматоформные расстройства». В этой рубрике «Панические расстройства» вошли в класс «Другие тревожные расстройства», а «Агорафобия с паническим расстройством» — в класс «Тревожно-фобические расстройства». При этом отечественные исследователи справедливо оценивают симптомокомплекс «паническое расстройство» как нозологически неспецифический, который может наблюдаться не только при неврозах, но и при аффективных расстройствах (депрессиях), различных формах шизофрении.
Основным (ядерным) синдромом панического расстройства являются повторные, неожиданно возникающие панические атаки. Приступ паники обычно возникает на фоне психогении (кульминация конфликта, острые стрессовые воздействия), а также биологических (гормональная перестройка, начало половой жизни, аборты, прием гормональных средств) и физиогенных (алкогольные эксцессы, первый прием наркотиков, инсоляция, физическая нагрузка) факторов. Паническая атака, однако, может возникнуть и аутохронно, при отсутствии предшествовавшего эмоционального и физического напряжения, на фоне повседневной деятельности больного.
Симптомы панического приступа возникают неожиданно, приступ развивается быстро, достигая своего пика за 10 мин. Обычная его длительность 20–30 мин, реже — около часа. Большая длительность приступа заставляет усомниться в правильности квалификации панического расстройства. Важно, что в отличие от многих пароксизмальных состояний для панической атаки не характерен продромальный период (аура). Послеприступный период характеризуется общей слабостью, разбитостью. Некоторая часть пациентов сообщает об ощущении «облегчения» после завершения приступа. Наличие постприступных спутанности и сна делает диагноз панической атаки сомнительным. Частота приступа варьирует от ежедневных до одного в несколько месяцев. Обычно у больных возникают 2–4 приступа в неделю.
Приступ характеризуется вегетативными, психическими расстройствами. К последним относятся аффективные расстройства, фобии, деперсонализационно-дереализационные нарушения, истеро-конверсионная симптоматика и сенестопатии. Вегетативные расстройства представлены картиной симпатикотонического криза, реже смешанного или вагоинсулярного.
Наиболее частыми и постоянными при панической атаке являются нарушения в сердечно-сосудистой и дыхательной системах. Нередко больные, описывая приступ, сообщают о внезапно начавшемся «сильном сердцебиении», ощущении «перебоев», «остановки», дискомфорта или боли в области сердца. Большинство панических атак сопровождаются подъемом артериального давления (АД), цифры которого могут быть достаточно значительными. По мере развития заболевания цифры АД снижаются параллельно дезактуализации страха, что может служить надежным диагностическим критерием при дифференциальной диагностике гипертонической болезни с кризовым течением и панического расстройства. Наиболее выраженные нарушения в дыхательной системе: затрудненное дыхание, чувство нехватки воздуха с одышкой и гипервентиляцией, «чувство удушья». Описывая приступ, пациенты сообщают, что «перехватило горло», «перестал поступать воздух», «стало душно». Именно эти ощущения заставляют больного открывать окна, балкон, искать «свежий воздух». Приступ может начинаться с ощущения удушья, и в этих случаях страх смерти возникает как следствие «затруднения» дыхания. Реже при панической атаке наблюдаются желудочно-кишечные расстройства, такие, как тошнота, рвота, отрыжка, неприятные ощущения в эпигастрии. Как правило, в момент криза наблюдаются головокружение, потливость, тремор с чувством озноба, «волны» жара и холода, парестезии, похолодание кистей и стоп. В завершающей стадии приступа наблюдается полиурия или частый жидкий стул. Объективно определяются изменение цвета лица, частоты пульса, колебания АД, причем нередко обнаруживается диссоциация между субъективной регистрацией вегетативных нарушений больными и их выраженностью при объективном осмотре. Психические составляющие панических приступов включают в себя в первую очередь эмоционально окрашенные фобии (страх смерти, страх катастрофы с сердцем, инфаркта, инсульта, падения, «утраты контроля» или «страх сумасшествия»). Возможны также дисфорические проявления (раздражительность, обида, агрессия), а также депрессивные — с тоской, подавленностью, безысходностью, жалостью к себе.
В то же время наблюдаются панические атаки, при которых отчетливых эмоциональных нарушений выявить не удается. В последние годы особый интерес вызывают панические атаки без страха. Названия этих приступов имеют много синонимов: «паника без паники», «соматически проявляющаяся паника», «алекситимическая паника», «маскированная тревога». Подобные состояния часто наблюдаются у больных, обращающихся за первичной медицинской помощью в отделения кардиологии и неврологии, и крайне редко встречаются среди больных психиатрических клиник. Истеро-конверсионные (функционально-неврологические) расстройства при приступах представлены чаще всего «чувством кома в горле», афонией, амаврозом, мутизмом, онемением или слабостью в конечностях; также отмечаются атаксия и вытягивание, «выворачивание», «скрючивание» рук. Редко наблюдаются дереализационные и деперсонализационные расстройства: «дурнота» в голове, «сноподобное состояние», чувство «отдаленности и отделенности» окружающего (так называемая «невротическая», или «истерическая», деперсонализация).
Лечение панического расстройства
Выделяют несколько стратегий в лечении панического расстройства: первое — купирование самой панической атаки; второе — предупреждение (контроль) панической атаки и вторичных по отношению к панике синдромов (агорафобии, депрессии, ипохондрии и т. д.).
Для купирования панической атаки используются медикаментозные средства и психофизиологические приемы. Наиболее эффективными препаратами являются бензодиазепины, из них более предпочтительны препараты быстрого действия: диазепам, лоразепам. Используются среднетерапевтические дозы. Возможно как пероральное, так и внутривенное введение препарата. Купирование атаки достигается спустя несколько минут (15–30) после введения лекарства. Однако частое (ежедневное) использование этих препаратов ведет к развитию синдрома привыкания, и в привычных дозировках они перестают действовать. В то же время нерегулярный прием бензодиазепинов («прием по требованию») и связанный с ним феномен отдачи могут способствовать учащению панических атак. К психофизиологическим приемам купирования пароксизма относятся: обучение релаксации, переход на диафрагмальное дыхание, «дыхание в мешок».
Стабилизирующая терапия, направленная на закрепление результатов (контроль панических атак), восстановление уровня социальной адаптации, преодоление агорафобических проявлений (тревога ожидания, избегающее поведение) и предотвращение ранних рецидивов (4–6 мес), включает назначение препаратов, обладающих антипаническим эффектом. В настоящее время выделяются следующие антипанические средства: трициклические антидепрессанты (ТАД), селективные серотонинергические препараты и ингибиторы моноаминооксидазы (МАО).
Трициклические антидепрессанты — первый класс лекарственных средств, у которого был обнаружен полноценный антипанический эффект. К наиболее часто применяемым препаратам данного класса при паническом расстройстве относятся имипрамин, кломипрамин, амитриптилин. ТАД являются препаратами выбора в случаях сопутствующих депрессивных расстройств и выраженной агорафобии.
Лечение ТАД начинают с малых доз (12,5–25 мг/сут), в дальнейшем дозы постепенно повышают до переносимого уровня (в среднем на 12,5–25 мг в течение 3–5 дней). Средняя эффективная суточная доза обычно составляет 150–200 мг/сут, реже достигает 300 мг. Крайне негативным свойством ТАД является отдаленность во времени их антипанической эффективности — первое улучшение наступает через 2–3 нед. Иногда в первые недели лечения наблюдается обострение симптоматики. Другим важным препятствием к назначению и длительному применению ТАД является широкий спектр побочных эффектов (сухость во рту, увеличение веса, запоры, сердцебиения, ощущение внутренней дрожи).
Другим классом антидепрессантов, широко применяемым при лечении панического расстройства, являются селективные ингибиторы обратного захвата серотонина (СИОЗС): флуоксетин (прозак, портал, продеп), флувоксамин (феварин, флоксифрал, лювокс), сертралин (золофт), пароксетин (паксил), циталопрам (ципрамил). Основным недостатком этой группы являются возникновение в течение первых 2–3 нед лечения гиперстимуляции (раздражительность, бессонница, нервозность) и усиление тревоги и панической симптоматики. Начальные дозы обычно минимальны (5 мг флуоксетина, 50 мг флувоксамина, 25 мг сертралина) и в течение 2 нед доза доводится до средней, а далее, при необходимости, повышается или остается прежней. В последующем, даже при длительной терапии, доза не меняется. Для длительного (поддерживающего) лечения эти препараты значительнее удобнее, чем ТАД, в связи с отсутствием холинолитического и адренергического действия и возможным однократным приемом в течение суток.
Широкое применение лекарственных средств, обладающих антипанической эффективностью, способствовало увеличению межприступного периода, что, в свою очередь, сделало возможным проведение адекватной психотерапии. Психотерапевтическое лечение обычно начинает применяться на этапе стабилизирующей (долечивающей) психофармакотерапии и продолжается еще некоторое время после прекращения приема лекарств, во многом облегчая процесс их отмены. В настоящее время наиболее распространенной при паническом расстройстве является поведенческая и реже когнитивная психотерапия. Ее применение позволяет уменьшить уровень тревоги в фобических ситуациях и редуцировать страх ожидания приступа. Когнитивная психотерапия направлена на коррекцию зафиксировавшихся ошибочных представлений больных, в соответствии с которыми на неугрожающие жизни соматические ощущения у пациентов возникают гиперболизированные реакции. Несмотря на то что поведенческие методы психотерапии при лечении панического расстройства в настоящее время считаются наиболее эффективными, необходимо учитывать, что, позитивно влияя на симптоматику заболевания, они могут оставить незатронутыми невротические структуры, сформированные в детстве. Это, в свою очередь, может положить конец начальным успехам лечения и привести к появлению новых симптомов или к возобновлению старых. Таким образом, видна необходимость изучения эффективности других видов психотерапии и применения их для лечения панического расстройства.
В отделении неврозов и психотерапии НИПНИ им. В. М. Бехтерева в течение ряда лет для лечения панических расстройств с успехом применяется индивидуальная и групповая личностно ориентированная (реконструктивная) психотерапия, основной целью которой является достижение позитивных личностных изменений (коррекция нарушенной системы отношений, неадекватных когнитивных, эмоциональных и поведенческих стереотипов), что ведет как к улучшению субъективного самочувствия пациента и устранению симптоматики, так и к восстановлению полноценного функционирования личности. Применение групповой формы психотерапии тем более оправдано, если при паническом расстройстве у пациентов зачастую возникает ограничительное поведение, социальная дезадаптация и нарушения в сфере межличностного функционирования. Однако, учитывая необходимость обеспечения психотерапевтической помощью всевозрастающего числа больных паническим расстройством, без повышения материальных затрат, но при сохранении степени эффективности лечебного воздействия, становится очевидной потребность в разработке и использовании краткосрочных групповых методов психотерапии. Сотрудниками отделения был разработан и апробирован метод групповой психотерапии, сочетающий в себе теоретические основы и принципы интерперсональной и личностно ориентированной (реконструктивной) психотерапии. Такая интеграция позволяет учитывать в лечебной работе факторы внутренней (интрапсихические механизмы) и внешней (психосоциальные факторы) детерминации функционирования личности, при этом психотерапевт получает возможность смещать акценты при анализе внутриличностных и межличностных проблем. В процессе психотерапии, ориентированной на коррекцию неадекватных интеракций, конфликтные отношения пациента утрачивают свой непременный и центральный характер. Это влечет за собой снижение интенсивности невротической симптоматики. Наблюдается уменьшение и внутриличностной проблематики, в частности за счет улучшения отношения к себе (повышения самооценки).
В нашем исследовании изучалась эффективность применения краткосрочной интерперсональной групповой психотерапии и индивидуальной личностно ориентированной (реконструктивной) психотерапии при лечении панических расстройств. Нами было обследовано 60 пациентов в возрасте от 18 до 51 года, из них 42 женщины и 18 мужчин. У всех пациентов было диагностировано паническое расстройство, согласно критериям МКБ-10. В зависимости от получаемого лечения все исследуемые были разделены на три группы: пациенты 1-й группы получали только медикаментозную терапию; у пациентов 2-й группы применялось комплексное лечение, включающее назначение фармакологических средств и проведение индивидуальной личностно ориентированной (реконструктивной) психотерапии; при лечении пациентов 3-й группы медикаментозная терапия использовалась в сочетании с краткосрочной интерперсональной групповой психотерапией. Медикаментозная терапия включала назначение в различных вариантах следующих препаратов: нейролептики — эглонил, атаракс, клопиксол; антидепрессанты — ремерон, леривон, коаксил, паксил; анксиолитики из класса бензодиазепинов — клоназепам, алпразолам.
С целью проверки эффективности использования предложенных методов лечения панических расстройств применялись клинический и экспериментально-психологический методы исследования. Методы экспериментально-психологического исследования включали в себя:
Экспериментально-психологические исследования проводились дважды — на диагностическом этапе до лечения и в последний день пребывания пациента в стационаре.
Предварительные данные, полученные в нашем исследовании, позволяют с достаточной степенью достоверности предположить, что сочетание лекарственной терапии с краткосрочной интерперсональной групповой психотерапией (3-я группа) дает снижение уровня симптоматики более быстрое, качественное и устойчивое, чем монотерапия лекарственными препаратами (1-я группа) или сочетание индивидуальной личностно ориентированной психотерапии с анксиолитиками (2-я группа) у пациентов с тревожно-паническими состояниями. Мотивация к лечению у пациентов 3-й группы формируется быстрее, готовность их к изменениям гораздо выше и проработка внутриличностных конфликтов качественнее, что обеспечивает более благополучный прогноз и меньшую частоту рецидивов. Сочетание психофармакотерапии и групповой интерперсональной терапии улучшает межличностное взаимодействие и в относительно короткие сроки повышает адаптивные способности пациентов, что очень важно в современных социально-экономических условиях.
Литература
М. В. Фурсова
НИПНИ им. В. М. Бехтерева, Санкт-Петербург
Многоликий Эглонил
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
НИИ психиатрии МЗ РФ, Москва
Б олее 20 лет Эглонил (генерическое наименование – сульпирид) находит широкое применение не только в психиатрии, но и в других областях медицины в связи с его разнообразными клиническими эффектами. Эглонил относится к группе атипичных нейролептиков, и поэтому в первые годы клинического изучения большинство исследований было направлено на определение его эффективности при психотических расстройствах. Однако накопление клинических данных выявило широкий спектр эффективности Эглонила, а также его важные отличия от классических нейролептиков. Во многом это связывается с фармакологическими свойствами Эглонила и его особым влиянием на дофаминовые рецепторы (O’Connor SE, Brown RA, 1982, Rich TD, 1984, 1999, 2001).
В отличие от типичных нейролептиков – антагонистов дофаминовых рецепторов (бутирофеноновых и фенотиазиновых производных), Эглонил является производным бензамида с селективной блокадой дофаминовых рецепторов (Rich TD, 1984). Ранее считалось, что Эглонил воздействует лишь на D2–рецепторы (Memo M, Battaini F, Spano PF et al, 1981, O’Connor SE, Brown RA, 1982), однако последние экспериментальные данные указывают также на блокаду D3 и D4–дофаминовых рецепторов.(Caley CF, Weber SS, 1995). Именно воздействие на D2 и сходные с ними D4–рецепторы признается в настоящее время основой антипсихотического эффекта нейролептиков (Wilson JM, Sanyal S et al., 1998, Emilien G, Maloteaux JM, Geurts M et al., 1999). Кроме того, Эглонил оказывает некоторое влияние на глутаматовые рецепторы, что сказывается на его фармакологических свойствах (Herrera–Marschitz M, Stahle L, Tossman U et al., 1984). Эглонил не влияет на адренергические, холинергические, гистаминергические и серотонинергические рецепторы, т.е. не вызывает соответствующих побочных действий. У Эглонила не выявлено активных метаболитов, а его выведение осуществляется преимущественно через почки. Отсутствие метаболизма в печени гарантирует отсутствие отрицательного влияния препарата на печень. В связи с преимущественным выделением с мочой Эглонил может накапливаться у больных с выраженной почечной недостаточностью (Barrett RJ, Ginos JZ, Lokhandwala MF,1982, Caley CF, Weber SS, 1995, Mauri MC, Bravin S, Bitetto A et al., 1996), что может вызывать побочные эффекты у этих пациентов.
В отличие от большинства других нейролептиков, при лечении Эглонилом отмечается повышение уровня пролактина в плазме крови – гиперпролактинемия (Rao VA, Bailey J, Bishop M et al., 1981, O’Connor SE, Brown RA, 1982).
Влияние Эглонила на продукцию пролактина исследовалось в разных терапевтических дозах. При этом было отмечено, что даже в минимальных дозах Эглонил существенно усиливает продукцию пролактина у здоровых испытуемых (McMurdo ME, Hovie PW, Lewis M et al., 1987). У мужчин выраженная гиперпролактинемия может вызывать гинекомастию, а также преходящую импотенцию и нарушение эякуляции (Buvat J, Racadot A, Buvat–Herbaut M, 1997), однако эти возможные последствия гиперпролактинемии, за исключением гинекомастии, не отмечаются в качестве побочных ни в одном из многочисленных клинических исследований Эглонила. В ряде исследований, проведенных в небольших группах женщин в послеродовом периоде, использование Эглонила предлагается для лечения недостаточности лактации. В качестве результата лечения указывается на значительно больший прирост в весе детей, матери которых получали Эглонил в малых дозах (150 мг/сут). При этом по сравнению с контрольной группой у женщин большее время сохранялась возможность грудного кормления (Ylikorkala O, Kauppila A, Kivinen S et al., 1982). Этот эффект был особенно значим у женщин, рожавших впервые (Aono T, Aki T, Koike K et al., 1982), а также при сравнении с эффектом окситоцина (Ylikorkala O, Kauppila A, Kivinen S et al, 1984). При этом не выявлялось каких–либо побочных эффектов как у матерей, так и у детей.
В последние годы наряду с широким изучением вовлеченности норадреналиновых и серотониновых рецепторов в патогенез расстройств депрессивного спектра, возрастает интерес к изучению роли дофаминовой системы. Так, в одном из исследований чувствительности дофаминовых рецепторов была выявлена значительно более выраженная реакция пролактина на введение Эглонила при депрессии, при сравнении с контрольной группой здоровых (Verbeeck WJ, Berk M, Paiker J et al., 2001). По мнению авторов, этот факт свидетельствует о вовлеченности дофаминовой системы в патогенез депрессии и предполагает, что эта система может становиться терапевтической мишенью при депрессивных расстройствах.
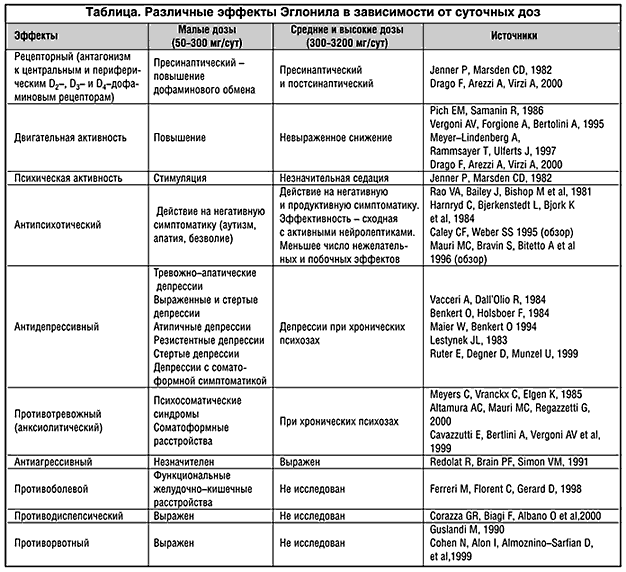
Следует отметить, что практически все исследования эффективности Эглонила подчеркивают существенные различия клинического действия малых и высоких суточных доз препарата. Различия терапевтических мишеней малых и высоких доз Эглонила объясняются в настоящее время их разным фармакологическим действием. Малые дозы, действуя на пресинаптические дофаминовые рецепторы и повышая дофаминовую нейротрансмиссию, помимо психомоторной стимуляции (Jenner P, Marsden CD, 1982), оказывают антидепрессивный (Vacceri A, Dall’Olio R, 1984, Benkert O, Holsboer F, 1984, Maier W, Benkert O 1994, Lestynek JL, 1983,Ruter E, Degner D, Munzel U, 1999), противотревожный (Meyers C, Vranckx C, Elgen K, 1985,Altamura AC, Mauri MC, Regazzetti G, 1990, Cavazzutti E, Bertlini A, Vergoni AV et al., 1999) и противоболевой (Ferreri M, Florent C, Gerard D, 1998 ) эффекты.
Эглонил в средних и высоких дозах, помимо антагонизма к пресинаптическим дофаминовым рецепторам, проявляет также антагонизм к постсинаптическим рецепторам, что сказывается в антипсихотическом эффекте препарата, свойственном всем нейролептикам – антагонистам дофамина. Однако двойное пре– и постсинаптическое действие средних и высоких доз Эглонила объясняет меньшую, сравнительно с некоторыми другими типичными нейролептиками, выраженность седации и моторного торможения (Jenner P, Marsden CD, 1982, Mauri MC, Bravin S, Bitetto A et al., 1996, Drago F, Arezzi A, Virzi A, 2000). В таблице приведены результаты некоторых клинических и экспериментальных исследований эффективности малых и высоких доз Эглонила.
Учитывая сходный с другими нейролептиками антипсихотический эффект средних и высоких доз Эглонила, наибольший интерес с нашей точки зрения представляет действие препарата в малых дозах. Известно, что Эглонил в малых терапевтических дозах активно используется в настоящее время при лечении широкого круга расстройств депрессивного спектра, соматоформных расстройств, а также некоторых функциональных соматических заболеваний не только в специализированной психиатрической, но и в общей медицинской практике.
Клинические исследования Эглонила при депрессивных расстройствах выявили его высокую эффективность при некоторых депрессивных расстройствах. Однако большинство авторов подчеркивало индивидуальную и мало прогнозируемую реакцию на лечение. Антидепрессивное действие Эглонила во многом связывалось с его психостимулирующим эффектом, проявляющимся прежде всего в уменьшении поведенческих и двигательных симптомов депрессии (Jenner P, Marsden CD, 1982) и в усилении влечений (Benkert O, Holsboer F, 1984), однако при этом даже в начале лечения не происходило усиления сопутствующих симптомов тревоги. Среди отрицательных свойств препарата авторы отмечали отсутствие профилактического эффекта при проведении поддерживающей терапии. В исследовании Lestynek JL (1983) также отмечалось, что в дозе 150 мг/сут Эглонил прежде всего уменьшает психомоторную заторможенность, что выявлялось на 5–й день лечения, а к 10–му дню прослеживался отчетливый антидепрессивный эффект у большинства (82%) обследованных пациентов
Высокая эффективность Эглонила выявлена также при хронической депрессии и дистимии, с положительным действием как на собственно симптомы депрессии, так и тревоги (Maier W, Benkert O, 1994). Это представляется одним из наиболее важных практических наблюдений, поскольку подтверждается эффективность Эглонила при затяжных тревожных депрессиях, наиболее распространенных сегодня в общей медицинской практике (WHO, 2000). При этом, однако, авторы отметили, что положительный эффект Эглонила был достаточно индивидуальным и рекомендовали проведение рандомизированных плацебо–контролированных исследований для выявления клинических предикторов эффективности препарата при хронических депрессиях.
В большом мультицентровом исследовании антидепрессивного действия Эглонила у 177 амбулаторных больных, проведенном в Германии (Ruther E, Degner D, Munzel U и др.,1999), выявлено значимое преимущество Эглонила в дозе 150–300 мг/сут при сравнении с плацебо в лечении депрессий легкой и умеренной выраженности. Результаты исследования показали, что нежелательные эффекты встречались со сходной частотой в обеих группах, однако отмечена их большая выраженность в группе больных, получавших плацебо. Лишь у 50% больных депрессией отмечалось повышение уровня пролактина выше нормальных значений. Это исследование, помимо наиболее важного результата – подтверждения наличия антидепрессивного эффекта, отметило безопасность назначения Эглонила в амбулаторной практике.
Исследования эффективности Эглонила при соматоформных расстройствах, часто встречающихся не столько в психиатрической, сколько в общей медицинской практике, и нередко трудно поддающихся лечению, выявили положительный эффект препарата, связанный с его многосторонним действием.
В сравнительном исследовании эффективности Эглонила и флупентиксола при разнообразных соматоформных расстройствах, включая психогенные головные боли, боли в области сердца, функциональные расстройства толстого кишечника (Meyers C, Vranckx C, Elgen K, 1985), выявлен положительный эффект в течение 4–х недель лечения 55 пациентов. При этом не было выявлено значимых различий в эффективности и наличии побочных эффектов у обоих препаратов. При лечении соматоформных расстройств Эглонилом отмечалось быстрое улучшение состояния больных, начиная уже с первой недели лечения c редукцией тревоги, ипохондрических фиксаций и сомато–вегетативных нарушений без выраженных побочных эффектов (Altamura AC, Mauri MC, Regazzetti G, 2000).
В крупном мультицентровом исследовании эффективности Эглонила при болевом синдроме (боли в животе психологической природы у 669 больных), проведенном во Франции (Ferreri M, Florent C, Gerard D, 2000), выявлено несколько положительных эффектов препарата. В течение 6–ти недель лечения Эглонилом в дозе 150 мг/сут у 91% пациентов значительно снизилась интенсивность болей, а у 89% – частота болевого синдрома. Кроме того, наряду с уменьшением выраженности тревоги, уменьшались и сопутствующие функциональные желудочно–кишечные симптомы – нормализовалась двигательная функция толстого кишечника, редуцировалась тошнота и рвота, улучшился аппетит.
Как показывает анализ современных клинических исследований эффективности Эглонила при депрессивных и соматоформных расстройствах, несмотря на выявление некоторых эффектов препарата, выделение специфики его действия требует дальнейшей разработки. В этой связи рассмотрение результатов некоторых экспериментальных нейропсихологических исследований дофаминовой системы может быть использовано для клинических сопоставлений. В последние годы было показано, что дофамин вовлечен в формирование связей между внешними стимулами и последующим вознаграждением или фрустрацией. Активация дофаминовой системы способствует обучению распознавания естественных стимулов и выделению побудительных мотивов, вызывающих желания (Schultz W., 1997, Spanagel R., Weiss F., 1999). При этом, однако, эта система не затрагивает гедонизма – получения удовольствий и таким образом не связана с патогенезом ангедонии – одного из центральных признаков типичной депрессии (Berridge KC, Robinson TE, 1998). На основании этих результатов можно предположить, что нарушение дофаминового обмена приводит к снижению побуждений, то есть к развитию атипичных симптомов апатического диапазона. Поэтому, по–видимому, наиболее выраженный антидепрессивный эффект Эглонил в малых терапевтических дозах проявляет при апатических и тревожно–апатических депрессиях, при которых снижение мотиваций и побуждений, сопровождающееся соматоформной ипохондрической и конверсионной симптоматикой, является основой расстройства.
В экспериментальных психофизиологических исследованиях депрессии были получены косвенные подтверждения этим наблюдениям. Оказалось, что антидепрессивный эффект Эглонила в малых дозах проявляется прежде всего на поведенческом уровне в виде повышения активности. При этом зглонил не оказывает влияния на поведение в других экспериментальных моделях депрессии (Vaccheri A, Dall’Ollo R, Gaggi R и др., 1984, Vergoni AV, Forgione A, Bertolini A, 1995, Drago F, Arezzi A, Virzi A, 2000).
Другим косвенным подтверждением является исследование влияния Эглонила (100 мг), бромокриптина и плацебо на ЭЭГ (Fm–тета активность) и выраженность тревоги, проведенное у 24 здоровых студентов (Mizuki Y. Suetsugi M, Ushijima I и др.,1997). Это исследование позволило авторам высказать предположение о зависимости чувствительности пресинаптических дофаминовых D2–рецепторов (терапевтической «мишени» малых, антидепрессивных доз Эглонила) от личностной тревожности. Эта чувствительность оказалась значительно выше у тревожных личностей, а противотревожный эффект препарата был связан с понижением активности рецепторов. При низкой личностной тревожности, что характерно, в частности, для пациентов с апатической депрессией, отмечалось снижение чувствительности D2–рецепторов, а противотревожное действие малых доз Эглонила было связано с ее повышением. Эти результаты не имеют подтверждения в других, в частности, в клинических исследованиях, однако стимулируют дальнейшие поиски индивидуальных факторов прогноза эффективности лечения разнородных по своему патогенезу депрессивных и тревожных расстройств.
Положительный эффект Эглонила при соматоформных расстройствах, особенно при локализации симптомов в области желудочно–кишечного тракта, объясняется блокадой не только центральных дофаминовых рецепторов, что приводит к уменьшению симптомов тревоги и депрессивной симптоматики, но и периферических рецепторов, что сказывается в нормализации моторной активности желудка, кишечника и желчного пузыря (Barrett RJ, Ginos JZ, Lokhandwala MF, 1982, Guslandi M,1990). Показано также, что Эглонил, как и другие противодофаминовые препараты, значимо снижает секреторную функцию желудка, но не влияет на базальную или стимулированную желудочную кислотность. Этот эффект с различным успехом используется в терапии язвы желудка (Caldara R, Masci E, Cambielli M и др.,1983, 2000).
Как показали результаты ряда исследований, периферический эффект Эглонила на дофаминовые рецепторы может широко использоваться при органической и функциональной диспепсии, гастродуодените, гепатите, а также для профилактики тошноты и рвоты при проведении химиотерапии и в предоперационном периоде (Guslandi M,1990, Cohen N, Alon I, Almoznino–Sarfian D и др.,1999).
Исследование эффективности левосульпирида (одного из изомеров Эглонила (сульпирида), обладающего большей периферической активностью) при функциональной диспепсии, было проведено итальянскими гастроэнтерологами (Corazza GR, Biagi F, Albano O и др, 2000). В течение 4–х недель лечения большой группы больных отмечалась нормализация подвижности желудочно–кишечного тракта, уменьшение тошноты и рвоты, вздутия кишечника, регургитации, эпигастральных болей. Достаточно редко встречались нежелательные эффекты терапии в виде галактореи и нарушений менструального цикла.
Следует особо отметить исследование эффективности левосульпирида при диабетическом парезе желудка (Mansi C, Savarino V, Vigneri S и др.,1995) и желчного пузыря (Mansi C, Savarino V, Vigneri и др.1995). Известно, что при хронической гипергликемии существенно страдает подвижность желудка и желчного пузыря. На основании положительных результатов исследования авторы отмечают, что при нормализации подвижности желудка и желчного пузыря в процессе лечения левосульпиридом достигается лучший контроль концентрации сахара крови. Сходные результаты, подтверждающие усиление моторной активности желчного пузыря, были получены при назначении Эглонила при язве двенадцатиперстной кишки (Szabelska K, Chojnacki J, Grzegorczyk и др., 1999).
Таким образом, разнообразные клинические эффекты Эглонила (сульпирида) объясняются следующими причинами:
1. Селективной блокадой дофаминовых (D2 D3 и D4) рецепторов, что определяет его специфические свойства атипичного нейролептика с минимальными побочными и нежелательными действиями.
2. Различным действием малых (50–300 мг/сут) и более высоких (300–3200 мг/сут) доз Эглонила на пресинаптические и постсинаптические дофаминовые рецепторы. Это различие объясняет проявление атипичного антидепрессивного, противотревожного или анксиолитического (малые дозы) и атипичного нейролептического (высокие дозы) эффекта Эглонила.
3. Как центральной, так и периферической блокадой дофаминовых рецепторов. Наличие периферического действия препарата на дофаминовые рецепторы объясняет его эффективность при некоторых соматоформных, а также функциональных соматических заболеваниях желудочно–кишечного тракта.
1. O’Connor SE, Brown RA. The pharmacology of sulpiride – a dopamine receptor antagonist. Gen. Pharmacol., 1982, 13, 185–193
2. Rich TD. Sulpiride: assessment of a pharmacologically and chemically distinct neuroleptic. Med. Hypotheses, 1984, 5, 14, 69–81
3. Memo M, Battaini F, Spano PF et al. Sulpiride and the role of dopaminergic receptor blockade in the antipsychotic activity of neuroleptics. Acta Psychiatr. Scand.,1981, 4, 63, 314–324
4. Caley CF, Weber SS. Sulpiride: an antipsychotic with selective dopaminergic antagonist properties. Ann Pharmacother.,1995, 2, 29, 152–160
5. Wilson JM, Sanyal S, Van Tol H. Dopamine D2 and D4 receptor ligands: relation to antipsychotic action. Eur. J. Pharmacol., 1998, 351, 3, 273–286
6. Emilien G, Maloteaux JM, Geurts M et al. Dopamine receptors – physiological understanding to therapeutic intervention. Pharmacol and Therapeutics, 1999, 84, 2, 133–156
7. Herrera–Marschitz M, Stahle L, Tossman U et al. Behavioural and biochemical studies with the benzamide sulpiride in rats. Acta Psychiatr. Scand. Suppl, 1984, 311, 147–162
8. Barrett RJ, Ginos JZ, Lokhandwala MF, Evaluation of peripheral dopamine receptor and alpha–adrenoceptor blocking activity of sulpiride. Eur. J. Pharmacol.,1982, 4, 79, 273–281
9. Mauri MC, Bravin S, Bitetto A et al. A risk–benefit assessment of sulpiride in the treatment of schizophrenia. Drug Saf., 1996, 5, 14, 288–298
10. Soares BG, Fenton M, Chue P. Sulpiride for schizophrenia. Cohrane Database Syst.Rev., 2000, Issue 2
11. Munk–Andersen E, Behnke K, Heltberg J et al. Sulpiride versus haloperidol, a clinical trial in achizophrenia. A preliminary report. Acta Psychiatr. Scand. Suppl., 1984, 311, 31–41
12. Shiloh R, Zemishlany Z, Aizenberg D et al. Sulpiride augmentation in people with schizophrenia partially responsive to clozapine. A double–blind, placebo–controlled study. Br.J.Psychiatry,1997,12, 171, 569–573
13. Raskin S, Durst R, Katz G et al. Olanzapine and sulpiride: a preliminary study of combination/augmentation in patients with treatment–resistant achizophrenia. J.Clin.Psychopharmacol.,2000, 20, 500–503
14. Harnryd C, Bjerkenstedt L, Bjork K, et al. Clinical evaluation of sulpiride in schizophrenic patients – a double–blind comparison with chlorpromazine. Acta Psychiiatr. Scand. Suppl.,1984, 311, 7–30
15. Jenner P, Marsden CD. The mode of action of sulpiride as an atypical antidepressant agent. Adv. Biochem. Psychopharmacol.,1982, 32, 85–103
16. Barfai A, Wiesel FA. Effect of sulpiride on vigilance in healthy subjects. Int.J.Psychophysiol., 1986, 4, 1–5
17. Meier–Lindenberg A, Rammsayer T, Ulferts J et al. The effect of sulpiride on psychomotor performance and subjective tolerance. Eur. Neuropsychopharmacol.,1997, 7, 219–223
18. Rao VA, Bailey J, Bishop M et al., A clinical and pharmacodynamic evaluation of sulpiride. Psychopharmacology,1981, 73, 77–80
20. Buvat J, Racadot A, Buvat–Herbaut M. Basal prolactinaemia and responses to TRH and to sulpiride in different categories of male sexual dysfunctions. Acta Psychiatr. Belg.,1997, 80, 487–493
21. Ylikorkala O, Kauppila A, Kivinen S et al. Sulpiride improves inadequate lactation. Br. Med. J., 1982, 7, 285, 249–251
22. Aono T, Aki T, Koike K et al. Effect of sulpiride on poor puerperal lactation. Am.J. Obstet. Gynecol.,1982, 8, 143, 927–932
23. Ylikorkala O, Kauppila A, Kivinen S et al. Treatment of inadequate lactation with iral sulpiride and buccal oxytocin. Obstet. Gynecol, 1984, 1, 63, 57–60
24. Verbeeck WJ, Berk M, Paiker J et al. The prolactin response to sulpiride in major depression: the role of the D(2) receptor in depression. Eur. Neuropsychopharmacol., 2001, 6, 11, 215–220
25. Vacceri A, Dall’Olio R, Gaggi R, et al. Antidepressant versus neuroleptic activities of sulpiride isomers on four animal models of depression. Psychopharmacology (Berl),1984, 83, 28–33
26. Benkert O, Holsboer F. Effect of sulpiride in endogenous depression. Acta Psychiatr. Scand. Suppl, 1984, 311, 43–48
27. Maier W, Benkert O, Treatment of chronic depression with sulpiride: evidence of efficacy in placebo–controlled single case studies. Psychopharmacology (Berl),1994, 8, 115, 495–501
28. Lestynek JL. Sulpiride and depression. Sem. Hop., 1983, 59, 2354–2357
29. Ruter E, Degner D, Munzel U. Antidepressant action of sulpiride. Results of a placebo–controlled double–blind trial. Pharmacopsychiatry,1999, 32,127–135
30. Meyers C, Vranckx C, Elgen K. Psychosomatic disorders in general practice: comparisons of treatment with flupentixol, diazepam and sulpiride. Pharmacotherapeutica,1985, 4, 244–250
31. Altamura AC, Mauri MC, Regazzetti G. L–sulpiride in the treatment of somatoform disturbances: a double–blind study with racemic sulpiride. Minerva Psichiatr.,2000, 32, 25–29
32. Cavazzutti E, Bertlini A, Vergoni AV et al. L–Sulpiride at a low, non–neuroleptic dose, prevents conditioned fear stress–induced fresing behavior in rats. Psychopharmacology (Berl),1999, 3, 143, 20–23
33. Ferreri M, Florent C, Gerard D, Sulpiride: study of 669 patient presenting with pain psychological origin. Encephale, 2000, 26, 58–66
34. Drago F, Arezzi A, Virzi A. Effects of acute or chronic administration of substituted benzamides in experimental models of depression in rats. Eur. Neuropsychopharmacology, 2000, 10, 437–442
35. WHO Guide to Mental Health in Primary Care. London: Royal Society of Medicine Press, 2000
36. Schultz W. Dopamine neurons and their role in reward mechanisms. Current Opinion in Neurobiology, 1997, 7, 191–197
37. Spanagel R., Weiss F. The dopamine hypothesis of reward: past and current status. Trnds in Neurosciences,1999, 22, 521–527
38. Berridge KC, Robinson TE. What is the role of dopamine in reward: hedonic impact, reward learning or ince salience? Brain Res.Rev,1998, 28, 3, 309–369
39. Vergoni AV, Forgione A, Bertolini A. Chronic administration of I–sulpiride at non–neuroleptic doses reduces the duration of immobility in experimental models of «depression–like» behavior. Psychopharmacology (Berl),1995, 121, 279–281
40. Mizuki Y. Suetsugi M, Ushijima I et al. Differential effects of dopaminergic drugs on anxiety and arousal in healthy volunteers with high and low anxiety. Prog. Neuropsychopharmacol. Biol. Psychiatry, 1997, 21, 573–590
41. Guslandi M. Antiemetic properties of levo–sulpiride. Minerva Med.,1990, 12, 81, 855–860
42. Caldara R, Masci E, Cambielli M et al. Effect of sulpiride isomers on gastric acid and gastrin secretion in healthy man. Eur.J.Clin.Pharmacol.,1983, 25, 319–322
43. Cohen N, Alon I, Almoznino–Sarfian D et al. Sulpiride versus metoclopramide in nononcologic patiets with vomiting and nausea. J.Clin. Gastroenterol.1999, 7, 29, 59–62
44. Corazza GR, Biagi F, Albano O et al. Levosulpiride in functional dyspepsia: a multicentric, double–blind, controlled trial. Ital. J. Gastroenterol.,2000, 28, 317–323
45. Mansi C, Savarino V, Vigneri S et al. Gastrocinetic effects of levosulpiride in dyspeptic patients with diabetic gastroparesis. Am.J. Gastroenterol., 1995, 11, 90, 1989–1993
46. Mansi C, Savarino V, Vigneri S et al. Effect of D2–dopamine raceptor antagonist levosulpiride on diabetic cholecystoparesis: a double–blind crossover study. Aliment. Pharmacol. Ther.,1995, 4, 9, 185–189
47. Szabelska K, Chojnacki J, Grzegorczyk J et al. Effect of procinetic drugs inhibiting dopaminergic system on gallbladder motility in subjects with duodenal ulcer. Pol. Merkuriusz. Lek., 1999, 6, 188–191
48. Pich EM, Samanin R., Disinhibitory effects of buspirone and low doses of sulpiride and haloperidol in two experimental anxiety models in rats: possible role of dopamine. Psychopharmacology (Berl), 1986, 89, 125–130