Что лучше гептор или эссенциале форте что
Что лучше: Гептор или Эссенциале форте Н
Гептор
Эссенциале форте Н
Исходя из данных исследований, Эссенциале форте Н лучше, чем Гептор. Поэтому мы советуем выбрать его.
Но не забывайте, что у данных препаратов в составе разные активные вещества. Поэтому обязательно проконсультируйтесь с врачом. Возможно, какой-то из них может не подойти для вашей терапии.
Сравнение эффективности Гептора и Эссенциаля фортя Н
Эффективность у Гептора достотаточно схожа с Эссенциалем фортем Н – это означает, что способность лекарственного вещества оказывать максимально возможное действие схоже.
Например, если терапевтический эффект у Гептора более выраженный, то при применении Эссенциаля фортя Н даже в больших дозах не получится добиться данного эффекта.
Также скорость терапии – показатель быстроты терапевтического действия у Гептора и Эссенциаля фортя Н примерно одинаковы. А биодоступность, то есть количество лекарственного вещества, доходящее до места его действия в организме, схожа. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Гептора и Эссенциаля фортя Н
Безопасность препарата включает множество факторов.
При этом у Эссенциаля фортя Н она выше, чем у Гептора. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Эссенциаля фортя Н, также как и у Гептора мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Эссенциаля фортя Н рисков при применении меньше, чем у Гептора.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Эссенциаля фортя Н и Гептора.
Сравнение противопоказаний Гептора и Эссенциаля фортя Н
Исходя из инструкции. Количество противопоказаний у Гептора достаточно схоже с Эссенциалем фортем Н и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Гептора и Эссенциаля фортя Н может быть нежелательным или недопустимым.
Сравнение привыкания у Гептора и Эссенциаля фортя Н
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Гептора достаточно схоже со аналогичными значения у Эссенциаля фортя Н. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Гептора значения «синдрома отмены» и «резистентности» достотачно малое, впрочем также как и у Эссенциаля фортя Н.
Сравнение побочек Гептора и Эссенциаля фортя Н
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Гептора больше нежелательных явлений, чем у Эссенциаля фортя Н. Это подразумевает, что частота их проявления у Гептора низкая, а у Эссенциаля фортя Н низкая. Частота проявления – это показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано. Нежелательное влияние на организм, сила влияния и токсическое действие у препаратов разное: как быстро организм восстановиться после приема и восстановиться ли вообще. При применении Гептора возможность у организма восстановится быстрее выше, чем у Эссенциаля фортя Н.
Сравнение удобства применения Гептора и Эссенциаля фортя Н
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Гептора лучше, чем у Эссенциаля фортя Н.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-04 13:46:07
Современные возможности терапии хронического панкреатита
Хронический панкреатит — длительно протекающее воспалительное заболевание поджелудочной железы, проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции поджелудочной железы. При хроническом панкреатит
Хронический панкреатит — длительно протекающее воспалительное заболевание поджелудочной железы, проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции поджелудочной железы. При хроническом панкреатите морфологические изменения поджелудочной железы сохраняются после прекращения воздействия этиологического агента. В настоящее время распространенность хронического панкреатита, по данным аутопсий, составляет от 0,01 до 5,4%, в среднем — 0,3-0,4%, при этом за последние 40 лет заболеваемость выросла примерно в два раза, что связывают с тем, что население стало употреблять больше алкогольных напитков, а также с воздействием вредных факторов окружающей среды (см. диаграмму 1).
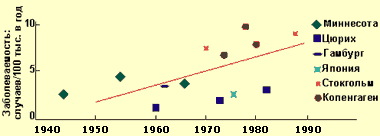 |
| Диаграмма 1. Заболеваемость ХП в 1945—1985 гг. (Worning H., 1990) |
В патогенезе хронического панкреатита важную роль играют несколько факторов. Одним из основных является обструкция главного панкреатического протока при конкрементах, воспалительном стенозе или опухолях. При алкогольном панкреатите повреждение поджелудочной железы связано с повышением содержания белка
в панкреатическом секрете, что приводит к возникновению белковых пробок и обструкции мелких протоков железы. Другим фактором, влияющим на патогенез алкогольного панкреатита, является изменение тонуса сфинктера Одди: его спазм вызывает внутрипротоковую гипертензию, а релаксация способствует рефлюксу дуоденального содержимого и внутрипротоковой активации панкреатических ферментов.
Разрушение экзокринной части поджелудочной железы вызывает прогрессирующее снижение секреции бикарбонатов и ферментов, однако клинические проявления нарушения переваривания пищи развиваются лишь при деструкции более 90% паренхимы органа. В первую очередь возникают проявления недостаточности липазы в виде нарушения всасывания жиров, жирорастворимых витаминов: A, D, E и K, что нечасто проявляется поражением костей, расстройствами свертывания крови. У 10–30% больных хроническим панкреатитом развивается сахарный диабет, обычно на поздних стадиях заболевания, нарушение толерантности в глюкозе наблюдается гораздо чаще. Для таких больных характерно развитие гипогликемических реакций на инсулин, недостаточное питание или злоупотребление алкоголем. Кетоацидоз развивается редко, что связано с одновременным снижением продукции инсулина и глюкагона.
Приступ хронического панкреатита проявляется иррадиирующими в спину болями в верхней половине живота, развивающимися после приема пищи, которые могут продолжаться в течение многих часов или нескольких дней. Нередко наблюдается тошнота, рвота, у 30–52% пациентов — снижение веса, у 16–33% — желтуха. Преходящая желтуха возникает вследствие отека железы при обострениях хронического панкреатита, постоянная — связана с обструкцией общего желчного протока вследствие фиброза головки поджелудочной железы. При разрывах протоков поджелудочной железы, на месте предыдущего некроза ткани происходит скопление секрета, что приводит к формированию псевдокист. Кисты могут быть бессимптомными или вызывать боли в верхней половине живота. При длительном течении заболевания, при уменьшении объема функционирующей паренхимы до 10% от нормы появляются признаки мальабсорбции (полифекалия, жирный стул, похудание).
В течении хронического панкреатита можно выделить несколько стадий (Lankisch P.G., Moessner Y.), умение различать которые важно для правильного подбора терапии. Так, на первой стадии заболевания клиническая симптоматика отсутствует: в этот период характерные для ХП изменения данных КТ или ЭРХПГ выявляются лишь при случайном обследовании.
На второй стадии возникают начальные проявления, характеризующиеся частыми эпизодами обострения ХП (которые могут быть ошибочно расценены как острый панкреатит). Заболевание видоизменяется от повторных приступов боли в животе до постоянных умеренных болей и похудания. С течением времени рецидивы становятся менее тяжелыми, но симптоматика сохраняется в периоды между приступами. На этой стадии может существенно ухудшаться качество жизни. Вторая стадия обычно продолжается на протяжении четырех—семи лет. Иногда заболевание быстро прогрессирует, развивается атрофия ПЖ, и нарушается функция органа.
У больных на третьей стадии постоянно присутствует симптоматика ХП, прежде всего — абдоминальная боль. Пациенты могут стать зависимыми от анальгетиков, значительно сокращают объем принимаемой пищи из-за опасения усиления боли. Появляются признаки экзокринной и эндокринной панкреатической недостаточности.
Особенность панкреатита на четвертой стадии — это атрофия ПЖ, развитие экзокринной и эндокринной недостаточности, что проявляется стеатореей, похуданием и сахарным диабетом. Снижается интенсивность боли, прекращаются острые приступы заболевания, могут развиваться тяжелые системные осложнения ХП и аденокарцинома поджелудочной железы.
Терапия панкреатита проводится по нескольким направлениям: отказ от употребления алкоголя; соблюдение диеты с низким содержанием жира (до 50–75 г/сут) и частым приемом небольших количеств пищи; купирование боли; ферментная заместительная терапия, борьба с витаминной недостаточностью; лечение эндокринных нарушений.
Лечение приступа хронического панкреатита, а также острого панкреатита проводиться по аналогичной схеме. Обязательные компоненты терапии: внутривенное введение растворов электролитов и коллоидов, голодная диета (полное голодание до двух дней) и анальгезия (например, меперидин). Рекомендуется введение свежезамороженной плазмы или альбумина. Диуретики не показаны большинству больных: олигурия разрешается при исчезновении гиповолемии и нормализации перфузии почек. Для облегчения рвоты, купирования пареза желудочно-кишечного тракта и уменьшения стимуляции поджелудочной железы может быть использована аспирация содержимого желудка через назогастральный зонд. Коагулопатия, возникающая при панкреатите, обычно требует назначения гепарина, свежей плазмы. В последние годы при остром панкреатите показана эффективность антагониста тромбоцит-активирующего фактора лексипафанта (60–100 мг/сут), однако его действие при хроническом панкреатите еще нуждается в уточнении.
Применение ингибиторов протеолитических ферментов (например, апротинина, габексата) является спорным. Исследования показывают, что при остром панкреатите не наблюдается дефицита ингибиторов протеаз, кроме того, проведенные клинические исследования не выявили преимуществ этих препаратов по сравнению с плацебо. Однако существуют данные, что габексат, низкомолекулярный ингибитор трипсина, эффективно используется для профилактики развития острого панкреатита, связанного с ЭРХПГ.
Ингибиторы секреции поджелудочной железы: глюкагон, соматостатин, кальцитонин, ингибиторы карбоангидразы, вазопрессин, изопреналин, также было предложено применять для лечения острого панкреатита, однако их эффективность к настоящему времени не получила достаточного подтверждения. Препараты пищеварительных ферментов можно использовать для лечения как в разгар заболевания с целью подавления панкреатической секреции, так и в период выздоровления, когда пациент снова получает возможность принимать пищу орально.
При билиарном обструктивном панкреатите должна быть проведена своевременная эндоскопическая декомпрессия желчных путей. Выполняется папиллосфинктеротомия, дилатация или стентирование панкреатического протока. Хирургическое лечение обструктивного панкреатита, безусловно, является основным методом, в то же время целесообразность проведения вмешательства в первые сутки после развития тяжелого приступа должна быть признана спорной. После стихания остроты воспаления целесообразно проведение холецистэктомии.
Схему длительной терапии при хроническом панкреатите можно разделить на две основные части, в соответствии с ведущими клиническими синдромами (см. диаграмму 2).
Боль могут облегчить большие дозы панкреатических ферментов. Попадание ферментов поджелудочной железы (прежде всего — трипсина) в двенадцатиперстную кишку по механизму отрицательной обратной связи вызывает снижение панкреатической секреции, снижение внутрипротокового давления и уменьшает боль. Традиционно для этой цели использовались порошок или таблетированные препараты панкреатина.
Если болевой синдром резистентен к терапии, при расширении главного протока более 8 мм, у 70–80% пациентов облегчение может принести латеральная панкреатоеюностомия. В случаях, когда панкреатический проток не расширен, показано проведение дистальной панкреатэктомии (при преимущественном поражении хвоста железы) или операция Уиппла (Whipple) (при поражении в основном головки железы). Альтернативой операции является чрезкожная денервация солнечного сплетения введением алкоголя, однако эффект этой процедуры сохраняется лишь в течение нескольких месяцев. Весьма перспективно эндоскопическое лечение под контролем эндоскопического УЗИ (дренирование псевдокист, невролиз солнечного сплетения).
Показаниями для заместительной терапии экзокринной панкреатической недостаточности являются исключительно клинические показатели: похудание, стеаторея, метеоризм. Классическая рекомендация, предусматривающая определение содержания жира в кале перед назначением лечения, в настоящее время потеряла свое значение из-за трудоемкости и низкой чувствительности данного метода. Для купирования внешнесекреторной панкреатической недостаточности используют различные препараты экстрактов поджелудочной железы (см. таблицу 1).
При выборе препарата для заместительной терапии следует учитывать следующие показатели:
Способность препарата активироваться только в щелочной среде — очень важное свойство, которое резко повышает эффективность ферментов; так, при использовании препарата, имеющего энтеросолюбильную оболочку, всасывание жиров повышается в среднем на 20% по сравнению с такой же дозой обычного средства. Однако при хроническом панкреатите происходит значительное снижение продукции бикарбонатов, что приводит к нарушению щелочной среды в двенадцатиперстной кишке. Это создает несколько проблем. Первая касается нарушения активации частиц ферментного препарата, покрытых энтеросолюбильной оболочкой. Вторая проблема заключается в том, что в кислой среде происходит преципитация желчных солей и нарушение эмульгации жира, что делает его малодоступным для расщепления липазой. Поэтому эффективность ферментной терапии (см. рисунок 1) может быть повышена благодаря одновременному назначению антацидов за 30 мин до и через 1 ч после еды или антисекреторных препаратов (Н2-блокаторы, омепразол), но необходимо помнить, что антациды, содержащие кальций или магний, ослабляют действие ферментных препаратов. Возможно использование препаратов, содержащих протеолитические ферменты растительного происхождения, которые сохраняют активность в гораздо более кислой среде, чем животные.
Значительное снижение качества жизни больного панкреатитом связано с такой проблемой, о которой обычно забывают, как стойкое вздутие живота. Нередко вздутие не купируется даже при приведении заместительной терапии высокими дозами ферментов. В этом случае к проводимой терапии необходимо добавить адсорбенты (симетикон, диметикон) или использовать комбинированные ферментные препараты, содержащие адсорбирующие вещества.
Разовая доза ферментов, которая рекомендуется для лечения внешнесекреторной панкреатической недостаточности, должна содержать не менее 20–40 тыс. ед. липазы. Обычно пациенту назначают две—четыре капсулы препарата (по 20—25 тыс. ед. липазы) при основных приемах пищи и по одной-две капсуле (по 8—10 тыс. ед. липазы) или таблетки панкреатина при употреблении небольшого количества пищи. При клинически выраженной панкреатической недостаточности обычно не удается полностью устранить стеаторею даже с помощью высоких доз препаратов, поэтому критериями адекватности подобранной дозы пищеварительных ферментов являются: прибавка веса, нормализация стула (менее трех раз в день), снижение вздутия живота.
Причины неэффективности заместительной терапии могут быть связаны как с неточной диагностикой заболевания, так и с неадекватным назначением терапии больному (см. рисунок 2).
Побочные эффекты ферментной терапии (см. рисунок 3) обычно не носят тяжелого характера, наиболее известный опасный побочный эффект — развитие фиброзирующей колопатии — возникает при длительном приеме очень высоких доз ферментов в виде микротаблеток: более 50 тыс. ед. липолитической активности на 1 кг веса тела в сутки.
Таким образом, терапия хронического панкреатита должна проводиться дифференцированно, в зависимости от ведущего клинического синдрома и стадии заболевания. Заболевание, которое удается обнаружить на первой стадии, как правило, не требует медикаментозной коррекции, в этом случае обычно достаточно изменения образа жизни и диетотерапии. Лечение ХП на второй стадии включает назначение таблетированного панкреатина, антисекреторных препаратов и спазмолитиков. Третья стадия обычно требует использования всего арсенала средств, которые имеются у врача для купирования панкреатической боли: микрогранулы панкреатина, антисекреторные препараты, октреотид, спазмолитики, мощные анальгетики, психотропные препараты. На последней, четвертой, стадии лечение основывается, прежде всего, на использовании микрогранул панкреатина в высокой дозе с целью проведения заместительной терапии.
По вопросам литературы обращайтесь в редакцию
А. В. Охлобыстин, кандидат медицинских наук
Э. Р. Буклис, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Лечение хронических холециститов
Болезни желчного пузыря и желчевыводящих путей составляют одну из важнейших медицинских и социальных проблем, так как во всем мире отмечается постоянный рост заболеваемости. Из года в год растет количество операций
Болезни желчного пузыря и желчевыводящих путей составляют одну из важнейших медицинских и социальных проблем, так как во всем мире отмечается постоянный рост заболеваемости. Из года в год растет количество операций на желчных путях, а также число послеоперационных осложнений, которые заставляют прибегать к повторным хирургическим вмешательствам и нередко приводят к стойкой потере трудоспособности больного.
Хронический бескаменный холецистит большинством авторов рассматривается как начальная стадия желчнокаменной болезни, так как при воспалительном процессе в желчном пузыре изменяется биохимическая структура желчи, и желчь приобретает литогенные свойства. Следовательно, раннее выявление и лечение хронического некалькулезного холецистита может служить профилактикой образования камней в желчном пузыре.
Основная роль в развитии хронических бескаменных холециститов отводится инфекции, которая попадает в желчный пузырь гематогенным путем по печеночной артерии и воротной вене, лимфогенным путем или восходящим путем из кишечника. Любой хронический очаг инфекции в организме (хронический тонзиллит, хронический сальпингоофорит, гайморит), также как и хронический воспалительный процесс в желудочно-кишечном тракте (ЖКТ), может быть источником поступления инфекции в желчь. При бактериологическом исследовании желчи чаще обнаруживают кишечную палочку, стафилококки, энтерококки, клебсиеллы, клостридии, тифозную и дизентерийные бактерии, протей. Однако только у 30–40% больных выявляется микрофлора в желчевыводящих путях, так как решающее значение в возникновении воспаления в желчных путях имеют сенсибилизация организма, снижение иммунологической реактивности макроорганизма.
Этиологическая роль вирусного гепатита в возникновении хронического холецистита в настоящее время не вызывает сомнения и, по литературным данным, такой вариант развития заболевания отмечается в 30% случаев. Описана роль паразитарной инвазии в двенадцатиперстной кишке и желчных путях (описторхоз, амебиаз, фасциолез, клонорхоз, лямблиоз), которая может способствовать активизации инфекции в желчном пузыре. Холецистит возникает и вследствие дисфункции желчных путей.
Билиарный тракт представляет собой сложную систему желчевыведения, включающую в себя общий печеночный проток, образующийся от слияния правого и левого печеночных протоков, желчный пузырь со сфинктером Люткенса, общий желчный проток, начинающийся от места соединения печеночного и пузырного протоков и ампулы большого сосочка двенадцатиперстной кишки.
При каждом приеме пищи желчный пузырь сокращается в 1–2 раза. Желчь при этом поступает в кишечник, где участвует в пищеварении. Желчный пузырь натощак содержит 30–80 мл желчи, однако при застое ее количество может увеличиваться.
У женщин желчный пузырь в состоянии функционального покоя имеет несколько больший объем, чем у мужчин, но сокращается быстрее. С возрастом сократительная функция желчного пузыря снижается.
Ведущая роль в возникновении дисфункциональных расстройств билиарного тракта принадлежит психоэмоциональным факторам — психоэмоциональным перегрузкам, стрессовым ситуациям. Дисфункции желчного пузыря и сфинктера Одди могут быть проявлениями невротических состояний.
Влияние психогенных факторов на функцию желчного пузыря и желчных путей реализуется с участием корковых и подкорковых образований, нервных центров продолговатого мозга, гипоталамуса, а также эндокринной системы.
Нарушения синхронности в работе желчного пузыря и сфинктерного аппарата лежат в основе дисфункциональных расстройств билиарного тракта и являются причиной формирования клинической симптоматики.
Нарушения двигательной функции билиарного тракта играют значительную роль в формировании не только болевого синдрома, но и диспепсических расстройств (чувство тяжести в эпигастрии и правом подреберье, рвота, изжога, отрыжка, горький привкус во рту, метеоризм, нарушения стула). Стенка желчного пузыря легко растяжима, что обусловлено наличием в средней ее оболочке как гладкомышечных, так и эластических волокон. Благодаря подобному строению стенки желчного пузыря происходит сокращение и всего органа, и его отдельных частей.
Моторная активность желчных путей регулируется с участием центральных рефлексов, локальных (гастродуоденальных) рефлексов, вызываемых механическим растяжением и воздействием компонентов пищи, и гуморальных влияний. Под действием этих регуляторных звеньев желчный пузырь сокращается, а сфинктер Одди расслабляется.
Важное место в регуляции функций желчевыделительной системы занимают гастроинтестинальные гормоны. При этом ведущая роль принадлежит холецистокинину, гастрину, секретину, мотилину, глюкагону.
Наиболее важным гуморальным стимулятором, обеспечивающим синхронное сокращение желчного пузыря и расслабление сфинктерного аппарата желчевыводящих путей в ответ на прием пищи, является холецистокинин. В настоящее время известно, что существует прямая связь через нервные волокна между двенадцатиперстной кишкой, с одной стороны, и желчным пузырем и сфинктером Одди — с другой, проводящая холинергическое возбуждение к нервным ганглиям желчного пузыря и сфинктера Одди.
Секретин, продуцируемый в двенадцатиперстной кишке, стимулирует секрецию воды, электролитов и бикарбонатов эпителием билиарных и панкреатических протоков и потенцирует эффекты холецистокинина.
Мотилин является важным гормоном, регулирующим моторику ЖКТ. Введение мотилина вызывает уменьшение объема желчного пузыря и усиление сократимости антрального отдела желудка.
К нейромедиаторам, вызывающим расслабление гладкомышечных клеток желчевыводящих путей, относятся вазоактивный интестинальный пептид (ВИП) и оксид азота (NO), вырабатывающийся под действием фермента NO-синтетазы. ВИП внутри мышечных клеток стимулирует повышение уровня циклической аденозинмонофосфорной кислоты, a NO — повышает уровень циклической гуанидинмонофосфорной кислоты. ВИП и NO взаимно усиливают продукцию друг друга.
В регуляции сокращения гладкой мускулатуры желчного пузыря определенную роль играет норадреналин, который выделяется симпатическими постганглионарными волокнами и, действуя пресинаптически на вагусные нервные окончания в ганглиях желчного пузыря, уменьшает выделение ацетилхолина из вагусных нервных окончаний.
В настоящее время термин «дисфункциональные расстройства билиарного тракта», согласно классификации функциональных расстройств органов пищеварения, включает в себя все заболевания, связанные с нарушением моторики билиарного тракта независимо от их этиологии. Согласно классификации функциональных расстройств ЖКТ, выделяют дисфункцию желчного пузыря и дисфункцию сфинктера Одди.
Употребление большого количества жирной и жареной пищи может вызвать спазм сфинктера Одди и Люткенса, а также нарушение метаболизма холестерина и желчных кислот, что предрасполагает к развитию холецистита.
К дисфункции желчевыводящих путей, развитию гипотонии и атонии сфинктера Одди, способствующих рефлюксу содержимого двенадцатиперстной кишки в желчевыводящие пути, приводит длительный прием холинолитиков и спазмолитиков с образованием «фармакологических» холестазов, а также дуоденостаз. Поэтому при язвенной болезни с локализацией процесса в луковице двенадцатиперстной кишки часто наблюдаются изменения со стороны желчевыводящих путей. Помимо моторно-секреторных расстройств в системе желчного пузыря и желчных путей, инфекции и нарушений процессов метаболизма в организме, в генезе развития холециститов имеют значение и некоторые другие факторы: генетическая предрасположенность, профессиональные вредности (работа с вибрацией, сидячая работа) и повторные беременности.
Изменения в химическом составе желчи (дискриния) в виде увеличения концентрации солей желчных кислот могут вызвать асептическое воспаление желчного пузыря. Доказано значение рефлюкса сока поджелудочной железы, являющегося следствием нарушения физиологических механизмов фатерова сосочка при общей ампуле для выводных протоков печени и поджелудочной железы, в желчевыводящие пути в генезе холецистита. При свободном оттоке в двенадцатиперстную кишку панкреатического сока изменений в желчном пузыре не выявляется, но при нарушении оттока и нарастании гипертензии в желчевыводящей системе растяжение желчного пузыря приводит к изменению нормального капиллярного кровотока в стенке пузыря. Это вызывает нарушение тканевого обмена, повреждение клеточных элементов и выделение цитокиназы, которая переводит трипсиноген в трипсин, что приводит к развитию ферментативных холециститов.
Желчнокаменная болезнь — многофакторное и многостадийное заболевание, характеризующееся нарушением обмена холестерина, желчных кислот и/или билирубина с образованием камней в желчном пузыре и/или желчных протоках.
В приведенной классификации желчнокаменной болезни выделены четыре стадии заболевания (А. А. Ильченко, 2002).
I, стадия начальная или предкаменная:
а) густая неоднородная желчь;
б) формирование билиарного сладжа
– с наличием микролитов;
– с наличием замазкообразной желчи;
– сочетание замазкообразной желчи с микролитами.
II, стадия формирования желчных камней:
– в общем желчном протоке;
– в печеночных протоках;
б) по количеству конкрементов
г) по клиническому течению
– с наличием клинических симптомов:
III, стадия хронического рецидивирующего калькулезного холецистита.
IV, стадия осложнений.
Таким образом, механизм развития холециститов сложен, многообразен, зачастую действуют несколько факторов, приводящих к заболеванию желчевыводящих путей.
Патогенетическая терапия холециститов ставит перед собой задачу снять воспалительный процесс в стенке желчного пузыря, нормализовать процессы желчеобразования и желчевыделения, предупредить образование камней. Учитывая важную роль в этом процессе фактора питания, лечение предполагает прежде всего частое, дробное питание. Прием небольшого количества пищи в одни и те же часы нормализует холерез, способствует лучшему оттоку желчи в кишечник и препятствует развитию холестаза. Однократный прием пищи в больших количествах может привести к интенсивному сокращению желчного пузыря и развитию желчной колики. Следовательно, целесообразным следует признать питание небольшими порциями 4–5 раз в день.
В связи с тем, что при воспалительном процессе в желчном пузыре происходит сдвиг рН в кислую сторону (ацидоз желчи), что способствует выпадению холестерина в виде кристаллов и изменению соотношения желчных кислот в сторону холестерина (холато-холестериновый коэффициент), в питании следует резко ограничить или исключить продукты, содержащие кислые валентности. Это прежде всего мучные, пряные блюда, мясо, рыба, мозги и др.
Содержание белков в диете больных холециститом должно соответствовать физиологической норме 80– 90 г в день. Богатые белком продукты — творог, молоко и сыр — вызывают сдвиг реакции желчи в щелочную сторону. Следует учитывать, что пища, бедная белками, ведет к развитию жировой дистрофии печени, нарушению процесса репарации и регенерации, нарушению синтеза многих ферментов и гормонов. Все это свидетельствует о том, что длительное ограничение потребления белка у больных хроническим холециститом не обосновано.
Жиры стимулируют желчеотделение, и основная масса больных не нуждается в их ограничении. Однако животные жиры богаты холестерином, и их следует ограниченно потреблять больным хроническим холециститом. При недостаточном поступлении желчи в кишечник жиры плохо расщепляются, что приводит к раздражению слизистой оболочки кишки и появлению диареи. Показано, что диеты с увеличенным количеством жира за счет растительного масла оказывают положительное влияние на липидный комплекс желчи, желчеобразование и желчевыделение. Рекомендуется липотропно-жировая диета с соотношением животных и растительных жиров 1:1. Следует также помнить, что растительные масла (кукурузное, подсолнечное, оливковое) благодаря содержанию в них ненасыщенных жирных кислот — арахидоновой, линолевой, линоленовой — улучшают обмен холестерина, участвуют в синтезе простагландинов (арахидоновая кислота), влияют на моторику желчного пузыря. Жиры повышают обмен жирорастворимых витаминов, особенно витамина А.
Углеводы, особенно легкоусвояемые (сахар, глюкоза, мед, варенье), которые раньше рекомендовались с целью повышения гликогенизации печени, следует ограничить, особенно при избыточной массе тела. Было доказано, что запасы гликогена уменьшаются только при массивном некрозе печени. Включение большого количества легкоусвояемых углеводов может усилить липогенез и тем самым увеличить вероятность образования желчных камней. Поэтому употребление мучных и сладких блюд следует ограничить. Диета должна быть богата растительной клетчаткой, которая устраняет запоры, а это рефлекторно улучшает опорожнение желчного пузыря. В рацион следует включить морковь, тыкву, арбузы, дыни, виноград, пшеничные и ржаные отруби. При оксалатурии и фосфатурии следует ограничить помидоры, щавель, шпинат, редиску. Содержание углеводов в первую неделю обострения холецистита должно составлять 250–300 г, со второй недели повышаться до 350 г, но доля простых сахаров должна составлять не более 50– 100 г в день.
Таким образом, при обострении хронического холецистита в первую неделю калорийность пищи составляет 2000 калорий, в дальнейшем при стихании воспалительного процесса калорийность можно повысить до 2500 калорий.
Полноценный витаминный состав пищи является необходимым условием диетотерапии хронических холециститов. Следует включать в рацион продукты, содержащие липотропные факторы: овсяную и гречневую крупы, творог, сыр, треску, соевые продукты. Большое значение имеет кулинарная обработка пищи. В период обострения назначают щадящий вариант диеты — стол № 5а, предусматривающий ограничение механических и химических раздражителей. В период ремиссии основным диетическим режимом является диета № 5, в которой исключаются продукты, богатые холестерином и экстрактивными веществами, острые закуски, соленые, копченые и жареные продукты. Общая калорийность диеты соответствует физиологической норме — 2500 калорий (90 г белка, 85 г жира, 350 г углеводов).
Основой медикаментозного лечения хронических холециститов является противовоспалительная терапия. Для подавления инфекции в желчных путях широко используются антибиотики. Выбор антибактериального препарата зависит от индивидуальной переносимости и от чувствительности к антибиотику микрофлоры желчи. Наиболее эффективными являются антимикробные препараты группы фторхинолонов — норфлоксацин (нолицин, норбактин, гираблок) по 0,4 г 2 раза в сутки, офлоксацин (таривид, заноцин) по 0,2 г 2 раза в сутки, ципрофлоксацин (ципробай, ципролет, цифран) по 0,5 г 2 раза в сутки, левофлоксацин (таваник, лефокцин) по 0,5 г 2 раза в сутки; макролиды — эритромицин по 0,25 г 4 раза в сутки, азитромицин (сумамед, азитрокс, азитрал) по 0,5 г 1 раз в сутки, кларитромицин (клацид, клабакс, клеримед) по 0,5 г 2 раза в сутки, рокситромицин (рулид, роксид, роксолид) по 0,1 г 2 раза в сутки, мидекамицин (макропен) по 0,4 г 2 раза в сутки и полусинтетические тетрациклины — доксациклин (вибрамицин, юнидокс солютаб, медомицин) по 0,1 г 2 раза в сутки, метациклин по 0,15 г 4 раза в сутки. Можно применять полусинтетические пенициллины: ампициллин по 0,5 г 4 раза в сутки, оксациллин по 0,5 г 4 раза в сутки, ампиокс по 0,5 г 4 раза в сутки — хотя они менее активны. В тяжелых случаях — цефалоспорины (кетоцеф, цефобид, клафоран, цефепим, роцефин). Предпочтительнее пероральный путь приема антибиотика, дозы обычные терапевтические, курс лечения — 7–8 дней, возможно повторение курса с другими антибиотиками через 3–4 дня. Коррекция антибактериальной терапии проводится после получения посева желчи на микрофлору и определения ее чувствительности к антибиотику.
При отсутствии чувствительности микрофлоры желчи к антибиотикам или наличии аллергии к ним рекомендуется ко-тримаксозол (бисептол, бактрим) по 2 таблетки 2 раза в сутки, хотя его эффективность значительно ниже, чем у антибиотиков, а неблагоприятное влияние на печень — выше. Хороший эффект дает применение нитрофурановых препаратов — фуразолидона, фурадонина, а также метронидозола (по 0,5 г 3 раза в сутки в течение 7–10 дней).
При выраженном болевом синдроме с целью уменьшения спазма сфинктера Одди и сфинктера Люткенса, при дисфункциях желчного пузыря по гипермоторному типу показаны спазмолитические средства. Существует несколько групп спазмолитиков, различающихся по механизму действия.
В качестве спазмолитиков используют как селективные (метацин, гастроцепин), так и неселективные М-холиноблокаторы (бускопан, платифиллин). Однако при приеме данной группы препаратов может наблюдаться ряд побочных эффектов (сухость во рту, задержка мочеиспускания, нарушения зрения, тахикардия, запоры). Сочетание довольно низкой эффективности данной группы препаратов с широким спектром побочных эффектов ограничивает применение этой группы лекарственных средств.
Спазмолитики прямого действия, такие как папаверин, дротаверин (но-шпа), эффективны для купирования спазмов. Однако для них не характерна избирательность действия, так как они влияют на все ткани, где присутствуют гладкие мышцы, в том числе на сосудистую стенку, и вызывают вазодилатацию.
Значительно более выраженной антиспастической активностью обладает мебеверина гидрохлорид (дюспаталин), который также оказывает прямое миотропное действие, однако он имеет ряд преимуществ перед другими спазмолитическими средствами. Он почти селективно расслабляет гладкие мышцы пищеварительного тракта, не влияет на гладкомышечную стенку сосудов и не имеет системных эффектов, свойственных холинолитикам. По механизму действия дюспаталин является блокатором натриевых каналов. Препарат обладает пролонгированным действием, и принимать его следует не чаще 2 раз в сутки в виде капсул по 200 мг.
К миотропным спазмолитикам относится пинаверия бромид (дицетел). Основной механизм его действия заключается в селективной блокаде кальциевых каналов, расположенных в клетках гладкой мускулатуры кишечника, желчевыводящих путей и в периферических нервных окончаниях. Дицетел назначают по 100 мг 3 раза в сутки при болевом синдроме.
Препаратом, оказывающим избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, является гимекромон (одестон). Данный препарат сочетает в себе спазмолитические и желчегонные свойства, обеспечивает гармоничное опорожнение внутри- и внепеченочных желчных путей. Одестон не обладает прямым желчегонным действием, но облегчает приток желчи в пищеварительный тракт, тем самым усиливает энтерогепатическую рециркуляцию желчных кислот. Преимущество одестона заключается в том, что он практически не оказывает влияния на другие гладкие мышцы, в частности кровеносной системы и кишечной мускулатуры. Применяется одестон по 200–400 мг 3 раза в день за 30 мин до еды.
Все спазмолитики назначаются курсом 2–3 нед.
В дальнейшем они могут использоваться при необходимости или повторными курсами. При остром болевом синдроме препараты могут применяться разово или короткими курсами.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и ноцицептивные механизмы. В настоящее время обсуждается возможность назначения при болях подобного генеза антидепрессантов, антагонистов 5-НТ3-рецепторов, агонистов k-опиоидных рецепторов, аналогов соматостатина.
Антидепрессанты (амитриптилин, миансерин и др.) применяются в средних дозах, продолжительность их приема должна составлять не менее 4–6 нед.
При дисфункции желчного пузыря, обусловленной гипомоторной дискинезией, для повышения сократительной функции применяют прокинетики в течение 10–14 дней: домперидон (мотилиум, мотониум, мотилак) или метоклопрамид (церукал) 10 мг 3 раза в день за 20 мин до еды.
Назначение желчегонных средств требует дифференцированного подхода в зависимости от наличия воспаления и типа дисфункции. Они показаны только после стихания воспалительного процесса. Все желчегонные препараты делят на две большие группы: холеретики — средства, стимулирующие желчеобразование, и холагога — средства, стимулирующие желчевыделение.
К холеретикам относятся препараты, увеличивающие секрецию желчи и стимулирующие образование желчных кислот (истинные холеретики), которые подразделяются:
Ко второй группе препаратов, стимулирующих желчевыделение, относятся:
Препараты указанных групп следует назначать дифференцированно, в зависимости от вида дискинезии, сопровождающей хронический холецистит.
В период обострения хронического бескаменного холецистита показаны физиотерапевтические процедуры: электрофорез со спазмолитиками при дисфункциях по гипермоторному типу и с сернокислой магнезией при гипомоторной дисфункции. Назначаются диатермия, индуктотермия, парафин, озокерит, УВЧ-терапия на область желчного пузыря. В последнее время появились работы, посвященные эффективности лазерной терапии хронического бескаменного холецистита. В период начала ремиссии можно использовать лечебную физкультуру, способствующую опорожнению желчного пузыря.
В терапии хронических бескаменных холециститов все большее значение приобретает лечение лекарственными травами — фитотерапия, которая позволяет пролонгировать лечебный эффект медикаментозных препаратов. Лекарственные растения также делят на две группы: холеретики и холекинетики, хотя многие из них обладают и тем и другим действием. К первой группе относятся: цветы бессмертника песчаного (фламин), кукурузные рыльца, мята перечная, пижма, плоды барбариса обыкновенного, корень девясила высокого, трава золототысячника, корень одуванчика, тысячелистник обыкновенный, сок черной редьки.
Во вторую группу входят: цветы боярышника, корень валерианы, корень одуванчика, плоды и кора барбариса обыкновенного, трава дымянки аптечной, цветы василька синего, календула, корень цикория дикого, плоды шиповника, семя тмина, семя укропа, пижма, бессмертник песчаный, лаванда, мелисса лекарственная. Лекарственные растения применяют в виде настоев и отваров. Широко применяются сборы из желчегонных трав, обладающих различным механизмом действия.
Настои и отвары из трав применяют по полстакана за 30 мин до еды 2–3 раза в день, длительно, в течение нескольких месяцев (2–3 мес). Целесообразно их готовить ежедневно или на 2 дня. Необходимо соблюдать принцип постепенного расширения спектра и добавления трав в сборы (но не более 5 трав), с учетом индивидуальной переносимости отдельных трав и сопутствующих заболеваний. Курсы фитотерапии необходимо повторять 3–4 раза в год.
Минеральные воды издавна широко применялись в лечении хронических холециститов, так как большинство из них обладают холеретическим и холекинетическим действием, влияют на химизм желчи, повышая холато-холестериновый коэффициент. Пероральное применение минеральных вод можно сочетать с интрадуоденальным промыванием, а также слепым зондированием (тюбаж без зонда). Тюбаж проводится утром натощак. Больной выпивает глотками в течение 40–50 мин 0,5 л дегазированной теплой минеральной воды (ессентуки, смирновская, славяновская) с добавлением 15– 20 г ксилита или 1/3 чайной ложки карловарской соли. При холецистите с гипомоторной дисфункцией желчного пузыря больному рекомендуется умеренная физическая активность за 1–1,5 ч до приема пищи. Широко используются бутилированные минеральные воды. Показано также пребывание на курортах: Ессентуки, Железноводск, Краинка, Монино, Дорохово, Карловы Вары и др. При назначении минеральных вод учитывается состояние секреторной функции желудка. Кроме того, бальнеологические факторы благоприятно влияют и на состояние нервной системы и нервно-гуморальные регуляторные механизмы желчеотделения.
Наличие билиарного сладжа в желчном пузыре как предкаменной стадии желчнокаменной болезни требует коррекции в лечении больных хроническим холециститом. Назначаются лекарственные средства, усиливающие холерез, холецистокинетики, а также препараты урсодезоксихолевой и хенодезоксихолевой кислот: урсофальк, урсосан — из расчета 10 мг/кг массы тела однократно на ночь или хенофальк, литофальк из расчета 15 мг/кг веса однократно на ночь. Длительность литолитической терапии составляет 3 мес, после чего проводят ультразвуковое исследование (УЗИ).
Лечение желчнокаменной болезни на стадии сформировавшихся камней требует различного подхода к ведению больных. Единственным неинвазивным методом лечения является пероральная литолитическая терапия препаратами желчных кислот.
Литолитическая терапия проводится при противопоказаниях к оперативному лечению и при отказе больного от операции. Однако имеются определенные противопоказания к назначению литолитической терапии: пигментные и смешанные камни, диаметр камней больше 10–15 мм, количество камней, занимающих более 1/3 желчного пузыря, нарушение сократительной функции желчного пузыря, наличие активного гепатита, билиарного цирроза и язвенной болезни в стадии обострения. Урсодезоксихолевую или хенодезоксихолевую кислоту назначают в дозе 15 мг/кг массы тела больного на два приема (утром и на ночь). Возможно сочетание этих препаратов в половинной дозе каждая (8 мг/кг веса). Терапия проводится длительно — в течение 1 года и дольше. УЗИ проводится каждые 3 мес. При отсутствии эффекта через 6 мес лечение прекращается, о чем заранее должен быть предупрежден больной. Возможны побочные эффекты терапии в виде диареи и транзиторного повышения аминотрансфераз, в связи с чем необходим контроль биохимического профиля крови каждые 3 мес.
При успешной терапии в дальнейшем назначаются препараты, усиливающие холерез и нормализующие моторно-эвакуаторную функцию желчного пузыря и желчевыводящих путей. С целью профилактики рецидивов холелитиаза через 1,5–2 года рекомендуются повторные курсы препаратов желчных кислот в половинных дозах в течение 2–3 мес.
К другим методам неоперативного лечения относится экстракорпоральная ударноволновая литотрипсия и контактная эндоскопическая литотрипсия.
Таким образом, исключив факторы, вызывающие развитие хронических холециститов, и взяв на вооружение принцип лечебного рационального питания, фармакологические средства, фитотерапию, санаторно-курортное лечение, можно воздействовать на сложные патогенетические механизмы развития хронического бескаменного холецистита и предотвратить развитие желчнокаменной болезни. Санация хронических очагов инфекции, лечение основных заболеваний являются обязательными компонентами терапии и позволяют предотвратить развитие хронического холецистита или его обострение. Однако, учитывая многообразие факторов и сложные механизмы развития патологии желчевыводящих путей, лечение, требующее терпения как от врача, так и от больного, должно быть длительным, пролонгированным (медикаментозная терапия, фитотерапия, минеральные воды) и проводиться последовательно.
Литература
И. Д. Лоранская, доктор медицинских наук, профессор
Л. Г. Ракитская, кандидат медицинских наук, доцент
Е. В. Малахова, кандидат медицинских наук
Л. Д. Мамедова, кандидат медицинских наук, доцент
РМАПО, Москва



