Что лучше импаза или тадалафил
Открытое несравнительное исследование препарата импазы для лечения эректильной дисфункции
Е. Б. Мазо, С. И. Гамидов, Р. И. Овчинников
ОТКРЫТОЕ НЕСРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ПРЕПАРАТА ИМПАЗЫ ДЛЯ ЛЕЧЕНИЯ
ЭРЕКТИЛЬНОЙ ДИСФУНКЦИИ
Урологическая клиника (зав — членкорр РАМН, проф Е Б Мазо) РГМУ, Москва
Введение. Эректильная дисфункция (ЭД) является хроническим состоянием и может быть определена как неспособность достигать и/или поддерживать эрекцию, достаточную для удовлетворения сексуальной активности. Распространенность ЭД среди мужчин всех возрастов составляет 10%, а в группе мужчин 40—70 лет она достигает 52% [1].
Из всех механизмов ЭД одним из наиболее распространенных является эндотелиальная дисфункция, которая заключается в неадекватной выработке оксида азота (NO) сосудистым эндотелием в ответ на адекватные стимулы (гемодинамическое воздействие, холинергическая стимуляция и др.).
В последние годы показано, что ЭД является в значительной степени излечимым состоянием. Сформулированы требования к препаратам, предназначенным для лечения ЭД: высокая эффективность, надежность, хорошая переносимость, безболезненность, неинвазивность.
Мишенями воздействия наиболее эффективных современных лекарственных средств для лечения ЭД являются, вопервых, эндотелиальная функция (для ингибиторов фосфодиэстеразы типа 5), а, вовторых, центральные дофаминергические механизмы (для апоморфина).
Проведенные исследования по применению силденафила цитрата — СЦ (Виагра) при ЭД показали высокую эффективность (58—85%) препарата в лечении ЭД [2, 3]. В то же время высокая стоимость препарата и существенный риск развития нежелательных лекарственных реакций, особенно у больных с сердечнососудистыми заболеваниями, ограничивают широкое применение данного препарата. Кроме того есть группа больных (15—42%), у которых применение СЦ неэффективно [4, 5]. Вышеперечисленное диктует необходимость поиска новых высокоэффективных, безопасных и доступных лекарственных препаратов для лечения ЭД.
С 2002 г. в практику введен новый отечественный препарат для лечения ЭД — импаза. Теоретической предпосылкой для создания импазы (действующее вещество — антитела к эндотелиальной NOсинтазе в сверхмалых дозах) явилось открытие модифицирующих свойств сверхмалых доз антител (О. И. Эпштейн, М. Б. Штарк, Т. М. Воробьева, 1999).
О механизмах действия импазы как представителя нового класса лекарственных средств на основе сверхмалых доз антител, с одной стороны, и принципиально нового средства восстановления эректильной функции, с другой, можно с достаточной уверенностью судить на основании экспериментальных исследований.
Доклинические исследования позволили сделать следующие выводы. При курсовом пероральном введении крысамсамцам в условиях физиологического (сезонного) и возрастного угнетения репродуктивной функции импаза достоверно стимулирует половое поведение и повышает копулятивную функцию животных. При этом изменение некоторых показателей свидетельствует о наличии у препарата центральных эффектов на механизмы эрекции [6, 7].
На фоне введения импазы было выявлено достоверное повышение в ткани кавернозных тел внутриклеточного уровня циклического гуанозинмонофосфата (сходные данные получены и для СЦ) [8]. Как при однократном, так и при курсовом введении импазы (в отличие от СЦ) в ткани кавернозных тел повышается содержание производных NO.
Увеличение содержания N0 в ткани кавернозных тел животных, получавших импазу, обусловлено двукратным повышением активности синтаз N0 (источники NO в кавернозных телах — нейрональная и эндотелиальная NOсинтазы).
Таким образом, экспериментально подтвержден основной периферический механизм действия импазы: повышение (восстановление) активности NOсинтазы — ключевого фермента, определяющего поддержание эрекции, т. е. при введении препарата повышается (восстанавливается) способность эндотелия вырабатывать N0, а значит, импаза способствует восстановлению эндотелиальной функции.
Результаты доклинических и клинических исследований нового российского гомеопатического препарата анти>Юсинтазы С12 + СЗО + С200 (импаза) позволяют предположить наличие у препарата способности не только улучшать, но и восстанавливать эректильную функцию.
Материал и методы. Сотрудники урологической клиники РГМУ совместно с НПО «Материа Медика» провели открытое несравнительное исследование препарата импазы в качестве средства лечения ЭД, целью которого являлась оценка клинической эффективности и безопасности препарата.
По протоколу в исследование включали мужчин с жалобами на снижение эрекции. Критериями включения в исследование являлись: пациенты в возрасте от 45 до 65 лет, имеющие проявление ЭД. Оценка эректильной функции по шкале МИЭФ (международный индекс эректильной функции) от 10 до 25 баллов, наличие протокола информированного согласия на проведение исследования. Лечение проводилось амбулаторное и в стационаре. Критерии исключения: регулярный прием лекарственных средств, приводящих к развитию ЭД в течение периода исследования; одновременный прием СЦ или других препаратов, предназначенных для лечения ЭД, хронический алкоголизм; подтвержденные эндокринные причины развития ЭД. А также если оценка эректильной функции по шкале МИЭФ менее 10 баллов, при наличии заболеваний, передающихся половым путем, неспособности пациента адекватно заполнить опросник МИЭФ; декомпенсированные заболевания, которые могут повлиять на проведение исследования; гиперчувствительность к любому из компонентов препаратов, применяемых в исследовании; участие в других клинических исследованиях в течение последнего месяца или в настоящее время.
Исследование проведено у 30 больных с ЭД в возрасте 45—65 лет (средний возраст 52,09 ± 4,75 года), из которых 11 страдали артериальной гипертензией, 7 — остеохондрозом позвоночника, 3 — сахарным диабетом, 2 имели в анамнезе тупую травму промежности, 1 — рассеянный склероз, 1 перенес радикальную простатэктомию, у 5 выявлена психогенная ЭД.
Всем больным проводили обследование, включавшее анализ данных истории заболевания, анамнеза половой активности, анкетирование по шкале МИЭФ, интракавернозный фармакологический тест, ультразвуковую допплерографию сосудов полового члена до и после моделирования искусственной эрекции, электромиографию полового члена, исследование гормонов крови (тестостерон, пролактин, тиреотропный гормон, трийодтиронин, тироксин) и стандартные лабораторные исследования (общий анализ крови, общий анализ мочи, глюкоза крови, креатинин, липидный профиль) для исключения хронических заболеваний.
Все больные принимали импазу по 1 таблетке через день независимо от полового акта (таблетку рекомендовалось держать во рту до полного рассасывания) в течение 12 нед. Количество попыток проведения полового акта не менее 4 в месяц.
Эффективность лечения оценивали по изменению показателей МИЭФ, субъективной оценке клинической эффективности пациентом, оценке клинической эффективности врачом (отличный эффект — возрастание показателя «эректильная функция» более чем на 50% или достижение значения шкалы 25 баллов и выше, хороший ответ — возрастание показателя на 30—50%, удовлетворительный ответ — на 10—30%, без эффекта — изменение показателя на ± 10%, ухудшение — снижение показателя на 10% и более), оценке переносимости терапии пациентом, наличию и характеру нежелательных явлений в период активной терапии.
Эффективность импазы в зависимости от патогенеза ЭД
| Патогенез ЭД | Эффективность | |||
| отличная | хорошая | удовлетнорительная | неэффективная | |
| Психогенная (n = 5) | 4 | 1 | 1 | — |
| Артериальная (n = 10) | 3 | — | 1 | 5 |
| Веноокюлознвная (n = 1) | — | 2 | — | 1 |
| Нейрогенная (n = 8) | 4 | — | 1 | 1 |
| Нсйроартсриальная (n =4) | — | 1 | 2 | 2 |
| Артериовеноаная (n=2) | — | — | — | 1 |
| Всего. | 11 | 4 | 5 | 10 |
23 (76,7%) больных получали регулярную медикаментозную терапию по поводу сопутствующих заболеваний (нитраты, ингибиторы ангиотензинпревращающего фактора, антагонисты кальция, аблокаторы, нестеродные противовоспалительные средства, сахароснижающие препараты), объем которой не изменялся в течение исследования. Около половины больных (14 человек — 46,7%) являлись активными курильщиками. 13 (43,3%) больных на момент исследования алкоголь не употребляли, 14 (46,7%) употребляли эпизодически (1 раз в неделю и реже), 3 (10%) — чаще 1 раза в неделю. Подавляющее большинство включенных в исследование больных 27 человек (90%) ранее специфического лечения не получали, 3 (10%) больных ранее получали СЦ с положительным эффектом, но прекратили лечение в связи с высокой его стоимостью.
По результатам комплексного андрологического обследования ЭД по патогенезу являлась психогенной у 5 (16,7%), органической у 25 (83,3%) больных, из них артериогенной у 10 (33,3%), веноокклюзивной у 1 (3,3%), нейрогенной у 8 (26,7%), нейроартериальной у 4 (13,3%), артериовенозной у 2 (6,7%) больных. Уровень гормонов в крови был в пределах возрастной нормы во всех случаях.
Результаты и обсуждение. До лечения средний показатель «эректильная функция» по шкале МИЭФ
составил 18,89 + 5,25 балла (10—25 баллов), через З мес 22,50 ± 4,86 балла (10—29 баллов). При этом у 11 (36,7%) больных эффективность лечения оценена как отличная (главным образом в связи с достижением значения показателя «эректильная функция» 25 баллов и более), у 4 (13,3%) — как хорошая, у 5 (16,7%) — как удовлетворительная, у 10 (33,3%) — без эффекта, ухудшения ни у одного больного зафиксировано не было.
В основном отличный эффект был отмечен у больных с психогенной, нейрогенной и субкомпенсированной артериальной ЭД (см. таблицу). Терапия импазой была неэффективна у больных с декомпенсированной артериальной недостаточностью, веноокклюзивной и смешанной ЭД (нейроартериальной,артериовенозной).
Достоверной зависимости эффекта импазы от массы тела больных зафиксировано не было.
Эффективность терапии импазой варьировала от 60 до 66,7% в зависимости от этиологии и патогенеза ЭД.
У 7 (23,3%) больных улучшение показателей МИЭФ происходило постепенно, по мере продолжения приема препарата импазы на протяжении 10—11 нед, что может свидетельствовать о терапевтическом воздействии и наступающем лечебном эффекте. Кроме этого, отмечалось увеличение числа половых актов и половой активности с 5—6 до 7—10 попыток в месяц. Суммарный балл показателей «удовлетворенность половым актом» и «общая удовлетворенность» опросника МИЭФ также возрос с 7,15 ± 2,37 до 12,48 ± 3,54 и с 4,58 ± 1,52 до 7,42 ± 2,69 соответственно. Достоверного изменения показателей «оргазм» и «половое влечение» опросника МИЭФ зафиксировано не было.
Переносимость и безопасность терапии оценены как «отличные». За время исследования не было зафиксировано ни одного нежелательного побочного явления как по оценке больных, так и по оценке врача. Какоголибо отрицательного влияния на течение сопутствующих заболеваний не наблюдалось, необходимость изменения терапии этих состояний также не возникала.
Заключение. Новый отечественный гомеопатический препарат импаза является эффективным средством лечения больных с органической и психогенной ЭД. Его эффективность достоверно превосходит эффект «плацебо» [9] и доказана доклиническими экспериментальными и клиническими исследованиями. Преимуществами данного препарата являются эффективность и высокая безопасность по сравнению с другими известными препаратами (СЦ, интракавернозные инъекции), возможность сочетания лечения с терапией сопутствующих заболеваний, в том числе ишемической болезни сердца, артериальной гипертензии и др., практически полное отсутствие побочных эффектов и системных негативных влияний, относительная низкая стоимость препарата и курсового лечения. Кроме того, возможность курсового применения с последовательным увеличением эффективности у части больных также указывает на лечебный эффект препарата импазы.
Новое в лечении эректильной дисфункции
Проблема эректильной дисфункции (ЭД), которой традиционно занимались практически только урологи и сексопатологи, ныне привлекает внимание врачей других специальностей благодаря появлению новых возможностей консервативного лечения этого расстройства. В п
Проблема эректильной дисфункции (ЭД), которой традиционно занимались практически только урологи и сексопатологи, ныне привлекает внимание врачей других специальностей благодаря появлению новых возможностей консервативного лечения этого расстройства.
В первую очередь необходимо определить этиологию ЭД и, если возможно, вылечить само заболевание, а не только устранить его симптомы. Известно, что ЭД может быть вызвана различными факторами. На некоторые из этих факторов можно воздействовать: например, изменить образ жизни пациента, отменить некоторые назначаемые ему лекарственные препараты. Во многих случаях корректировка терапии, которую пациент получает по поводу заболевания внутренних органов, может помочь преодолеть негативные изменения в сексуальной сфере, наблюдающиеся при некоторых видах лечения. Например, при развитии ЭД у больных с артериальной гипертензией отменяют тиазидные диуретики и неселективные β-адреноблокаторы и отдают предпочтение антагонистам кальция, ингибиторам ангиотензинпревращающего фермента и α-адреноблокаторам, которые в меньшей степени влияют на половую сферу (M. A. Khan et al., 2002; C. M. Ferrario, P. Levy, 2002); применение ингибиторов ангиотензиновых рецепторов может даже несколько повышать сексуальную активность у мужчин (R. Fogari, A. Zoppi, 2002).
Пациентам с андрогенной недостаточностью необходима консультация эндокринолога для решения вопроса о назначении заместительной гормональной терапии. Тестостерон обычно назначают в тех случаях, когда неэффективны другие методы и средства (в первую очередь ингибиторы фосфодиэстеразы 5-го типа — ФДЭ-5). Заместительная гормональная терапия тестостероном противопоказана пациентам с симптомами заболевания предстательной железы и раком простаты в анамнезе.
Лечение собственно ЭД включает неинвазивные (медикаментозная терапия, применение вакуум-констрикторных устройств) и инвазивные методы (интракавернозные инъекции вазоактивных веществ, оперативное лечение). Преимущества и недостатки различных методов лечения ЭД представлены в таблице 1.
Медикаментозная терапия ЭД
Наиболее эффективным и удобным методом лечения как психогенной, так и органической ЭД считают применение ингибиторов ФДЭ-5. Появление на фармацевтическом рынке первого препарата из группы ингибиторов ФДЭ-5 — силденафила цитрата (виагры) — ознаменовало новую эпоху в лечении ЭД; относительно недавно к нему «присоединились» варденафил (левитра) и тадалафил (сиалис).
Все эти препараты обладают одинаковым механизмом действия. При сексуальной стимуляции вследствие активации нервной системы и высвобождения оксида азота в гладкомышечных клетках сосудов накапливается циклический гуанозинмонофосфат (цГМФ). Именно он запускает каскад биохимических реакций, приводящих к возникновению и поддержанию эрекции. В норме концентрация цГМФ снижается при прекращении сексуальной стимуляции вследствие разрушения ФДЭ-5. При ЭД отмечается дефицит цГМФ, обусловленный различными патогенетическими факторами, и его разрушение ФДЭ-5 приводит к недостаточной эрекции или ее отсутствию. Ингибиторы ФДЭ-5 не оказывают прямого расслабляющего влияния на кавернозные тела, но усиливают релаксирующий эффект оксида азота путем ингибирования ФДЭ-5 и повышения концентрации цГМФ при сексуальном возбуждении.
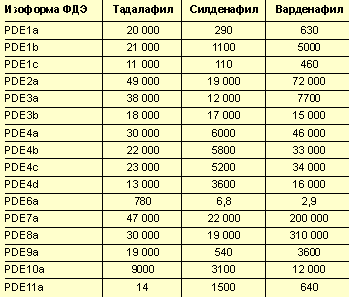
ФДЭ-5 локализуется преимущественно в кавернозной ткани, хотя обнаруживается также в гладкой мускулатуре сосудов других органов, легких, почках, кардиальном отделе желудка, тромбоцитах. Распределение ФДЭ-5 в организме достаточно индивидуально, поэтому некоторые пациенты отмечают те или иные нежелательные эффекты, общие для препаратов этой группы и связанные с блокадой этого фермента. К таким нежелательным явлениям относятся головная боль, приливы, диспепсия (по типу рефлюкса) и заложенность носа. Блокада других изоформ ФДЭ — всего их известно 11 (табл. 2), — как правило, клинически не значима и не сопровождается какими-либо серьезными нежелательными эффектами, поскольку все ингибиторы ФДЭ-5 высокоселективны и эффект их действия обратим.
По сравнению с другими препаратами этой группы, тадалафил в меньшей степени блокирует ФДЭ-6 (табл. 3). Блокада этой изоформы ФДЭ обусловливает преходящие нарушения цветового зрения, соответственно при ее использовании имеется минимальный риск нарушений цветовосприятия. С другой стороны, тадалафил, по сравнению с силденафилом и варденафилом, менее селективен в отношении ФДЭ-11, однако ее блокада не сопровождается какими-либо зарегистрированными клиническими эффектами. Этот изоэнзим ФДЭ обнару жен в ткани яичек, однако, как показали исследования W. J. Hellstrom и соавторов (2002), ежедневный прием тадалафила в дозе 10 или 20 мг в сутки в течение 6 мес не оказывает отрицательного влияния на сперматогенез.
 |
| Относительная селективность ингибиторов ФДЭ-5 |
Фармакокинетика силденафила, тадалафила и варденафила существенно различается (табл. 4). Все три препарата быстро всасываются из желудочно-кишечного тракта.
Биодоступность представляет собой выраженную в процентах часть свободного лекарственного вещества в плазме крови после его энтерального введения. При этом она определяется потерями вещества при его всасывании из пищеварительного тракта и при первом прохождении через печеночный барьер. Биодоступность силденафила составляет 40%, варденафила — 15%. Биодоступность тадалафила (85%) вычислена косвенным путем, так как активное вещество не растворяется в воде и не может вводиться внутривенно.
Одновременный прием жирной пищи уменьшает и задерживает всасывание силденафила. Скорость и полнота всасывания варденафила также зависят от жирности пищи: если содержание жиров превышает 57%, эти показатели уменьшаются, а если не превышает 30% — не изменяются. Скорость и степень всасывания тадалафила не зависят от приема пищи.
Время достижения максимальной концентрации лекарственного вещества отражает скорость его всасывания и наступления терапевтического эффекта. Пиковый уровень концентрации препарата в плазме достигается в среднем через 1 ч после приема силденафила и варденафила. Максимальная концентрация тадалафила в плазме наблюдается в среднем через 2 ч после приема препарата. Клинический эффект препаратов зависит также от минимальной терапевтической концентрации и начинает проявляться задолго до достижения максимальной концентрации. В ряде клинических исследований показано, что у большинства пациентов терапевтический эффект ингибиторов ФДЭ-5 проявляется уже к 30-й минуте после их приема.
После однократного перорального приема 100 мг силденафила максимальная концентрация препарата в плазме крови достигает 450 нг/мл; 20 мг варденафила — около 20,9 нг/мл; 20 мг тадалафила — 378 нг/мл. Этот параметр имеет значение при сравнении различных форм одного и того же препарата: например, максимальная концентрация может оказаться ниже, чем минимальная эффективная концентрация, при которой данное вещество оказывает терапевтическое действие. Разные препараты имеют различные терапевтические концентрации, поэтому в данном случае сравнение этого показателя неинформативно.
Период полувыведения (Т1/2) — время, за которое концентрация препарата в крови уменьшается наполовину от ее начальной (максимальной) величины, — составляет для силденафила и варденафила 4 ч, для тадалафила — 17,5 ч. Практически это означает, что по продолжительности действия тадалафил существенно превосходит другие ингибиторы ФДЭ-5. Равновесная концентрация тадалафила достигается на 5-й день при ежедневном приеме и превышает первоначальную в 1,6 раза, поэтому препарат не обладает способностью к кумуляции. Предположение о возможности кумуляции тадалафила при достаточно частом и регулярном его приеме не подтверждается и клиническими данными, при этом имеются свидетельства хорошей переносимости препарата мужчинами, принимавшими тадалафил в течение 2 лет (F. Montorsi et al., 2004).
Ингибиторы ФДЭ-5 метаболизируются с участием системы цитохрома P450, выделение их происходит главным образом через печень.
Прямых сравнительных исследований эффективности и безопасности ингибиторов ФДЭ-5 не проводилось, однако ввиду схожести механизма действия вышеуказанных новых препаратов с силденафилом сравнение их клинической эффективности при лечении ЭД вообще не имеет смысла. Потенция не является относительной с клинической точки зрения, так как она служит формой оценки эффективной концентрации препарата. Проще говоря, клинический эквивалент дозы и конечный результат соответствуют друг другу.
Результаты различных исследований достаточно трудно сопоставлять ввиду различий в популяции пациентов, а также принимая во внимание критерии включения и методы статистического анализа.
В условиях in vitro варденафил продемонстрировал наибольшую тропность к ФДЭ-5 по сравнению с силденафилом и тадалафилом, т. е. его концентрация, необходимая для эффективной блокады ФДЭ-5, была минимальной. Однако с учетом его низкой биодоступности и разницы в дозах, применяемых в клинической практике, терапевтический эффект варденафила in vivo сопоставим c другими ингибиторами ФДЭ-5. Согласно данным, полученным в ходе регистрации препаратов в Европе (табл. 5), доля успешных попыток полового акта составила 66% на фоне терапии силденафилом в дозе 50–100 мг, 65% — варденафилом в дозе 20 мг и 75% — тадалафилом в дозе 20 мг. В сравнимых исследованиях улучшение способности достигать эрекцию на фоне терапии силденафилом отметили 84% больных (I. Goldstein et al., 1998), варденафилом — 80% (H. Porst et al., 2001), тадалафилом — 81% (H. Padma-Nathan et al., 2001).
Принципиально ингибиторы ФДЭ-5 различаются по продолжительности клинического эффекта: в отношении силденафила и варденафила она составляет около 5 ч, тадалафила — 36 ч. Отдельные исследования показали, что при определенных условиях длительность клинического эффекта силденафила и варденафила может превышать 4–5 ч, в то время как у тадалафила он стабильно продолжительный в широкой популяции. Препараты непродолжительного действия следует использовать незадолго до полового акта; возникающая при этом зависимость интимной близости от времени действия препарата может приводить к психологическому дискомфорту. После приема тадалафила пациенты могут выбрать наиболее подходящий момент для интимной близости в течение 1,5 сут. При достаточно высокой сексуальной активности очевидным представляется и фармакоэкономический эффект: при примерно одинаковой стоимости трех препаратов по соотношению цена/время действия применение тадалафила оказывается более выгодным.
Активность препаратов in vitro значительно различается в зависимости от лаборатории, проводившей анализ, и от того, использовался ли в ходе сравнения оригинальный препарат либо он был синтезирован (выделен) в лабораторных условиях. На клиническую эффективность влияют ряд параметров, таких, как биодоступность, скорость элиминации, связывание с белками крови и т. д., поэтому терапевтический эффект может не соответствовать ожиданиям, основанным на высокой активности in vitro. В связи с этим во время клинических исследований оптимальная с точки зрения эффективности и безопасности доза подбирается опытным путем. Принятые режимы дозирования препаратов приведены в таблице 6.
Профиль безопасности трех ингибиторов ФДЭ-5 также довольно схож (табл. 7). Силденафил и варденафил по сравнению с тадалафилом несколько чаще вызывают приливы и нарушения зрения, но реже — диспепсию (дискомфорт в эпигастрии) и миалгии.
 |
| Нежелательные эффекты ингибиторов ФДЭ-5 (в %) по данным регистрации препаратов в Европе (EU Summary of Product Characteristics) |
Как уже отмечалось выше, большинство нежелательных эффектов этих препаратов, за исключением нарушения зрения, обусловлены блокадой ФДЭ-5. Длительный период полувыведения тадалафила приводит к более высокой частоте миалгии, которая обычно возникает в покое, в вечерние или ночные часы и обусловлена депонированием крови в мышцах. Подобные эффекты были выявлены также в ходе клинических исследований других ингибиторов ФДЭ-5 — при использовании их в более высоких дозах или с более высокой частотой. Нежелательные явления ингибиторов всех ФДЭ-5, как правило, непродолжительные и имеют тенденцию к спонтанной регрессии. Их продолжительность, как правило, меньше, чем длительность терапевтического действия препаратов вследствие более низкой концентрации ФДЭ-5 в некавернозной ткани и быстрой адаптации организма к второстепенному эффекту. Продолжительность побочных эффектов совпадает с продолжительностью терапевтического действия исключительно редко.
С точки зрения гемодинамики по действию ингибиторы ФДЭ-5 напоминают нитраты (кстати, силденафил изначально разрабатывался именно для лечения стенокардии). Поскольку оксид азота участвует в регулировании уровня артериального давления, ингибиторы ФДЭ-5 обладают небольшим гипотензивным эффектом, который может потенцироваться при одновременном приеме с нитратами и приводить к значительному снижению уровня АД. Именно поэтому основным противопоказанием к применению ингибиторов ФДЭ-5 считают одновременный прием органических нитратов: согласно существующим рекомендациям, их можно использовать не ранее, чем через 24 ч после приема коротко действующих ингибиторов ФДЭ-5, и не ранее, чем через 48 ч после приема тадалафила. Если у пациента есть необходимость в периодическом приеме нитратов, то выбирать наиболее безопасный из трех ингибиторов ФДЭ-5 не приходится, так как приступ стенокардии может возникнуть в любое время после применения этих лекарств или непосредственно во время полового акта. Вообще считается, что нитраты не улучшают прогноз у больных ИБС, поэтому в большинстве случаев их прием можно прекратить или, при необходимости, заменить данные средства на другие препараты, обладающие схожим механизмом действия. После прекращения приема нитратов в случае, если не возникло клинических осложнений, пациент может начать терапию ингибиторами ФДЭ-5 без угрозы для здоровья и жизни.
При использовании ингибиторов ФДЭ-5 следует также учитывать потенциальный риск развития осложнений, затрагивающих сферу сексуальной активности, в течение 90 дней после перенесенного инфаркта миокарда, при нестабильной стенокардии или стенокардии, возникающей во время полового акта, при развившейся в течение последних 6 мес сердечной недостаточности II функционального класса и выше по NYHA, при неконтролируемых нарушениях сердечного ритма, артериальной гипотензии (АД
Д. Ю. Пушкарь, доктор медицинских наук, профессор
А. В. Верткин, доктор медицинских наук, профессор
А. С. Сегал, доктор медицинских наук, профессор
А. В. Тополянский, кандидат медицинских наук, доцент
П. Б. Носовицкий, кандидат медицинских наук
Е. В. Кривцова
МГМСУ, ННПОСМП, Москва