Что лучше инсулин или метформин при диабете 2 типа
Комбинированный отечественный инсулин и метформин при сахарном диабете 2 типа в повседневной клинической практике
Цель исследования: оценить показатели углеводного обмена на фоне применения двухфазного человеческого генноинженерного инсулина (Росинсулина М микс 30/70) у больных сахарным диабетом 2 типа (СД2), ранее не получавших инсулинотерапию, не достигших целевых показателей углеводного обмена в результате проводимой терапии пероральными сахароснижающими препаратами.
Дизайн: открытое нерандомизированное клиническое исследование.
Материалы и методы: исследование включало 36 пациентов с СД2 (11 мужчин и 25 женщин), получавших комбинацию препаратов метформина и сульфонилмочевины в максимально переносимых дозах, не достигших целевых показателей углеводного обмена.
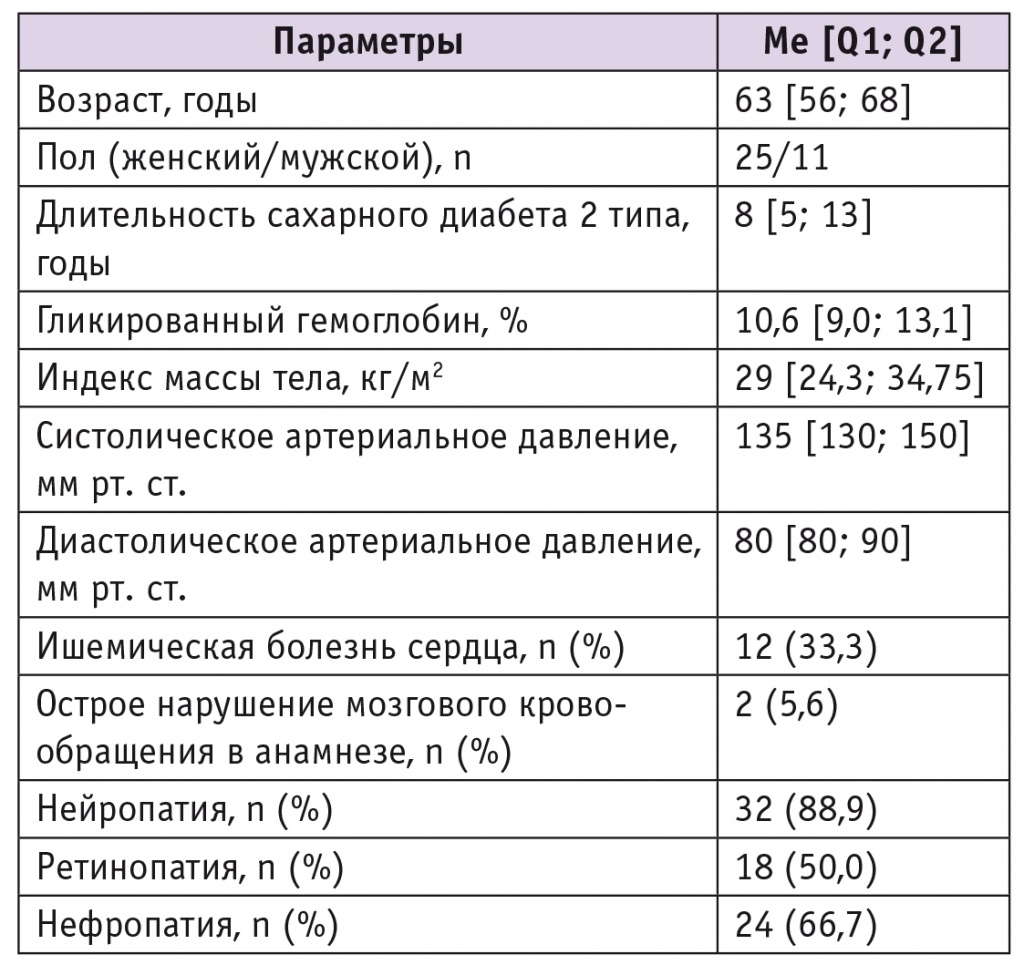
Результаты: показатели состояния углеводного обмена до назначения инсулина: уровень гликированного гемоглобина (HbA1c) — 10,6% [9,0%; 13,1%], гликемии натощак — 11,1 [8,9; 14,6] ммоль/л. Через 6 месяцев инсулинотерапии в сочетании с метформином содержание НbА1C снизилось на 2,4%, уровень гликемии натощак — на 4,1 ммоль/л. За период наблюдения не было новых сердечнососудистых событий.
Заключение: показана положительная динамика показателей углеводного обмена на фоне применения двухфазного человеческого генноинженерного инсулина в сочетании с пероральными сахароснижающими препаратами в реальной клинической практике.
Рымар Оксана Дмитриевна — д. м. н., заведующая лабораторией клиникопопуляционных и профилактических исследований терапевтических и эндокринных заболеваний НИИТПМ — филиала ФГБУН ФИЦ ИЦиГ СО РАН. 630089, г. Новосибирск, ул. Бориса Богаткова, д. 175/1. Email: orymar23@gmal.com
Долинская Юлия Александровна — заведующая эндокринным отделением клиники НИИТПМ — филиала ФГБУН ФИЦ ИЦиГ СО РАН. 630089, г. Новосибирск, ул. Бориса Богаткова, д. 175/1. Email: dolinyulia@yandex.ru
Данная работа предусматривала максимально простой дизайн в условиях реальной клинической практики: последовательное включение пациентов без процедуры рандомизации, отсутствие контрольной группы. Вопросы о включении пациента в исследование, назначении Росинсулина М микс 30/70 и его начальной дозе, дозах пероральных сахароснижающих препаратов решались лечащим врачом пациента.
Все больные подписали письменное информированное согласие на участие в исследовании после получения от лечащего врача подробной информации о предстоящей программе, порядке ее проведения, побочных эффектах, которые могут возникнуть в результате лечения. Исследование соответствовало этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава России от 19.06.2003 г. № 266. Протокол исследования был одобрен локальным Этическим комитетом.
На 1м визите (в период госпитализации в эндокринологическое отделение) осуществлялось включение в исследование больных, которым, согласно существующим клиническим рекомендациям, была необходима инициация инсулинотерапии. Оценивались демографические (пол, возраст) и антропометрические (рост, вес, ИМТ) данные, длительность СД, степень компенсации углеводного обмена (уровни HbA1c, глюкозы венозной плазмы натощак). Наличие осложнений: ретинопатии, нейропатии, нефропатии — и сопутствующих заболеваний фиксировалось врачом на основании доступной в медицинских картах и историях болезни информации.
Для каждого пациента лечащий врач обосновывал целевой уровень HbA1c. Росинсулин М микс 30/70 назначался в соответствии с инструкцией к препарату и показаниями для старта инсулинотерапии. Введение инсулина в картриджах производилось шприцручками КомфортПен под кожу 2 раза в сутки перед приемом пищи.
На 2м и 3м визитах в условиях амбулаторного приема эндокринолог оценивал массу тела, ИМТ, состояние компенсации углеводного обмена (содержание HbA1c, глюкозы венозной плазмы натощак), корректировал дозу инсулина. Результаты обследований, дозы инсулина, нежелательные явления на 1м визите и после 3 и 6 месяцев наблюдения регистрировались в индивидуальной регистрационной карте пациента. Общая продолжительность наблюдения составила 24 недели.
Переносимость инсулинотерапии оценивали по наличию местных и общих аллергических реакций на препарат, развитию гипогликемических реакций. Основным критерием безопасности проводимой терапии было количество серьезных нежелательных явлений, в том числе тяжелых дневных и ночных гипогликемических состояний в течение 6 месяцев применения инсулина. Гипогликемией считали уровень глюкозы в крови ниже 3,9 ммоль/л и/или наличие клинических симптомов, которые расценивались пациентом как типичные проявления гипогликемии.
Гипогликемия определялась как легкая, если эпизод самостоятельно купировался пациентом. Тяжелая гипогликемия — эпизод с потерей сознания или без, потребовавший для купирования помощи других лиц.
Эффективность лечения оценивали по динамике уровней HbA1с, глюкозы плазмы натощак через 3 и 6 месяцев после старта инсулинотерапии. Контрольные лабораторные исследования глюкозы плазмы натощак выполнялись в местных лабораториях в соответствии с общепринятыми процедурами стандартизации и контроля качества. Уровень HbA1c определяли в цельной капиллярной крови прибором DCA Vantage (Siemens).
Таблица 1
Основные антропометрические и метаболические показатели пациентов с сахарным диабетом 2 типа на этапе включения в исследование
Таблица 2
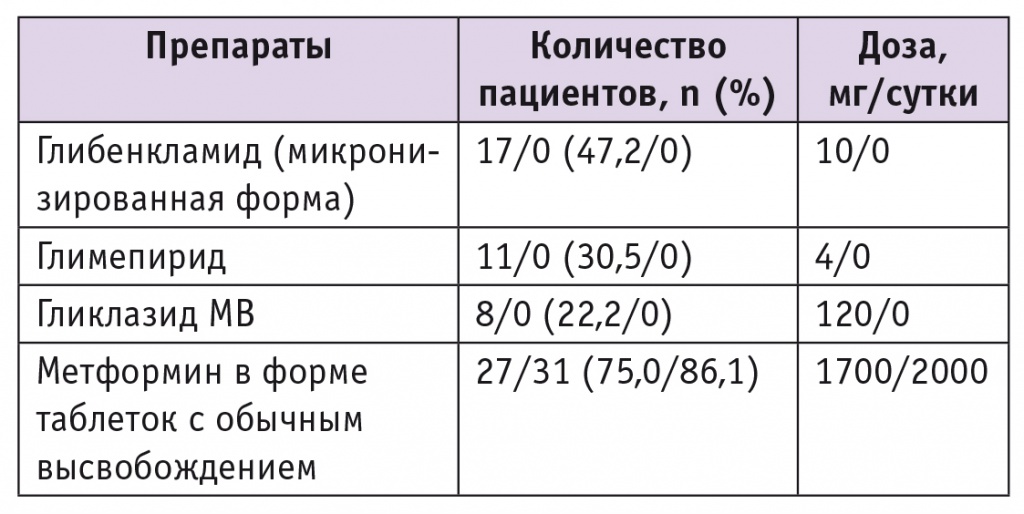
Таблетированная сахароснижающая терапия пациентов с сахарным диабетом 2 типа до/после назначения инсулинотерапии
В настоящее время принято суточную дозу смешанных инсулинов делить поровну между утренней и вечерней инъекциями, однако некоторые больные достигают лучших показателей при назначении 2/3 суточной дозы перед завтраком и 1/3 перед ужином. В данном исследовании 27 человек (75,0%) по назначению лечащего врача получали 2/3 суточной дозы инсулина утром и 1/3 вечером, 9 человек (25,0%) делили дозу поровну.
Средняя суточная доза Росинсулина М микс 30/70, подобранная на 1м визите, — 37 [31; 48] Ед/сут. В ходе контрольных визитов она корректировалась в зависимости от показателей углеводного обмена и через 6 месяцев составила 36 [30; 46] Ед/сут. Важно, что применение смешанных видов инсулина практически не меняет образ жизни пациента, кроме того, не требует частого мониторинга гликемии — достаточно контролировать уровень глюкозы в крови 1 раз в день перед завтраком и периодически проводить дополнительный тест ночью. Возможность ограничиться двумя инъекциями инсулина помогает больным преодолеть страх перед многочисленными инъекциями.
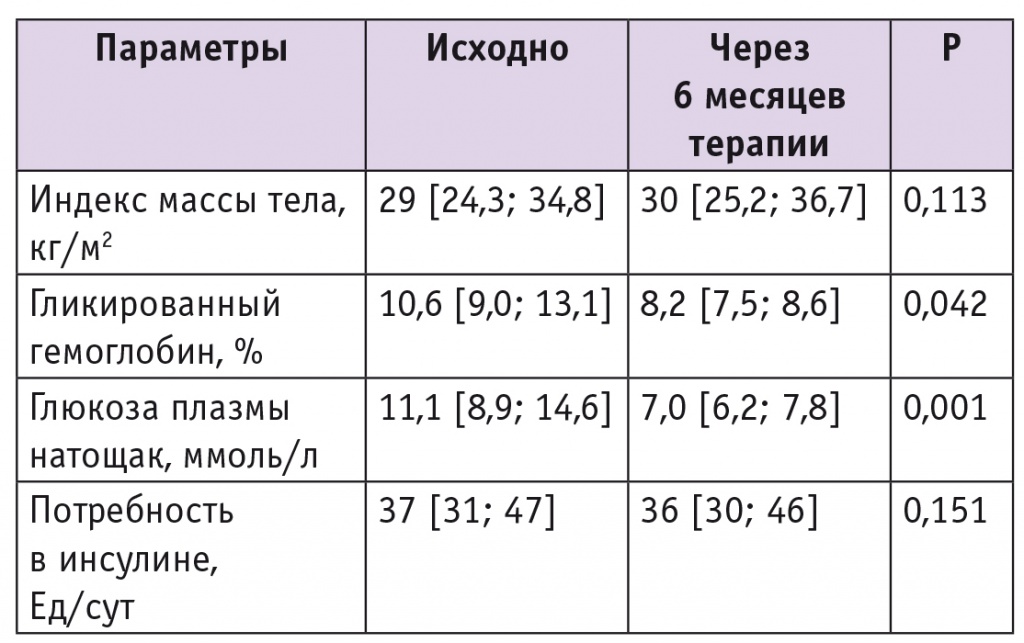
Через 3 и 6 месяцев после назначения инсулинотерапии отмечалось значительное снижение уровней гликемии и НbА1с. Через 6 месяцев инсулинотерапии в сочетании с метформином медиана НbА1с уменьшилась на 2,4% (р = 0,042), гликемии натощак — на 4,1 ммоль/л (р табл. 3 ).
Таблица 3
Динамика антропометрических и метаболических показателей у пациентов с сахарным диабетом 2 типа на фоне комбинированной терапии Росинсулином М микс 30/70 в сочетании с метформином
Несмотря на значительное снижение содержания НbА1с через 6 месяцев лечения, целевого уровня (менее 7,5%) достигло небольшое количество пациентов — 9 (25,0%), что связано с исходно плохим гликемическим контролем в исследуемой группе, повышенной осторожностью врачей в связи с риском развития гипогликемических состояний.
Один пациент сообщил о тяжелой гипогликемии через 3 месяца наблюдения. Частота легких гипогликемических состояний составила в среднем 2–4 в месяц на одного человека. Местных реакций на введение препарата и других нежелательных явлений не было.
ОБСУЖДЕНИЕ
Полученные результаты показали, что Росинсулин М микс 30/70 в комбинации с метформином обладает выраженным сахароснижающим эффектом у больных с неудовлетворительным контролем гликемии на фоне предшествующей комбинированной терапии метформином с сульфонилмочевиной. Следует отметить, что данные результаты были получены в условиях реальной клинической практики. По своим характеристикам участники исследования представляли типичную когорту пациентов с СД2: с избыточной массой тела или ожирением, сопутствующей АГ, у 50,0% имелась диабетическая ретинопатия, у 88,9% — диабетическая нейропатия, у 33,3% — ИБС, у 5,6% — ОНМК в анамнезе. За период наблюдения не было новых сердечнососудистых событий. Прибавка массы тела за 6месячный период наблюдения не отмечена. Один пациент сообщил о тяжелой гипогликемии через 3 месяца, поэтому доза инсулина была скорректирована, в дальнейшем тяжелые гипогликемии не повторялись.
Достижение значимого улучшения показателей углеводного обмена произошло на фоне незначительного количества зафиксированных гипогликемических состояний, что позволяет говорить о безопасности терапии генноинженерным комбинированным инсулином при соблюдении рекомендаций, изложенных в Алгоритмах диагностики и лечения СД.
ЗАКЛЮЧЕНИЕ
Учитывая изложенные данные, можно заключить что применение Росинсулина М микс 30/70 позволяет эффективно и без увеличения ИМТ на фоне незначительного количества легких гипогликемических состояний, без риска тяжелой гипогликемии, местных реакций и нежелательных явлений улучшить показатели углеводного обмена у больных СД2, не достигающих целевых значений гликемии на фоне проводимой терапии пероральными сахароснижающими препаратами. Режим инъекций комбинированного инсулина 2 раза в сутки в дополнение к метформину для пациентов с СД просто реализовать в качестве первого этапа введения инсулина.
___
Работа выполнена в рамках бюджетной темы ГЗ № 032420180001, рег. № ААААА171171128502802.
Выбор режима инсулинотерапии при сахарном диабете 2 типа
В последние годы показания к проведению инсулинотерапии у больных сахарным диабетом (СД) 2 типа значительно расширились. По данным Британского проспективного исследования диабета (UKPDS), ежегодно 5–10% больных со впервые диагностированным
В последние годы показания к проведению инсулинотерапии у больных сахарным диабетом (СД) 2 типа значительно расширились. По данным Британского проспективного исследования диабета (UKPDS), ежегодно 5–10% больных со впервые диагностированным СД 2 типа требуется терапия инсулином [12], а спустя 10–12 лет — уже около 80% пациентов нуждаются в постоянной инсулинотерапии. С течением времени у больных СД 2 типа ухудшается гликемический контроль, обусловленный нарастающим снижением остаточной секреции β-клеток. Периферическая чувствительность к инсулину остается относительно сохранной, что определяет необходимость выбора оптимальной терапии на каждом этапе развития заболевания [4, 6, 10]. Монотерапия пероральными сахароснижающими препаратами (ПССП) обычно эффективна в первые 5–6 лет заболевания, в дальнейшем возникает необходимость использования комбинации из двух и более препаратов с различным механизмом действия, корригирующих как дефицит инсулина, так и инсулинорезистентность. В то же время лечение с помощью диеты, физических нагрузок, приема препаратов сульфонилмочевины или метформина не оказывает существенного влияния на прогрессирующее снижение секреторной функции β-клеток. По данным UKPDS, у 40% больных к моменту постановки диагноза СД 2 типа уже имеется выраженное снижение секреторной функции β-клеток. Длительность периода от дебюта СД 2 типа до назначения постоянной инсулинотерапии зависит в первую очередь от снижения функциональной активности β-клеток и усугубления инсулинорезистентности. Состояние хронической гипергликемии значительно сокращает продолжительность этого периода. У больных СД 2 типа имеется целый ряд параметров, усиливающих инсулинорезистентность: сопутствующие заболевания, применение лекарственных препаратов с отрицательным метаболическим действием, низкая физическая активность, повышение массы тела, депрессия и частые стрессы. Наряду с глюкозо- и липотоксичностью они ускоряют снижение функциональной активности β-клеток у больных СД 2 типа.
При прогрессирующем снижении остаточной секреции β-клеток, неэффективности терапии ПССП назначается инсулин, препараты которого на российском рынке представлены и зарубежными, и отечественными производителями (актрапид, протофан, хумулин, биосулин и др.), как в виде монотерапии, так и в комбинации с таблетированными сахароснижающими препаратами. В инсулинотерапии, по скромным подсчетам, нуждаются около 40% больных сахарным диабетом 2 типа, однако реально получают инсулин менее 10% больных. Анализ клинической практики лечения СД 2 типа свидетельствует о позднем начале инсулинотерапии, а также о неудовлетворительной метаболической компенсации диабета, даже на фоне инсулинотерапии (низкие дозы инсулина). Это может случиться либо по вине врача — из-за опасения прибавки веса и развития гипогликемии, либо из-за негативного отношения пациента к данному виду терапии — при отсутствии регулярного самоконтроля гликемии. Обычно инсулинотерапию назначают больным, имеющим длительное, более 10–15 лет, течение сахарного диабета и выраженные сосудистые осложнения.
Основным преимуществом инсулинотерапии как метода лечения СД 2 типа является воздействие на основные патофизиологические дефекты, присущие этому заболеванию [6, 8, 10]. В первую очередь это касается компенсации недостатка эндогенной секреции инсулина на фоне прогрессирующего снижения функции β-клеток.
Показания к инсулинотерапии у больных СД 2 типа
В последнее время врачи осознали необходимость проведения инсулинотерапии для ликвидации глюкозотоксичности и восстановления секреторной функции β-клеток при умеренной гипергликемии. На первых этапах заболевания дисфункция β-клеток носит обратимый характер и эндогенная секреция инсулина восстанавливается при снижении гликемии. Ранняя инсулинотерапия у больных СД 2 типа хотя и не является традиционной, но представляется одним из возможных вариантов медикаментозного лечения при плохом метаболическом контроле на этапе диетотерапии и физических нагрузок, минуя этап ПССП. Данный вариант наиболее оправдан у пациентов, которые предпочитают терапию инсулином использованию других сахароснижающих препаратов, пациентам с дефицитом массы тела, а также при вероятности латентного аутоиммунного диабета взрослых (LADA).
Успешное снижение гепатической продукции глюкозы при СД 2 типа требует ингибирования двух процессов: глюконеогенеза и гликогенолиза. Поскольку введение инсулина способно снизить глюконеогенез и гликогенолиз в печени и улучшить периферическую чувствительность к инсулину, появляется возможность оптимальной коррекции основных патогенетических механизмов СД 2 типа. Положительными эффектами инсулинотерапии больных сахарным диабетом 2 типа являются:
Лечение больных СД 2 типа в первую очередь направлено на достижение и длительное поддержание целевых уровней HbA1c, гликемии как натощак, так и после приема пищи, что приводит к снижению риска развития и прогрессирования сосудистых осложнений.
До начала инсулинотерапии СД 2 типа необходимо обучить больных методам самоконтроля, пересмотреть принципы диетотерапии, проинформировать пациентов о возможности развития гипогликемии и методах ее купирования [1, 4, 15]. Терапия инсулином, в зависимости от показаний, может назначаться больным СД 2 типа как на короткий, так и на длительный период времени. Кратковременная инсулинотерапия обычно используется при острых макрососудистых заболеваниях (инфаркт миокарда, инсульт, АКШ), операциях, инфекциях, обострении хронических заболеваний в связи с резким повышением потребности в инсулине в эти периоды, как правило, возникающей при отмене таблетированных сахароснижающих препаратов [7, 9, 15]. В острых ситуациях применение инсулина быстро устраняет симптомы гипергликемии и неблагоприятные последствия глюкозотоксичности.
В настоящее время отсутствуют четкие рекомендации относительно выбора начальной дозы инсулина. В основном подбор производится на основании оценки клинического состояния, с учетом суточного профиля глюкозы, массы тела больного. Потребность в инсулине зависит от инсулинсекреторной способности β-клеток, сниженной на фоне глюкозотоксичности, степени инсулинорезистентности. Пациентам с СД 2 типа и ожирением, имеющим инсулинорезистентность различной степени выраженности, для достижения метаболического контроля может потребоваться 1 и более ЕД инсулина на 1 кг массы тела в сутки. Наиболее часто назначается болюсная инсулинотерапия, когда инсулин короткого действия (или аналог человеческого инсулина) применяется несколько раз в день, возможна комбинация инсулина короткого и промежуточного действия (перед сном или два раза в день) или аналога пролонгированного инсулина (перед сном). Количество инъекций и суточная доза инсулина зависят от уровня гликемии, пищевого режима и общего состояния больного.
Временная долгосрочная инсулинотерапия (2–3 мес) назначается в следующих ситуациях [9, 13]:
В таких случаях назначаются инсулин короткого действия (2–3 раза) и пролонгированный инсулин перед сном или два раза в день под контролем гликемии, а ПССП обычно отменяются.
После устранения глюкозотоксичности, при стойкой нормализации показателей гликемии, снижении уровня HbA1c, положительной динамике в общем, соматическом статусе больного и сохранной эндогенной секреции инсулина на фоне временной инсулинотерапии, под контролем гликемии постепенно назначаются ПССП, а суточная доза инсулина медленно уменьшается. Другим вариантом является комбинированная терапия инсулином и ПССП.
При сниженной эндогенной секреции инсулина назначается монотерапия инсулином.
В лечении СД 2 типа существуют несколько вариантов терапии, как комбинированной с таблетированными препаратами, так и монотерапии инсулином. Выбор, соответственно, делается на основании клинического опыта врача, с учетом особенностей соматического статуса пациента, сопутствующих заболеваний и их медикаментозной терапии. Чаще всего при СД 2 типа применяется комбинированная терапия инсулином и таблетированными сахароснижающими препаратами, когда пероральная монотерапия не позволяет добиться адекватного контроля гликемии. Вариантами комбинированной терапии являются следующие сочетания: производные сульфонилмочевины и инсулин, меглитиниды и инсулин, бигуаниды и инсулин, тиазолидиндионы и инсулин [2, 11, 14].
К преимуществам комбинированной терапии относится лучшая мотивация пациента, быстрое устранение глюкозотоксичности, улучшение чувствительности периферических тканей к инсулину и повышение эндогенной секреции инсулина.
Положительным эффектом комбинированной терапии СД является не только достижение контроля гликемии, но и снижение суточной дозы таблетированных препаратов, возможность использования небольших доз инсулина и, соответственно, меньшая прибавка в весе [7]. Режим инсулинотерапии при комбинированном лечении может включать, в дополнение к прежней, пероральной терапии, одну инъекцию инсулина промежуточного действия перед сном, эффективно подавляющую избыточную продукцию глюкозы печенью и нормализующую гликемию натощак. По нашим, а также литературным данным, средняя потребность в инсулине при комбинированной терапии составляет 0,2–0,5 ЕД/кг массы тела у больных с нормальным весом и достигает 1 ЕД/кг массы тела и более — при избыточном весе. Необходимо соблюдать определенные этапы в проведении инсулинотерапии у больных СД 2 типа [8]. На первом этапе назначается стартовая доза в виде однократной инъекции инсулина промежуточного действия 0,2–0,3 ЕД/кг массы тела (у пожилых 0,15 ЕД/кг массы тела), в среднем 8–12 МЕ перед сном, при необходимости возможно введение инсулина перед завтраком. Следующим этапом является титрация дозы инсулина, проводимая каждые 3–4 дня, для достижения индивидуальных параметров метаболического контроля. Рекомендуется при гликемии натощак более 10,0 ммоль/л увеличить дозу на 6–8 МЕ инсулина, при гликемии более 8,0 ммоль/л — на 4–6 МЕ, а при гликемии более 6,5 ммоль/л — на 2 МЕ. Продолжительность периода титрования обычно составляет 6–12 нед, в это время регулярно оценивается динамика веса, при отрицательной динамике уменьшается калорийность рациона и, по возможности, увеличиваются физические нагрузки. Если однократное введение инсулина не обеспечивает адекватного гликемического контроля, можно рекомендовать двукратное введение пролонгированного инсулина или готовые смеси инсулинов в режиме двух- или трехкратного введения [14]. На следующем этапе определяется тактика дальнейшего лечения, отмена инсулинотерапии и монотерапия ПССП или продолжение комбинированной терапии. При неудовлетворительном метаболическом контроле, увеличении суточной дозы инсулина более 30–40 ЕД показана монотерапия инсулином.
Монотерапия инсулином у больных СД 2 типа проводится как в режиме традиционной инсулинотерапии, так и интенсифицированной инсулинотерапии (базис-болюсной). Значительный прогресс диабетологии связан с широким арсеналом различных видов инсулина, и практикующие врачи имеют возможность выбирать лечение, идя навстречу потребностям и возможностям пациента. В лечении СД 2 типа применимы любые режимы инсулинотерапии, позволяющие успешно контролировать гипергликемию и избежать нежелательной гипогликемии.
Возможные варианты режимов инсулинотерапии
Наиболее важная составляющая инсулинотерапии — это применение адекватных доз инсулина, обеспечивающих достижение и длительное поддержание целевых уровней гликемии, а не выбор того или иного варианта режима терапии.
Преимуществом инсулина по сравнению с ПССП является то, что ранняя инсулинотерапия у больных СД 2 типа лучше сохраняет эндогенную секрецию инсулина и обеспечивает более полный метаболический контроль (таблица).
Самым эффективным прандиальным регулятором является инсулин короткого действия. Подкожное введение препаратов инсулина короткого действия перед приемом пищи позволяет предупредить резкий подъем уровня глюкозы после еды.
Значительное снижение эндогенной секреции инсулина на протяжении СД 2 типа при неэффективности других, раннее применяемых режимов инсулинотерапии, требует необходимости базис-болюсной инсулинотерапии. Режим интенсивной инсулинотерапии возможен только у пациентов с сохранным интеллектом, без выраженных когнитивных нарушений, после соответствующего обучения и при условии регулярного мониторирования гликемии в течение суток, в том числе обязательного мониторирования в 3 ч ночи [14]. Интенсифицированная инсулинотерапия не показана больным, перенесшим инфаркт миокарда, острое нарушение мозгового кровообращения, а также лицам с нестабильной формой стенокардии [7, 9].
Выше мы уже упоминали о пересмотре показаний к инсулинотерапии при СД 2 типа, точнее говоря, о необходимости их расширения. Как правило, необходимость в инсулинотерапии прямо пропорциональна длительности диабета; по некоторым данным, через 10–12 лет после дебюта заболевания в подобном лечении нуждаются почти 80% больных. Многие пациенты, нуждающиеся в инсулинотерапии, но не являющиеся кандидатами на проведение интенсивной инсулинотерапии, могут достичь хорошей компенсации благодаря двухразовой базис-болюсной схеме.
В подобных случаях следует отдавать предпочтение готовой смеси инсулина в пропорции 30 : 70. Использование подобной готовой смеси инсулина обеспечивает рациональную и «физиологическую» пропорцию инсулина короткого действия (1 : 3) и средней продолжительности действия (2 : 3), которая покрывает потребность как в «болюсном», так и «базисном» инсулине у больных СД 2 типа.
Использование готовой смеси в пропорции 30 : 70, вводимой с помощью щприц-ручки, представляется рациональным, особенно для пожилых пациентов с СД 2 типа. Такой инсулин обладает преимуществом перед базисным инсулином, так как лечения только базальным инсулином, при отсутствии короткого, недостаточно для эффективного контроля гликемии после приема пищи. Терапия готовыми смесями в пропорции 30 : 70 начинается с суточной дозы 0,4–0,6 ЕД/кг массы тела, обычно разделенной поровну на 2 инъекции — перед завтраком и ужином, у части пациентов 2 : 3 суточной дозы назначается перед завтраком и 1 : 3 — перед ужином. Далее доза инсулина при необходимости постепенно увеличивается каждые 2–4 дня на 4–6 ЕД, до достижения целевых уровней контроля.
Побочные эффекты инсулинотерапии включают прибавку в весе, что также характерно для всех сахароснижающих препаратов, за исключением метформина, и гипогликемии. Повышение массы тела, наблюдаемое у больных СД 2 типа, находящихся на инсулинотерапии, обусловлено в первую очередь устранением последствий хронической гипергликемии: глюкозурии, дегидратации, энергозатрат. Среди других причин — восстановление положительного азотистого баланса, а также повышение аппетита. В начале терапии потребность в более высокой дозе инсулина у части больных обусловлена выраженной инсулинорезистентностью. Методы профилактики увеличения массы тела у больных СД 2 типа, находящихся на инсулинотерапии, включают обучение пациентов, ведение пищевого дневника, снижение калорийности рациона, ограничение употребления поваренной соли и повышение физической активности.
Значительным преимуществом в плане ограничения увеличения массы тела у больных СД типа 2 с избыточным весом обладает комбинированная терапия инсулином и метформином, для которой характерны не только дополнительное снижение гликемии натощак, но и уменьшение потребности в экзогенном инсулине (17–30%), а также низкий риск гипогликемий, липопротективный эффект.
Тяжелые гипогликемии отмечаются значительно реже у больных СД 2 типа, находящихся на инсулинотерапии, в сравнении с пациентами на интенсивной инсулинотерапии при СД 1 типа. Они гораздо чаще возникают и в ряде случаев имеют рецидивирующее течение при лечении СД 2 типа некоторыми производными сульфонилмочевины длительного действия, нежели при терапии инсулином.
Главным критерием адекватности дозы инсулина у больных СД 2 типа является уровень гликемии. В начале инсулинотерапии для достижения компенсации СД могут потребоваться бoльшие дозы инсулина, что в основном обусловлено снижением чувствительности к инсулину вследствие хронической гипергликемии и инсулинорезистентностью. При достижении нормогликемии потребность в инсулине уменьшается.
Основными параметрами метаболического контроля СД 2 типа являются показатели гликемии натощак и после приема пищи, уровень HbA1c. Согласно Федеральной целевой программе «Сахарный диабет», основной целью инсулинотерапии при СД 2 типа является достижение следующих параметров: гликемии натощак— ≤6,5 ммоль/л, гликемии через 2 ч после еды —
А. М. Мкртумян, доктор медицинских наук, профессор
Е. В. Бирюкова, кандидат медицинских наук, доцент
Н. В. Маркина
МГМСУ, Москва