Что лучше мовалис или реопирин
Боли в спине
Подбор лекарственных средств для лечения болей в спине
Доктор Перец ® — 100 % натуральное тепло для облегчения мышечных и суставных болей 1
Перцовый пластырь № 1 в России по объемам продаж 2
100 % натуральные экстракты красного перца и красавки 2
Основа, позволяющая коже дышать 3
1 Согласно ТУ Доктор Перец ®. Данное утверждение относится только к активным компонентам пластыря, оказывающим тепловой воздействие.
2 Лидер рынка перцовых пластырей по объему продаж в стоимостном и количественном выражении за период июль 2020‑июль 2021 на основе данных ООО «Айкьювиа Солюшнс»
3 Согласно ТУ Доктор Перец ®
Список лекарств от боли в спине
Форма выпуска
таблетки, покрытые пленочной оболочкой, порошок для приготовления суспензии для приема внутрь
«Дексалгин», «Дексалгин 25»
таблетки, покрытые оболочкой, раствор для внутривенного и внутримышечного введения
«Биоран», «Дикловит», «Флотак», «Раптен рапид», «Раптен Дуо», «Диклофенак ретард Оболенское», «Диклофенак-УБФ», «Табук-Ди», «Наклофен», «Наклофен СР», «Диклофенак-АКОС», «Диклофенак-ФПО», «Диклофенак-Эском»
таблетки пролонгированного действия, покрытые оболочкой, капсулы с модифицированным высвобождением, суппозитории ректальные, раствор для внутримышечного введения
таблетки, покрытые оболочкой
«Ибупрофен», «Бруфен СР», «Солпафлекс», «Ибупром Макс»,
таблетки, покрытые оболочкой, таблетки шипучие, таблетки для рассасывания,
капсулы пролонгированного действия, гранулы для приготовления раствора для приема внутрь, суспензия,
суппозитории ректальные (для детей), суспензия для приема внутрь (для детей)
раствор для внутривенного введения
Ибупрофен + кодеина фосфата гемигидрат
таблетки, покрытые оболочкой
таблетки, покрытые оболочкой
таблетки диспергируемые (для детей)
Ибупрофен + питофенон + фенпивериния бромид
таблетки, покрытые оболочкой
капсулы, таблетки, суппозитории ректальные, для внутримышечного введения
гранулы для приготовления раствора для приема внутрь
таблетки, раствор для внутривенного и внутримышечного введения
«Ксефокам», «Ксефокам рапид»
таблетки, покрытые оболочкой, лиофилизат для приготовления раствора для внутривенного и внутримышечного введения
«Матарен», «Мелоксикам», «Мовасин», «Мовикс», «Мовалис»,
таблетки, раствор для внутримышечного введения + суспензия для приема внутрь (Мовалис), суппозитории ректальные
таблетки, гранулы для приготовления суспензии для приема внутрь, суспензия для приема внутрь
раствор для внутримышечного введения
Миорелаксанты
Мильгамма композитум, Полиневрин®
«Мидокалм-Рихтер», «Толперизон с лидокаином-Ферейн»
раствор для внутривенного и внутримышечного введения
«Сирдалуд», «Тизанил», «Тизанидин-Тева», «Тизалуд»
капсулы с модифицированным высвобождением
таблетки, покрытые пленочной оболочкой, раствор для внутримышечного введения
NB! Ибупрофен в таблетках может быть как рецептурного, так и безрецептурного назначения, в отличие от других НПВП, у которых безрецептурными являются только наружные формы!
Форма выпуска
крем для наружного применения
Глюкозамин (глюкозамина сульфат, глюкозамина сульфата натрия хлорид)
таблетки, таблетки покрытые пленочной оболочкой, раствор для внутримышечного введения, порошок для приготовления раствора для приема внутрь
Хондроксид ® Максимум, «Фармаскин ТГК»
крем для наружного применения
Глюкозамин + ибупрофен + хондроитина сульфат
капсулы, таблетки покрытые пленочной оболочкой
гель для наружного применения
мазь для наружного применения
Глюкозамин + хондроитина сульфат + витамин Е
аэрозоль для наружного применения
крем для наружного применения
мазь для наружного применения
спрей для наружного применения дозированный
«Диклофенак», «Диклонат П», «Наклофен»,
гель для наружного применения
трансдермальная терапевтическая система, пластырь трансдермальный
гель для наружного применения
крем для наружного применения
гель для наружного применения
крем для наружного применения
аэрозоль для наружного применения
раствор для местного применения
гель для наружного применения
гель для наружного применения
трансдермальная терапевтическая система
Хондроксид ® Форте (мелоксикам+хондроитина сульфат&)
крем для наружного применения
мазь для наружного применения
гель для наружного применения
мазь для наружного применения
«Ваньтун Артиплас», «Перцовый пластырь Доктор перец с обезболивающим действием», «Перцовый пластырь» (белладонны листьев экстракт + перца стручкового плодов экстракт)
Витамины группы B
Дополнением к базовой анальгетической терапии может служить применение как «разогревающих», так и локальных «охлаждающих» средств, в частности трансдермальных систем на основе местных анестетиков (лидокаина и т. п.), блокирующих распространение болевых импульсов.
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Сравнительная эффективность нестероидных противовоспалительных препаратов при болях в спине
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В настоящее время боли в спине (БС) широко распространены, а в развитых странах, по данным экспертов ВОЗ, сравнимы с неинфекционной эпидемией, что в большинстве случаев связано с возрастающими нагрузками на человека [4]. Высокая инвалидизация лиц трудоспособного возраста вследствие поражений опорно-двигательного аппарата возводит проблему лечения БС в ранг актуальной. Популяционные исследования выявили ассоциацию болей в нижней части спины (БНС) с такими факторами, как пол и возраст, осанка, мышечная сила, подвижность позвоночника. В недавно проведенном в Швеции популяционном исследовании спинальных болей среди лиц в возрасте 35-45 лет установлено, что частота возникновения болей за последний год составила 66,3%, причем данный показатель среди женщин был незначительно выше, чем среди мужчин. У 25% респондентов возникли существенные проблемы с трудоспособностью, степенью нарушения функционального статуса. В Великобритании вследствие болей в спине в 1992 г. было потеряно 90 миллионов рабочих дней, что уступало только заболеваниям органов дыхания и кровообращения. При этом 75% больных составили пациенты от 30 до 59 лет, то есть в период максимальной трудоспособности.
Все случаи болей в спине делятся на первичные и вторичные.
Вторичный синдром БС может быть связан с врожденными аномалиями, травматическими поражениями позвоночника, опухолевыми и инфекционными процессами, остеопорозом, заболеваниями внутренних органов.
БС чаще всего развивается в возрасте от 20 до 50 лет (пик заболеваемости в возрасте от 35 до 45 лет). Именно в этой возрастной группе обычно диагностируют первичный (механический) синдром БС, тогда как у больных моложе 20 лет и старше 50 лет преобладает вторичный синдром БС (табл. 1).
Диагностика БС требует участия врачей разных специальностей: терапевта, ревматолога, невропатолога, ортопеда и хирурга, задачей которых, в частности, является исключение вторичного характера болей в нижней части спины.
Провоцирующими факторами острого течения БС могут быть травма, подъем непосильного груза, неподготовленные движения, длительное пребывание в нефизиологической позе, переохлаждения. Хроническая боль может возникать как после регресса острой боли, так и независимо от нее.
Лечение проводится с учетом формы заболевания и варианта его течения с использованием консервативного и хирургического подходов.
В настоящее время показания к хирургическому лечению сужены, поскольку накопились факты о том, что даже при очень хорошей методике хирургической декомпрессии и стабилизации заболевание склонно рецидивировать.
При обострении клинических проявлений БС ранее рекомендовался отдых в течение нескольких недель. Однако во всех исследованиях последних лет подчеркивается, что не постельный режим, а ранняя активизация больных должна быть главным компонентом программы лечения, что способствует улучшению питания межпозвонкового диска, в связи с чем постельный режим при остром течении ограничивается несколькими днями.
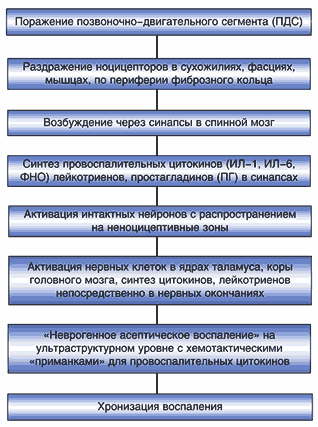
Дегенеративный процесс в межпозвонковом диске активирует ноцицепторы по периферии фиброзного кольца, в сухожилиях, фасциях, мышцах с последующей передачей импульсов в спинной мозг. При этом запускаются иммунные и биохимические реакции, завершающиеся формированием асептического нейрогенного воспаления. В связи с этим целесообразность назначения НПВП обоснована (схема 1) [3].
Схема 1. Механизмы асептического неврогенного воспаления при спондилоартрозе (Borenstein D., 2000).
В настоящее время появилась возможность применения такого НПВП, как кетопрофен (Кетонал) при остеоартрозе, а также при лечении болей в спине. Кетопрофен является производным пропионовой кислоты. Особенностью его противовоспалительного действия является не только ингибирование синтеза простагландинов на уровне циклооксигеназы; он также ингибирует липооксигеназу, обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны. При приеме внутрь препарат быстро и максимально полно абсорбируется из желудочно-кишечного тракта. Максимальная концентрация в крови достигается через 1-2 часа. Кетонал хорошо проникает в синовиальную жидкость и соединительную ткань. Значимые уровни концентраций достигаются уже через 15 минут после однократного внутримышечного введения 100 мг кетопрофена. Важным преимуществом препарата является то, что он представлен различными лекарственными формами: капсулами, таблетками форте и ретард, раствором для внутримышечных инъекций, кремом и суппозиториями.
Кетонал обладает «сбалансированной» активностью в отношении ингибиции ЦОГ-1 и ЦОГ-2, что позволяет оптимально сочетать высокую эффективность с хорошей переносимостью, сравнимой, по данным ряда авторов, с переносимостью селективных НПВП [3,5]. Исследователи связывают мощный болеутоляющий эффект Кетонала с его доказанным центральным воздействием, которое реализуется на уровне задних рогов спинного мозга, а также за счет непосредственного влияния на таламические центры болевой чувствительности, что, по-видимому, связано с угнетением синтеза простагландинов в ЦНС [4,5].
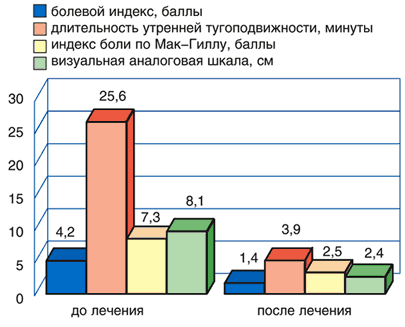
Рис. 1. Динамика клинических показателей у пациентов с болями в спине до и после лечения Кетоналом форте
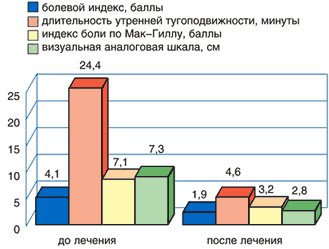
Рис. 2. Динамика клинических показателей у пациентов с болями в спине до и после лечения диклофенаком
Оценки эффективности лечения больным и врачом практически не отличались друг от друга и свидетельствовали о выраженной клинической эффективности препаратов. Высокая эффективность отмечена у 93,3% пациентов, принимавших Кетонал форте, у 73,3% пациентов, принимавших диклофенак.
Переносимость препарата «хорошая» или «очень хорошая» была отмечена у 80% больных, принимавших Кетонал, и у 64% принимавших диклофенак. Основными побочными эффектами при приеме как диклофенака, так и Кетонала были изжога, дискомфорт в эпигастральной области. Прекращение лечения потребовалось лишь в 1 случае, когда у пациента развилась крапивница на фоне приема диклофенака, которая была расценена, как побочный эффект средней степени тяжести.
Таким образом, в настоящее время лечение болей в спине оптимизировано использованием препаратов группы НПВП, в частности, Кетонала, в силу его высокой эффективности, проявляющейся отчетливо выраженной положительной динамикой с регрессом болевых проявлений у пациентов с БС.
1. Клинические рекомендации для практических врачей, основанные на доказательной медицине. Изд. дом «ГЭОТАР-МЕД», 2001, с. 606-611.
2. Насонов Е.Л. Нестероидные противовоспалительные препараты (перспективы применения в медицине). М., 2000, 262.
3. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ-2 в клинической практике. Русский медицинский журнал, том 10, №22, 2002, с 1014-1017.
4. Ветшев П.С., Ветшева М.С. Принципы аналгезии в раннем послеоперационном периоде. Хирургия, 2002, №12, с. 49-52.
5. Чичасова Н.В., Насонов Е.Л., Имаметдинова Г.Р. Применение кетопрофена (кетонал) в медицинской практике. Фарматека, 2003, №5, с. 30-32.
6. Borenstein D. «Эпидемиология, этиология, диагностическая оценка и лечение поясничной боли». Междун. Медиц. Журнал, 2000, №35, с. 36-42.
7. WHO. Department of noncomunicable disease menagement. Low back pain iniciative. Geneve.1999.
Традиционные нестероидные противовоспалительные препараты: место «золотого стандарта» вакантно
Врачи, профессиональные обязанности которых связаны с необходимостью лечения большого числа больных, испытывающих хроническую боль неонкологической природы (прежде всего, ревматологи и неврологи), нуждаются в наличии среди своего терап
Врачи, профессиональные обязанности которых связаны с необходимостью лечения большого числа больных, испытывающих хроническую боль неонкологической природы (прежде всего, ревматологи и неврологи), нуждаются в наличии среди своего терапевтического арсенала эффективных, удобных и недорогих анальгетических препаратов. Такую позицию на современном фармакологическом рынке занимают неселективные нестероидные противовоспалительные препараты (н-НПВП) [1, 2]. Это большое семейство т. н. «традиционных» средств, основное фармакологическое действие которых связано с блокадой циклооксигеназы-2 (ЦОГ-2) и снижением синтеза провоспалительных простагландинов, терапевтическое применение которых насчитывает более 130 лет — с того момента, когда были опубликованы первые данные об эффективности салициловой кислоты при остром ревматизме [3]. На сегодняшний день в России зарегистрировано и широко используется 11 представителей группы н-НПВП: ацетилсалициловая кислота, ибупрофен, индометацин, пироксикам, лорноксикам, кетопрофен, декскетопрофен, напроксен, кеторолак, диклофенак и ацеклофенак.
Диклофенак долгое время считался «золотым стандартом» среди НПВП. Обладая умеренной селективностью в отношении ЦОГ-2 (соотношение ингибирующей активности в отношении этого фермента и его физиологической изоформы ЦОГ-1 составляет примерно 1:1), этот препарат сочетает высокую обезболивающую и противовоспалительную активность и обладает вполне удовлетворительной, по сравнению с большинством других н-НПВП, переносимостью [2, 4, 5]. Так, в 1994 г. Henry D. и сотр. провели анализ всех доступных им данных по частоте развития желудочно-кишечных кровотечений и перфорации язв при использовании различных НПВП, что позволило авторам представить градацию основных представителей этой лекарственной группы в зависимости от риска развития опасных ЖКТ-осложнений. Диклофенак занимал в этом списке почетное второе место, лишь в 2 раза превышая по токсичности наиболее безопасный по тем временам препарат из группы н-НПВП — ибупрофен и далеко оставив позади такие популярные лекарства, как индометацин, пироксикам и кетопрофен [6]. Последующие исследования подтвердили это соотношение. Так, в популяционном исследовании Lanas A. и сотр. (2006) среди н-НПВП риск развития ЖКТ-осложнений на фоне приема диклофенака и ибупрофена также оказался в несколько раз меньше, чем при использовании трех указанных выше препаратов [7].
При этом необходимо отметить, что ибупрофен является относительно безопасным средством лишь при использовании его в низких, анальгетических дозах (до 1600 мг/сутки). Повышение дозы этого препарата закономерно сопровождается нарастанием риска развития лекарственных осложнений, и в стандартных противовоспалительных дозах (до 2400 мг/сутки) он не менее опасен, чем индометацин [6].
Переносимость диклофенака успешно выдерживала сравнение с селективными НПВП в ходе ряда рандомизированных контролируемых исследований (РКИ), в частности, масштабного 18-месячного MIDAL (диклофенак vs этерококсиб, n = 34,701) [8]. Это позволило одному из ведущих мировых экспертов по вопросу эффективности и безопасности этого класса лекарственных средств Singh G. отнести этот препарат к числу «низкотоксичных» НПВП. Мнение Singh G. подтверждается данными популяционного исследования «Comparing Apples with Oranges…» («Сравнение яблок и апельсинов…»), в котором оценивался риск развития опасных ЖКТ-осложнений у 688424 жителей Калифорнии, США, в 1999–2005 гг. регулярно принимавших различные НПВП. Оказалось, что диклофенак вызывал серьезные нежелательные эффекты на 30% чаще, чем знаменитые своей безопасностью «коксибы» — целекоксиб (относительный риск, ОР 0,72) и валдекоксиб (ОР 0,73), и достоверно не отличался от рофекоксиба, но при этом существенно превосходил по своей безопасности такой популярный в США НПВП, как напроксен [9].
Однако следует быть откровенным — слава «золотого стандарта» среди НПВП была завоевана не абстрактным диклофенаком, а оригинальным препаратом, созданным швейцарской компанией Ciba-Gaigi. Этот препарат, в настоящее время выпускаемый фирмой «Новартис», до сих пор широко используется во всем мире, и именно он применялся в ходе большинства известных клинических исследований НПВП, предусматривающих назначение диклофенака в качестве препарата сравнения [2, 4, 5].
К сожалению, репутация диклофенака в нашей стране была испорчена после появления на фармакологическом рынке огромного количества генериков этого препарата. Эффективность и безопасность подавляющего большинства этих «диклофенаков» не была проверена в ходе хорошо организованных и длительных РКИ [5]. Правда, генерики дешевы и вполне доступны социально незащищенным слоям населения нашей страны, что сделало диклофенак самым популярным НПВП в России. По данным опроса 3000 больных в 6 регионах России и Москве, регулярно получающих НПВП, этот препарат использовали 72% респондентов [10]. Однако низкая стоимость, пожалуй, является единственным достоинством дешевых генериков.
Именно с генерическим диклофенаком в последнее время связано наибольшее абсолютное число опасных лекарственных осложнений, наблюдаемых в нашей стране. По нашим данным, среди 3088 ревматологических больных, регулярно принимавших диклофенак, язвы и эрозии ЖКТ были выявлены у 540 (17,5%). Интересно, что частота ЖКТ-осложнений на фоне приема диклофенака не отличалась от частоты подобных осложнений, возникших при использовании общепризнанно более токсичных препаратов — индометацина (17,7%) и пироксикама (19,1%) [11].
Очень важно мнение самих пациентов о безопасности лекарственного препарата, и мнение это основывается, прежде всего, на его субъективной переносимости. Ведь в реальной клинической практике риск развития НПВП-гастропатии — бессимптомных язв и относительно редких, угрожающих жизни осложнений — кровотечений и перфорации (эта патология возникает, к счастью, менее чем у 1 из 100 больных в течение года регулярного приема НПВП) беспокоит пациентов меньше, чем появление выраженной диспепсии. Боли в эпигастральной области, тяжесть и тошнота возникают как минимум у каждого пятого больного, получающего НПВП (по нашим данным, более 30%), причем сами больные определяют четкую взаимосвязь между развитием этих симптомов и приемом лекарств [10, 12–14].
Важно отметить, что развитие диспепсии, в отличие от НПВП-гастропатии, в большей степени определяется контактным действием НПВП, следовательно, зависит от фармакологических свойств конкретного препарата. Зачастую препараты различных коммерческих фирм, содержащие одно и то же действующее вещество, обладают различной переносимостью, и это, прежде всего, относится к дешевым генерикам диклофенака [12].
Из-за широкого применения генериков, существенно потеснивших на фармакологическом рынке более качественный, но существенно более дорогой оригинальный препарат, у многих российских врачей и пациентов создалось мнение о диклофенаке как о препарате с умеренной эффективностью, но с высоким риском нежелательных эффектов. К сожалению, хотя ведущие российские эксперты неоднократно заявляли о существенных различиях в эффективности и безопасности между оригинальным диклофенаком и его дешевыми копиями, до настоящего времени не было проведено каких-либо серьезных клинических исследований в нашей стране для того, чтобы подтвердить это положение.
Другим аспектом проблемы безопасности диклофенака является повышение риска кардиоваскулярных катастроф. Этот вопрос активно обсуждается в последние годы в свете печально знаменитого «кризиса коксибов» и повышенного внимания к возможности класс-специфического негативного влияния НПВП на состояние сердечно-сосудистой системы. Так, согласно данным, полученным McGettigan P. и Henry D. (2006) в ходе метаанализа наиболее крупных наблюдательных и когортных исследований НПВП, применение диклофенака ассоциируется с наибольшим риском развития инфаркта миокарда, по сравнению с другими популярными н-НПВП. Для диклофенака ОР этого тяжелого осложнения составил 1,4, в то время как для напроксена 0,97, для пироксикама 1,06, для ибупрофена 1,07 и для индометацина 1,3 [15].
Определенную тревогу при использовании диклофенака вызывает возможность развития такого редкого, но потенциально угрожающего жизни осложнения, как острый лекарственный гепатит и острая печеночная недостаточность [16]. Еще в 1995 г. медицинским контролирующим органом США (FDA) были представлены данные анализа 180 случаев серьезных осложнений со стороны печени при использовании этого препарата, в т. ч. приведшие к летальному исходу. При этом в США диклофенак не являлся столь широко используемым НПВП (уступая ацетилсалициловой кислоте, ибупрофену и напроксену). К моменту проведения анализа диклофенак применялся в США лишь 7 лет, поскольку был допущен FDA на фармакологический рынок этой страны только в 1988 г. [17].
Суммируя вышесказанное, мы можем заключить, что на сегодняшний день диклофенак не может считаться истинным «золотым стандартом» среди н-НПВП, прежде всего потому, что достаточно высокая частота нежелательных эффектов, возникающих на фоне приема этого препарата, уже не соответствует современным представлениям о безопасной анальгетической терапии.
Альтернативой диклофенака на российском фармакологическом рынке может стать его «ближайший родственник» ацеклофенак. Этот интересный препарат обладает существенными достоинствами — прежде всего, высокой эффективностью, безопасностью и доступностью, позволяющей ему претендовать на место н-НПВП с наилучшим на сегодняшний день сочетанием фармакологических свойств. Ведущие зарубежные и российские эксперты и, прежде всего, академик В. А. Насонова высказали свое положительное мнение по данному вопросу [18–21].
Ацеклофенак — производное фенилацетиловой кислоты, являющейся представителей промежуточной группы (выделяемой отдельными авторами) «преимущественно селективных ЦОГ-2 ингибиторов». Так, по данным Saraf S., соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 у этого препарата составляет 0,26, и это меньше, чем у эталонного селективного ингибитора ЦОГ-2 целекоксиба — 0,7, хотя и больше, чем у рофекоксиба — 0,12 [22]. Исследование Hinz B. и соавт. (2003) показало, что после приема 100 мг ацеклофенака активность ЦОГ-2 в нейтрофилах человека блокируется более чем на 97%, в то время как активность «физиологической» ЦОГ-1 лишь на 46%. Для приема 75 мг диклофенака это соотношение было существенно хуже и составляло 97% и 82% соответственно [23].
Ацеклофенак обладает высокой биодоступностью, быстро и полностью всасываясь после перорального приема, при этом пиковая концентрация в плазме достигается через 1–3 часа. В человеческом организме он практически полностью метаболизируется в печени, основным его метаболитом является биологически активный 4-гидроксиацеклофенак, а одним из дополнительных, что интересно, диклофенак. В среднем через 4 часа половина препарата покидает организм, причем 70–80% экскретируется с мочой, а примерно 20% попадает в кал. Концентрация препарата в синовиальной жидкости составляет 50% от плазменной [22, 24].
Помимо основного фармакологического эффекта (блокады ЦОГ-2), для ацеклофенака доказано подавление синтеза важнейших провоспалительных цитокинов — таких как интерлейкин-1 (ИЛ-1) и фактор некроза опухоли (ФНО-альфа) [22]. Снижение ИЛ-1 — ассоциированной активации металлопротеиназ является одним из важнейших механизмов, которым определяется позитивное влияние ацеклофенака на синтез протеогликанов суставного хряща. Это свойство относится к числу главных достоинств этого препарата, поскольку служит дополнительным аргументом в плане целесообразности его использования при наиболее частом ревматологическом заболевании — остеоартрозе (ОА) [21, 24]. Масштабным подтверждением этого факта стало исследование Dingle J. (1999), в ходе которого было проанализировано влияние 13 различных НПВП на состояние хряща (650 проб, взятых у больных с ОА и в качестве контроля материал от 180 лиц без патологии суставов). Согласно полученным результатам, ацеклофенак был отнесен к числу препаратов, активно подавляющих катаболизм хрящевой ткани. Это особенно важно, учитывая тот факт, что для многих других н-НПВП — индометацина, ибупрофена и диклофенака in vitro показано отсутствие эффекта или даже негативное влияние на состояние суставного хряща [25].
Такие данные были получены, в частности, в исследовании Blot L. и соавт. (2000), материалом для которого послужили биоптаты медиального надмыщелка бедра от 40 больных умеренно выраженным или тяжелым гонартрозом. Хрящевая ткань была инкубирована с добавлением меченого глюкозамина в присутствии или отсутствии (контроль) ацеклофенака, мелоксикама и диклофенака. В дальнейшем с использованием анион-обменной хромотографии оценивалась концентрация хондроитина и гиалуроновой кислоты как маркеров активности хрящевого метаболизма. Согласно полученным результатам, диклофенак не оказывал значимого эффекта на метаболизм хряща, в то время как ацеклофенак и мелоксикам имели достоверно стимулирующее влияние [26].
Ацеклофенак применяется в клинической практике с конца 80-х годов, и по данным на 2004 г. им было пролечено более 75 млн человек в мире [18]. В настоящее время на фармакологическом рынке представлено 18 различных препаратов ацеклофенака: Aceclofar (AE); Aceflan (BR); Air-Tal (BE); Airtal (CL, ES, PT); Airtal Difucrem (ES); Aital (NL); Barcan (DK, FI, NO, SE); Beofenac (AT, DE); Berlofen (AR); Biofenac (BE, GR, NL, PT); Bristaflam (AR, CL, MX); Falcol (ES); Gerbin (ES); Locomin (CH); Preservex (GB); Proflam (BR); Sanein (ES); Sovipan (GR). В России ацеклофенак зарегистрирован с 1996 г. и используется под торговой маркой «Аэртал».
Доказательная база эффективности и безопасности ацеклофенака хорошо представлена в работе Dolley M. (2001). Эта работа является, вероятно, наиболее крупным метаанализом, оценивающим результаты 13 РКИ с активным контролем (n = 3574), а также наблюдательных, когортных и нерандомизированных исследований (суммарно 142746 больных). Доказана эффективность ацеклофенака в отношении выраженности боли при ревматических и неревматических заболеваниях, улучшение функции и повышение активности при остеоартрозе и дорсопатиях, а также влияние на число воспаленных суставов и утреннюю скованность при ревматоидном артрите и анкилозирующем спондилоартрите. При этом лечебное действие этого препарата не меньше, а в ряде ситуаций несколько выше, по сравнению с диклофенаком, кетопрофеном, ибупрофеном и напроксеном [24].
Наибольшее число хорошо организованных исследований эффективности и безопасности ацеклофенака связано с лечением ОА. При этом заболевании ацеклофенак успешно выдержал сравнение с парацетамолом, пироксикамом, напроксеном и диклофенаком (табл.).
Так, в недавней работе Batlle-Gualde E. и соавт. (2007), 168 больных ОА в течение 6 недель принимали ацеклофенак 200 мг/сутки или парацетамол 3 г/сутки. Исследование выявило несомненное преимущество ацеклофенака — снижение боли по ВАШ было больше на 7,6 мм, индекса Лекена на 1,6, отсутствие эффекта отмечалось лишь у 1 больного (при приеме парацетамола — у 8), р = 0,001. Суммарное число каких-либо нежелательных эффектов не различалось и составило 29% и 32% соответственно [27].
В 12-недельном РКИ Ward D. и сотр. (1995) было показано более высокое лечебное действие ацеклофенака в дозе 200 мг/сутки по сравнению с диклофенаком 150 мг/сутки у 397 больных ОА. Так, существенное (более 50%) уменьшение выраженности боли отмечалось у 71% и 59% больных (р = 0,005) соответственно. При этом неприятные симптомы со стороны ЖКТ достоверно реже возникали на фоне приема ацеклофенака, в частности, диарея возникла лишь у 1%, в то время как при терапии диклофенаком у 6,6% больных [28].
По результатам аналогичного по дизайну, длительности и размеру исследуемой группы (n = 374) исследования Kornasoff D. и сотр. (1997), ацеклофенак 200 мг был столь же эффективен, как напроксен 1000 мг/сутки в отношении выраженности боли и нарушения функции у больных гонартрозом. При этом нежелательные эффекты возникли у 12,6% и 16,3% больных соответственно [29].
Близкие данные были получены Perez Busquier M. и сотр. (1997). В этом 2-месячном РКИ (n = 240, больные с гонартрозом) лечебное действие ацеклофенака 200 мг/сутки оказалось аналогично эффекту пироксикама 20 мг/сутки. Однако диспепсия возникла у 24 и 33 больных, при этом у 7 больных, получавших пироксикам, нежелательные эффекты явились причиной отмены терапии, а у одного развилось опасное желудочно-кишечное кровотечение, в то время как серьезных осложнений на фоне ацеклофенака не было [30].
Ацеклофенак хорошо зарекомендовал себя при лечении ревматоидного артрита (РА). В работе Martin-Mele E. и сотр. (1998) эффективность этого препарата в дозе 200 мг/сутки сравнивалась с кетопрофеном 200 мг/сутки у 169 больных РА. В течение трех месяцев наблюдения оба препарата обеспечивали существенное снижение выраженности боли, улучшение общего самочувствия, при этом также было отмечено достоверное уменьшение выраженности артритов (снижение индекса Ричи) и длительности утренней скованности. Ацеклофенак был несколько более эффективен — лечение было прервано из-за неэффективности лишь у 4 больных, в то время среди принимающих кетопрофен — у 7. Очень важно, что ацеклофенак продемонстрировал лучшую переносимость, поскольку побочные эффекты стали причиной его отмены у 2 больных, по сравнению с 11 больными, получавшими препарат сравнения [31].
Эффективность ацеклофенака была показана не только при ревматических заболеваниях, но и при таком нередком патологическом состоянии, как дисменорея. Так, Letzel H. и сотр. (2006) показали, что однократное или повторное применение ацеклофенака столь же успешно купирует боли, как и напроксен 500 мг, существенно превосходя действие плацебо [33].
Возможность использования ацеклофенака в комплексной терапии послеоперационной боли была изучена на классической модели стоматологических манипуляций (экстракция зуба). В работе Presser Lima P. и сотр. (2006) было показано, что этот препарат оказывал эффективное обезболивающее действие, особенно в той ситуации, если первый прием проводился в режиме «предоперационной анальгезии», т. е. за 1 час до удаления зуба [34].
Наиболее крупным исследованием, посвященным изучению эффективности ацеклофенака в реальной клинической практике, стала европейская программа оценки удовлетворенности врачей и пациентов результатами анальгетической терапии (Lammel E. и сотр., 2002). Исследуемую группу составили 23 407 больных в Австрии, Бельгии, Голландии и Греции, испытывающих боли, связанные с ревматической патологией (РА, ОА, АС и дорсопатии), травмами и перенесенными операциями. Любопытно, что более половины из них были неудовлетворены предшествующей терапией НПВП, что явилось причиной для перехода на ацеклофенак. Длительность терапии и число визитов не лимитировались и определялись лечащими врачами исходя из клинической ситуации.
Результаты исследования были оценены его организаторами как превосходные. В конце периода наблюдения 85% больных оценили эффективность ацеклофенака как «очень хорошую», у 32% отмечалось полное купирование боли, а число пациентов, на момент включения оценивающих боль как «тяжелую», сократилось с 41% до 2% [35].
Фактически параллельно с работой Lammel E. и сотр. в Великобритании было проведено знаменитое исследование SAMM, целью которого было сравнительное изучение безопасности ацеклофенака в реальной клинической практике (контролем выступил диклофенак) (рис. 1). Ацеклофенак был назначен 7890, а диклофенак 2252 пациентам с РА, ОА и АС сроком на 12 месяцев. Исследование завершили 27,9% и 27,0% больных, средняя длительность приема НПВП составила около полугода. Полученные данные вполне оправдали надежды исследователей — ацеклофенак достоверно превосходил препарат сравнения по своей безопасности: суммарное число осложнений составило 22,4% и 27,1% (р
А. Е. Каратеев, доктор медицинских наук
ГУ ИР РАМН, Москва