Что лучше супракс или спектрацеф при пневмонии
Каждый, кто хоть раз сталкивался с приемом антибиотиков, знает, что это мощные препараты, которые не назначают просто так. Мы поговорим о препарате Супракс, созданного на основе цефалоспоринов 3 поколения.
Показания
Супракс предназначен для лечения инфекционно-воспалительных процессов, вызванных бактериями, которые чувствительны к цефиксиму. Поэтому перед началом приема необходимо сдать анализы на определение возбудителя инфекции.
Таким образом, Супракс применяют при следующих заболеваниях:
Противопоказания
Антибиотик имеет ряд противопоказаний, среди них:
Побочные эффекты
Во время терапевтического лечения Супракс может вызвать следующие побочные эффекты:
Обычно данные побочные реакции не проявляются достаточно ярко и слабо выражены. Поэтому в большинстве случаев не требуют прекращения лечения.
Как принимать Супракс
Согласно инструкции по применению, Супракс принимают 1 раз в день внутрь вне зависимости от приема пищи.
Как правильно пить Супракс
Капсулы для приема внутрь
Суспензия для приема внутрь
Чтобы правильно приготовить суспензию, встряхните гранулы во флаконе, постепенно влейте в него 40 мл прохладной воды, каждый раз тщательно взбалтывая до образования однородной суспензии. Если приготовление во флаконе невозможно, то стоит использовать стеклянную либо эмалированную посуду. Для полного растворения гранул, стоит дать постоять получившемуся раствору около пяти минут. Суспензию Супракс можно не хранить в холодильнике.
Продолжительность курса терапии зависит от диагноза, тяжести течения заболевания, наличия осложнений и особенностей организма пациента. Ее определяет лечащий врач. В среднем лечение длится 7-10 дней.
Стоит отметить, что при продолжительном приеме Супракса у пациента может возникнуть хроническая диарея и последующее развитие тяжелого колита.
Также, на фоне приема лекарственного средства могут наблюдаться головокружения или приступы сильной головной боли. Лучше воздерживаться от управления автомобилем, сложной техникой, требующей немедленного реагирования или концентрации.
Супракс во время беременности и ГВ
Прием Супракса во время беременности назначается только при наличии угрозы жизни матери. Причем это возможно только во втором и третьем триместрах. В первом триместре прием Супракса может вызвать аномалии или врожденные уродства у плода.
Супракс при беременности
В период лактации Супракс противопоказан. Если препарат все-таки назначен, необходимо перевести ребенка на искусственное вскармливание.
Аналоги Супракса
Знаете, чем именно Супракс лучше аналогов? Он применяется для лечения агрессивных возбудителей, и достаточно эффективно. И все это амбулаторно! Также препарат может применяться постепенно, то есть у врача есть возможность назначить ступенчатую терапию. Это необходимо при довольно серьезных случаях. Лечение начинают с парентеральных форм цефалоспоринов 3 поколения, а через 2-3 дня, когда состояние пациента улучшилось, переходят на пероральный прием Супракса.
Аналогичным терапевтическим эффектом с капсулами Супракс обладают следующие препараты:
Синонимами (препаратам, имеющими в составе то же действующее вещество) являются:
Помните, что заменять один препарат другим может только лечащий врач, который учитывает не только тяжесть состояния пациента, характер течения болезни, но и противопоказания и возможные побочные эффекты.
Супракс/Панцеф
В основе данных антибиотиков одно и то же активное вещество. Если ориентироваться на отзывы пациентов, то при приеме Панцефа организм реже проявляет негативные реакции в виде побочных эффектов.
Супракс/Сумамед
Сумамед в своей основе содержит азитромицин, который обладает более широким антимикробным действием. Сумамед назначают детям, он вызывает меньше побочных эффектов и продолжительность курса меньше.
Супракс/Амоксиклав
В отличие от Амоксиклава Супракс лучше переносится и реже вызывает дисбактериоз и другие расстройства ЖКТ.
Дополнительная информация о препарате
Итак, цефалоспорины – антибиотики, которые характеризуются широким спектром воздействия, они отличаются высокой бактерицидностью и невосприимчивостью к бета-лактамазам (ферментам бактерий, которые разрушают антибиотик, в результате чего его действие становится неэффективным). В общем, в каком-то смысле, цефалоспорины эффективнее пенициллинов. И вот в основе Супракса как раз цефалоспорины третьего поколения. И это первый такой антибиотик, который можно принимать внутрь. В основе Супракса – цефиксим. Цефиксим влияет на клеточную стенку патогена, угнетая ее образование.
Супракс угнетает жизнедеятельность стрептококков, гемофильной, кишечной палочки, протей, сальмонеллы, цитробактера и гонококков. Однако Супракс бессилен перед синегнойной палочкой, большинством стафилококков, энтеробактеров и листерий. Что касается приема препарата, то еда никак не влияет на его биодоступность. Да, удлиняет период достижения максимального содержания в крови и только. Супракс еще хорош тем, что принимать его нужно один раз за день. Это связано с временем полувыведения препарата из организма. Он выводится долго. С мочой выходит около 50% лекарства. И это здорово, потому что это эффективно помогает при лечении инфекций мочевыводящих путей. Однако с диуретиками его лучше не принимать, так как вывод лекарства замедляется. Вообще Супракс отлично проникает к месту инфекции. Основными очагами инфекции, с которыми взаимодействует Супракс, являются полость среднего уха, придаточные пазухи носа, миндалины, легкие, желчные пути. Если ориентироваться на отзывы пациентов о приеме Супракса, то они отмечают незначительное угнетение миклофлоры кишечника. Вы можете найти Супракс в двух лекарственных формах, которые ориентированы на разные возрастные группы: капсулы по 400 мг для взрослых пациентов и гранулы для приготовления суспензии с клубничным вкусом 100 мг/5 мл – 60 мл для детей.
Эффективность цефалоспорина III поколения цефиксима (супракса) при заболеваниях органов дыхания у детей
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из важнейших компонентов комплексного лечения заболеваний органов дыхания у детей. Оптимизация антибиотикотерапии при лечении заболеваний органов дыхания должна подчиняться основным принципам, с одной стороны, соответствия строгим показаниям и адекватного выбора наиболее эффективного препарата с учетом антибиотикограммы и, с другой — отказа от необоснованного назначения антибиотика. Необходимо учитывать тяжесть течения и период заболевания, чувствительность микрофлоры бронхов к назначенному препарату, наличие и характер побочных явлений антибиотика, а также дозу препарата с учетом возрастных особенностей. Выбор антибактериального препарата и путей его введения у детей до сих пор представляет сложную задачу для врача, особенно при рецидивирующих и хронических бронхолегочных заболеваниях.
В настоящее время фармацевтическая промышленность располагает огромным арсеналом антибактериальных пероральных средств, которые находят широкое применение в практике в связи с наличием лекарственных форм, предназначенных для детей, в виде суспензий, сиропов, таблеток с соответствующей дозировкой. Оценивая классические пути введения антибиотиков, а именно парентеральный (внутривенный и внутримышечный) и пероральный, в ряде случаев у детей следует отдать предпочтение последнему, как наиболее щадящему, исключающему психотравмирующий эффект. Парентеральный путь введения препарата, зарекомендовавший себя как основной метод лечения болезней органов дыхания, при многих несомненных достоинствах (точность дозирования, высокие пиковые концентрации) не лишен недостатков. Это, в первую очередь, связано с опасностью возможного переноса инфекции, вероятностью послеинъекционных осложнений, а также психотравмирующим действием инъекций как болезненного фактора. Все это диктует необходимость дифференцированного подхода к выбору методов введения антибиотиков и разумного ограничения показаний к парентеральному введению препаратов у детей.
Особого внимания заслуживает также внедрение в детскую практику «ступенчатого» метода лечения, сокращающего сроки парентерального введения антибиотиков до 2–5 дней. Он заключается в переходе на прием адекватного антибиотика внутрь перорально при наметившемся положительном клиническом эффекте.
Трудно переоценить значение создания новых пролонгированных форм антибиотиков, способствующих сокращению кратности их введения и обладающих не только широким спектром действия, но и низкой токсичностью, что особенно важно для детей.
Использование антибиотиков внутрь, особенно пролонгированных форм, значительно уменьшает риск распространения инфекционных заболеваний, снижает нагрузку на медицинский персонал и позволяет шире применять препараты как в стационаре, так и в поликлинических условиях.
Однако следует подчеркнуть, что прием антибиотиков внутрь (оральная антибактериальная терапия) как стартовое лечение наиболее показано при легких и среднетяжелых формах болезни, в том числе при заболеваниях верхних дыхательных путей, неосложненных острых пневмониях и обострениях хронических и рецидивирующих воспалительных бронхолегочных заболеваний.
Многолетний клинико-бактериологический мониторинг, проведенный в НИИ педиатрии НЦЗД РАМН, позволил установить, что микробный спектр при хронических бронхолегочных заболеваниях у детей в периоде обострения представлен в основном 3 пневмотропными микроорганизмами [1]. При этом Haemophilus influenzae является доминирующим причинным фактором инфекционного процесса, составляя 61–70%, из которых в 27% случаев она находится в ассоциации с Streptococcus pneumonia. Streptococcus pneumoniae выделяется у 36% больных. Значительно реже определяется участие в этиологии хронического воспаления Branchamella catarrhalis — 4–10%, Рroteus mirabilis — 2,2%, Klebsiella pneumoniae — 1,1%, Streptococcus pyogenes — 1,1%, Staphylococсus aureus — 0,1% [1].
Учитывая распространенность устойчивых к препаратам пенициллинового ряда и макролидам штаммов микроорганизмов, а также их высокую b-лактамазную активность, в том числе Haemophilus influenzae и Branchamella catarrhalis, препаратами выбора при рецидивирующих и хронических заболеваниях органов дыхания являются цефалоспорины II и III поколения.
Сравнительное изучение бактериологической активности цефалоспоринов I, II и III поколений по отношению к пневмотропным бактериям, выделяемым при бронхолегочных заболеваниях у детей, позволило установить высокую бактериологическую активность цефалоспоринов III поколения (табл. 1). При этом четко показано отсутствие существенной разницы в активности парентеральных и пероральных форм антибиотиков по отношению к основным этиологически значимым микробам при данной патологии [2]. Все это обосновывает применение пероральных форм цефалоспориновых антибиотиков III поколения при рецидивирующих и хронических бронхолегочных заболеваниях.
В последние годы внимание педиатров привлечено к полусинтетическому оральному цефалоспориновому антибиотику III поколения цефиксиму (супраксу), характеризующемуся широким спектром действия и высокой активностью в отношении грамотрицательных микроорганизмов: Haemophilus influenzae, Branchamella catarrhalis, в том числе лактамазообразующих бактерий, большинства штаммов энтеробактерий, таких, как Klebsiella pneumoniae, Escherichia coli и пр., а также в отношении протеев [3,4,5].
Супракс обладает бактерицидным механизмом действия, и по степени активности против Haemophilus influenzae и Branchamella catarrhalis он не уступает парентеральным цефалоспоринам III поколения, характеризуется пролонгированной фармакокинетикой, созданием эффективной концентрации в крови и очагах воспаления, в тканях и жидкостях организма. Важным является образование эффективной концентрации цефиксима в мокроте (0,016-0,04), в легочной ткани (0,04-0,22) и в других тканях верхних дыхательных путей. Минимальная подавляющая концентрация цефиксима составляет: в отношении Streptococcus pneumoniae — 0,01-0,25, Haemophilus influenzae — 0,06-0,25, Branchamella catarrhalis — 0,01-0,8 (3,6). Достоинство препарата заключается также в наличии детской лекарственной формы для приема внутрь в виде суспензии (для детей в возрасте от 6 месяцев до 8 лет в дозе 8 мг на 1 кг массы) и капсул (для детей старше 12 лет в дозе 400 мг), обладающих пролонгированным действием, что обеспечивает однократный прием антибиотика.
Основными показаниями для назначения цефиксима (супракса) у детей являются заболевания верхних и нижних дыхательных путей при установленной или вероятной этиологии воспаления, вызванной чувствительными штаммами микробов (табл. 2).
Курс лечения цефиксимом (супраксом) при острой пневмонии составляет 7–10 дней, при обострении рецидивирующего бронхита — 7–10 дней, при обострении хронических воспалительных бронхолегочных заболеваний — 10–14 дней и более.
Высокая клиническая и бактериологическая эффективность цефиксима (супракса) доказана, в том числе при многоцентровых исследованиях у детей при заболеваниях органов дыхания [4, 5, 6, 7, 8].
Нами проведено изучение эффективности и безопасности супракса у 61 ребенка в возрасте 3–15 лет при обострениях рецидивирующего бронхита (15 детей), хронических воспалительных бронхолегочных заболеваний (46 детей), развившихся в результате неблагоприятного исхода острых пневмоний с формированием хронического бронхита на основе пневмосклероза, деформации бронхов и бронхоэктазов, а также на фоне врожденных пороков развития бронхов и легких. Все дети в периоде обострения бронхолегочного процесса получали наряду с супраксом комплексную терапию, включающую муколитические, мукорегуляторные и бронхоспазмолитические препараты по показаниям, кинезитерапию. Клиническая эффективность выявлена у 54 из 61 (88,6%) больного. Она характеризуется:
Клиническая эффективность препарата подтверждается результатами бактериологических исследований. Эрадикация микробов из мокроты или бронхиального секрета к 6-7-му дню лечения супраксом наблюдалась:
Однако у 4 детей при эрадикации Haemophilus influenzae на фоне приема цефиксима был выделен Streptococcus pneumoniae. Возможно, у этих больных имела место реинфекция.
Как правило, дети хорошо переносили препарат, и побочных эффектов не наблюдалось.
В заключение следует отметить высокую эффективность нового перорального цефалоспоринового антибиотика III поколения цефиксима (супракса) при лечении острых, рецидивирующих и хронических воспалительных заболеваний органов дыхания у детей. Наличие детской лекарственной формы (суспензии), пероральный способ приема 1 раз в сутки, широкий спектр действия, высокая чувствительность основных этиологически значимых бактерий, отсутствие выраженных побочных эффектов, щадящий метод лечения — все это ставит препарат в число перспективных антибактериальных средств в педиатрической практике, что особенно важно при нарастании резистентности микробов к другим антибиотикам. Эти качества позволяют применять супракс у детей раннего и старшего возраста не только в стационаре, но и в амбулаторных условиях при заболеваниях органов дыхания, в том числе при лечении рецидивирующих и хронических заболеваний органов дыхания.
По вопросам литературы обращайтесь в редакцию.
Е. В. Середа, доктор медицинских наук, профессор
Л. К. Катосова, доктор биологических наук, профессор
И. К. Волков, доктор медицинских наук
Научный центр здоровья детей РАМН, Москва
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
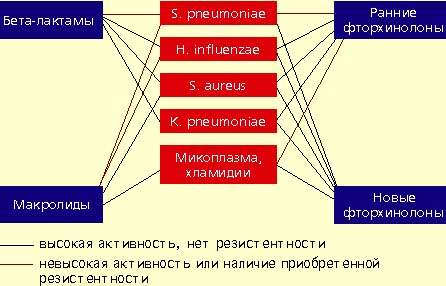 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.



