Что лучше темодал или темозоломид
Что лучше темодал или темозоломид
Лечение злокачественных глиом является одной из самых сложных проблем в нейроонкологии. Это мультидисциплинарная проблема, в решении которой принимают участие нейрохирурги, лучевые терапевты, химиотерапевты и патоморфологи. Среди всех злокачественных глиом особое место занимают глиобластомы, характеризующиеся агрессивностью течения и резистентностью к стандартной терапии. Наиболее значительных успехов в лечении этих опухолей за последние 10 лет удалось добиться за счет включения в схему лечения алкилирующего препарата темозоломид.
В 2004 г. в исследовании III фазы, проведенном Европейской организацией по изучению и лечению рака (EORTC) и Национальным институтом рака Канады (NCIC), получены результаты, указывающие на увеличение медианы выживаемости и 2-летней выживаемости среди больных глиобластомой, которые получали лучевую терапию и одновременно, а затем и адъювантно принимали темозоломид [1]. Преимущество химиолучевой терапии отмечено во всех клинических прогностических подгруппах, включая больных 60–70 лет. Наиболее значимым фактором, позволяющим предсказать результат лечения и эффективность темозоломида, было метилирование промотора MGMT. Определение метилирования гена MGMT позволяет выделить подгруппу больных, которым применение темозоломида с наибольшей вероятностью принесет клиническую пользу [2, 3]. С момента получения результатов исследования комбинированный режим, включающий проведение лучевой терапии с ежедневным приемом темозоломида (75 мг/м²/сут внутрь 1–42-й дни в период проведения лучевой терапии) с последующими 6 циклами темозоломида в адъювантном режиме (150–200 мг/м2/сут внутрь 1–5-й дни каждые 28 дней), стал стандартом лечения злокачественных глиом.
Вместе с тем не всем пациентам можно назначать пероральную форму препарата. К этой группе относятся пациенты с нарушением функции глотания вследствие повышения внутричерепного давления или поражения ствола головного мозга; пациенты, не способные принимать препараты
внутрь из-за нарушения проходимости желудочно-кишечного тракта, неукротимой тошноты и рвоты или другой сопутствующей патологии, нарушающей системное всасывание лекарственного средства, а также дети. Решить эту проблему и расширить возможности применения темозоломида удалось благодаря разработке и внедрению в клиническую практику внутривенной формы препарата.
Результаты ряда исследований, проведенных на приматах (кроме человекообразных) [4], собаках и крысах [5], показали одинаковые профили фармакокинетики (ФК) темозоломида в плазме после приема внутрь или внутривенного введения. На основании
этих данных было проведено пилотное клиническое исследование, сравнившее профили ФК темозоломида при пероральном приеме и внутривенном введении в течение 60 минут в эквивалентной дозе. По результатам исследования, площадь под кривой концентрации (AUC) была одинаковой при
пероральном приеме и внутривенном введении темозоломида. Однако отношение (вну тривенная: пероральная форма) максимальных концентраций препарата после введения (Cmax) не соответствовало критериям эквивалентности доз. Скорость внутривенной инфузии была основным параметром, требовавшим оптимизации, чтобы максимально соответствовать кинетике всасывания из желудочно-кишечного тракта и достигать значе ний Cmax, как при эквивалентном пероральном приеме. Проведено имитационное моделирование методом Монте-Карло для оценки результатов перекрестных исследований применения препарата в эквивалентных дозах с использованием популяционной ФК-модели, полученной в предыдущем популяционном исследовании пероральной формы темозоломида [6], показавшее, что при внутривенной инфузии в течение 90 минут можно добиться равноценности действия относительно Cmax.
Заслуживают внимания результаты многоцентрового открытого рандомизированного перекрестного исследования по сравнению ФК внутривенной и пероральной форм темозоломида [7]. Основной целью исследования была оценка сопоставимого системного действия (Cmax и AUC) темозоломида и его активного метаболита MTIC при внутривенном введении и пероральном приеме. Были рандомизированы 22 пациента, получавших терапию темо золомидом в течение 5 дней (пероральный прием препарата один раз в день в течение 4 дней и однократное внутривенное введение темозоломида на 3-й или 4-й день). Одиннадцати пациентам препарат вводился внутривенно на 3-й день и еще 11 пациентам – на 4-й день. В этом исследовании для внутривенного введения была выбрана доза темозоломида 150 мг/м², утвержденная для первого цикла лечения пациентов с рецидивами глиом. Препарат вводился внутривенно в течение 90 минут на 3-й или 4-й день в середине 5-дневного цикла лечения. Результаты этого исследования показали, что внутривенное введение в течение 90 минут и пероральный прием темозоломида в эквивалентной дозе соответствовали критериям эквивалентности доз, исходя из отношения средних величин AUC и Cmax для темозоломида и MTIC [7]. Авторы исследования отметили хорошую переносимость внутривенной формы темозоломида. Возникшие во время применения препарата нежелательные явления соответствовали ранее зарегистрированным у пациентов с рецидивирующей глиомой, принимавших пероральную форму темозоломида, за исключением местных реакций при внутривенном введении. Реакции в
месте инъекции были в основном слабовыраженными и преходящими [7]. Полученные результаты позволили рекомендовать внутривенное введение темозоломида по показаниям и схемам, утвержденным для пероральной формы препарата.
В России темозоломид зарегистрирован для применения в комплексной терапии злокачественных глиом в 2001 г. Накопленный опыт показал эффективность и хорошую переносимость препарата в форме капсул для перорального приема. В 2012 г. зарегистрирована новая лекарственная форма темозоломида – лиофилизат для приготовления раствора для внутривенной инфузии. Присутствие в клинической практике двух лекарственных форм послужило основанием для сопоставления переносимости и оценки побочных эффектов темозоломида при различных путях введения.
Цель исследования заключалась в оценке переносимости и нежелательных эффектов темозоломида при пероральном приеме и внутривенном введении для оптимизации выбора лекарственной формы препарата и улучшения качества жизни в процессе лечения больных со злокачественными глиомами.
Материал и методы
В радиологическом отделении Челябинского областного клинического онкологического диспансера с
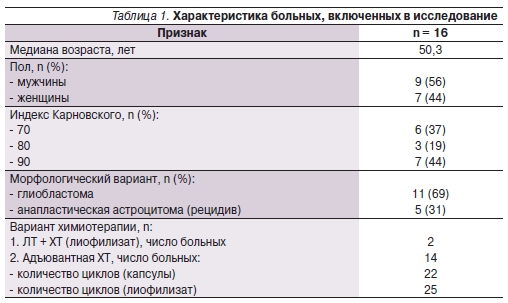
августа 2012 по январь 2013 г. темозоломид в форме лиофилизата получили 16 больных со злокачественными глиомами в возрасте от 30 до 66 лет; характеристика представлена в табл. 1.
Все больные были оперированы и имели морфологическую верификацию. Преобладали больные с первичной глиобластомой (n = 11). У 5 больных был рецидив анапластической астроцитомы.
Двум больным темозоломид вводился внутривенно за час до сеанса облучения в дозе 75 мг/м2 в течение 40 дней курса лучевой терапии (ЛТ). Назначение внутривенной инфузии было связано с проблемами проглатывания капсул в одном случае и наличием в анамнезе язвенной болезни желудка в другом. ЛТ проводилась на ускорительном комплексе “Elekta Synergy” с 3-D-планированием до суммарной дозы 60 Гр, подводимых за 30 фракций в течение 6 недель.
Четырнадцать больных получали последовательно темозоломид перорально (22 цикла) и внутривенно
(25 циклов) в процессе адъювантной химиотерапии (АХТ) в дозе 150–200 мг/м2 5 дней 28-дневного цикла. Непосредственно перед инфузией лиофилизат во флаконе разводили в 41 мл воды для инъекций. Приготовленный раствор, содержащий 2,5 мг темозоломида в 1 мл, вводили через центральный или периферический венозный катетер в течение 90 минут.
Результаты
Для реализации цели исследования были поставлены следующие задачи:
1. Оценить характер и тяжесть нежелательных эффектов, связанных с применением темозоломида перорально и внутривенно.
2. Оценить преимущества каждой лекарственной формы.
3. Определить группу больных с показаниями к назначению внутривенной формы темозоломида.
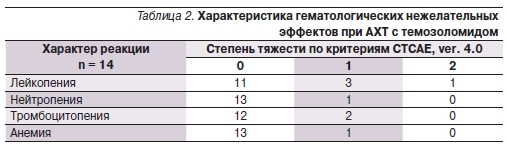
Тяжесть нежелательных явлений оценивалась по критериям Common Terminology Criteria for Adverse Events (CTCAE), ver. 4.0.
Гематологические показатели оценивались на 21-й и 28-й дни цикла. Гематологическая токсичность темозоломида оказалась невысокой (табл. 2). При назначении темозоломида одновременно с ЛТ на протяжении всего курса лечения гематологических токсических реакций не отмечено. Из 14
больных, получавших АХТ, гематологическая токсичность имела место в единичных случаях. Анемия и тромбоцитопения 1-й степени тяжести, лейкопения 1–2-й степеней, нейтропения 1-й степени по критериям CTCAE, ver. 4.0, развивались после 3–4 циклов независимо от способа введения препарата.
Среди негематологических нежелательных эффектов заслуживают внимания реакции со стороны пищеварительной системы (табл. 3). Тошнота 1–2-й степеней тяжести отмечена всеми больными (n = 14), получавшими капсулы темозоломида в течение всех 22 циклов АХТ. Рвота 1-й степени тяжести была у 12 из 14 больных при проведении 16 из 22 циклов АХТ. Как правило, рвота возникала в первые
1–2 дня приема капсул темозоломида в дозе 200 мг/м2. Стандартная антиэметическая терапия включала назначение дексаметазона в дозе до 8,0 мг в сутки и метоклопрамида в дозе 2,0 мл в/м 3–4 раза в день. Диспепсия 1-й степени тяжести отмечена у 6 из 14 больных в процессе 10 из 22 циклов
АХТ с применением капсул темозоломида. Все больные с диспепсией имели в анамнезе хронические
заболевания желудочно-кишечного тракта.
Таблица 3. Характеристика негематологических нежелательных эффектов при АХТ с темозоломидом.
При внутривенном введении темозоломида тошнота 1-й степени была у 2 из 14 больных во время проведения 3 из 25 циклов АХТ.
Появление слабости 1-й степени тяжести отметили 7 женщин и 1 мужчина в течение первых двух недель после завершения 18 и 12 циклов с применением капсул и лиофилизата темозоломида соответственно.
Не отмечено каких либо нежелательных эффектов при внутривенном введении темозоломида в дозе
75 мг/м2 ежедневно одновременно с ЛТ. Местных реакций, связанных с внутривенным введением препарата в дозах 75 и 150–200 мг/м2, также не зафиксировано.
Обсуждение
До настоящего времени темозоломид остается наиболее эффективным препаратом в лечении злокачественных глиом. По результатам рандомизированного исследования III фазы EORTC-NCIC, представленным в работе R. Stupp и соавт. [3], медиана выживаемости больных с глиобластомами, получавших комплексную терапию с темозоломидом, увеличилась на 2,5 месяца и составила 14,6 месяца (2-летняя выживаемаемость составила 27,2 % в группе комбинированной терапии по сравнению с 10,9 % в группе ЛТ).
Анализ 5-летних данных показал, что преимущества в выживаемости в группе химиолучевой терапии сохранялись до 5 лет и достигали уровня статистической значимости даже среди больных с плохим прогнозом (возраст старше 60 лет, класс V). Пятилетняя выживаемость в общей группе комбинированной терапии составила 9,8 % по сравнению с 1,9 % в группе ЛТ. В группе благоприятного прогноза (возраст моложе 50 лет, соматический статус 0–1 и полная резекция опухоли) 5-летняя выживаемость составила 28,4 % [3].
Тем не менее прогноз при данной морфологической форме остается неблагоприятным. Низкая продолжительность жизни при длительности комплексной терапии около 9–10 месяцев заставляет уделять особое внимание качеству жизни не только после завершения, но и в процессе лечения.
Токсичность и безопасность внутривенной формы темозоломида оценивались в исследовании
K. Motomura и соавт. [8]. Восемь пациентов со злокачественными глиомами в возрасте от 3 до 40 лет получали внутривенную форму темозоломида по стандартной схеме R. Stupp. Поводом к назначению внутривенной формы служило наличие дисфагии у больных с опухолью ствола головного мозга
или затрудненное проглатывание крупных капсул детьми. Токсические реакции при внутривенном введении темозоломида не отличались от наблюдаемых при пероральном его приеме в других исследованиях. Сопоставимой оказалась и биоэквивалентность обеих форм препарата [8].
В нашем исследовании в процессе проведения АХТ у большинства больных, принимавших капсулы
темозоломида в дозе 150–200 мг/м2, возникали диспепсические реакции. Внутривенное введение препарата оказалось менее токсичным. Все больные, получавшие темозоломид в обеих лекарственных формах, отметили лучшую переносимость внутривенной инфузии по сравнению с приемом капсул.
Полученные результаты позволяют рекомендовать внутривенное введение темозоломида в следующих ситуациях: при нарушении глотания вследствие неврологического дефицита, затрудненном проглатывании капсул, тяжелой тошноте и рвоте при предшествующем приеме капсул, при хронических заболеваниях органов желудочно-кишечного тракта, а также у детей. Ввиду хорошей переносимости возможно проведение инфузий в условиях дневного стационара или амбулаторно.
Преимущества темозоломида в форме капсул реализуются наиболее полно в процессе лучевой терапии в связи с хорошей переносимостью препарата в дозе 75 мг/м2 и необходимостью ежедневного его приема перед сеансом облучения с целью радиосенсибилизации. Однако для больных с нарушением глотания возможно только внутривенное введение темозоломида. В этих случаях необходимо предусмотреть установку центрального венозного катетера на весь период лечения.
Таким образом, полученные нами результаты по сравнению внутривенного и перорального введения темозоломида в отношении нежелательных явлений свидетельствуют о невысокой токсичности препарата. Наличие двух лекарственных форм расширяет возможности применения темозоломида
у больных со злокачественными глиомами.
Литература
1. Stupp R, Mason WP, van der Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005;352 (10):987–96.
2. Gerson Sl. Clinical relevance of MGMT in the treatment of cancer. J Clin Oncol 2002;20 (9):2388–99.
3. Stupp R, Hegi ME, Mirimanoff RO, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in randomized phase III
study: 5-year analysis of the EORTC-NCIC trial. The lancet oncology 2009;10(5):459–66.
4. Patel M, McCully C, Godwin Ket al. Plasma and cerebrospinal fluid pharmacokinetics of intravenous
temozolomide in non-human primates. J Neurooncol 2003;61(3):203–07.
5. Reyderman L, Statkevich P, Thonoor CM et al. Disposition and pharmacokinetics of temozolomide
in rat. Xenobiotica 2004;34 (5):487–500.
6. Jen JF, Cutler DL, Pai SM, et al. Population pharmacokinetics of temozolomide in cancer patients. Pharm Res 2000;17(10):1284–89.
7. Diez BD, Statkevich P, Zhu Y, et al. Evaluation of the exposure equivalence of oral versus intravenous temozolomide. Ottaviano Cancer Chemother Pharmacol 2010;65(4): 727–34.
8. Motomura K, Natsume А, Wakabayashi Т. Intravenous administration of temozolomide as a useful alternative over oral treatment with temozolomide capsulesin patients with gliomas. J Neurooncol (2012) 106:209–211.
Применение парентеральной формы препарата Темодал® (темозоломид) в терапии глиобластом
В статье на конкретном примере рассмотрена эффективность темозоломида, назначенного на раннем этапе диагностики глиобластомы. Показано, что химиолучевая терапия с использованием темозоломида и последующая монохимиотерапия парентеральным Темодалом (темозоломид) хорошо переносятся, способствуют значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими схемами терапии и являются золотым стандартом первой линии терапии у пациентов с глиобластомой.
В статье на конкретном примере рассмотрена эффективность темозоломида, назначенного на раннем этапе диагностики глиобластомы. Показано, что химиолучевая терапия с использованием темозоломида и последующая монохимиотерапия парентеральным Темодалом (темозоломид) хорошо переносятся, способствуют значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими схемами терапии и являются золотым стандартом первой линии терапии у пациентов с глиобластомой.
Злокачественные глиомы составляют 50–60% всех первичных опухолей центральной нервной системы. Прогноз их лечения неблагоприятный, а качество жизни больных снижается вследствие тяжелых неврологических нарушений и осложнений на фоне применяемой терапии. Алгоритм лечения предусматривает хирургическую резекцию с последующей лучевой терапией и химиотерапией [1]. При глиальных опухолях используются противоопухолевые препараты: темозоломид, нитрозопроизводные (ломустин, нимустин, кармустин, фотемустин), винкристин, прокарбазин, комбинация «ломустин + прокарбазин + винкристин», производные платины (цисплатин, карбоплатин), этопозид, бевацизумаб (в монотерапии или в комбинации с иринотеканом). Наиболее эффективным препаратом в лечении злокачественных глиом признан темозоломид [2].
Темозоломид – алкилирующий препарат, механизм действия которого состоит в присоединении метильной группы к ДНК, что приводит к нарушению структуры последней и гибели клетки [3]. Пероральный темозоломид обладает 100%-ной биодоступностью, а также быстрой и полной всасываемостью в кишечнике.
Необходимо отметить, что препарат включен в стандарты лечения злокачественных глиом в России и доступен для пациентов. При лечении злокачественных глиом темозоломид назначают в дозе 150–200 мг/м 2 в течение пяти суток каждые 28 дней [4]. Длительный прием темозоломида – в течение всего курса радиотерапии приводит к истощению метилгуаниновой метилтрансферазы (МГМТ) – фермента, обеспечивающего клеточную репарацию ДНК и влияющего на прогноз эффективности химиотерапии, даже в отсутствие метилирования МГМТ, что дает надежду на успех лечения [5, 6].
На сегодняшний день стандартом лечения пациентов с глиобластомой в качестве первой линии после удаления или биопсии (после гистологической верификации опухоли) считается проведение комбинированной химиолучевой терапии с использованием темозоломида (его ежедневный прием во время лучевой терапии с последующими поддерживающими курсами химиотерапии данным препаратом) [2]. Добавление темозоломида к лучевой терапии на самых ранних этапах лечения глиобластом обеспечивает статистически значимое увеличение общей выживаемости и увеличение времени до прогрессирования [3]. Результаты клинических исследований показали, что все больные, получавшие темозоломид в обеих лекарственных формах, отмечали лучшую переносимость внутривенной инфузии по сравнению с пероральным приемом капсул. Наличие двух лекарственных форм расширяет возможности применения темозоломида при злокачественных глиомах, позволяет проводить лечение с наименьшей токсичностью и обеспечивать наиболее высокое качество жизни пациентов в процессе лечения [4].
Клинический случай 1
Женщина, 40 лет. Заболела остро в июле 2015 г., имел место приступ с потерей сознания. Пациентка была доставлена в клинику бригадой скорой помощи. При выполнении компьютерной томографии (КТ) головного мозга выявлена опухоль головки хвостатого ядра с поражением мозолистого тела и паравентрикулярных отделов лобной доли справа. 13 июля выполнена операция – удаление новообразований больших полушарий головного мозга с применением нейрохирургической техники под контролем навигации. Гистологически – глиобластома G4. После операции отмечался небольшой неврологический дефицит, обусловленный онемением в левой верхней конечности. Результаты магнитно-резонансной томографии (МРТ) головного мозга, проведенной 30 июля, показали наличие опухоли правой височно-лобной области с распространением на базальные ядра мозга справа и передние отделы корпуса мозолистого тела, послеоперационной порэнцефалической кисты правой височно-лобной области. Назначены химиолучевая терапия, затем шесть курсов монохимиотерапии темозоломидом. С учетом наличия в послеоперационном периоде периодических головокружений, тошноты и рвоты после приема пищи выбрана парентеральная форма препарата Темодал®. Лучевая терапия начиналась через 25 дней после операции. 3D-планирование выполнялось на планирующей системе Aмфора 2.13 с использованием КТ-топометрии и совмещения данных МРТ-сканирования режима T1 для визуализации остаточной опухоли. Облучению (доза 30 Гр) подвергался весь объем головного мозга, затем уменьшенными полями – остаточная опухоль с краем безопасности 1–2 см (суммарная доза до 60 Гр). Лечение проводилось в режиме стандартного фракционирования на гамма-терапевтическом аппарате АГАТ-Р1. Одновременно с лучевой терапией (30 фракций в суммарной дозе 60 Гр) пациентка получала темозоломид в дозе 75 мг/м 2 ежедневно внутривенно в течение 42 дней. Во время лечения еженедельно проводилось исследование крови с подсчетом числа клеток. Гематологической токсичности на протяжении всего периода химиолучевого лечения не зарегистрировано. Снижения дозы и временной отмены препарата не потребовалось. Спустя четыре недели по завершении комбинированной терапии выполнено шесть курсов монохимиотерапии темозоломидом. Во время первого курса препарат назначали в дозе 150 мг/м 2 внутривенно в течение пяти дней с последующим 23-дневным перерывом. С учетом того что на первом цикле гематологической и негематологической токсичности не зафиксировано, на втором курсе доза увеличена до 200 мг/м 2 внутривенно. В такой же суточной дозе препарат назначали и в последующих циклах. В каждом цикле пациентка принимала препарат в течение пяти дней подряд с последующим 23-дневным перерывом. На фоне лечения неврологического дефицита не отмечалось. Контрольная МРТ головного мозга показала значительное уменьшение размера зоны патологического накопления контраста и зоны перифокального отека (рис. 1).
Ситуация на март 2016 г.: пациентка жива, продолжает работать и вести активный образ жизни, неврологическая симптоматика полностью купирована. Гематологической и негематологической токсичности на протяжении всего периода лечения не зафиксировано. Планируется продолжить монохимиотерапию парентеральной формой темозоломида до прогрессирования заболевания с оценкой эффекта (МРТ головного мозга) каждые три месяца.
Клинический случай 2
Мужчина, 39 лет. Заболел остро, в конце марта 2015 г. появились выраженные головные боли, слабость в правых конечностях, замедленная речь. Бригадой скорой медицинской помощи пациент был доставлен в клинику. При выполнении КТ головного мозга выявлено объемное образование левой лобной доли головного мозга. 13 апреля проведена операция – микрохирургическое удаление опухоли левой лобной доли, островка с применением интраоперационной навигации. Гистологически – глиобластома G4. После операции наблюдался неврологический дефицит в виде правостороннего гемипареза и нарушения речи. Контрольная МРТ головного мозга, проведенная 28 апреля, показала состояние после субтотального удаления опухоли лобно-теменной области головного мозга слева, латеральную дислокацию срединных структур вправо. Лучевая терапия начата через 28 дней после операции. 3D-планирование выполнено на планирующей системе Aмфора 2.13 с использованием КТ-топометрии и совмещения данных МРТ-сканирования режима T1 для визуализации остаточной опухоли. Облучению (доза до 30 Гр) подвергался весь объем головного мозга, затем уменьшенными полями – остаточная опухоль с краем безопасности 1–2 см (суммарная доза до 60 Гр). Лечение проводилось в режиме стандартного фракционирования на гамма-терапевтическом аппарате АГАТ-Р1. Одновременно с лучевой терапией (30 фракций в суммарной дозе 60 Гр) пациент получал Темодал® (темозоломид) в дозе 75 мг/м 2 ежедневно внутривенно в течение 42 дней. Во время лечения еженедельно проводилось исследование крови с подсчетом числа клеток. Гематологической токсичности на протяжении всего периода химиолучевого лечения не зафиксировано. Снижения дозы и временной отмены препарата не потребовалось. Спустя четыре недели по окончании комбинированной терапии проведено шесть курсов монохимиотерапии темозоломидом. Во время первого курса препарат назначали в дозе 150 мг/м 2 внутривенно в течение пяти дней с последующим 23-дневным перерывом. С учетом того что на первом цикле гематологической и негематологической токсичности не наблюдалось, во время второго курса дозу увеличили до 200 мг/м 2 внутривенно. В такой же суточной дозе препарат назначали и на последующих циклах. В каждом цикле пациент принимал препарат в течение пяти дней подряд с последующим 23-дневным перерывом. На фоне лечения наблюдались клинически выраженная положительная динамика, уменьшение неврологического дефицита. Контрольная МРТ головного мозга продемонстрировала значительное уменьшение размера зоны патологического накопления контраста и зоны перифокального отека (рис. 2).
Ситуация на март 2016 г.: пациент жив, не работает, но выполняет всю работу по дому, полностью себя обслуживает, сохраняется незначительное нарушение речи. Гематологической и негематологической токсичности на протяжении всего лечения не зарегистрировано. Планируется продолжить монохимиотерапию парентеральной формой темозоломида до прогрессирования заболевания с оценкой эффекта (МРТ головного мозга) каждые три месяца.
Рассмотренные клинические случаи иллюстрируют потенциальный благоприятный эффект темозоломида, назначенного на ранних этапах диагностики глиобластомы совместно с лучевой терапией, а также в виде адъювантной монохимиотерапии. Оба пациента продолжают получать парентеральную форму темозоломида с отмечающейся частичной ремиссией.
Данная схема лечения позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования и сохранить качество жизни и социальный статус больных.
Низкая токсичность препарата Темодал® (темозоломид) при внутривенном введении позволяет рекомендовать проведение инфузий в условиях дневного стационара или амбулаторно. При адъювантной химиотерапии риск нежелательных негематологических эффектов выше, в связи с чем расширяются показания к внутривенному введению темозоломида: нарушение глотания, трудности при проглатывании капсул, тяжелая тошнота и рвота при предшествующем приеме капсул, хронические заболевания органов желудочно-кишечного тракта. Таким образом, наличие двух лекарственных форм расширяет возможности применения темозоломида при злокачественных глиомах [4].
При выборе и проведении терапии глиобластом с дифференцировкой G4 следует учитывать, что заболевание неизлечимо. Медиана выживаемости, как правило, менее года с момента постановки диагноза. Даже в самых благоприятных ситуациях большинство пациентов умирают в течение двух лет. Именно поэтому основными задачами лечения являются увеличение продолжительности жизни больных (одно- и двухлетняя выживаемость), улучшение качества жизни (компенсация неврологического дефицита, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни пациентов [7].
В настоящее время использование лучевой терапии совместно с темозоломидом признано стандартом лечения мультиформной глиобластомы в большинстве стран, в том числе в России. Химиотерапию при глиобластоме предпочтительно начинать совместно с лучевой терапией.
На фоне лучевой терапии и применения темозоломида (75 мг/м 2 ежедневно в течение всего курса лучевой терапии, а затем 150–200 мг/м 2 в течение пяти суток каждые 28 дней) наблюдалось повышение двухлетней выживаемости при глиобластомах до 27,2%, трехлетней – до 16,7%, четырехлетней – до 13% (при проведении лучевой терапии без темозоломида – 11,2, 3,7 и 3,2% соответственно) [2, 7].
Возможность молекулярной диагностики глиальных опухолей позволяет прогнозировать успех химиотерапии. Пациенты со злокачественными глиомами, у которых отмечается метилирование промотора МГМТ, лучше отвечают на терапию темозоломидом. Пациенты с глиобластомой, получавшие терапию темозоломидом на фоне лучевой терапии, при наличии метилированного промотора МГМТ имели общую выживаемость 21,7 месяца, а в его отсутствие – только 15,3 месяца. При хромосомном анализе оценка потери гетерозиготности 1p/19q (1p/19q loss) в олигодендроглиальных опухолях предопределяет успех химиотерапии по схеме «ломустин + прокарбазин + винкристин». Однако результаты ряда работ показывают, что потеря гетерозиготности 1p/19q является показателем меньшей агрессивности опухоли. В лаборатории нашего центра сегодня это становится рутинным исследованием с умеренной стоимостью. Изучается определение корреляции генетических аберраций в опухолевой ткани и в плазме крови, что позволяет определять тактику лечения и прогноз заболевания на этапе дооперационного обследования [3, 5, 6].
Следующим этапом в развитии лекарственного лечения онкологических заболеваний центральной нервной системы скорее всего станет использование комбинаций современных схем с таргетной терапией. Если предварительные данные проводимых исследований подтвердятся, можно будет говорить о том, что выживаемость больных в недалеком будущем увеличится до 25 месяцев при комбинации лучевой терапии с темозоломидом и бевацизумабом. Дальнейшее понимание патогенеза глиальных опухолей поможет разделить их на несколько нозоформ с разным патогенезом, но с общими клиническими и морфологическими проявлениями. Более четкое представление о механизмах развития опухоли будет способствовать целенаправленному и точному использованию таргетных препаратов [8, 9].
Немаловажен и вопрос переносимости химиотерапевтического лечения: в рассмотренных клинических случаях в отсутствие гематологической и негематологической токсичности удалось сохранить качество жизни и социальный статус пациентов на протяжении всего периода лечения [7, 8].
Химиолучевая терапия с темозоломидом и последующая монохимиотерапия парентеральным препаратом Темодал® (темозоломид) хорошо переносятся и приводят к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими схемами лечения. Подобная схема является золотым стандартом первой линии терапии пациентов с глиобластомой и служит основой для разработки новых высокоэффективных режимов лечения [2, 7–9].