Что лучше цефтриаксон или цефоперазон сульбактам при пневмонии
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
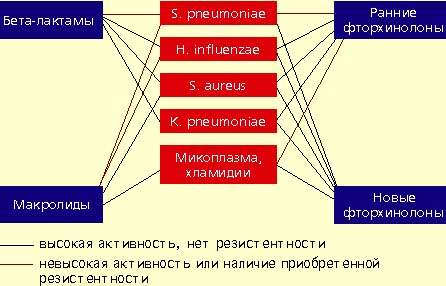 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Роль цефалоспоринов в лечении внебольничной пневмонии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цефалоспориновые антибиотики, которые в настоящее время являются наиболее широко применяемыми антимикробными препаратами в клинической практике, были открыты в начале 60–х годов ХХ века.
Популярность использования этих препаратов объясняется наличием у них следующих характерных особенностей:
– бактерицидное действие,
– хорошие фармакокинетические показатели,
– устойчивость к b–лактамазам стафилококков у препаратов I и II поколения и грамотрицательных бактерий у препаратов III и IV поколений,
– хорошая переносимость, низкая токсичность и небольшая частота побочных явлений,
– простота и удобство дозирования,
– возможность сочетания с другими антибактериальными средствами.
В зависимости от спектра антимикробной активности цефалоспорины принято подразделять на поколения. Классификация препаратов представлена в таблице 1.
Цефалоспорины I поколения активны в отношении грамположительных бактерий (стафилококки, стрептококки, пневмококки). В отношении грамотрицательных бактерий их активность ограничена и препараты разрушаются b–лактамазами грамотрицательных бактерий. Препараты стабильны к b–лактамазам стафилококков.
В настоящее время показанием для применения цефалоспоринов I поколения являются интраоперационная профилактика в хирургии и гинекологии, нетяжелые инфекции кожи и мягких тканей. Оптимальным препаратом для этого является цефазолин, т.к. имеет наибольший период полувыведения (2 ч). Также возможно применение цефалоспоринов I поколения, как альтернативы пенициллиназостабильным пенициллинам (оксациллин и др.) при доказанной или предполагаемой стафилококковой этиологии инфекции. Применение при инфекциях дыхательных путей и мочевых инфекциях не оправдано.
Пероральные препараты немного уступают по уровню активности парентеральным препаратам.
Цефалоспорины II поколения сохраняют высокую активность в отношении грамположительных бактерий, но по сравнению с цефалоспоринами I поколения обладают повышенной активностью в отношении грамотрицательных микроорганизмов (H. influenzae) и большей стабильностью к b–лактамазам. Цефалоспорины II поколения широко применяются в клинической практике для лечения внебольничных инфекций (пневмония, пиелонефрит) в качестве монотерапии, при нетяжелых госпитальных – обычно в комбинации с аминогликозидами. Возможно применение цефуроксима в виде ступенчатой терапии, т.к. имеется пероральная форма препарата. Парентеральные и пероральные формы существенно не различаются по уровню активности.
Цефалоспорины II поколения (цефуроксим) рассматриваются также в качестве препаратов выбора для интраоперационной профилактики в хирургии и гинекологии.
Цефалоспорины III поколения обладают высокой активностью в отношении грамотрицательных микроорганизмов, кроме того, некоторые препараты этой группы (цефтазидим, цефоперазон) активны в отношении P. aeruginosa. Однако активность в отношении стафилококков у этого поколения препаратов несколько снижена. Пероральные цефалоспорины III поколения (цефиксим, цефтибутен) практически лишены антистафилококковой аткивности.
Цефалоспорины III поколения широко применяются для лечения различных тяжелых инфекций, главным образом госпитальных (интраабдоминальные, послеоперационные осложнения в хирургических стационарах различного профиля, инфекции кожи мягких тканей, раневая инфекция). Учитывая способность цефалоспоринов этого поколения (Роцефин) проникать через гематоэнцефалический барьер, что особенно важно при воспалении, они используются при инфекциях нервной системы (менингит). Показана эффективность препаратов этой группы для терапии инфекций в онкогематологии при лечении больных с нейтропенией.
Пероральные препараты существенно уступают парентеральным перпаратам в отношении Enterobacter spp., Serratia spp., C. freundii.
Цефалоспорины IV поколения имеют наиболее широкий спектр активности среди всех цефалоспоринов, сочетают в себе высокую активность в отношении грамотрицательных бактерий и стафилококков. В некоторых случаях они проявляют активность в отношении тех штаммов Enterobacteriaceae, которые устойчивы к препаратам III поколения. Область применения та же, что и у цефалоспоринов III поколения – тяжелые инфекции, в основном госпитальные, различной локализации.
Несмотря на то, что цефалоспориновые антибиотики обладают широким спектром антимикробной активности, существуют микроорганизмы, в отношении которых цефалоспорины лишены какой–либо активности. Прежде всего это облигатные и факультативные внутриклеточные микроорганизмы, такие как хламидии, микоплазмы, легионеллы, риккетсии. Микоплазмы обладают истинной природной резистентностью к цефалоспоринам вследствие того, что у них отсутствует мишень действия этих препаратов – пептидогликан клеточной стенки. Несмотря на то, что цефалоспорины проявляют некоторую активность in vitro по отношению к хламидиям и легионеллам, клинической активностью они не обладают, т.к. не проникают внутрь клеток, где локализуются эти возбудители (табл. 2).
Цефалоспорины не активны в отношении энтерококков и грамотрицательных анаэробных микроорганизмов, за исключением некоторых цефалоспоринов II поколения (цефамицинов).
Механизмы резистентности
Грамположительные бактерии
Стафилококки. 1. Продукция плазмидных b–лактамаз, разрушающих природные и некоторые полусинтетические пенициллины, однако все поколения цефалоспоринов устойчивы к этим ферментам.
2. Модификация пенициллинсвязывающих белков. В этом случае наблюдается устойчивость к метициллину (оксациллину), а также ко всем b–лактамным антибиотикам, включая цефалоспорины и карбапенемы. Несмотря на то, что в отношении некоторых метициллин–(оксациллин)–резистентных штаммов золотистого стафилококка (MRSA) цефалоспорины проявляли активность in vitro, результаты клинических исследований свидетельствуют, что при наличии метициллин–(оксациллин)–резистентности стафилококков эффективность цефалоспоринов отсутствует.
Стрептококки обладают высокой природной чувствительностью к цефалоспоринам. Но благодаря широкому их применению, возникла глобальная проблема приобретенной устойчивости стрептококков. Есть сообщения о выделении отдельных штаммов стрептококков группы В и S. viridans, резистентных к цефалоспоринам I–III поколений.
Более серьезной проблемой является устойчивость пневмококков к пенициллину, т.к. это сопровождается устойчивостью к цефалоспоринам I–II поколений, но в большинстве случаев цефалоспорины III–IV поколений сохраняют свою активность.
Энтерококки. Устойчивость энтерококков к цефалоспоринам обусловлена низким сродством их пенициллинсвязывающих белков к этим антибиотикам.
E. faecium обладает природной устойчивостью ко всем цефалоспоринам. В отношении E. faecalis цефалоспорины также неактивны, за исключением цефепима, препарата IV поколения, характеризующегося некоторой антиэнтерококковой активностью. Неизвестно клиническое значение этого факта, не исключено, что на фоне терапии цефепимом риск развития энетрококковой суперинфекции меньше, по сравнению с другими цефалоспоринами.
Грамотрицательные бактерии
Neisseria spp. (N. meningitidis, N. gonorrhoeae), Moraxella catarrhalis обладают высокой природной чувствительностью к цефалоспоринам. Препаратами выбора при этих инфекциях наряду с бензилпенициллином считаются цефалоспорины III–IV поколений. Продукция b–лактамаз у N. meningitidis встречается крайне редко. Наряду с этим отмечается увеличение частоты продукции плазмидных b–лактамаз широкого спектра у некоторых штаммов N. gonorrhoeae, что делает цефалоспорины III поколения препаратами выбора в лечении гонореи вместо бензилпенициллина. У M. catarrhalis продукция плазмидных b–лактамаз достигает 80–90%, в связи с этим сохраняют высокую активность цефалоспорины II–IV поколений, в отличие от цефалоспоринов I поколения, которые подвергаются гидролизу.
Shigella spp., Salmonella spp., Proteus mirabilis характеризуются высокой природной чувствительностью к цефалоспоринам, активность нарастает от I к IV поколению. В этой группе микроорганизмов редко выявляется продукция хромосомных b–лактамаз класса С или плазмидных b–лактамаз расширенного спектра, которые гидролизуют большую часть цефалоспориновых антибиотиков. Основной механизм антибиотикорезистентности обусловлен продукцией плазмидных b–лактамаз широкого спектра действия (до 50% у госпитальных штаммов), разрушающих цефалоспорины I поколений, препараты других поколений стабильны к этим ферментам.
Haemophilus spp. обладает природной чувствительностью к цефалоспоринам II–IV поколений; к препаратам I поколения H. influenzae устойчива. Обычно при нетяжелых инфекциях, вызванных H. influenzae, используются цефалоспорины II поколения, а при тяжелых – цефалоспорины III поколения.
Klebsiella spp., Escherichia coli. Внебольничные штаммы сохраняют чувствительность к цефалоспоринам II–IV поколения, Наибольшей природной активностью в отношении этих микроорганизмов обладают цефалоспорины III–IV поколений. Основной механизм резистентности госпитальных штаммов этих микроорганизмов обусловлен продукций b–лактамаз расширенного спектра, разрушающих цефалоспорины I–III поколения, а также частично препараты IV поколения. Обычно это характерно для штаммов микроорганизмов, выделенных в отделениях реанимации и интенсивной терапии. Так, продукция b–лактамаз расширенного спектра Klebsiella spp. может достигать 100%. Однако цефалоспорины II–III поколения проявляют высокую активность при внебольничных инфекциях, обусловленных этими микроорганизмами, а при госпитальных инфекциях активность этих препаратов значительно ниже. В большинстве случаев цефалоспорин IV поколения – цефепим – сохраняет активность в отношении штаммов, продуцирующих b–лактамазы расширенного спектра действия. Эффективность того или иного поколения цефалоспоринов можно оценить только на основании локального бактериологического мониторинга в конкретном стационаре.
Группа Enterobacter spp., Serratia spp., Citrobacter freundii, Morganella morganii, Providencia rettgeri. не чувствительна к цефалоспоринам I поколения, слабо чувствительна к цефалоспоринам II поколения, высоко чувствительна к препаратам III–IV поколений. Основной механизм резистентности этих микроорганизмов обусловлен гиперпродукцией хромосомных b–лактамаз класса С, разрушающих цефалоспорины II–III поколений. Обычно данный механизм резистентности возникает в результате элиминация чувствительных штаммов и селекции штаммов–гиперпродуцентов хромосомных b–лактамаз класса С, на фоне лечения цефалоспоринами III поколения. Только препараты IV поколения сохраняют активность в отношении штаммов–гиперпродуцентов.
Pseudomonas aeruginosa от природы устойчива к цефалоспоринам I–II поколения. В настоящее время препаратами выбора для стартовой терапии являются некоторые препараты цефалоспоринов III поколения (цефтазидим, цефоперазон) и цефепим. По уровню активности в отношении синегнойной палочки они располагаются в следующем порядке: цефтазидим = цефипим > цефоперазон.
P. aeruginosa обладает различными механизмами резистентности к цефалоспоринам, такими как продукция хромосомных b–лактамаз класса С, нарушением проницаемости клеточной стенки, эффлюкс – активное выведение препаратов из клетки. Уровень устойчивости к антипсевдомонадным цефалоспоринам варьирует в различных стационарах, но обычно он ниже, чем к ингибитор–защищенным пенициллинам, ципрофлоксацину, имипинему.
Acinetobacter spp. характеризуется природной устойчивостью к цефалоспоринам I–II поколения и достаточно низкой чувствительностью к препаратам III–IV поколения. Иногда проявляют активность цефтазидим и цефепим. Препаратом выбора является цефоперазон/сульбактам (за счет собственной активности сульбактама).
Анаэробные микроорганизмы
Грамположительные анаэробные кокки и Clostridium spp. (за исключением C. difficile) высокочувствительны к цефалоспоринам. Bacteroides fragilis и другие микроорганизмы этой группы продуцируют хромосомные b–лактамазы класса А, поэтому обладают устойчивостью к цефалоспориновым антибиотикам. В связи с этим при лечении смешанных аэробно–анаэробных инфекций (интраабдоминальные) цефалоспорины (за исключением цефоперазона/сульбактама) необходимо сочетать с антианаэробными препаратами (метронидазол или линкозамиды). Некоторые препараты (цефокситин, цефметазол, цефотетан) благодаря устойчивости к гидролизу хромосомными b–лактамазами обладают активностью в отношении анаэробных бактерий, поэтому при смешанных инфекциях могут использоваться в качестве монотерапии. Однако в последние годы отмечено увеличение резистентности B. fragilis к препаратам этой группы.
Фармакокинетика цефалоспоринов
Цефалоспорины хорошо всасываются при внутримышечном введении. Большинство цефалоспоринов плохо всасывается из пищеварительного тракта. Однако часть препаратов абсорбируется достаточно хорошо и поэтому может вводиться перорально. Биодоступность последних – от 40–95%. Они накапливаются в крови в бактерицидных концентрациях, что и обеспечивает необходимый фармакотерапевтический эффект. Концентрация в тканях и жидкостях составляет от 30 до 70%, внутрь клетки препараты не проникают. В крови цефалоспорины частично связываются с белками плазмы. Проницаемость через физиологические барьеры и через гематоэнцефалический барьер имеет следующие особенности:
– препараты I поколения – не проникают,
– II поколение – умеренно при воспалении,
– III–IV поколение – хорошо проникают при воспалении (за исключением цефоперазона).
Трансплацентарный переход составляет от 20 до 40%. Препараты цефалоспоринов не метаболизируются в организме, за исключением цефотаксима, который превращается в активный метаболит дезацетилцефотаксим. Большинство цефалоспориновых антибиотиков выводятся почками (фильтрацией и секрецией), отдельные препараты преимущественно с желчью в кишечник (цефоперазон, цефтриаксон). Период полувыведения 1–2 часа, за исключением цефтибутена, цефиксима (4 ч), цефтриаксона (8 часов).
Переносимость
цефалоспориновых антибиотиков
Цефалоспорины характеризуются хорошей переносимостью. Наиболее частыми нежелательными явлениями при применении цефалоспоринов являются аллергические реакции (2–3%), и хотя их частота существенно меньше по сравнению с пенициллинами. необходимо помнить, что примерно у 10% больных с гиперчувствительностью на пенициллины возможно развитие перекрестной реакции к цефалоспоринам.
Из других нежелательных реакций следует отметить местную болезненность при внутримышечном введении цефалоспоринов. Возможно введение с лидокаином для уменьшения болезненности. При внутривенном введении редко наблюдалось развитие флебитов (менее 1%), для уменьшения риска их развития необходимо медленное введение в течение 2–4 мин.
Реакции со стороны желудочно–кишечного тракта наблюдались редко (около 2%), чаще при применении пероральных препаратов. Парентеральные цефалоспорины, экскретирующиеся с желчью (цефоперазон, цефтриаксон), в большей степени вызывали диарею. Необходимо помнить, что при применении цефалоспоринов, как и других антибиотиков, возможно развитие тяжелой антибиотик–ассоцированной диареи, вызванной Clostridium difficile, и псевдомембранозного колита, однако частота этого осложнения невысока (1%). При применении ранних цефалоспоринов I поколения (цефалоридин) были описаны нефротоксические эффекты, особенно при сочетании с аминогликозидами. Современные препараты цефалоспоринов лишены нефротоксических свойств. Для некоторых цефалоспоринов, имеющих в структуре метилтиотетразольную группу в 3 позиции (цефамандол, цефметазол, цефоперазон, цефотетан), характерны специфические нежелательные реакции:
– дисульфирам – реакции при приеме алкоголя;
– геморрагический синдром в результате нарушения синтеза протромбина и нарушения всасывания витамина К.
Клиническое значение геморрагического синдрома на фоне применения этих цефалоспоринов невелико, однако риск возможен у больных с почечной и печеночной недостаточностью, в связи с чем в этих случаях следует контролировать протромбиновое время.
Цефалоспориновые антибиотики не обладают тератогенным или эмбриотоксическим свойствами, поэтому при необходимости могут применяться у беременных.
Клиническое значение цефалоспоринов
при внебольничной пневмонии
У госпитализированных пациентов с нетяжелой внебольничной пневмонией препаратами выбора (наряду с аминопенициллинами) являются цефалоспорины II поколения (цефуроксим), а при течении заболевания средней тяжести и тяжелом – цефалоспорины III поколения (цефтриаксон или цефотаксим) в комбинации с макролидным антибиотиком. У больных внебольничной пневмонии средней тяжести в допустимых случаях амбулаторного лечения (доступность и обеспечение инъекций) может использоваться монотерапия цефтриаксоном с учетом особенностей фармакокинетики и возможности однократного введения препарата (табл. 3).
Основываясь на данных нескольких исследований последних лет, были сделаны предположения, что летальность и время госпитализации пациентов с ВП или пневмонией, сопровождающейся вторичной бактериемией, может быть снижена назначением режимов антимикробной терапии, включающих макролид и/или фторхинолон, или любую другую комбинацию из 2–х эффективных препаратов.
В двух из этих исследований при анализе больших групп пациентов с неопределенной этиологией внебольничной пневмонии >60% случаев, показано, что снижение уровня летальности в течение 30 дней после назначения комбинированной терапии является значимым для пациентов, которые относятся к прогностически неблагоприятным: по возрасту, наличию сопутствующих заболеваний, промедлению в назначении антибактериальной терапии, нахождению в домах престарелых и нуждающихся в госпитализации ОРИТ.
В рекомендациях IDSA (2003 г.) при развития нетяжелой ВП у лиц с сопутствующими заболеваниями, не получавших предшествовавшей антибактериальной терапии, предпочтение следует отдавать новым макролидам или респираторным фторхинолонам, а имевший место недавний прием антибиотиков «модифицирует» лечение: назначается монотерапия респираторными фторхинолонами или высокодозная терапия b–лактамами, а именно цефалоспоринами III поколения (цефтриаксон, цефотаксим) в сочетании с новыми макролидами.
В соответствии с рекомендациями IDSA (2003 г.) пациентам, госпитализированным по поводу ВП, целесообразно назначение комбинированной терапии, включающей b–лактам (цефотаксим, цефтриаксон, ампициллин/сульбактам, эртапенем) и новый макролид, или монотерапию респираторным фторхинолоном.
В настоящее время получены многочисленные свидетельства того, что при комбинированном назначении больным ВП b–лактамов и макролидов удается оптимизировать клинические исходы заболевания (уменьшить риск летального исхода, сократить госпитальный этап лечения) по сравнению с монотерапией b–лактамами. Имеются также доказательства того, что комбинированная терапия (b–лактам + макролид) более эффективна, чем монотерапия b–лактамами, при лечении тяжелой пневмококковой пневмонии, осложненной вторичной бактериемией. В ряду возможных объяснений подобного «терапевтического синергизма» следует, очевидно, учитывать многообразные эффекты макролидов: подавление смешанной инфекции и факторов вирулентности возбудителей, снижение адгезии бактерий к слизистой оболочке дыхательных путей, уменьшение продукции и улучшение реологических свойств бронхиального секрета, иммуномодулирующее действие.
Добавление макролида к b–лактаму, как независимый фактор улучшения прогноза при тяжелой пневмонии, в настоящее время не вызывает сомнений.
Для лечения тяжелой и средней степени тяжести внебольничной пневмонии у госпитализированных пациентов препаратами выбора являются в основном цефалоспорины III поколения, такие как цефтриаксон (Роцефин) и цефотаксим (табл. 4). Препараты обладают одинаковым спектром антимикробной активности. Однако основное их различие состоит в фармакокинетике: у цефтриаксона (Роцефина) период полувыведения составляет около 8 часов, соответственно достаточно 1 кратного введения. В то время как у цефотаксима период полувыведения около 1,1 ч, что требует 3 кратного введения, а соответственно, увеличивается неудобство и дискомфорт для пациента, затраты на лечение, возрастает риск развития постинъекционных осложнений.
Таким образом, оптимальным препаратом для лечения тяжелой внебольничной пневмонии является цефтриаксон (Роцефин, фармацевтическая компания ф. Хоффманн–Ля Рош Лтд., Швейцария), антибиотик разумного выбора при широком спектре показаний, обладающий оптимальным режим дозирования – один раз в сутки и низким уровнем природной и приобретенной резистентности. Высокий профиль безопасности – двойной компенсаторный путь выведения – обеспечивает высокую эффективность препарата.
Литература
1. Яковлев С.В. Современное значение цефалоспоринов в стационаре, РМЖ Антибиотики, т.13, №10, 2005.
2. Яковлев С.В., Яковлев В.П. Beta лактамные антибиотики. Consilium Medicum, т. 8, №1, 2006.
3. Сидоренко С.В., Яковлев С.В. Бета–лактамные антибиотики, РМЖ, т.5, № 21, 1997.
4. Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. 2001; М.: Ремедиум, 2001.
5. Mufson MA, Stanek RJ. Bacteremic pneumococcal pneumonia in one American city 20–year of longitudinal study, 1978–1997. Am J Med 1999$ 107 (Suppl 1A) 34S–43S.
6. Stahl JE, Barza M, DesJardin J, Martin R, Eckman MH. Effects of macrolides as part of initial emperic therapy on length of stay in patients hospitalized with CAP. Arch Intern Med 1999; 159: 2576–80/
7. Waterer GW, Somes GW, Wunderink RG. Monotherapy may be suboptimal for severe bacteremic pneumococcal pneumonia. Arch Intern Med 2001; 161:1837–42.
8. Gleason PP, Meehan TP, Fine M et al. Associations between initial antimicrobial therapy and medical outcomes for hospitalized elderly patients with pneumonia. Arch Intern Med 1999; 159: 2562–72.
9. Dudas V, Hopefl A, Jacobs R et al. Antimicrobial selection for hospitalized patients with presumed community–acquired pneumonia: a survey of nonteaching US community hospitals. Ann Pharmacother 2000; 34: 446–52.
10. Houck PM, MacLehose RF, Niederman MS et al. Empiric antibiotic therapy and mortality among Medicare pneumonia inpatients in 10 Western States: 1993, 1995, and 1997. Chest 2001; 119: 1420–6
11. Чучалин А.Г., Синопальников А.И., Страчунский Л.С. и др. Внебольничная пневмония у врослых: практические рекомендации по диагностике, лечению и профилактике (пособие для врачей). Клин. микроб., антимикроб. химиотер. 2003; 5 (3): 198–224.
12. Brown RB, Iannini P, Gross P et al. Impact of initial antibiotic choice on clinical outcomes in community–acquired pneumonia: analysis of a hospital claims–made database. Chest 2003; 123: 1503–11.
13. Рациональная антимикробная терапия, под редакцией Яковлева В.П., Яковлева С.В., М.: «Литтерра», 2003.
14. Ewig S, Ruis M, Torres A et al. Pneumonia acquired in the community through drug resistant Streptococcus pneumonia. American Journal of Respiratory and Critical Care Medicine 1999; 159: 1835–42.
15. Ламберт П.А., Конвей Б.Р. Сравнение фармацевтического качества непатентованных лекарственных препаратов, содержащих цефтриаксон, с Роцефином ® Journ. of Chemotherapy, 15(4), Aug. 2003.


