Что лучше визанна или диферелин
Что лучше визанна или диферелин
Современный подход к лечению больных эндометриозом состоит в комбинации хирургического метода, направленного на максимальное удаление эндометриоидных очагов, и гормономодулирующей терапии. Медикаментозная терапия (без хирургической верификации диагноза) возможна при аденомиозе и наружном генитальном эндометриозе, если отсутствуют кистозные процессы в яичниках и другие опухолевидные образования в малом тазу. При наличии эндометриоидной кисты яичника необходимо хирургическое лечение.
Поскольку в большинстве случаев заболевание начинается в раннем репродуктивном возрасте, основным условием лечения должно быть сохранение фертильности. Именно поэтому молодых пациенток по возможности следует вести консервативно, назначая медикаментозные средства. Медикаментозная терапия эндометриоза является неспецифической, нацелена в основном на уменьшение выраженности имеющихся симптомов, и подбирают ее индивидуально. Только в отсутствие положительного эффекта на протяжении 6 мес рассматривают вопрос о хирургическом вмешательстве [1—5].
Гормональную терапию применяют для временного подавления функции яичников с формированием состояния «псевдоменопаузы» или инициирования состояния псевдодецидуализации с последующей атрофией очагов эндометриоза — базис и этиопатогенетическая основа гормональной терапии. Согласно российским клиническим рекомендациям по ведению больных эндометриозом [6—9], гормональная терапия может быть использована в качестве эмпирической при лечении пациенток с симптомами, свидетельствующими о высокой вероятности наличия эндометриоза без кистозных (овариальных) форм, а также в качестве противорецидивной терапии после лапароскопического удаления видимых очагов эндометриоза, капсулы эндометриоидной кисты либо удаления очагов эндометриоза при инфильтративной форме заболевания.
В качестве гормональной терапии применяют препараты первой линии — прогестины, комбинированные оральные контрацептивы (КОК), нестероидные противовоспалительные средства (НПВС) и препараты второй линии — агонисты гонадотропин-рилизинг-гормона (аГнРГ) (при курсе более 6 мес в сочетании со средствами для заместительной гормональной терапии), левоноргестрел-высвобождающую внутриматочную терапевтическую систему. Оптимальным выбором при легкой и умеренной тазовой боли, предположительно вызванной гетеротопиями, могут служить КОК и прогестины.
Комбинированная терапия эстрогенами и прогестагенами
Механизм лечебного действия КОК — центральный (антигонадотропный, связанный со снижением пиковой секреции лютеинизирующего гормона) и периферический (антипролиферативный и противовоспалительный эффекты, обусловленные взаимодействием прогестагенного компонента с рецепторами прогестерона). В результате такой терапии наблюдаются подавление овуляции, снижение влияния эндогенных эстрогенов, торможение пролиферации эндометрия, изменение структуры эндометриоидных очагов, снижение выраженности хронической тазовой боли, улучшение физического и психологического состояния (стабилизация эмоционального статуса, обеспечение контроля течения предменструального синдрома и предменструального дисфорического расстройства). Кроме того, прием КОК способствует формированию искусственного менструального цикла, обеспечивает надежную контрацепцию. Препараты безопасны при длительном приеме, после их отмены быстро восстанавливаются менструальный цикл и фертильность. Предпочтительнее непрерывный режим приема КОК [6—13].
Прогестагены
Прогестагены считаются первой линией терапии с уровнем доказательности 1а. Во-первых, прогестагены оказывают центральное действие, блокируя гипоталамо-гипофизарно-яичниковую цепь, что снижает секрецию эстрогенов яичниками [14, 15]. Во-вторых, они оказывают непосредственное влияние на эндометриоидные очаги, стимулируя дифференцировку стромальных клеток (децидуализацию) и секреторную трансформацию эпителиальных клеток эндометрия, что, в конечном счете, приводит к его атрофии. В-третьих, прогестагены активируют 17β-гидростероиддегидрогеназу 2-го типа (17β-ГСД-2), преобразующую эстрадиол в менее активный эстрон. Прогестагены оказывают ингибирующее влияние на синтез простагландина E2 (ПГE2), играющего ключевую роль в патогенезе эндометриоза и способствующего повышению синтеза эстрогенов за счет модулирующего влияния на экспрессию ароматазы [16—18].
Терапию прогестагенами необходимо осуществлять в непрерывном режиме и в достаточно высоких дозах, на фоне которых развивается аменорея, что позволяет купировать болевой синдром, предотвратить распространение новых поражений, обеспечить регресс уже имеющихся очагов. Наиболее частым побочным эффектом непрерывного приема прогестагенов являются кровотечения прорыва, вероятность возникновения которых снижается по мере увеличения продолжительности лечения. Среди прогестагенов для перорального приема можно выделить медроксипрогестерона ацетат, мегестерола ацетат, норэтистерона ацетат, дидрогестерон, диеногест, преимущества и побочные эффекты которых представлены ниже.
Медроксипрогестерона ацетат (МПА, Провера) применяется для купирования боли при эндометриозе. Считается, что эффективность МПА схожа с эффективностью КОК. МПА при пероральном приеме для коррекции эндометриоза необходимо применять в высоких дозах, что может привести к неблагоприятному влиянию на липидный профиль, связанному с проявлением андрогенных и глюкокортикоидных свойств препарата (увеличение массы тела, возникновение изменений настроения, депрессии и раздражительности), и на углеводный обмен (ухудшение толерантности к глюкозе). Этим обусловлен ряд ограничений, в частности МПА запрещен к использованию у женщин с ожирением и/или сахарным диабетом 2-го типа, которые принимают перорально сахароснижающие препараты [19, 20].
Мегестерола ацетат (Мегейс) является синтетическим прогестагеном. Считается, что действие препарата связано с наличием антилютеинизирующего эффекта, реализующегося через гипофиз. Существует указание о местном эффекте мегестрола, полученном при непосредственном введении прогестагенов в полость матки. Препарат нашел свое применение при паллиативном лечении рака эндометрия и рака молочной железы. В обычной практике для лечения эндометриоза активно не применяется.
Норэтистерона ацетат (НЭТА) — производное 19-нортестостерона 2-го поколения. Среди положительных эффектов приема этого препарата можно отметить снижение болевого синдрома при хронической тазовой боли, диспареунии, дисменорее и нарушениях желудочно-кишечного тракта. К отрицательным моментам можно отнести метаболические нарушения в виде увеличения массы тела, дислипидемии, гиперинсулинемии при приеме в небольшой дозе в непрерывном режиме [10, 11, 21, 22].
Дидрогестерон (Дюфастон) избирательно воздействует на эндометрий, что позволяет предотвратить повышенный риск развития гиперплазии эндометрия и/или карциногенеза в условиях избытка эстрогенов. Является препаратом выбора во всех случаях эндогенной недостаточности прогестерона [23, 24].
Диеногест (Визанна) является прогестагеном 4-го поколения и объединяет фармакологические свойства группы прогестерона и прогестероноподобных соединений, а также производных 19-нортестостерона. Специфичность его действия дополняется минимальными влияниями на метаболические параметры. Диеногест — первый гестаген, который вызывает клинически значимый антиандрогенный эффект, не проявляя эстрогенной и андрогенной активности. Исследования показали, что диеногест оказывает ановуляторное и антипролиферативное влияние за счет подавления секреции цитокинов в строме эндометриальных клеток [15, 25]. Диеногест характеризуется хорошей переносимостью, отсутствием негативных метаболических и сосудистых эффектов, относительно умеренным ингибирующим действием на секрецию гонадотропинов, а также сильным прогестагенным влиянием на эндометрий и высокой биодоступностью при приеме внутрь (более 90%) [26, 27]. Диеногест также оказывает антиангиогенное, противовоспалительное, иммуномодулирующее, обезболивающее действие. Диеногест в дозе 2 мг/сут купирует связанную с эндометриозом боль (при дисменорее, диспареунии и диффузной тазовой боли), значительно уменьшает распространенность эндометриоидных очагов и не уступает по эффективности аГнРГ [28—37]. Препарат подходит для долгосрочного лечения эндометриоза (в сочетании с препаратами кальция и витамином D3), поскольку его хорошо переносят больные, и он не оказывает негативного влияния на метаболический профиль и функцию печени. Частота возникновения кровотечений прорыва сопоставима с таковой при лечении другими прогестагенами и снижается по мере увеличения длительности терапии.
Среди прогестагенов для парентерального применения можно выделить медроксипрогестерона ацетат (Депо-Провера) в лекарственной форме с медленным высвобождением препарата и левоноргестрелвысвобождающую внутриматочную терапевтическую систему (Мирена).
Медроксипрогестерона ацетат (Депо-Провера) в лекарственной форме с медленным высвобождением препарата эффективен для купирования болевого синдрома, связанного с эндометриозом. Среди негативных эффектов этого препарата можно выделить длительные и обильные кровотечения прорыва, которые с трудом поддаются коррекции, поскольку эффект прогестагена не может быть быстро и полностью нивелирован. В связи с этим данный препарат рекомендуется пациенткам с остаточным эндометриозом после оперативного удаления матки, поскольку исключается возможность кровотечений прорыва [19, 20].
Левоноргестрелвысвобождающая внутриматочная терапевтическая система (Мирена). Левоноргестрел — представитель 2-го поколения гестагенов, относится к классу 19-норстероидов и является самым активным из известных в настоящее время гестагенов. Левоноргестрел оказывает сильное антиэстрогенное и антигонадотропное действие, что обеспечивает контрацептивный и лечебный эффекты.
Мирена является высокоэффективным средством, предназначенным для длительного использования, и оказывает контрацептивное, лечебное и профилактическое действие. Внутриматочная терапевтическая система Мирена представляет собой Т-образную полиэтиленовую конструкцию с контейнером, содержащим левоноргестрел. Через специальную мембрану, покрывающую контейнер, осуществляется непрерывное контролируемое высвобождение левоноргестрела 20 мкг/сут, который поступает непосредственно в полость матки и приводит к атрофии эутопического и эктопического эндометрия, уменьшению кровопотери во время менструации и развитию аменореи у некоторых пациенток. Длительность использования Мирены составляет 5 лет, после чего можно продолжить лечение, введя новую систему. Побочные эффекты схожи с таковыми при непрерывном режиме использования других прогестагенов [43—45].
В лечении эндометриоза эффективны гестагены без андрогенной активности. К ним относятся ципротерона ацетат, дидрогестерон, медроксипрогестерона ацетат и диеногест. Диеногест оказался наиболее эффективным как для профилактики, так и для лечения эндометриоза. Рекомендуемые дозы большинства пероральных прогестагенов для лечения эндометриоза достаточно высокие, что не отвечает современным требованиям, предъявляемым к препаратам (максимальный эффект при минимальной дозе). В наиболее низкой дозе используют диеногест (Визанна, 2 мг/сут) и левоноргестрел (внутриматочная терапевтическая система Мирена, 20 мг/сут).
Антигонадотропины
Наиболее широкое применение из препаратов этой группы нашел препарат Гестринон. Гестринон (Неместран) — стероидный гормон, производное 19-нортестостерона, снижает выведение гонадотропина, что приводит к атрофии эндометрия (дисменорея, диспареуния, меноррагия купируются в первые месяцы лечения). Оказывает андрогенное, антиэстрогенное и антигестагенное действие. Влияет на эктопические имплантаты вне матки. Препарат назначают в непрерывном режиме в 1-й и 4-й дни менструального цикла в дозе 2,5 мг, затем 2 раза в неделю по установленным дням в течение 6 мес.
Длительность применения препарата ограничена из-за выраженных побочных эффектов: головная боль, повышенная возбудимость, раздражительность, депрессия, судороги, задержка жидкости, увеличение массы тела, уменьшение объема молочных желез, понижение тембра голоса, снижение либидо, повышение активности «печеночных» трансаминаз, «приливы» крови к лицу, тошнота, диспепсия, кровянистые выделения из матки в первые недели приема, пигментация кожи, акне, себорея, гипертрихоз [46, 47].
Агонисты гонадотропин-рилизинг-гормона
Препараты аГнРГ наиболее эффективны при лечении тяжелых и инфильтративных форм эндометриоза. Действие аГнРГ заключается в подавлении эстрогенной стимуляции для развития эндометриоза. Это состояние гипогонадотропного гипогонадизма лишает существующий эндометриоз поддержки эстрогенами и приводит к вторичной аменорее, предотвращая новый перитонеальный высев эндометриоидных очагов. На фоне лечения аГнРГ исчезают дисменорея, тазовые боли, через 3—4 мес — диспареуния, к концу курса лечения выраженность болевого синдрома снижается в среднем в 4 раза. Лечение с помощью аГнРГ не обеспечивает профилактику рецидивирования заболевания, особенно при глубоких формах эндометриоза. Частота возникновения рецидивов через 5 лет после окончания курса терапии составляет 53%, а при тяжелых инфильтративных формах — 73%.
В клинической практике используют Синарел, Золадекс, Диферелин, Декапептил депо, Бусерелин, Люкрин депо в виде депо-формы, внутримышечных инъекций, подкожных имплантатов, интраназального спрея. Терапия препаратами аГнРГ очень эффективна, однако сопровождается в качестве побочных эффектов признаками снижения уровня эстрогенов (приливы, сухость влагалища, головная боль, снижение либидо) и деминерализацией костной ткани. По этой причине перед назначением аГнРГ женщинам из группы риска развития остеопороза целесообразно проведение остеоденситометрии. Для уменьшения частоты и выраженности гипоэстрогенных побочных реакций без влияния на эффективность применения аГнРГ используется так называемая терапия «прикрытия» («add-back» терапия): низкие дозы эстрогенов и прогестинов, тиболон и т. д. Комбинация с терапией «прикрытия» дает возможность применять аГнРГ в течение более чем 6 мес, что необходимо при глубоких инфильтративных формах заболевания, тяжелом болевом синдроме, рецидивировании или персистенции очагов ретроцервикального эндометриоза и невозможности их полного удаления, до и после операции по поводу аденомиоза и прочее [48—52].
Обобщенные сведения о препаратах, применяемых для лечения эндометриоза, представлены в таблице. 
Лечение эндометриоза другими средствами является либо паллиативным (анальгетики, НПВС), либо экспериментальным (ингибиторы ароматазы, селективные модуляторы эстрогеновых рецепторов (СЭРМ), агонисты эстрогеновых рецепторов β (ЭР-β), антиангиогенные препараты и прочее). Современная фармакология предусматривает комплексную терапию эндометриоза с использованием иммуномодуляторов, противовирусных и гормональных препаратов [53—55].
Нестероидные противовоспалительные средства
НПВС назначаются для устранения болевого синдрома и менструальной кровопотери. НПВС снижают длительность и интенсивность менструальных кровотечений за счет блокады активности циклооксигеназы, что влечет за собой снижение синтеза простагландинов и обеспечивает прокоагулянтный эффект. Кроме того, препараты этой группы оказывают антиноцицептивное действие. Но недостатками НПВС являются ульцерогенное действие на слизистую оболочку пищеварительного тракта, угнетение почечного кровотока, а также краткосрочность лечебного действия, постепенное «привыкание» и снижение эффективности.
Витамин D
В настоящее время активно обсуждается связь уровня витамина D, агента с антипролиферативным, противовоспалительным и иммуномодулирующим действием, и эндометриоза — заболевания, имитирующего опухолевый рост и удовлетворяющего большинству критериев аутоиммунного заболевания [56].
Синтез витамина D, экспрессия рецепторов витамина D и 1α-гидроксилазы в нормальном циклически функционирующем эндометрии, регулирование ферментов и рецепторов витамина D в эутопическом эндометрии женщин с эндометриозом, характерный полиморфизм протеина, связывающего витамин D, проявляющийся дифференциальной экспрессией аллеля Gc2 в эндометриоидных очагах, обратная зависимость между развитием эндометриоза и уровнем 25 (OH)D в сыворотке крови в сочетании с увеличением уровня протеина, связывающего витамин D, в моче женщин с эндометриозом — все это свидетельствует в пользу потенциальной роли витамина D и его метаболитов как местных аутокринных/паракринных агентов, имеющих значение в этиологии и патогенезе эндометриоза.
В большинстве источников описана связь низкого уровня витамина D с развитием и тяжестью течения генитального эндометриоза. Прием витамина D сопровождается уменьшением болевых ощущений при первичной дисменорее путем ингибирования синтеза простагландинов. Витамин D также эффективен в купировании вторичной дисменореи или хронической тазовой боли при эндометриозе, обусловленной процессом нейроангиогенеза.
Терапия препаратами витамина D у пациенток с эндометриозом, особенно при низких уровнях 25 (OH)D в плазме, может позволить уменьшить дозу НПВС или отказаться от этой группы препаратов. Витамин D увеличивает вероятность наступления беременности при бесплодии, ассоциированном с эндометриозом, в том числе при применении методов вспомогательных репродуктивных технологий. Необходимо проведение крупных рандомизированных исследований применения витамина D при эндометриозе для более углубленного понимания механизмов действия и разработки оптимальных терапевтических доз. Применение витамина D может стать новой медикаментозной стратегией как в лечении, так и в первичной профилактике развития данного заболевания [56].
Нашими коллегами предложен следующий алгоритм диагностики и лечения эндометриоза. При подозрении на эндометриоз у пациентки с одним или несколькими клиническими симптомами (хроническая тазовая боль; дисменорея, влияющая на качество жизни; диспареуния; регулярные желудочно-кишечные симптомы, болезненность при дефекации; периодические проявления со стороны мочевой системы; бесплодие в сочетании с одним из вышеперечисленных симптомов) важно провести тщательное диагностическое обследование. В план обследования входят гинекологическое исследование, включая ректовагинальное; ультразвуковое исследование органов малого таза; оценка метаболизма железа (уровень гемоглобина, железа, ферритина общей железосвязывающей способности); магнитно-резонансная томографияи/или компьютерная томография органов малого таза (при подозрении на глубокий инфильтративный эндометриоз); лапароскопия и/или гистероскопия. Далее тактика ведения пациентки зависит от ее репродуктивных планов. Если у пациентки выявлен наружный генитальный эндометриоз I—II стадии, и она планирует беременность, то показаны прегравидарная подготовка и протокол стимуляции яичников с аГнРГ, гестагенная поддержка при вспомогательных репродуктивных технологиях. Если при наличии наружного генитального эндометриоза I—II стадии пациентка не планирует беременность, то выбор медикаментозного или хирургического лечения зависит в первую очередь от предпочтений самой пациентки, ей показана длительная противорецидивная терапия. При тяжелых формах (глубокий инфильтративный эндометриоз и т. д.) независимо от репродуктивных планов пациентки важен индивидуальный и мультидисциплинарный подход с привлечением смежных специалистов. Необходимо предусмотреть предоперационную гормональную терапию при вовлечении смежных органов, лапароскопическое лечение, противорецидивную терапию [57].
Заключение
До настоящего времени ни одна из предложенных стратегий лечения эндометриоза не привела к его полному излечению и не позволила избежать рецидивов, что обусловлено множественными полисистемными нарушениями, лежащими в основе его этиопатогенеза. В некоторых случаях единственным методом лечения эндометриоза может быть полная хирургическая ликвидация очага с последующим назначением гормональной противорецидивной терапии.
Финансирование. Работа выполнена при финансовой поддержке гранта — Конкурс 2018 г. «Проведение фундаментальных научных исследований и поисковых научных исследований отдельными научными группами». Название проекта «Современные клинико-морфологические и иммунобиологические аспекты генитального эндометриоза», № проекта 18−15−00165.
Концепция и дизайн статьи — Л.А., К.А., Э.Х., О.Л.
Сбор и обработка материала — К.А., Э.Х.
Написание текста — К.А., Э.Х.
Редактирование — К.А., О.Л.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников
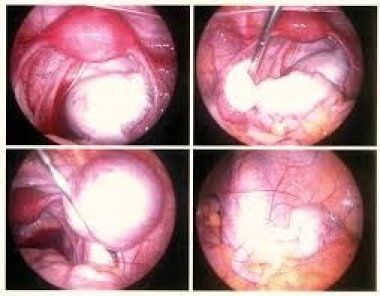
Изучены эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обоснованы условия и показания к минимально инвазивному вмешательству.
Efficiency and long-term results of sclerotherapy of ovary endometriosis were studied; conditions and indications for minimal invasive intervention were grounded.
Эндометриоз по праву считается одной из главных причин женского бесплодия и в силу особенностей морфогенеза тяжело поддается медикаментозной терапии. Онкологическая настороженность при эндометриозе остается малоизученной, вызывая много споров и дискуссий. Каждая локализация эндометриоза имеет не только свои клинические, но и патофизиологические и гистологические отличия. Эндометриозу яичников отводится особая роль, для подтверждения которой существует ряд фактов:
1) в структуре всех локализаций эндометриоидных гетеротопий эндометриоз яичников занимает первое место;
2) эндометриоз яичников неблагоприятно воздействует на фолликулогенез в целом и функцию желтого тела в частности;
3) эндометриоз яичников угнетает овариальный резерв, разрушая функциональную ткань яичников;
4) считается, что изначально именно эндометриоз яичников приводит к развитию тяжелого осложнения — глубоко инфильтративного эндометриоза, вовлекая в патологический процесс экстрагенитальные органы и структуры — мочевыводящие пути, кишечник, окружающую брюшину;
5) эндометриоз яичников, в отличие от других локализаций нозологии, представляет наибольшую потенциальную угрозу для озлокачествления.
Эндометриомы (эндометриоидные кисты) яичников занимают лидирующие позиции не только в структуре всех поражений эндометриозом, но и среди причин женского бесплодия, ассоциированного с эндометриозом. Более того, особенности гистогенеза эндометриом (способность к инфильтрации в окружающие ткани) обуславливают снижение объема функционирующей ткани яичника независимо от размеров новообразования [2]. В отношении тактики лечения пациенток с эндометриомами в репродуктивном периоде существуют две точки зрения: одни авторы считают, что при средних размерах эндометриоидных кист до 30 мм целесообразно проведение медикаментозной терапии, другие — придерживаются мнения о необходимости цистэктомии при таких новообразованиях.
Недопустимо медикаментозное лечение эндометриоидных кист яичников без верификации диагноза, так как предполагаемая «эндометриоидная киста» на самом деле может быть опухолью яичника или «переродиться» в нее в процессе лечения». Действительно, с одной стороны, пассивное наблюдение или медикаментозная терапия эндометриом связаны с высоким риском различных осложнений (снижение функции яичников, экспансивный рост новообразования, угроза его озлокачествления), с другой — хорошо известно, что классическая цистэктомия при эндометриоидных кистах яичников сопряжена с потенциальной потерей фолликулярного запаса. Следовательно, для решения данной проблемы необходим некий компромисс, который позволил бы не только избежать повреждения функциональной ткани яичников, но и снизить риски, обусловленные онкологической настороженностью. Сегодня роль «золотой середины» лечения пациенток с эндометриоидными кистами яичников играет аспирационная (склерозирующая) терапия. В литературе последних лет появилось сравнительно большое количество публикаций на эту тему. В частности, García-Tejedor et al. из университетского госпиталя Барселоны (Bellvitge University Hospital-IDIBELL, Испания) опубликовали результаты предварительного анализа 27 случаев склеротерапии эндометриом яичников, выполненных в период 2010–2014 гг. При этом указали частоту рецидивов новообразования всего лишь 12% в течение 17 мес наблюдения [5]. Профессор А. И. Давыдов и соавт. первое подобное вмешательство осуществили в 1999 г. у пациентки 32 лет с единственным яичником, в котором диагностирован рецидив эндометриоидной кисты после предшествующих цистэктомий [6]. Первый опыт оказался удачным: после 2 лет бесплодия у женщины наступила беременность, закончившаяся срочными родами. С того периода были произведены 124 подобные манипуляции, ретроспективный анализ которых позволил обосновать четкую позицию по данному вопросу.
Целью данной работы было изучить эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обосновать условия и показания к минимально инвазивному вмешательству.
Пациенты и методы исследования
За период 1999–2017 гг. выполнены 124 вмешательства по методике аспирационной (склерозирующей) терапии эндометриоидных кист яичников. Возраст пациенток варьировал от 18 до 42 лет, составив в среднем 26,4 ± 4,2 года. Средний возраст менархе составил 13,3 ± 1,2 года. Продолжительность менструального цикла у большинства больных (68%) находилась в пределах 25–29 дней. У 92% пациенток длительность менструального кровотечения была 4 и более дней, жалобы на обильные менструации предъявляли 26% больных, а у 36 менструации сопровождались болями различной интенсивности. Одну и более беременностей имели 24 (19%) пациентки; соответственно, не было беременностей у 100 (81%) женщин. Первичное бесплодие диагностировано у 42 (34%) пациенток, вторичное бесплодие — у 9 (7%). Роды в анамнезе имели 26 (20%) больных, у 16% — беременность закончилась самопроизвольным прерыванием в сроки 3–11 нед гестации, причем у 10% женщин — после экстракорпорального оплодотворения. При анализе перенесенных заболеваний обращает на себя внимание высокий инфекционный индекс в детстве. Оперативные вмешательства на придатках матки в связи с новообразованиями яичников различного генеза в прошлом выполнены у 38 (31%) пациенток, в том числе по поводу эндометриоидных кист — у 26 (21%). Следует уточнить, что у 22 из 38 (18%) больных в ходе предшествующих хирургических вмешательств были удалены придатки матки.
Длительность основного заболевания колебалась от нескольких месяцев до 4 лет (в среднем — 1,6 ± 0,6 года). Его ведущими симптомами были: тазовые боли различной интенсивности — 74%, дисменорея — 22%, диспареуния — 14%, меноррагии — 5% (перечисленные симптомы сочетались в различных отношениях). Лишь 15 (12%) пациенток не предъявляли жалоб, у них образования яичников были выявлены гинекологом и/или врачом ультразвуковой диагностики при профилактическом осмотре. При гинекологическом исследовании патологические образования в проекции придатков матки обнаружены у 38% женщин, у 12% — высказано предположение об их наличии. Соответственно в 50% наблюдений новообразования яичников диагностированы только с помощью эхографии.
Методика аспирационной (склерозирующей) терапии эндометриом яичников хорошо известна и описана ранее [6]. Следует акцентировать внимание на необходимости полной санации полости кисты и экспозиции 70% раствора этанола не менее чем на 40 с (в зависимости от исходного объема эндометриомы).
Результаты исследования и их обсуждение
Средний диаметр эндометриом яичников в наших исследованиях варьировал от 25 до 65 мм. В 84 (67,7%) наблюдениях патологический процесс был односторонним, в 72,3% — двусторонним. У 43 (34,6%) женщин имел место рецидив заболевания после предшествующей цистэктомии, у 28 (22,6%) — эндометриоидные кисты локализовались в единственном яичнике и еще у 7 (5,6%) пациенток при ультрасонографии яичник, контрлатеральный от эндометриодного образования, был резко уменьшен в размерах, а в его срезах отсутствовали признаки антральных фолликулов (после предшествующей цистэктомии по поводу эндометриоидных кист). То есть фактически у 35 (28,2%) пациенток эндометриома диагностирована в единственном яичнике. Ультразвуковая характеристика эндометриоидных кист хорошо изучена и не требует обсуждения. Следует уточнить, что их главным акустическим критерием считается констатация внутри патологического образования мелкоточечной эхо-позитивной взвеси на фоне повышенного уровня звукопроводимости. Обнаружение подобной картины позволяет почти в 100% наблюдений установить точный диагноз до хирургического вмешательства.
Для выявления локусов неоангиогенеза — одного из основных маркеров злокачественной опухоли — использовали цветное допплеровское картирование в режиме энергетического допплера. В этом режиме у больных с эндометриомами кровоток регистрировали в области ворот яичника, а также по периферии новообразования в сохранной ткани яичника. Объем содержимого эндометриоидной кисты, эвакуированного в ходе аспирационной терапии, варьировал от 2 до 12 мл. Однако истинный объем содержимого этих кист было сложно оценить вследствие высокой плотности «шоколадной» жидкости, что практически всегда требовало предварительного лизиса с помощью 0,9% раствора NaCl. Важным этапом склерозирующей терапии эндометриом является экспозиция 70% раствора этанола на завершающем этапе вмешательства. Ее длительность зависит от объема полости новообразования и составляет 60–90 с. Суть данного этапа аспирационной терапии — вызвать легкий ожог (химическая деструкция) и в последующем — склероз эндометриоидной выстилки кисты. Склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением. Вопрос о роли послеоперационной гормональной терапии больных эндометриозом яичников до настоящего времени остается поводом для дискуссий. Существует точка зрения, что после полного удаления капсулы эндометриоидных кист, других очагов эндометриоза нет необходимости в применении гормональных средств. В то же время никто не отрицает сравнительно высокую частоту рецидивов эндометриом после цистэктомии, что можно объяснить наличием микроскопических и/или непигментированных гетеротопий, рост которых в последующем обуславливает рецидивы патологических образований. В любом случае, аспирационная терапия предусматривает обязательное назначение гормональных препаратов.
Применение в послеоперационном периоде экзогенных гормонов (антигормонов) преследует следующие цели:
1) дополнить склерозирующий эффект этанола;
2) подавить пиковые выбросы гормонов аденогипофиза, способствующие рецидиву заболевания.
Традиционно препаратами первой линии лечения пациенток с эндометриозом после хирургического вмешательства считаются комбинированные оральные контрацептивы (КОК) — эстроген-гестагенные средства [4]. При выборе последних особое внимание уделяют типу прогестагена, так как именно эти соединения оказывают антипролиферативное действие на очаги эндометриоза.
Эффективность результатов комплексной (склерозирующей + медикаментозной) терапии эндометриом оценивали по следующим параметрам:
1) частота рецидивов новообразования;
2) длительность периода, в течение которого произошел рецидив эндометриомы;
3) частота наступления беременности.
Ретроспективный анализ полученных результатов показал, что частота рецидивов заболевания в течение первых 12 мес наблюдения составила 38,7% (48 из 124 наблюдений). В то же время в течение первых 3 мес наблюдения этот показатель не превысил 9,7% (12 из 124 наблюдений). В период 7–12 мес после вмешательства самопроизвольная беременность наступила у 36,3% (46) женщин, которая во всех наблюдениях закончилась родами. Причем часть пациенток (20,1%) по разным причинам не планировали беременности.
Сегодня главная дилемма в отношении эндометриом яичников — оперировать или не оперировать. Справедливо отметить, что по данному вопросу мнения ученых всего мира разделились. Действительно, некоторые авторы ратуют в пользу нехирургического подхода при эндометриомах яичников диаметром до 3 см, аргументируя свою позицию резким снижением, а иногда потерей фолликулярного запаса после хирургических вмешательств на яичниках по поводу эндометриоидных образований. Нельзя не признать, что данный факт имеет высокий уровень достоверности. Механизмы снижения/утраты фолликулярного запаса после хирургического лечения больных эндометриомами яичников различны. Однако главная причина тесным образом связана непосредственно с морфогенезом эндометриом. Хорошо известно, что эндометриоидные кисты в отличие от других доброкачественных новообразований яичников характеризуются наличием плотных подэпителиальных сращений между капсулой кисты и воротами яичников — места прохождения основных кровеносных и лимфатических сосудов, питающих яичник. Поэтому цистэктомия при эндометриоидных кистах — это уже большая травма для яичника, а необходимость лигирования (коагуляции) яичника в области его ворот вызывает дополнительные нарушения в системе кровоснабжения яичника. «Агрессивность» цистэктомии при эндометриомах — это одна сторона медали. Другая — напрямую связана с онкологической настороженностью. Сегодня не является поводом для дискуссий риск озлокачествления эндометриоза. Однако в обсуждении данной проблемы «ускользает» важное уточнение: способностью к малигнизации обладает, как правило, эндометриоз яичников. Именно для этой локализации эндометриоза характерны атипические формы, которые принято рассматривать как фазу перехода доброкачественного процесса в злокачественный [8]. Проведенные по данной проблеме клинико-статистические исследования установили, что в отдаленном периоде наблюдения (11,4 года) риск развития рака яичников у пациенток с эндометриомами яичников в 2 раза выше, чем в популяции [9].
Анализ данных литературы и опыт собственных наблюдений по данной проблеме позволяют обосновать ряд положений:
1) эндометриоз — гистологический диагноз, характеризующийся специфическими морфоструктурными особенностями; до хирургического вмешательства «эндометриодная киста яичника» — лишь предположительное заключение методов инструментальной диагностики (УЗИ, КТ, МРТ);
2) нецелесообразно проводить медикаментозное лечение при эндометриоидных кистах яичников без их гистологической верификации вследствие погрешности диагностики даже при использовании ультрасовременных методов нехирургической визуализации;
3) учитывая высокие риски повреждения фолликулярного запаса после хирургического лечения эндометриом, особенно при их рецидивах, необходимо ставить вопрос о применении аспирационной (склерозирующей) терапии;
4) склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением.
Важно подчеркнуть, что от комплаентности экзогенных гормонов зависит исход микроинвазивного (максимально щадящего для функции яичников) хирургического вмешательства, коим является склеротерапия. Сегодня КОК вполне справедливо причисляют к препаратам первой линии выбора, которые используют для купирования тазовой боли у пациенток с эндометриозом. Их потенциальными преимуществами являются сравнительно низкая цена, небольшая частота побочных эффектов, возможность длительного лечения. Последний аспект имеет особое значение у женщин, не планирующих беременность. При выборе КОК для послеоперационного лечения пациенток с эндометриоидными кистами яичников необходимо учитывать фармакодинамику прогестагена, входящего в состав КОК. Данные литературы свидетельствуют, что эффективность диеногеста при эндометриозе сопоставима с таковой агонистов гонадотропин-рилизинг-гормона [10]. Однако в отличие от последних прогестагены не модулируют развитие эстроген-дефицитных состояний, тяжело переносимых пациентами. В литературе последних лет сведения об эффективности склерозирующей терапии эндометриом имеют разноречивый характер. В метаанализе Cohen et al., основанном на изучении мировых источников (Pubmed, Embase, Ovid Medline, Google Scholar, Clinicaltrials. gov, Cochrane Central Register of Controlled Trials), частота рецидивов эндометриом после склерозирующей терапии варьирует от 0% до 62,5% (соответственно эффективность — от 37,5% до 100%) [11]. В наших исследованиях частота рецидивов составила 38,7%, что коррелирует с «нижней границей» эффективности данного метода. В то же время мы считаем это достаточно высоким результатом, основанным на многолетнем опыте. Различия в эффективности склерозирующей терапии, представленные в литературе, по-видимому, объясняются длительностью периода наблюдения за этими пациентками. В частности, в наших исследованиях в течение первых 3 мес наблюдения этот показатель не превысил 9,7%, что в итоге способствовало наступлению беременности у 46 из 124 женщин. С учетом того, что 25 (20,1%) женщин, вошедших в настоящее исследование, не планировали беременность и использовали гормональную контрацепцию (диеногест + этинилэстрадиол), частота наступления беременности в данной группе достигла 46,4%.
Необходимо подчеркнуть, что склеротерапия эндометриом яичников не должна рассматриваться в качестве панацеи в лечении таких пациенток. Ее популяризация не означает отказ от применения других методов хирургического вмешательства. Безусловно, данный метод обеспечивает максимально бережное отношение к фолликулярному запасу. Однако он имеет и свои ограничения, такие как невозможность выполнения овариолизиса, отсутствие визуального контроля над деструкцией капсулы кисты, отсутствие информации о распространенности эндометриоза. Более того, благоприятный исход аспирационной терапии эндометриоидных кист яичников во многом зависит от соблюдения условий и показаний к подобному вмешательству:
Заключение
Склеротерапия эндометриом яичников с ультразвуковым мониторингом вмешательства — минимально инвазивный метод лечения пациенток репродуктивного возраста, обеспечивающий сохранность фолликулярного запаса. Также данный метод можно рассматривать в качестве выбора в сложных клинических ситуациях: рецидив эндометриоидной кисты единственного яичника; предшествующие многократные оперативные вмешательства на единственном яичнике; высокий риск осложнений абдоминального хирургического вмешательства и др. Аспирационная терапия эндометриом не должна рассматриваться в качестве основного метода лечения таких пациенток, для ее применения разработаны определенные условия и показания. Склерозирование капсулы эндометриом яичников не является монотерапией, ее исход во многом определяется адекватностью послеоперационного гормонального лечения.
Литература
М. Б. Таирова 1
А. И. Давыдов, доктор медицинских наук, профессор
ФГАОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников/ М. Б. Таирова, А. И. Давыдов
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 20-23
Теги: тазовая боль, эндометриома, склерозирующая терапия