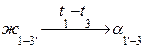что показывает линия ликвидус диаграммы состояния сплавов
Диаграммы состояния сплавов
Процесс кристаллизации металлических сплавов, а также происходящих в них изменений при охлаждении до комнатной температуры принято изображать графически в виде так называемых диаграмм состояния. При их помощи удается наглядно и коротко описывать различные превращения в сплавах, например при закалке, отжиге и других операциях. Диаграмм состояния, как и сплавов, очень много, но здесь будут рассмотрены только диаграммы, наиболее типичные для некоторых цветных сплавов.
На рис. 9 приведен наиболее простой вид диаграммы состояния, каким является, например, диаграмма состояния сплавов меди с никелем (Cu—Ni), которые при кристаллизации из жидкого состояния образуют однородный твердый раствор при любых соотношениях компонентов. По горизонтальной оси диаграммы откладывают в процентах содержание компонентов в сплаве, а по вертикальной оси — температуру. Поле диаграмм сплава Cu—Ni делится двумя линиями anb и amb на три области. Выше линии anb, называемой линией ликвидуса, сплав находится в жидком состоянии и образует однородный жидкий раствор (ж.р.). Ниже линии amb, называемой линией солидуса, сплав находится в твердом состоянии и образует однородный твердый раствор (тв.р.). Между линиями ликвидуса и солидуса сплав находится в процессе кристаллизации, т. е. здесь одновременно существуют жидкий раствор и кристаллы выделяющегося из жидкости твердого раствора.
На левой вертикальной оси, в точке а, показана температура плавления или затвердевания меди 1083° С, на правой вертикальной оси, в точке b — температура плавления или затвердевания никеля 1452° С. По линии ликвидуса начинается кристаллизация сплава, а по линии солидуса — заканчивается затвердевание сплава. Отсюда ясно, что кристаллизация твердых растворов идет не при постоянной температуре, как у чистых металлов, а в некотором интервале температур.
Рассмотрим процесс кристаллизации сплава, содержащего 30% Ni. После достижения температуры 1240° С, соответствующей точке п на линии ликвидуса, начинается кристаллизация сплава. При температуре 1200° С, отвечающей точке t, сплав состоит из жидкого раствора и кристаллов твердого сплава. При дальнейшем охлаждении, когда температура сплава достигает 1170° С (точка т на линии солидуса), сплав целиком переходит в твердый раствор и таким остается при охлаждении до комнатной температуры и ниже.
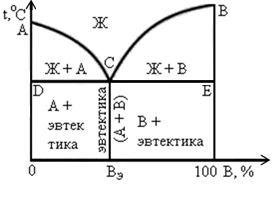
На рис. 10 приведена диаграмма состояния сплавов, состоящих из свинца и сурьмы (Pb—Sb), которые, как говорилось ранее, обладают полной взаимной растворимостью в жидком состоянии, а при затвердевании образуют не твердый раствор, а механическую смесь кристаллов Pb и Sb.
В этом случае поле диаграммы разделено на пять областей линиями: ликвидуса acb, солидуса dсe и эвтектической cf. Выше линии ликвидуса сплав находится в жидком состоянии и представляет собой однородный жидкий раствор. Ниже линии солидуса сплав, состоящий из кристаллов свинца и сурьмы, находится в твердом состоянии. Между линиями ликвидуса и солидуса сплав находится в стадии кристаллизации.
Проследим за изменениями состояния сплава с изменением температуры при различных содержаниях свинца и сурьмы. Как видно из диаграмм, а также из рис. 8, чистые металлы начинают кристаллизоваться соответственно при 327 и 631° С, а эвтектика — при 245° С. Сплав, состоящий из 90% свинца и 10% сурьмы, начинает кристаллизоваться при температуре 270° С, отвечающей линии ас.
При этом из жидкости выпадают кристаллы чистого свинца. Этот процесс продолжается до температуры 245° С, отвечающей линии cd. Оставшаяся жидкость при 245° С превращается в эвтектику — механическую смесь кристаллов свинца и сурьмы. Таким образом, этот сплав в твердом состоянии состоит из кристаллов свинца и эвтектики. Аналогично сказанному изменяется состояние сплава, содержащего 20% свинца и 80% сурьмы, с той лишь разницей, что кристаллизация начнется при температуре 540°С и после затвердевания сплав будет состоять из кристаллов сурьмы и эвтектики.
В целях упрощения на рис. 11 приведена только часть диаграммы состояния сплавов алюминия с медью (Al—Cu). Эти металлы в жидком состоянии обладают полной взаимной растворимостью, а в твердом — ограниченной, к тому же зависящей от температуры. Поле диаграммы делится на несколько областей, из которых рассмотрим только области, прилегающие к левой стороне диаграммы, отвечающей деформируемым алюминиевым сплавам. Выше линии acb, как и в предыдущих случаях, сплав образует однородный жидкий раствор. В области треугольника acd одновременно существуют жидкий раствор и кристаллы твердого раствора меди в алюминии, обозначаемые а. В области adf находится только твердый раствор а, наконец, в области dfk находится в твердом состоянии сплав, состоящий из кристаллов а и химического соединения меди с алюминием CuAl2.
Характерной особенностью настоящей диаграммы является линия df, отвечающая предельной растворимости меди в алюминии. Как видно из диаграммы, максимальное содержание меди в алюминии достигается при температуре 548°С и составляет 5,65%. С понижением температуры содержание меди в твердом растворе а постепенно уменьшается. Так, например, при 400 и 300′ С, как это можно видеть по ходу линии df, содержание меди в твердом растворе соответственно составляет только 1,4 и 0,95%, а при комнатной температуре оно не превышает 0,2 %.
Проследим за изменением состояния алюминиевого сплава, содержащего 4% меди (дуралюмины Д1 и Д16) при медленном его охлаждении.
Выше линии ликвидуса (см. рис. 11) сплав находится в жидком состоянии. При температуре, отвечающей точке t1, сплав состоит из жидкости и кристаллов твердого раствора ос. В интервале температур t2 и t3 сплав находится в твердом состоянии и представляет собой твердый раствор, состоящий из алюминия и 4% меди. При дальнейшем охлаждении из твердого раствора выпадает химическое соединение CuAl2, вследствие чего концентрация меди в твердом растворе снижается по линии df. По окончании охлаждения до комнатной температуры структура сплава будет состоять из слабоконцентрированного твердого раствора ос и выпавших кристаллов CuAl2, распределенных главным образом по границам кристаллов а.
При вторичном нагреве сплава указанные превращения в нем будут происходить в обратном порядке, в частности химическое соединение CuAl2 вновь перейдет в твердый раствор и содержание меди в последнем будет возрастать по линии df. Если сплав, нагретый, предположим, до 520° С, вновь охладить, но не медленно, как это было показано выше, а быстро, погружая в холодную воду, то выделения химического соединения CuAl2 из твердого раствора не произойдет и сплав будет состоять только из кристаллов твердого раствора меди в алюминии. Такой раствор является пересыщенным и поэтому неустойчивым. Обычно твердость и прочность сплавов, состоящих из пересыщенных растворов, возрастают, изменяются также другие свойства.
Другим примером диаграмм состояния с ограниченной растворимостью компонентов в твердом состоянии может служить диаграмма сплавов меди с цинком. Часть такой диаграммы приведена на рис. 12. Как видно из диаграммы, предельная растворимость цинка в меди при комнатной температуре составляет 38% и практически не меняется до температуры 453° С. При дальнейшем повышении температуры растворимость цинка уменьшается и при 903° С составляет 32,5%. Сплавы меди с цинком при содержании цинка до 38%, называемые a-латунями и представляющие собой твердые растворы, обладают высокой пластичностью и потому хорошо обрабатываются давлением в холодном состоянии. Латуни с более высоким содержанием цинка также представляют твердые растворы, основой которых служит не чистый металл, а химическое соединение CuZn.
Эти латуни, как например Л59, обладают низкой пластичностью в холодном состоянии, но хорошо обрабатываются давлением в горячем состоянии.
Диаграммы состояния сплавов



ДИАГРАММЫ СОСТОЯНИЯ ДВОЙНЫХ СПЛАВОВ
Диаграмма состояния представляет собой графическую зависимость состояния сплавов данной системы от их концентрации (химического состава) и температуры. По ней можно установить, какие превращения происходят в сплавах при нагреве и охлаждении, определить, при каких температурах произойдет затвердевание.
Диаграммы состояния строят экспериментальным путем на основе результатов термического анализа, изучения структур сплавов в твердом состоянии, по результатам физических методов исследований.
Диаграмма состояния сплавов, образующих неограниченные твердые растворы.
Диаграмма состояния сплавов, образующих ограниченные твердые растворы.
Диаграмма состояния сплавов, образующих неограниченные твердые растворы и перитектику.
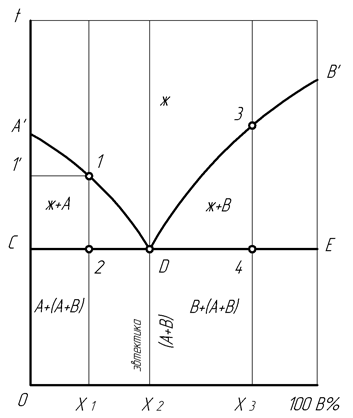
Смесь кристаллов в сплаве называется эвтектикой или эвтектической смесью, если она закристаллизовалась из жидкости при температуре более низкой, чем температуры плавления отдельных компонентов, образующих этот сплав, (по-гречески eutektos означает легко плавящийся, легкоплавкий).
Процесс образования новой фазы за счет растворения (расплавления) старой фазы в жидкости называется перитектическим.Температура, при которой происходит этот процесс, называется перитектической.
Для определения относительного количества (массы) сосуществующих фаз и структурных составляющих одного сплава пользуются правилом отрезков коноды.
Правило отрезков коноды.Для определения количества жидкой и твердой фаз сплава по диаграмме состояния:
1. Восстановить перпендикуляр к точке, характеризующей состав данного сплава (т. е. провести линию сплава).
3. Соотношение между жидкой и твердой частями сплава будет обратно пропорционально отрезкам, на которые линия сплава делит коноду.
4. Для определения количества твердой части сплава надо взять отношение длины отрезка, прилегающего к жидкой части сплава, к длине всей коноды.
5. Для определения количества жидкой части сплава надо взять отношение длины отрезка, прилегающего к твердой части сплава, к длине всей коноды. Поскольку в выражение для количественного определения температура не входит, то правило отрезков верно для любых температур и, следовательно, любых двухфазных областей разных диаграмм состояний.
ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗО-ЦЕМЕНТИТ:
Металлические сплавы и диаграммы состояния
Сплавами являются твёрдые вещества, получаемые сплавлением двух или более простых веществ, называемых компонентами. В металлическом сплаве основными компонентами являются металлы. Для металлического сплава меняя соотношение компонентов, можно получить бесчисленное множество вариантов сплава, и каждый вариант будет иметь свою структуру и свойства, температуру плавления, затвердения и т.д.
В технике большинство сплавов получают взаимным растворением их составляющих в жидком состоянии, т.е. доводят компоненты до плавления. Однако сплавы могут быть получены в твёрдом состоянии в процессе смешивания и спекания порошков компонентов под давлением при высоких температурах. Расплавленные компоненты при охлаждении и кристаллизации могут образовывать твердые металлические сплавы с различным строением: смеси, твердые растворы, химические соединения.
Наиболее часто встречающиеся сплавы – твёрдые растворы, в которых компоненты в твердом состоянии частично или полностью растворены друг в друге. Можно просто представить понятие твёрдого раствора можно, если, например, заморозить солёную воду. В этом случае лёд уже будет представлять собой твёрдый раствор соли в воде.
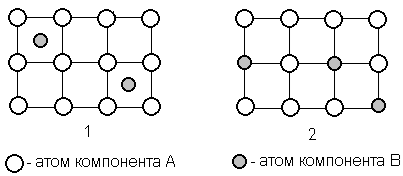
Растворение атомов одного из компонентов в кристаллической решётке другого компонента может идти по типу внедрения, когда атомы растворенного элемента располагаются между атомами растворителя (рисунок 1.1), и по типу замещения, когда атомы растворенного элемента замещают атомы растворителя (рисунок 1.2).
Рисунок 1 – Строение твёрдого раствора внедрения и замещения
При образовании твёрдого раствора внедрения его растворимость всегда ограниченная, что связано с ограниченными размерами межатомных промежутков в кристаллической решётке растворителя.
Чем больше концентрация твёрдого раствора, тем больше увеличены межатомные расстояния в решетке. Такие твёрдые растворы возникают при сплавлении металлов с неметаллами, имеющими малый атомный радиус – углеродом, азотом, бором, водородом. Примером твёрдых растворов внедрения, имеющих промышленное значение, являются твёрдые растворы углерода в ОЦК и ГЦК решётке железа – феррит и аустенит.
Информация о состоянии и структуре сплавов просто и сжато может быть представлена в виде диаграммы состояния – графического изображения состояния сплавов в зависимости от температуры и концентрации компонентов. Такие диаграммы также называют структурными с добавлением слова равновесные, что указывает на образование таких фаз и структур, которые соответствуют наименьшему значению свободной энергии системы.
На любой диаграмме состояния можно выделить следующие точки и линии:
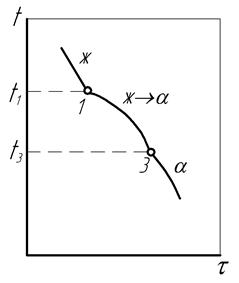
Ликвидус – точка, отвечающая началу кристаллизации.
Линия ликвидус – геометрическое место точек ликвидус.
Солидус – точка, отвечающая концу кристаллизации.
Линия солидус – геометрическое место точек солидус.
Фигуративная точка– точка, взятая в пределах диаграммы состояния, которая показывает температуру сплава, его состояние, процентное соотношение компонентов.
Фигуративная линия – линия, проходящая через фигуративную точку параллельно оси температур.
Рассмотрим основные диаграммы состояния двойных сплавов.
Рисунок 2 – Диаграмма состояния I рода
Диаграмма состояния II рода характерна для сплавов с неограниченной растворимостью компонентов друг в друге, имеющих одинаковые типы кристаллических решеток. Диаграмма (рисунок 3) содержит область жидкой фазы (выше линии ликвидус АСВ), двухфазную область α + Ж, расположенную между линиями АСВ и АDВ, область твердой фазы α (ниже линии солидус АDВ). Фаза α представляет собой твердый раствор компонентов А и В, азерна этой фазы имеют общую кристаллическую решетку.
Рисунок 3 – Диаграмма состояния II рода
Диаграмма состояния III рода характерна для сплавов с ограниченной растворимостью компонентов друг в друге. На диаграмме (рисунок 4) линия АDВ является линией ликвидус, а линия АСDЕВ – линией солидус. Фаза α является твердым раствором компонента В в компоненте А, а фаза β – твердым раствором компонента А в компоненте В. Эвтектика для рассматриваемой диаграммы представляет собой смесь мелкозернистых фаз α и β. Эвтектика кристаллизуется при наименьшей для данной системы температуре, т.е. на линии СЕ.
Линия СF показывает предельную растворимость компонента В в компоненте А, а линия ЕК – предельную растворимость компонента А в компоненте В. Ниже линии СF из α-фазы начинают выделяться атомы компонента В, образуя вторичные кристаллы βIIβ-твер-дого раствора. Аналогично ниже линии ЕК из β-фазы выделяются атомы компонента А, образуя вторичные кристаллы αIIα-твердого раствора. Структура доэвтектических сплавов ниже линии СЕ состоит из первичных зерен α-фазы, эвтектики (α + β) и зерен вторичной βII-фазы. А структура заэвтектических сплавов состоит из первичных зерен β-фазы, эвтектики (α + β) и зерен вторичной αII-фазы.
Рисунок 4 – Диаграмма состояния III рода
Диаграмма состояния IV рода (рисунок 5) относится к сплавам, в которых сплавляемые компоненты образуют устойчивое химическое соединение АтВп. Поэтому в данном случае химическое соединение выступает в роли самостоятельного компонента, способного образовывать сплавы с каждым из исходных компонентов.
Химическое соединение АтВп образует с компонентами А и В сплавы, которые характерны для диаграммы состояния I рода.
Рисунок 5 – Диаграмма состояния IV рода
Рисунок 6 – Изменение твёрдости и электрического сопротивления в зависимости от рода диаграммы
Для сплавов и компонентов, образующих химическое соединение, максимальные значения твердости и электрического сопротивления наблюдаются при концентрации компонентов, соответствующих химическому соединению (рисунок 6,г).
Таким образом, если известны характер взаимодействия между компонентами и тип диаграммы состояния, то возможен выбор состава сплава, обеспечивающего заданные физико-химические свойства.
1. Что такое сплав? Что является компонентами для металлического сплава? Сколько компонентов должно присутствовать, чтобы вещество можно было назвать сплавом?
2. Способы получения сплава.
3. Типы растворения твёрдых растворов. Показать на рисунке. Какой тип растворения способствует увеличению межатомных расстояний.
4. Что такое диаграмма состояния?
5. Ликвидус как точка и как линия (определения).
6. Солидус как точка и как линия (определения).
7. Фигуративная точка, фигуративная линия (определения).
8. Диаграммы состояний I, II, III, IV рода. Для каких сплавов характерна каждая из диаграмм, особенности диаграмм. Уметь показать на каждой из диаграмм ключевые точки и линии (солидус, ликвидус и др.)
9. Диаграммы изменения твёрдости и электрического сопротивления. Уметь изобразить – как изменяются эти свойства для каждого рода диаграмм.
Диаграммы состояния сплавов
В зависимости от взаимной растворимости компонентов, результатов их физико-химического взаимодействия диаграммы состояния сплавов могут иметь несколько основных видов.
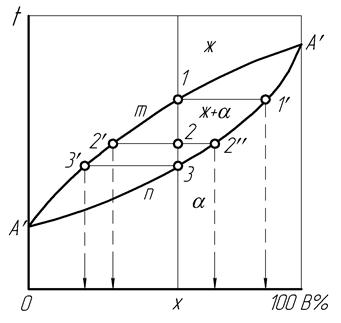
Диаграмма состояния сплавов с неогра-ниченной растворимостью компонентов уста-навливает температуры, при которых происходят начало и окончание превращений имеющихся двух фаз сплава – жидкой и твердой (рис. 17).
Точка А’ соответствует равновесной температуре кристаллизации либо плавления компонента А, точка В’ – равновесной температуре тех же превращений компонента В. Линия А’mB’ характеризует изменение температуры начала кристаллизации жидких сплавов в зависимости от концентрации компонентов и называется «ликвидус», что по-латыни означает «жидкий». Линия А’nВ’ указывает на изменение температуры окончания кристаллизации сплавов в зависимости от их концентрации и называется «солидус» (по-латыни «твердый»).
Рис. 17. Диаграмма состояния сплавов с неограниченной растворимостью компонентов
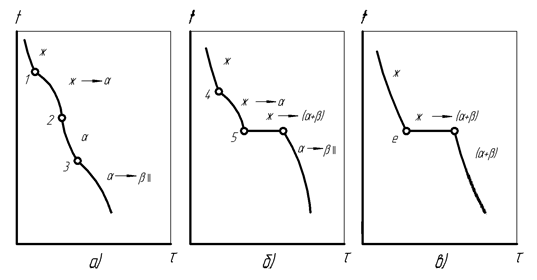
Анализ диаграммы состояния позволяет для сплава любой концентрации и при любой температуре определить его фазовое состояние, состав фаз и количественное соотношение между фазами. Для этого через точку концентрации сплава, например, Х проводится вертикаль и рассматриваются превращения сплава в трех названных областях диаграммы при охлаждении.
В жидкофазной области сплав обладает бивариантным равновесием (С=2), которое сохраняется при изменениях концентрации и температуры.
Во время достижения температурой жидкого сплава точки 1 на ликвидусе начинает выделяться вторая фаза – кристаллы твердого раствора, и равновесие становится моновариантным (С=1). Из-за этого дальнейшее охлаждение и поддержание равновесного фазового состояния происходит только при соответствующих изменениях концентрации жидкой и твердой фаз. Эти равновесные концентрации при каждой определенной температуре характеризуются соответствующими точками на ликвидусе и солидусе, связанными прямой, параллельной оси концентраций и называемой «конодой». Для данной температуры начала кристаллизации в точке 1 конодой является прямая 1– 1′. Перпендикуляры, опущенные из ее концов на ось концентраций, показывают, что в начале кристаллизации жидкая фаза имеет исходную концентрацию Х, а выделяющиеся кристаллы обогащены более тугоплавким компонентом В.
При дальнейшей кристаллизации с охлаждением сплава до температуры точки 2 происходит изменение концентрации как жидкой фазы за счет ее обогащения компонентом А по ликвидусу от точки 1 к точке 2′, так и кристаллов твердой фазы по солидусу от точки 1′ к точке 2» путем диффузии в них компонента А из жидкости. Рассмотренные процессы подчиняются правилу концентраций, согласно которому для определения концентрации двух фаз сплава через точку его двухфазного состояния на диаграмме проводится конода, после чего проекция точки ее пересечения с ликвидусом на горизонтальную ось диаграммы указывает концентрацию жидкой фазы, а проекция точки пересечения коноды с солидусом – концентрацию твердой фазы.
Ко времени снижения температуры до точки 3 солидуса заканчивается кристаллизация жидкости, получившей обогащение компонентом А по ликвидусу от точки 2′ к точке 3′. В это же время благодаря диффузии происходит повышение содержания компонента А в кристаллах по солидусу от точки 2» к точке 3, где окончательно затвердевший сплав приобретает исходную концентрацию Х, и его равновесие становится бивариантным (С=2).
По результатам анализа диаграммы можно построить кривую охлаждения сплава любой концентрации с указаниями о фазовых состояниях и фазовых превращениях во всех областях диаграммы (рис. 18). При этом записывается схема фазового превращения жидкости в кристаллы с характеристиками температурного интервала превращения (вверху) и изменений концентрации фаз (внизу):
Рис. 18. Кривая кристаллизации сплава с неограниченной растворимостью компонентов и концентрацией Х
В случае ускоренного охлаждения сплава процесс диффузионного выравнивания химического состава кристаллов твердого раствора отстает от скорости кристаллизации, из-за чего возникает химическая неоднородность затвердевшего сплава, называемая ликвацией. Каждый кристалл при этом получает обогащение своей внутренней части более тугоплавким компонентом В, что представляет внутрикристаллитную (дендритную) ликвацию. В объеме металлической отливки такое обогащение наблюдается у ее поверхностных кристаллических слоев, что называется зональной ликвацией. В большинстве случаев из-за ликвации возникает неоднородность свойств литого изделия и происходит ухудшение его качества.
С использованием диаграммы возможно определение количественного отношения объемов фаз в двухфазной области сплава, что производится при помощи правила отрезков. Оно определяет, что объемы жидкой фазы Vж и твердой фазы Va обратно пропорциональны длинам отрезка коноды 2 – 2′, прилегающего к ликвидусу, и отрезка 2 – 2», прилегающего к солидусу (рис. 17):
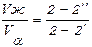
По диаграмме рассмотренного типа кристаллизуются такие сплавы, как
Cu – Ni, Fe – Ni, Co – Ni, Sb – Bi и др.
Диаграмма состояния сплавов с растворимостью компонентов в жидком состоянии, с нерастворимостью и образованием эвтектики в твердом характеризует температуры превращений трех фаз: жидкой, кристаллов А и В (рис. 19).
Линии ликвидус A’DB’ и солидус CDE формируют на диаграмме три фазовых области. Выше ликвидуса существует жидкий сплав, который при охлаждении ниже участка A’D выделяет кристаллы А, ниже участка DB’ – кристаллы В. При температуре ниже солидуса CDE затвердевший сплав состоит из кристаллов А и В.
Рис. 19. Диаграмма состояния сплавов с нерастворимостью компонентов
Для сплавов с концентрацией Х1 (менее Х2) в точке 1 ликвидуса начинается выделение кристаллов А, обусловливая моновариантное равновесие (С=1). Согласно правилу концентраций, понижение температуры до точки 2 солидуса, не меняя состава кристаллов А на участке 1 / – С приводит к обогащению жидкости компонентом В по ликвидусу от точки 1 до то точки D. Здесь жидкость приобретает концентрацию Х2 так, что в точке 2 жидкость завершает кристаллизацию при наиболее низкой температуре с одновременным выделением кристаллов А и В. Температура этого превращения остается постоянной, поскольку фазовое равновесие становится нонвариантным (С=0).
Такой сплав является эвтектикой (легкоплавящимся), процесс его кристаллизации из жидкого состояния с образованием двух твердых фаз представляет эвтектическое превращение. Правило отрезков показывает, что после затвердевания сплава Х1 доля выделившихся в нем кристаллов А пропорциональна отрезку 2 – D, доля эвтектики, содержащей кристаллы А и В, пропорциональна отрезку С – 2. Структура эвтектики характеризуется кристаллическими зернами в виде дендритных сростков фазовых частиц различной формы. Эти фазы находятся в сложной физико-химической взаимосвязи, что придает эвтектике свойства отличные от свойств каждой фазы. Затвердевшая эвтектика имеет концентрацию Х2 и, являясь двухфазной структурой, сохраняет при окончательном охлаждении моновариантное равновесие (С=1).
Концентрация сплава Х2 является эвтектической, такой сплав сохраняет жидкое состояние до наиболее низкой, эвтектической температуры. При ее достижении из жидкости происходит быстрое, эвтектическое выделение фазовых кристаллов А и В при сохранении постоянной температуры, т.к. превращение является нонвариантным (С=0).
Сплавы с концентрацией менее, чем Х2 называются доэвтектическими, при концентрации более Х2 сплавы относятся к заэвтектическим. Кристаллизация заэвтектических сплавов, например, Х3 характеризуется превращениями, подобными рассмотренному доэвтектическому сплаву Х1. Они происходят при температурах ниже точки 3 ликвидуса и отличаются выделением из жидкости кристаллов В с одновременным обогащением жидкости компонентом А. Во время достижения эвтектической температуры точки 4 солидуса сплав затвердевает с образованием структуры, содержащей кристаллы В и ту же эвтектику из кристаллов А и В.
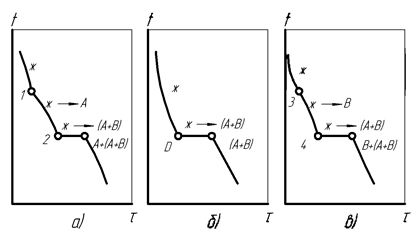
Кривые охлаждения рассмотренных типов сплавов с нерастворимыми компонентами и схемы фазовых превращений характеризуют процессы, протекающие во всех областях диаграммы (рис. 20).
Рассмотренный тип диаграммы отражает кристаллизацию сплавов Pb – Sb, Pb – Ag, Sn – Zn, Bi – Cd и др.
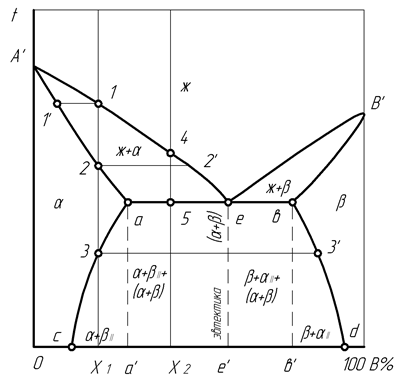
Д и а г р а м м а с о с т о я н и я с п л а в о в с к о м п о н е н т а ми, о г р а н и ч е н н о р а с т в о р и м ы м и в ж и д к о м с о с т о я н и и и о б р а з у ю щ и м и э в т е к т и к у, учитывает имеющиеся пределы концентрации компонентов, до которых каждый из них может раствориться в другом (рис. 21). Поэтому кроме ликвидуса А’еВ’ и солидуса А’aebB’, на диаграмме имеются линии сольвус (раствор): ас – изменение растворимости В в А, bd – изменение растворимости А в В.
Существующий выше ликвидуса жидкий сплав при охлаждении ниже А’е выделяет кристаллы a с окончанием этой кристаллизации ниже участка А’а солидуса. При дальнейшем охлаждении устойчивость a- раствора сохраняется для сплавов с концентрацией от 0 до с. Во время охлаждения жидкости ниже участка еВ’ происходит выделение кристаллов b, которое заканчивается ниже участка bB’ солидуса, после чего b- раствор сохраняет свою устойчивость для сплавов с концентрацией от d до 100. Завершение кристаллизации сплавов с концентрацией от с до d происходит с образованием смеси кристаллов a- и b-растворов.
В сплавах с концентрацией от с до а’, например, Х1 из жидкости в точке 1 образуются кристаллы a, тем самым создается моновариантное равновесие (С=1). С понижением температуры до точки 2 концентрация жидкости меняется по линии 1 – 2′, концентрация кристаллов a – по линии 1’– 2. Последующее охлаждение кристаллов a происходит с бивариантным равновесием (С=2) до точки 3 сольвуса, где твердый раствор a оказывается насыщенным компонентом В. За счет этого компонент В выделяется с образованием кристаллов твердого раствора bII, где индекс указывает на его возникновение не из жидкости, а из твердого раствора, равновесие системы становится моновариантным (С=1). При окончательном затвердевании концентрация кристаллов a изменяется по сольвусу от точки 3 к с, кристаллов bII – по сольвусу от точки 3 / к d; в этом случае доля кристаллов a соответствует длине отрезка Х1d, доля кристаллов bII – длине отрезка сХ1.
Рис. 21. Диаграмма состояния сплавов с компонентами, ограниченно растворимыми
и образующими эвтектику
Сплавы с доэвтектической концентрацией от а’ до е’, например, Х2 при охлаждении из жидкого состояния проявляют эвтектические свойства жидкости. Снижение температуры от точки 4 до точки 5 вызывает образование кристаллов a с повышением концентрации В до предельной растворимости в точке а и обогащение жидкости до эвтектической концентрации в точке е, что происходит при моновариантном равновесии (С=0) и постоянной температуре. Доля эвтектики в сплаве соответствует отрезку а5, кристаллы составляют долю, пропорциональную отрезку 5е.
Кривые охлаждения характерных сплавов иллюстрируют рассмотренные превращения, соответствующие диаграмме состояния при ограниченной растворимости компонентов (рис. 22).
Рис.22. Кривые кристаллизации сплавов с ограниченной растворимостью компонентов: а – сплав доэвтектической концентрации Х1, б – сплав доэвтектической концентрации Х2, в – сплав эвтектической концентрации е’
Согласно приведенному типу диаграммы кристаллизуются сплавы Al – Cu, Al – Si, Cu – As, Cu – O и др.
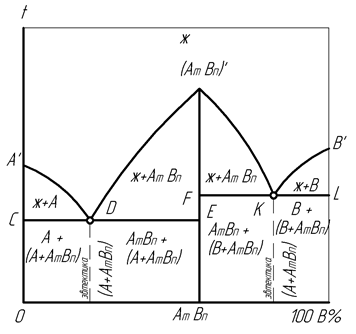
Д и а г р а м м а с о с т о я н и я с п л а в о в с к о м п о н е н т а м и, р а с т в о р и м ы м и в ж и д к о м с о с т о я н и и и о б р а з у ю щ и м и у с т о й- ч и в о е х и м и ч е с к о е с о е д и н е н и е п р и к р и с т а л л и з а ц и ихарактеризуется однотипным эвтектическим взаимодействием между указанным химическим соединением и каждым компонентом сплава (рис. 22).
Рис. 23. Диаграмма состояния сплавов с компонентами, образующими устойчивое химическое соединение
Такие сплавы создаются между металлами и металлоидами при нормальной валентности, когда их химическое соединение вида АmBn приобретает температуру плавления более высокую, чем у компонентов А и В, поэтому представляет дистектику (трудноплавящееся). Это соединение не разлагается при нагреве до температуры плавления, на диаграмме играет роль самостоятельного компонента и создает максимум (AmBn)’ на ликвидусе A’D(AmBn)’KB’.
При указанных условиях компонент AmBn как бы разделяет диаграмму на две части, левая из которых может рассматриваться как диаграмма состояния сплавов A – AmBn, правая – как диаграмма состояния сплавов AmBn – B.
Обе части диаграммы имеют характерные эвтектические концентрации сплавов, соответствующие точкам D и K, а также линии солидус CDE и FKL, определяющие значения постоянной температуры эвтектических превращений. Поэтому в процессе охлаждения жидкости все фазовые превращения происходят аналогично рассмотренной выше диаграмме состояния сплавов с нерастворимыми компонентами (рис. 19).
Согласно этой аналогии, после завершения кристаллизации ниже солидуса CDE сплавы содержат фазы A и AmBn при наличии эвтектической структуры (A+AmBn). Ниже солидуса FKL в сплавах имеются фазы B и AmBn, включая эвтектику (B+AmBn).
При наличии определенной растворимости между химическим соединением и компонентами сплава на данной диаграмме появляются области их полной или частичной растворимости, как было показано ранее на соответствующих диаграммах.
Рассмотренная диаграмма состояния характеризует превращения при кристаллизации сплавов Fe – O, Mn – S, Cu – P, Ca – Mg и др.
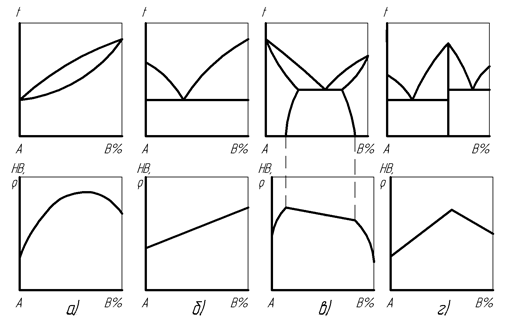
Анализ диаграмм состояния позволяет не только установить характеристики фазового состава и структурного состояния сплавов, но и предопределить свойства сплавов, зная свойства входящих в них компонентов. Взаимосвязь между диаграммами фазового равновесия сплавов и диаграммами изменения их основных свойств впервые была выявлена Н.С. Курнаковым, поэтому ее называют правилом Курнакова. При этом, если на диаграммах фазового равновесия по вертикальной оси откладываются температуры плавления и кристаллизации существующих фаз сплава, то на диаграммах Курнакова по вертикальной оси откладываются значения соответствующего свойства сплава при определенной температуре. Наиболее отчетливо указанные взаимосвязи проявляются при измерениях твердости НВ, пластичности d, электросопротивления r, коэрцитивной силы Нс, при оценке ферромагнитных свойств, коррозионной стойкости, обрабатываемости.
Правило Курнакова указывает, что при наличии в сплавах только одной фазы (твердого раствора) изменение ее состава вызывает криволинейную зависимость свойств, если же в сплавах присутствует двухфазная эвтектика, то зависимость свойств сплава является прямолинейной (рис. 24).
Рис. 24. Правило Курнакова для основных видов диаграмм состояния сплавов:
а – с образованием неограниченных твердых растворов, б – с образованием эвтектики, в – с образованием ограниченных твердых растворов,
г – с образованием химического соединения
При неограниченной растворимости компонентов образование уже небольшой концентрации фазы твердого раствора вызывает на диаграмме свойств резкое увеличение твердости НВ, электросопротивления r и других характеристик, превышающих соответствующие показатели свойств компонентов сплава (рис. 24, а). Такие сплавы отличаются хорошей обрабатываемостью давлением, невысокими показателями литейных свойств и обрабатываемости резанием.
В случае нерастворимости компонентов основные свойства двухфазной структуры с эвтектикой изменяются пропорционально соотношению фаз сплава и численно составляют средние арифметические значения свойств обеих фаз (рис. 24, б). У этих сплавов почти отсутствует обрабатываемость давлением, литейные свойства и обрабатываемость резанием являются повышенными.
Для ограниченной растворимости компонентов изменение свойств сплавов в однофазных областях соответствует криволинейным зависимостям, в двухфазной области – прямолинейной зависимости (рис. 24, в).
С образованием химического соединения свойства двухфазной структуры сплавов изменяются пропорционально соотношению фаз и достигают максимума при концентрации, отвечающей химическому соединению (рис. 24, г). Поэтому такие сплавы имеют значения твердости, хрупкости, температуры плавления значительно выше, чем исходные компоненты.
Правило Курнакова дает возможность производить рациональный выбор компонентов и концентрации сплава для получения фазового и структурного состояния, обусловливающего формирование заданных свойств сплава.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет