что показывает титр раствора
Титр раствора
Титр раствора (от фр. titre — качество, характеристика) — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³).
Различают титр по растворённому веществу и титр по определяемому веществу (условный титр).
Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора.
Рассчитывается по формуле:



Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора.
Рассчитывается по формуле:



Условный титр и титр по растворённому веществу связаны следующей формулой:


См. также
Ссылки
Полезное
Смотреть что такое «Титр раствора» в других словарях:
титр раствора — число граммов растворённого вещества на 1 мл раствора. * * * ТИТР РАСТВОРА ТИТР РАСТВОРА, число граммов растворенного вещества в 1 мл раствора … Энциклопедический словарь
ТИТР РАСТВОРА — в аналитической химии количество растворённого вещества в граммах, содержащееся в 1 мл раствора. Напр. Т. (титр) 0,001 означает, что в 1 мл раствора содержится 0,001 г растворённого вещества … Большая политехническая энциклопедия
ТИТР РАСТВОРА — число граммов растворенного вещества в 1 мл раствора … Большой Энциклопедический словарь
ТИТР РАСТВОРА — число граммов растворённого в ва на 1 мл раствора … Естествознание. Энциклопедический словарь
титр — а, м. titre m. 1. хим., биол. В аналитической химии концентрация раствора. применяемого в объемном химическом анализе, выраженная в граммах на кубический миллиметр. Титр раствора. БАС 1. ♦ Титр бактерий это максимальное разведение исследуемой… … Исторический словарь галлицизмов русского языка
Титр (в аналитич. химии) — Титр (от франц. titre качество, характеристика), в аналитической химии концентрация раствора, выраженная количеством (в граммах) растворённого вещества в 1 мл раствора или количеством какого либо вещества, реагирующего с 1 мл данного раствора.… … Большая советская энциклопедия
Титр — Титр: Титр раствора в химии. Титры в кино и телевидении. Титр бактерий Титр в иммунохимическом анализе Титр в текстильной промышленности … Википедия
Титр — I (от франц. titre качество, характеристика) в аналитической химии (См. Аналитическая химия) концентрация раствора, выраженная количеством (в граммах) растворённого вещества в 1 мл раствора или количеством какого либо вещества,… … Большая советская энциклопедия
титр — а; м. (франц. titre) 1) Надпись на кадре в фильме, передающая слова действующих лиц или содержащая пояснительный текст. Титры кинофильма. Внутрикадровый титр. (субтитр) 2) хим. Концентрация раствора, употребляемого для титрования. Титр раствора … Словарь многих выражений
ТИТР — 1) вес шелковых нитей определенной длины; 2) в химии крепость раствора, измеряемая весом растворенного вещества в кубическом сантиметре (или другой объемной единице) его раствора. Полный словарь иностранных слов, вошедших в употребление в русском … Словарь иностранных слов русского языка
Способы выражения концентрации
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = 41,2/76 = 0,54 моль
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mH2O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Титр раствора и титр по определяемому веществу.
Концентрацию растворов, применяемых в титриметрии, выражают не только через моль-экв/л (нормальность), но и через титр раствора ( 


Титр вещества 
Титр вещества 


где 
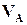

Иногда титр для удобства в расчетах выражают в мг/мл. Через простой титр легко рассчитать молярную концентрацию (молярность) или молярную концентрацию эквивалента (нормальность) раствора, подставив туда выражение массы вещества через титр.


Пример. Пусть в растворе соли, объемом 250 см 3 содержится 0,5 г 
Исходя из формул (4.8) и (4.9), Т(Na2CO3) = 0,005/250 = 

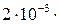


Титр по определяемому веществу 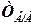
Титр по определяемому веществу 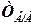



Между титрами Т(В) и 
m(В)= 

где V(B) в мл – объем раствора В, пошедший на реакцию (титрование) с веществом А; m(В) – масса вещества реагента В (титранта), m(А) – масса вещества А, эквивалентная массе реагента Вв его растворе объемомV(B).


Тогда молярная концентрация эквивалента (нормальность) раствора В через значение 
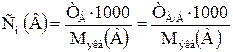
Если для рабочего раствора В известно значение 




Классификация растворов, применяемых для титрования
И способы их приготовления.
В титриметрии используют растворы, концентрация которых установлена каким-либо способом с высокой степенью точности. Такие растворы называют стандартными титрованными или просто титрованными. Растворы классифицируют по назначению и по способу установления их концентрации.
По назначению их условно делят на рабочие растворы и растворы стандартов (первичные и вторичные).
Рабочими называют растворы, которые используются непосредственно в анализе при определении содержания вещества. Если рабочий раствор не относится к стандартным, то его необходимо отстандартизировать непосредственно перед выполнением анализа, так как концентрация в процессе хранения могла существенно измениться. Точную концентрацию рабочего раствора находят путем титрования стандартного раствора или установочных веществ (метод точных навесок). Это касается, например, таких рабочих растворов, как: NaOH, Na2S2O3×5H2O.
Под стандартным раствором понимают такой титрованный раствор, который устойчиво сохраняет свою концентрацию при длительном хранении. Основное назначениестандартных растворов — определение точной концентрации рабочих и иных растворов, применяемых в титровании.
Процесс установления точной концентрации раствора путем его титрования по стандарту называется стандартизацией.
По способу определения концентрации различают первичные стандарты или растворы с приготовленным титром и стандартизированные растворы.
Стандартные растворыклассифицируютпо способу определения их концентрации.Различают: первичные стандарты или растворы с приготовленным титром и вторичные стандарты — растворы с установленным титром.
Первичные стандарты — это растворы, которые готовят либо по точной навеске вещества (рис. 4.10), либо путем разведения специально приготовленных стандартизированных реагентов – фиксаналов (рис. 4.11). Фиксанал представляет собой стеклянную запаянную ампулу, выпускаемую промышленностью и содержащую строго нормированное количество реагента, обычно рассчитанного на 1 л 0,1 н. раствора.
Рисунок 4.10 – Порядок операций при приготовлении раствора первичного
стандарта по точной навеске: 1 – мерная колба Мора; 2 – воронка;
3 – бюкс с навеской вещества; 4 – промывалка с дистиллированной водой;
5 – пипетка или капельница.
а – перенос навески вещества в мерную колбу; б – ополаскивание воронки;
в – доведение объема раствора стандарта до метки.
Порядок приготовления раствора методом разведения из фиксанала показан на рисунке 4.11. Чтобы стандарт, полученный этим методом, был качественным и отвечал всем требованиям, необходимо исключить потери вещества при вскрытии ампулы и переносе его в колбу, а также следить, чтобы осколки ампулы не попали в раствор. Это во многом зависит от правильности обращения с ампулой.
Рисунок 4.11 – Способ приготовления растворов первичного стандарта
методом разведения из фиксанала: 1 – мерная колба Мора на 1л;
2 – нижний боек; 3 – воронка; 4 – ампула фиксанала; 5 – верхний боек.
Перед использованием, ампулу следует ополоснуть дистиллированной водой и только затем ее вскрывать специальным бойком. Сразу же после переноса вещества в колбу, нужно тщательно промыть ампулу дистиллированной водой, не менее, чем 6-ти кратным ее объемом. Этот метод приготовления первичного стандарта проще, чем по точным навескам, но уступает ему в точности. Его используют не только для получения растворов солей, но и различных кислот.
Так как для приготовления раствора первичного стандарта пригодны только точная мерная посуда и аналитические весы, то и к веществам, применяемым для этой цели, предъявляют ряд обязательных требований. В качестве первичного стандарта можно использовать только такие реактивы, которые характеризуются:
Ø точным соответствием формульному составу и относительно высокой молекулярной массой;
Ø устойчивостью при хранении как в твердом виде, так и в растворе (отсутствие процессов гидратации, гидролиза, окисления и карбонизации);
Ø простотой в приготовлении и хорошей растворимостью;
Ø необратимостью реакции при стандартизации, селективностью;
Ø возможностью точной фиксации Т. Э. каким-либо методом.
Вторичным стандартом называют такие стандартизированные растворы, которые устойчивы при хранении и могут быть использованы для стандартизации других растворов.
Примером раствора, обладающего свойствами вторичного стандарта, является соляная кислота. Ее разбавленные растворы могут храниться длительное время, до 1-го месяца и более, без заметного изменения концентрации. Бура, используемая в протолитометрии для стандартизации HCl, относится к первичным стандартам и готовится по точной навеске. Тогда, как рабочий раствор NaOH – свойствами стандарта не обладает вообще и его концентрацию приходится устанавливать заново при каждом использовании.





