что позволяет иммобилизация ферментов на нерастворимых носителях
Иммобилизация ферментов путем адсорбции на нерастворимых носителях
ИММОБИЛИЗАЦИЯ ФЕРМЕНТОВ ПУТЕМ АДСОРБЦИИ НА НЕРАСТВОРИМЫХ НОСИТЕЛЯХ
— студ. 5 курса спец. «Биотехнология»
— к. с.н., доц. каф. Биотехнологии
Ферменты и ферментативные системы традиционно применяются в самых различных областях практической деятельности в пищевой, фармацевтической, текстильной, кожевенной и других отраслях промышленности, в медицине, сельском хозяйстве, органическом синтезе, химическом анализе и т. д. Тем не менее, развитие прикладной энзимологии долгое время сдерживалось дороговизной или полным отсутствием на мировом рынке нужных ферментов, особенно их чистых препаратов. Очевидно, можно ожидать в недалеком будущем благодаря успехам микробиологии коренного решения вопроса производства соответствующих ферментов в достаточном количестве.
Возможности применения ферментов осложнены, кроме того, еще, по крайней мере, двумя причинами. Во-первых, ферменты неустойчивы при хранении, а также при различных воздействиях, особенно тепловых. Во-вторых, многократное использование ферментов затруднено из-за сложности их отделения от реагентов и продуктов реакции. По этим причинам практическое использование ферментов могло быть ограничено, но уже на сегодняшний день найдены пути решения и этих проблем.
Принципиально новые перспективы открылись перед прикладной энзимологией в результате создания иммобилизованных ферментов. Дж. Нельсон и Е. Гриффин еще в 1916 г. показали, что инвертаза, адсорбированная на угле (т. е. иммобилизованная), сохраняет каталитическую активность. В 20—30-х годах работы по изучению адсорбции белков и ферментов были продолжены, однако исследования этого периода представляли главным образом академический интерес и не преследовали практических целей. В 1939 г. Дж. Пфанмюллер и Г. Шлейх получили первый патент на применение адсорбированных на древесных опилках протеолитических ферментов для обработки шкур. Принципиально важный шаг в направлении создания прочных конъюгатов ферментов с носителями был сделан в 1953 г. Н. Грубхофером и Д. Шлейтом, впервые применившими метод ковалентного связывания.
Адсорбционная иммобилизация является наиболее старым из всех существующих сейчас способов иммобилизации ферментов. Еще в 1916 г. Дж. Нельсон и Э. Гриффин провели успешную иммобилизацию инвертазы путем адсорбции на активированном угле и геле гидроксида алюминия. Этот же метод был использован для получения первого технологического иммобилизованного ферментного препарата в 1969 г., когда И. Шибата с сотрудниками осуществили гидролиз N-ацетил-D, L-аминокислот под действием адсорбционно иммобилизованной L-аминоацилазы. В настоящее время адсорбционная иммобилизация благодаря целому ряду преимуществ является наиболее широко распространенным способом получения иммобилизованных ферментных препаратов промышленного значения.
Носители для адсорбционной иммобилизации можно разделить на два основных класса – неорганические и органические. В качестве неорганических носителей главным образом используются кремнезем, оксиды алюминия, титана и других металлов, различные природные алюмосиликаты (глины), пористое стекло, керамика, активированный уголь и др. Среди органических носителей наибольшее распространение получили различные полисахариды и полимерные ионообменные смолы, коллаген.
Обычно носители применяются в виде порошков, мелких шариков и гранул. Важнейшими характеристиками носителей являются удельная поверхность, размер пор, механическая прочность и химическая стойкость.
Иммобилизация ферментов путем адсорбции на нерастворимых носителях отличается исключительной простотой и достигается при контакте водного раствора фермента с носителем. После отмывки неадсорбировавшегося фермента препарат иммобилизованного биокатализатора готов к использованию. На практике для получения адсорбционно-иммобилизованных ферментов применяются следующие методические подходы.
Статический способ наиболее прост и состоит в том, что носитель вносят в водный раствор фермента и полученную смесь оставляют на некоторое время без перемешивания. Иммобилизация достигается за счет самопроизвольной диффузии фермента к поверхности носителя с последующей адсорбцией. Недостатком метода является то, что для получения препарата с высоким содержанием адсорбированного фермента и равномерного заполнения поверхности носителя последний приходится выдерживать в контакте с раствором фермента в течение длительного времени (несколько суток).
В лабораторной практике чаще всего применяется способ с перемешиванием, при котором носитель суспендируется в растворе фермента и полученная смесь непрерывно перемешивается с помощью магнитной или механической мешалки или на лабораторной качалке. Этот способ гораздо эффективнее статического и обеспечивает более равномерное заполнение поверхности носителя адсорбированным ферментом.
Иногда для проведения адсорбционной иммобилизации применяют метод электроосаждения. В этом случае в раствор фермента погружают два электрода, на поверхность одного из которых помещают слой носителя. При включении электрического тока молекулы фермента благодаря имеющимся на их поверхности заряженным группам начинают перемещаться в растворе в направлении соответствующего электрода и осаждаются на поверхности носителя.
Для технологического использования наиболее удобен метод нанесения в колонке. Существует две модификации этого метода. В одной из них через колонку, заполненную носителем, с помощью насоса прокачивают в направлении сверху вниз раствор фермента в режиме непрерывной циркуляции. В другом варианте метода направление потока изменено на противоположное, т. е. раствор фермента подается в нижнюю часть колонки, причем скорость потока подбирается так, чтобы частицы носителя оставались во взвешенном состоянии, образуя «кипящий слой». Метод нанесения в колонке обладает тем преимуществом, что позволяет проводить нанесение фермента, промывку, а затем и сам ферментативный процесс в одной и той же колонке без дополнительных манипуляций с носителем.
Удерживание адсорбированной молекулы фермента на поверхности носителя может обеспечиваться за счет неспецифических ван-дер-ваальсовых взаимодействий, электростатических взаимодействий, водородных связей и гидрофобных взаимодействий между носителем и поверхностными группами белка. Относительный вклад каждого из типов связывания зависит от химической природы носителя и функциональных групп на поверхности молекулы фермента. В большинстве случаев основную роль в связывании фермента играют электростатические взаимодействия и водородные связи. Взаимодействия с носителем могут оказаться настолько сильными, что сорбция биокатализатора будет сопровождаться разрушением его структуры. Например, при адсорбции некоторых растительных клеток на гранулах цитодекса клеточная стенка деформируется, повторяя рельеф поверхности частиц носителя.
К числу основных преимуществ метода адсорбционной иммобилизации следует отнести доступность и дешевизну сорбентов, выступающих в роли носителей, которым к тому же можно придать любую конфигурацию и обеспечить требуемую пористость. Не менее важным фактором является также простота применяемых методик. Кроме того, при адсорбционной иммобилизации нередко удается одновременно решить и проблему очистки фермента, поскольку связывание белка с носителем во многих случаях достаточно специфическое. Действительно, многие из носителей для адсорбционной иммобилизации применяются также и при очистке ферментов.
Применение метода ограничивается недостаточно высокой прочностью связывания фермента с носителем. Как уже указывалось, при изменении внешних условий может происходить десорбция фермента с носителя, что ведет к потерям дорогостоящего биокатализатора и загрязнению конечного продукта. К недостаткам метода адсорбционной иммобилизации следует отнести также отсутствие общих рекомендаций, позволяющих заранее сделать правильный выбор носителя и оптимальных условий проведения иммобилизации конкретного фермента. Эту задачу приходится каждый раз решать заново, используя метод проб и ошибок.
Некоторых из перечисленных затруднений удается избежать при иммобилизации ферментов путем включения в гели.
1. Введение в прикладную энзимологию. / Под ред. и К. Мартинека. – М. : Изд-во МГУ. – 1982. – 384 с.
2. Габанова, методы обработки растительного сырья / / / Современные наукоемкие технологии. – № 2. – 2004.
5. Тривен, М. Иммобилизованные ферменты. Вводный курс и применение в биотехнологии / М. Тривен. – М. – 1983.
6. Rosevear, A. Immobilized biocatalysts – a critical review / A. Rosevear / / J. Chem. Technol. Biotechnol. – 1984. – 34 B. – P. 127-150.
Что позволяет иммобилизация ферментов на нерастворимых носителях
Фармацевтический рынок является одним из самых высокодоходных и быстроразвивающихся секторов мировой экономики: «темпы его роста составляют 8–14 % в год, чистая прибыль достигает 18 % от общего дохода, тогда как в других сферах этот индекс равняется около 5 %». Современный фармацевтический рынок по своим объемам уступает только рынку продовольствия, и, по некоторым прогнозным оценкам, уже в ближайшем будущем его доля увеличится до 30–35 % от общего объема потребительского рынка [3].
Результатом активной инвестиционной деятельности ведущих фармацевтических компаний является постоянное появление на рынке новых продуктов, внедрение которых стало тем потенциалом, который лежит в основе движущей силы этой отрасли. В результате фармацевтический рынок является рынком дифференцированного продукта с большим разнообразием лекарственных средств, предназначенных для удовлетворения одной и той же потребности.
Развитие фармацевтической и косметической отраслей промышленности требует разработки и внедрения новых эффективных препаратов, обладающих высокой конкурентоспособностью на рынке. В этом отношении наиболее перспективными являются гидролитические ферменты. Выявление особенностей структуры и функционирования гидролаз становится особенно актуальным в связи с их биологической ролью.
В настоящее время в клинической медицине достигнуты определенные успехи при лечении энзимами ряда заболеваний. Протеиназы широко применяются в ревматологии, гинекологии, урологии, ангиологии, травматологии. Так как нативные ферменты быстро теряют свою активность в водных растворах, то их нужно использовать непосредственно после разведения и не оставлять на хранение. Это является большой проблемой при создании готовых форм. Одним из путей решения данной проблемы является создание иммобилизованных форм ферментов, т.е. ферментов, которые фиксированы на носителях различной структуры. Иммобилизация позволяет ферментам сохранять активность в течение длительного времени, и особенно актуальна в многокомпонентных системах, таких как зубные гели и пасты. Особое значение при создании лекарственных препаратов на основе иммобилизованных ферментов имеет подбор соответствующего носителя и способа иммобилизации.
Целью данной работы являлось изучение взаимодействия протеолитических ферментов папаина и химопсина с различными высокомолекулярными и низкомолекулярными соединениями, применяемыми для создания зубных гелей и паст.
Материалы и методы исследования
В качестве носителей для иммобилизации использовали циклодекстрины производства Xian Hong Chang Parmaceuticals Co., Ltd. Некоторые физико-химические свойства циклодекстринов представлены в табл. 1 [1].
Основные аспекты иммобилизации ферментов на примере липаз
Дата публикации: 02.06.2014 2014-06-02
Статья просмотрена: 1928 раз
Библиографическое описание:
Клюева, М. В. Основные аспекты иммобилизации ферментов на примере липаз / М. В. Клюева. — Текст : непосредственный // Молодой ученый. — 2014. — № 8 (67). — С. 320-325. — URL: https://moluch.ru/archive/67/11432/ (дата обращения: 18.12.2021).
В данной статье рассматриваются различные подходы к классификации способов иммобилизации ферментов, дана характеристика наиболее широко используемых методов и приведены частные случаи применения этих методов для иммобилизации липаз.
Ключевые слова: иммобилизация ферментов, липазы.
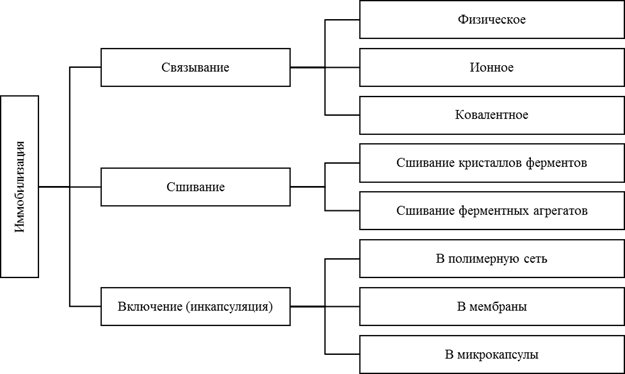
Иммобилизация — это включение молекул фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться с находящимися в ней молекулами субстрата, эффектора или ингибитора. Присоединение фермента к нерастворимому носителю имеет ряд преимуществ. Иммобилизованные ферменты легко удалять из реакционной смеси простой фильтрацией. Они используются многократно, что экономически целесообразно, несмотря на затраты, связанные с иммобилизацией. В процессе исследования таких ферментов оказалось, что многие из них значительно более устойчивы к внешним воздействиям, чем свободные.
Независимо от своей природы и способа получения, иммобилизованный фермент, по своему определению, выполняет две функции [1]:
1. Некаталитические функции, которые разрабатываются для отделения катализатора от среды применения с целью повторного использования катализатора и в особенности контролирование процессом;
2. Каталитические функции, которые разрабатываются для превращения субстратов в желаемых условиях.
За последние десятилетия в научной литературе были описаны тысячи протоколов и освещены различные стратегии иммобилизации. Ферменты можно присоединить к носителю взаимодействиями, варьирующими от обратимых физической адсорбции и ионного связывания до прочных ковалентных связей. При этом классификация методов иммобилизации зависит от взглядов авторов.
Классической считается классификация методов иммобилизации на физические и химические [2]:
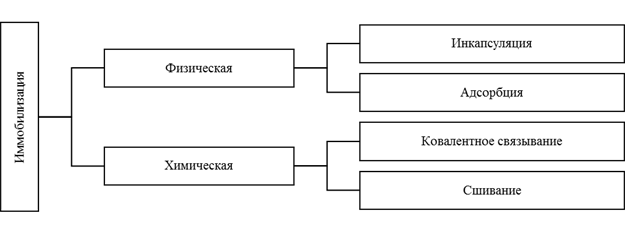
Sheldon [3] предлагает иную классификацию методов иммобилизации ферментов:
Рис. 2. Классификация методов иммобилизации по типу фиксации фермента в носителе
При этом автор отмечает, что проведение чёткой границы между методами связывания фермента и его инкапсуляцией представляет собой довольно сложную задачу. В своей работе он определил связывание как метод, при котором иммобилизация фермента производится на подготовленном заранее носителе, а при инкапсуляции иммобилизация фермента производится одновременно с приготовлением носителя (в одной среде).
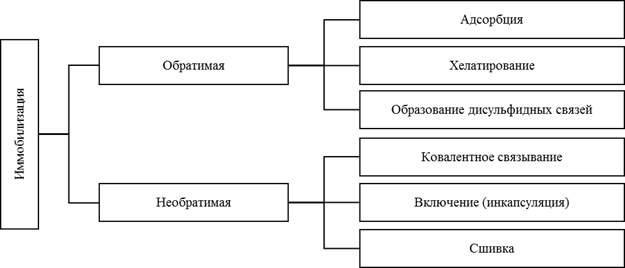
Другая классификация, предложенная Brena и сотр. [4] разделяет методы иммобилизации, в зависимости от силы связывания фермента и носителя, на обратимые и необратимые. Необратимая иммобилизация подразумевает столь прочное связывание, что отделение фермента от носителя невозможно без потери биологической активности фермента и/или разрушения носителя. А при обратимой иммобилизации возможно отделение фермента от носителя при мягких условиях.
Рис. 3. Классификация методов иммобилизации, основанная на обратимости процесса
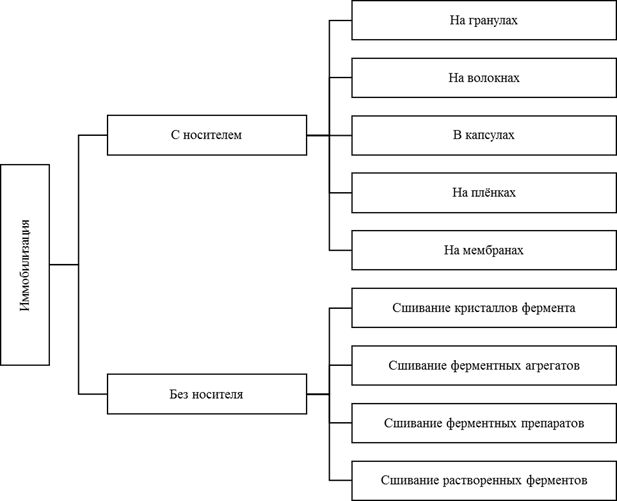
Ключевым моментом классификации Сao [1] является иммобилизация фермента с носителем или без него. При иммобилизации с носителем фермент фиксируется на носителе физическим или химическим связыванием. В противоположность этому подходу, ферменты, иммобилизованные без носителя, не нуждаются в дополнительной неактивной массе.
Ниже рассмотрены основные техники, применяемые для иммобилизации ферментов: адсорбция, ковалентное сшивание с носителем (перекрестное сшивание) и включение/инкапсуляция. [5]
Адсорбция — это процесс, при котором действие межмолекулярных сил, приводит к аккумуляции фермента на твёрдой поверхности. Так как адсорбция сильно зависит от межмолекулярных взаимодействий поверхностей носителя и фермента, такие свойства фермента как его заряд и полярность становятся крайне важными для полного и воспроизводимого покрытия носителя ферментом. Образующиеся при этом связи между ферментом и носителем являются слабыми (в основном это Ван-дер-Ваальсовы силы, водородные связи и гидрофобные взаимодействия), и оказывают малый эффект на каталитическую активность. Однако, именно потому, что эти связи такие слабые, фермент можно легко десорбировать от носителя. Адсорбция является наиболее легкой и наименее дорогой техникой иммобилизации для подготовки биокатализаторов на твёрдых носителях. [2]
Рис. 4. Классификация методов иммобилизации в зависимости от наличия носителя
Процесс адсорбции можно описать двумя основными этапами:
1. Диффузия фермента из основной части раствора к поверхности носителя;
2. Связывание фермента в местах адсорбции на поверхности носителя.
Скорость связывания липазы с поверхностью носителя гораздо выше скорости диффузии, поэтому процесс адсорбции часто регулируется именно диффузией. Однако, в случае с некоторыми непористыми носителями, такими как зеолит типа Y, процесс адсорбции контролируется поверхностной кинетикой. [6]
При адсорбции на гидрофобных носителях большинство липаз проявляют значительное повышение активности. Было показано, что эта особенность связана с конформационными изменениями фермента при адсорбции, образующими открытый и доступный для субстрата активный сайт. Таким образом, липазы узнают гидрофобные поверхности похожие на их природные субстраты и подвергаются поверхностной активации в процессе иммобилизации. Особое внимание уделяется специфичной адсорбции липаз на нестандартных сильно гидрофобных поверхностях носителя. [7] [6]
Shah и соавт. провели адсорбцию липаз Candida rugosa на многослойных углеродных нанотрубках с высоким сохранением их биологической активности (97 %). Начальная скорость переэтерификационной активности полученного иммобилизованного биокатализатора повысилась по сравнению с лиофилизованным порошковым ферментом в 2,2 раза в безводной гексановой, и в 14 раз в водо-несмешиваемой ионной жидкости. В обоих случаях иммобилизованный фермент показал в 4,5 раза больший выход бутилбутирата в сравнении со свободным ферментом на протяжении 24 часов. Исследования на трансмисионном электронном микроскопе подтвердили, что иммобилизованный фермент прикреплен на многослойных нанотрубках. Авторы предпологают, что взаимодействие с гидрофобной поверхностью нанотрубок вызвало конформационные изменения, которые привели структуру липазы в состояние «открытой крышки». Подобные техники иммобилизации ферментов на наноразмерных носителях создают почву для разработки биореакторов меньших размеров и миниатюрных биосенсорных устройств. [8]
I.E. de Fuentes и др. определяли ферментативную активность липаз Rhizomucor miehei иCandida cylindracea после адсорбции на трёх различных филлосиликатах — сепиолит, палыгорскит и монтмориллонит (были получены из месторождений в Испании). Полученные данные сравнивали с результатами экспериментов со схожей техникой иммобилизации на широко используемой анионообменной смоле Doulite A-568. При гидролизе различных этиловых эфиров, ферменты, иммобилизованные на волокнистых материалах (палыгорскит и сепиолит) проявили наиболее высокую гидролитическую активность по сравнению с иммобилизованными на слоистых силикатах (монтмориллонит) и сферических частицах (Duolite A-568). [9]
Иммобилизация липаз с помощью нековалентной адсорбции оказалась полезной в безводных системах, благодаря низкой растворимости липаз в органических растворителях, в которых десорбция незначительна. По этой причине и благодаря простоте процедуры, использование адсорбированных липаз широко распространено в промышленном масштабе при катализе в гидрофобных растворителях. [6]
При иммобилизации ферментов посредством ковалентного сшивания с носителем происходит образование прочных химических связей между ферментом и носителем, что делает невозможным растворение фермента в реакционной среде.
Методы сшивания в общем можно разделить на два основных класса:
1. Активация носителя добавлением реакционной функции к полимеру
2. Модификация скелета полимера для получения активированной группы.
Процессы активации в общем проектируются с целью создания электрофильных групп на носителе, которые на этапе сшивания реагируют с сильными нуклеофильными группами на поверхности белков. Наиболее часто используемые реакции затрагивают следующие боковые цепи аминокислот: лизин (ε-аминогруппа), цистеин (тиольная группа), аспарагиновая и глутаминовая кислоты (карбоксильные группы). [4]
Липаза Candida rugosa была ковалентно иммобилизована на целлюлозу, производные целлюлозы (ацетат целлюлозы и фталеат целлюлозы) и целлюлозные композитные мембраны с использованием таких активирующих агентов, как периодат натрия или карбодиимид. Также были подготовлены и использованы для иммобилизации другие нецеллюлолитические мембраны (нейлон, полиуретан, хитозан и гидроксиэтилметакрилат). [10]
Выделенная и очищенная липаза Pseudomonas aeruginosa SRT9 была иммобилизована на три(4-формилфенокси)цианурат с формированием основания Шиффа. Выход иммобилизации составил 85 %. Свободная и иммобилизованная липазы использовались при гидролизе оливкового масла в водной среде. Сравнительное исследование выявило, что иммобилизованная липаза показала сдвиг оптимума pH с 6,9 (свободная липаза) до 7,5, а также сдвиг в температурном оптимуме с 55°С до 70°С. При этом термостабильность иммобилизованной липазы возросла на 20–25 %, начальная активность составила 75 % после 7-ми циклов. Также препарат показывал хорошую стабильность в органических растворителях (особенно в 30 % ацетоне и метаноле). [11]
Метод иммобилизации путём включения основан на фиксации фермента внутри полимерной сети, которая удерживает фермент, а также позволяет субстрату и продуктам катализа проходить сквозь неё. В отличие от ковалентного метода, при иммобилизации включением, фермент не связывается с носителем или мембраной. Существуют разные способы включения ферментов, например, включение в гель или волокна, а также микроинкапсулирование. Практическое использование этих методов ограничивает пределы переноса масс сквозь мембраны или гели. [4] [6] [12]
M.Phisalaphong с соавт. исследовали получение биодизеля из пальмового масла с использованием свободной и иммобилизованной форм липазы Candida rugosa. Было изучено три метода иммобилизации: 1. адсорбция липазы на CaCO3: 2. включение липазы в Ca-альгинатный гель; 3. включение CaCO3-иммобилизованной липазы в Ca-альгинатный гель. Липаза, включенная в Ca-альгинатный гель после 48 часов ферментации показала наиболее высокий выход этилового эфира (74 %), по сравнению с липазами, иммобилизованными другими методами, тогда как при использовании свободных липаз наблюдался выход этилового эфира в 83 % после 24 часов. [13]
Таким образом, при грамотно подобранных способов иммобилизации — метода, носителя, условий процесса, можно получать такие комплексы фермент-носитель, который будет превосходить нативный фермент по многим показателям. Иммобилизация биокатализаторов позволяет значительно расширить сферы применения определённых ферментов, что открывает новые горизонты для биотехнологической промышленности.
1. Linqiu Cao Luuk van Langen, Roger A.Sheldon Immobilised enzymes: Carrier-bound or carrier-free? [Journal] // Current Opinion in Biotechnology. — [s.l.]: Elsevier, 2003. — pp. 387–394.
2. Mohd Basyaruddin Abdul Rahman Noor Mona Md. Yunus, Siti Salhah Othman, Abu Bakar Salleh, Mahiran Basri Immobilized Enzymes [Book Section] // New Lipases and Proteases / ed. al. A. B. Salleh et. — [s.l.]: Nova Science Publishers, Inc., 2006.
3. A.Sheldon Roger Enzyme Immobilization: The Quest for Optimum Performance [Journal] // Adv. Synth. Catal.. — Weinheim: Wiley-VCH Verlag GmbH & Co., 2007. — pp. 1289–1307.
4. Beatriz Brena Paula Gonzalez-Pommbo, Francisco Batista-Viera Immobilization of Enzymes: A Literature Survey [Book Section] // Methods in Molecular Biology: Immobilization of Enzymes and Cells / ed. M.Guisan Jose. — New York: Humana Press, 2013.
5. Michael J.Moehlenbrock Shelley D.Minteer Introduction to the Field of Enzyme Immobilization and Stabilization [Book Section] // Methods and Protocols: Enzyme Stabilization and Immobilization. — [s.l.]: Humana Press, 2011.
6. Zorica D. Knezevic Slavica S. Siler-Marinkovic, Ljiljana V. Mojovic Immobilized Lipases as Practical Catalysts [Journal] // APTEFF. — 2004. — pp. 151–164.
7. M.Guisan Jose New Opportunities for Immobilization of Enzymes [Book Section] // Methods in Molecular Biology. — New York: Humana Press, 2013. — 3: Vol. 1051.
8. Shweta Shah Kusum Solanki and Munishwar N Gupta Enhancement of lipase activity in non-aqueous media upon immobilization on multi-walled carbon nanotubes [Journal] // Chemistry Central Journal. — November 29, 2007.
9. Isidoro Emilio de Fuentes Cesar Antonio Viseras, Daniela Ubiali, Marco Terreni, Andreas Rafael Alcantara Different phyllosilicates as supports for lipase immobilisation [Journal] // Journal of Molecular Catalysis B: Enzymatic. — 2001. — pp. 657–663.
10. M. G. Carneiro-da-Cunha J. M. S. Rocha, F.A. P. Garcia, M. H. Gil Lipase immobilisation on to polymeric membranes [Journal] // Biotechnology Techniques. — 1999. — pp. 403–409.
11. Borkar Prita Khobragade Chandrahas, P. Venkata Ramana, Bodade Ragini, M. Swetha Immobilization and stabilization of Pseudomonas aeruginosa SRT9 lipase on tri(4-formyl phenoxy) cyanurate [Journal] // Korean Journal of Chemical Engineering. — 2011. — pp. 867–874.
12. Cao Linqiu Carrier-Bound Immobilized Enzymes.Principles, Applications and Design [Book]. — Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
13. N. Sawangpanya C. Muangchim, M. Phisalaphong Immobilization of Lipase on CaCO3 and Entrapment in Calcium Alginate Bead for Biodiesel Production [Journal] // Science Journal Ubon Ratchathani University. — 2010. — pp. 46–51.