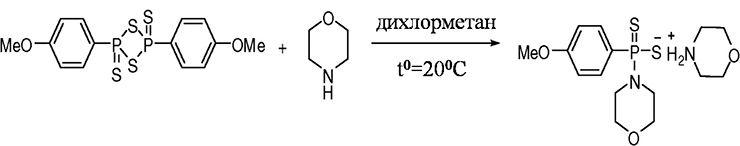что представляет собой сероводород
Сера. Сероводород
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.

В наши дни сера используется как сырьё для производства серной кислоты, пороха, при вулканизации каучука, в органическом синтезе, а также для борьбы с вредителями сельского хозяйства. Порошок серы применяют в медицине в качестве наружного дезинфицирующего средства.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая сера представляет собой жёлтый порошок, нерастворимый в воде. При кристаллизации из хлороформа CHCl3 или из сероуглерода CS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. ромбическая сера состоит из циклических молекул S8, имеющих форму короны. При 113 о С она плавится, превращаясь в жёлтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются цепочки. А если нагреть серу до 445 о С, она закипает. Выливая кипящую серу струйкой в холодную воду, можно получить пластическую серу – резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются игольчатые кристаллы моноклинной серы (tпл = 119 о С). Подобно ромбической сере, эта модификация состоит из молекул S8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
Нахождение в природе
В природе сера находится как в свободном состоянии, так и в виде соединений. Важнейшие из них следующие: FeS2 – пирит; или железный (серный) колчедан, CuS – медный блеск, Ag2S – серебряный блеск, PbS – свинцовый блеск. Сера часто встречается в виде сульфатов: гипса – CaSO4 ∙2H2O; мирабилита, или глауберовой соли Na2SO4∙10H2O; горькой (английской) соли MgSO4 ∙ 7H2O и др. Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах (в составе белков).
Получение
Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют из них в специальных аппаратах – автоклавах.
В лабораторных условиях свободную серу можно получить, например, при сливании растворов сероводородной и сернистой кислот, при неполном сгорании сероводорода:
Химические свойства серы
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами имеющими меньшую ЭО). Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам и кислотам – окислителям).
Взаимодействие серы с простыми веществами

Сера реагирует как окислитель:
Сероводород H2S
Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
Вызывает сильную коррозию металлов.
Также является продуктом нефтепереработки.
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
ПДК H2S в воздухе населенных мест- 0,008 мг/м 3 (ГН 2.1.6.1338-03 Предельно допустимые концентрации загрязняющих веществ в атмосферном воздухе населенных мест).
— реакция взаимодействия разбавленных кислот с сульфидами
— реакция взаимодействия сульфида алюминия с водой
— сплавление парафина с серой.
В природе встречается довольно редко в составе попутного нефтяного газа (ПНГ), природного газа, вулканического газа, в растворенном виде в природных водах.
Образуется при гниении белков, содержащих в составе серосодержащие аминокислоты метионин или цистеин.
Сероводород — новое лекарство для сосудов
Трудно поверить, что столь неприятная для нашего обоняния молекула может быть полезной.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Сероводород (H2S) наряду с другими газообразными молекулами, такими как монооксид углерода и монооксид азота, является важной внутриклеточной сигнальной молекулой, которая в последнее время стала объектом большого числа фундаментальных исследований. Как оказалось, H2S участвует в регуляции разнообразных физиологических процессов, связанных с регуляцией гомеостаза, иммунитета, передачи нервных импульсов в клетках центральной и периферической нервной системы. Однако среди огромного разнообразия биологических функций этой молекулы особое место выделяют ее роли в регуляции работы сердечнососудистой системы, в частности — формировании нормальных показателей артериального давления. Обнаружение такого свойства молекулы H2S положило начало новому направлению в фармакологии, связанному с поиском и созданием принципиально новой группы антигипертензивных препаратов, действие которых основывалось бы на высвобождении молекул H2S.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Сероводород многим известен как газ, обладающий дурным запахом тухлых яиц. Первые упоминания о сероводороде датируются 16 веком, когда в 1713 году итальянский врач Бернардино Рамадзини описал влияние сероводорода на организм человека в своем труде «De Morbis Artificum», или «Заболевания рабочих». В главе «Болезни очистителей уборных и выгребных ям» он описывает болезненное воспаление глаз, которое было распространено среди таких рабочих. Воспаление это часто приводило к присоединению вторичной инфекции, а иногда и к полной слепоте. Рамадзини предположил, что во время работы из разрушенных экскрементов выделяются неизвестные летучие кислоты, которые и вызывают раздражение глаз. Как известно в настоящее время, сероводород образуется везде, где органическое вещество подвергается гниению [20].
В 1863 году Феликс Гоппе-Зейлер исследовал влияние чистого сероводорода на кровь человека и по изменениям в видимой области спектра поглощения, соответствующей гемоглобину, обнаружил зеленый пигмент. Он назвал новую форму гемоглобина сульфгемоглобином. Эта находка в дальнейшем привела к рождению гипотезы о том, что сероводород наряду с нитритом натрия и оксидом углерода (угарным газом) является кровяным ядом. Однако в условиях in vivo этот пигмент так и не был обнаружен.
Непосредственные исследования биологического действия сероводорода начались на рубеже XX века, но посвящены они были преимущественному изучению токсических свойств сероводорода [20]. Рассматривать сероводород в качестве сигнальной молекулы, которая не только является токсическим агентом, но и участвует в регуляции функциональной активности различных клеток нашего организма, стали только в конце XX века. Начало исследованиям в этой области положили японские ученые Абе и Кимура, которые в 1996 г. впервые описали возможность синтеза сероводорода в тканях головного мозга и указали на его способность регулировать функции клеток [4].
Хотя сероводород был обнаружен в тканях головного мозга еще в 1980-х годах, первоначально его сочли за артефакт, который образовался вследствие быстрого увеличения концентрации сульфидов в тканях после смерти. При этом появление сероводорода связывали с его высвобождением из дисульфидных соединений серы (так называемых «sulfane sulfur») во время препарирования тканей [16].
В настоящее время сероводород отнесен к группе так называемых газотрансмиттеров — газообразных внутриклеточных сигнальных молекул, выполняющих в клетке специфические регуляторные функции. H2S хорошо растворим в липофильных веществах. Его растворимость в липидах в пять раз превосходит растворимость в воде, что обусловливает хорошую проникающую способность H2S через мембранные структуры клетки и не требует участия специальных ион-транспортных систем. Константа проницаемости (РМ) сероводорода через бислойные липидные мембраны достаточно высока и составляет 0.5±0.4 см/с (для сравнения РМ для кислорода составляет примерно 0.0050±0.0006 см/с) [17]. Это позволяет считать сероводород высоко доступной молекулой, эффективно осуществляющей свои функции внутри клеток.
Другими молекулами, входящими в группу газотрансмиттеров, являются хорошо известный монооксид азота (NO), а также монооксид углерода (CO).
Синтез сероводорода
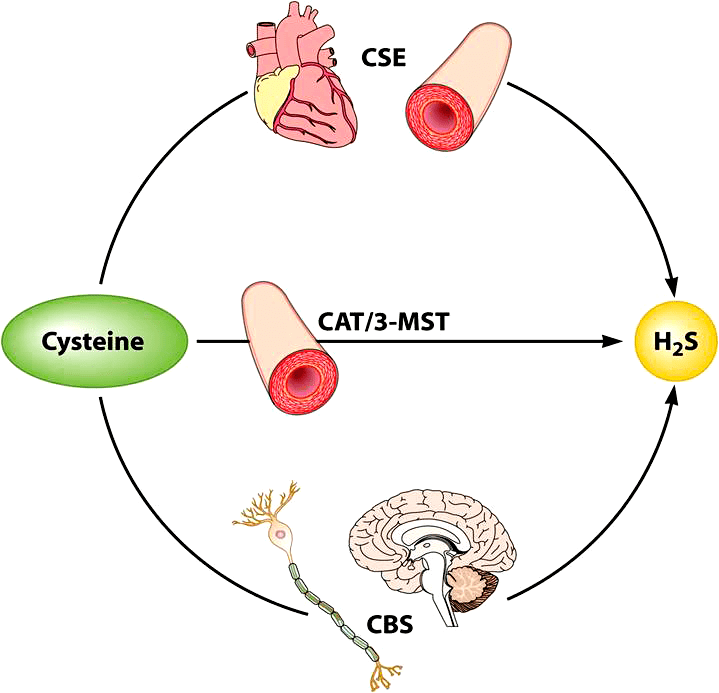
Внутриклеточный синтез сероводорода осуществляется в различных клетках нашего организма. В настоящее время известно три фермента, в результате работы которых синтезируется сероводород: цистотионин-β-синтаза (CBS), цистотионин-γ-лиаза (CSE) и 3-меркаптопируватсульфуртрансфераза (3-MST).
При этом CBS осуществляет синтез сероводорода преимущественно в нервных клетках. В гладкомышечных клетках кровеносных сосудов, сокращение-расслабление которых обеспечивает изменение тонуса последних, синтез сероводорода осуществляет фермент CSE [16], [22], а в эндотелиальных клетках, выстилающих изнутри просвет сосуда, — 3-MST [11], [21] (рис. 1).
Рисунок 1. Синтез сероводорода. В гладкомышечных клетках кровеносных сосудов, в кардиомиоцитах синтез сероводорода обусловлен активностью фермента цистотионин-γ-лиазы (CSE), тогда как в эндотелиальных клетках — комплекс 3-меркаптопируватсульфуртрансферазы (3-MST) и цистеин-аминотрансферазы (CAT). В клетках органов, не относящихся к кровеносному руслу, сероводород преимущественно синтезируется благодаря активности цистотионин-β-синтазы (CBS). Хотя фермент CBS локализован преимущественно в нейронах и клетках нейроглии, он также был обнаружен в клетках печени, почек, поджелудочной железы.
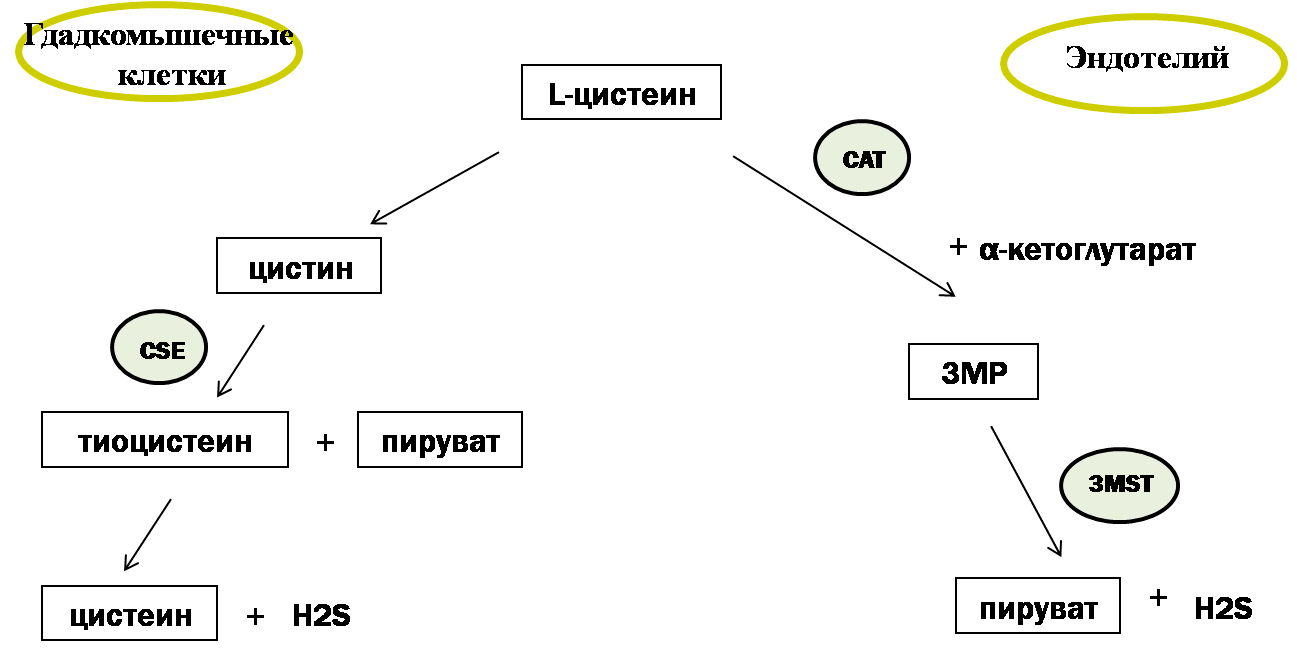
Все три фермента используют в качестве субстрата для синтеза сероводорода серосодержащую аминокислоту L-цистеин, катализируя реакцию его десульфгидратации: происходит отщепление от цистеина атома серы без последующего его окисления, что ведет к образованию H2S. Под действием CSE происходит преобразование цистина (дисульфид цистеин) до тиоцистеина, пирувата и аммиака, с последующим неферментативным преобразованием тиоцистеина до цистеина и H2S (рис. 2). В то же время, CBS использует несколько другой путь синтеза H2S, который заключается в конденсации гомоцистеина с цистеином, и последующим образованием цистатионина [16]. В качестве субстрата синтеза сероводорода могут использоваться и другие серосодержащие аминокислоты, такие как метионин и цистин.
Рисунок 2. Схема синтеза сероводорода в гладкомышечных и эндотелиальных клетках кровеносных сосудов. Условные обозначения: CAT — цистеин-аминотрансфераза; CST — цистотионин-γ-лиаза; 3МSТ — 3-меркаптопируват-сульфуртрансфераза; 3МР — 3-меркаптопируват.
Фермент 3-меркаптопируват-сульфуртрансфераза (3MST) функционирует в комплексе с другим ферментом — цистеин-аминотрансферазой (CAT). Выделяют митохондриальную и цитозольную формы CAT. Используя в качестве субстрата серосодержащую аминокислоту L-цистеин и α-кетоглутарат, CAT продуцирует 3-меркаптопируват (3МР), из которого при участии фермента 3MST синтезируется непосредственно H2S [18]. В отсутствии α-кетоглутарата синтез H2S прекращается.
Сероводород и сердечнососудистая система
Как показали многочисленные исследования, одной из систем, где сероводород играет ключевую роль как сигнальная молекула, является сердечнососудистая система, в частности — кровеносные сосуды. Осуществляя свое регуляторное действие в сосудах артериального русла, он принимает активное участие в регуляции артериального давления [23].
Исследования среди людей показали, что в группе лиц с нормальными показателями артериального давления уровень H2S в плазме крови составлял 34 мкМ, тогда как у больных артериальной гипертонией он был снижен до 20 мкМ. Назначение больным артериальной гипертонией ингаляций сероводорода способствовало снижению показателей артериального давления [29]. При проведении исследований на крысах было обнаружено, что внутривенное болюсное введение раствора сероводорода вызывало у них дозозависимое снижение артериального давления [16].
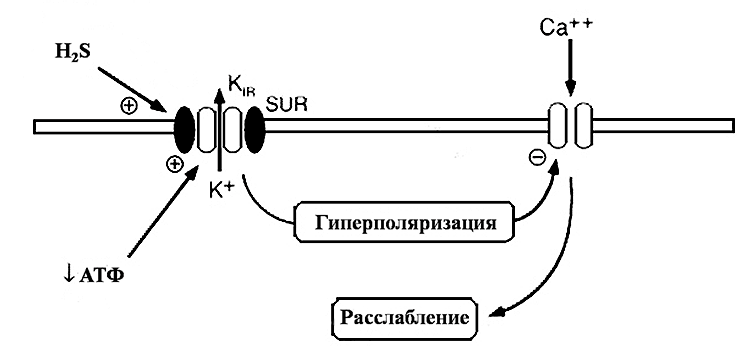
В условиях in vitro донор сероводорода гидросульфид натрия (NaHS), активно используемый в экспериментальной практике, также вызывал расслабление различных отделов артериального и венозного русла: грудной, мезентериальной, почечной артерий, аорты, воротной вены и т.д. Несмотря на существенную роль эндотелия в регуляции сосудистого тонуса, его удаление не оказывало существенного влияния на эффекты сероводорода в гладкомышечных клетках [16]. Это свидетельствует о прямом влиянии сероводорода на гладкомышечные клетки через присущие им регуляторные механизмы. Расслабляющее действие сероводорода на гладкомышечные клетки связано преимущественно с открыванием особых структур в их мембране — калиевых каналов, чувствительных к концентрации внутриклеточного источника энергии — аденозинтрифосфата (АТФ) [10], [28].
Связываясь с серосодержащими группами белков этих каналов, сероводород изменяет их пространственную конфигурацию и тем самым способствует открыванию каналов [2], [24]. Открывание калиевых каналов ведет к увеличению выхода ионов калия из клетки в межклеточную среду. В то же время, активации АТФ-чувствительных калиевых каналов сопровождается инактивацией потенциал-чувствительных кальциевых каналов L-типа, обеспечивающих поступление ионов кальция (Са 2+ ) в клетку. Высокая внутриклеточная концентрация Са 2+ является необходимым условием развития сократительного ответа со стороны мышечной клетки. Закрывание кальциевых каналов способствует снижению концентрации свободного внутриклеточного Са 2+ [29]. Эти процессы в совокупности запускают механизмы расслабления в гладкомышечных клетках, что в конечном итоге приводит к снижению тонуса кровеносных сосудов и артериального давления в целом (рис. 3).
Рисунок 3. Влияние сероводорода на мембранные процессы. Сероводород, взаимодействуя с АТФ-чувствительными калиевыми каналами, вызывает их активацию и увеличение выхода ионов калия из клетки. Вследствие этого снижается мембранный потенциал на мембране (гиперполяризация) и инактивируются кальциевые каналы. В результате прекращения поступления в клетку ионов кальция происходит расслабление гладкомышечной клетки.
В регуляции релаксирующего действия сероводорода участвуют также и другие внутриклеточные молекулярные механизмы, однако их роль не столь выражена и однозначна [23].
Физиологическая роль сократительного эффекта сероводорода до конца не ясна: является ли он побочным продуктом каких-то внутриклеточных молекулярных реакций, или же несет на себе функциональную нагрузку? В первом случае увеличение тонуса сосудов может быть результатом взаимодействия сероводорода с активными формами кислорода, что приводит как к снижению концентрации самого сероводорода, так и образованию продуктов, способных вызывать сократительный ответ со стороны гладкомышечных клеток. Второй же случай предполагает специфическую активацию сероводородом ионных механизмов, направленных на развитие кратковременного локального спазма, например, в случае нарушения целостности сосудистой стенки [12].
В сердце сероводород снижает сократимость миокарда как в условиях in vitro, так и в условиях in vivo [9], [27]. Этот эффект также частично связан с активацией АТФ-чувствительных калиевых каналов мембран кардиомиоцитов [16]. В экспериментах по моделированию инфаркта миокарда у крыс было обнаружено, что концентрация сероводорода в миокарде и плазме крови таких крыс была на 60% ниже по сравнению с контрольной группой. При этом введение NaHS снижало уровень смертности среди крыс с инфарктом миокарда за счет уменьшения его сократимости и торможения некроза кардиомиоцитов [8].
Дальнейшие перспективы
Учитывая роль сероводорода в регуляции тонуса кровеносных сосудов, ученые всего мира активно взялись за разработку лекарственных средств, действие которых основывалось бы на повышении или понижении в крови концентрации этого газотрансмиттера. В настоящее время возможные молекулы-кандидаты на роль лекарственных соединений можно разделить на две группы: молекулы, которые, растворяясь, непосредственно высвобождают сероводород (NaHS, Na2S, GYY4137) и молекулы-предикторы эндогенного синтеза сероводорода (N-ацетилцистеин, L-цистеин) [7].
N-ацетилцистеин и L-цистеин — предшественники синтеза эндогенного H2S. Увеличение внутриклеточной концентрации этих молекул вызывает дополнительную активацию ферментов CSE и CBS и, следовательно, усиление синтеза H2S. Существенным преимуществом этих молекул является практически полное отсутствие побочных эффектов. Однако трудности, связанные с регулированием конечной концентрации образующегося H2S, вносят свои ограничения на использование N-ацетилцистеина и L-цистеина в клинической практике [26].
Возможные молекулы-претенденты на роль нового лекарственного вещества должны обладать рядом свойств. Во-первых, они должны быть хорошо растворимы в воде. Во-вторых, не должны оказывать токсического действия. В-третьих, не должны быстро метаболизироваться в организме. И в-четвертых, обладать пролонгированным действием, что возможно при достаточно медленном высвобождении сероводорода молекулой-донором в условиях in vivo.
В настоящее время в экспериментальной практике наиболее часто в качестве донора сероводорода используются гидросульфид натрия (NaHS) и сульфид натрия Na2S. Однако при растворении этих молекул происходит слишком быстрое высвобождение сероводорода, что в условиях in vivo вызывает резкое падение артериального давления, вплоть до сосудистого коллапса [16]. Процесс высвобождения сероводорода в этом случае трудно контролируется, что делает NaHS и Na2S непригодными для использования в терапевтических целях.
Недавно Ли с соавторами [14] получили из реактива Лавессона новую молекулу-донор сероводорода, которую они обозначили как GYY4137 (рис. 4). В отличие от гидросульфида натрия, GYY4137 высвобождает сероводород постепенно, что делает эту молекулу более перспективной для дальнейших фармакологических исследований. В моделях на крысах в условиях in vivo и in vitro исследователи установили, что GYY4137 обладает сосудо-расслабляющими свойствами и оказывает антигипертензивное действие.
Рисунок 4. Схема синтеза GYY4137 из реактива Лавессона
Другим направлением в разработках «сероводородных» препаратов является встраивание сероводород-высвобождающих группировок в уже имеющиеся и широко используемые лекарственные молекулы. Альтернативные доноры сероводорода могут быть получены путем добавления сульфидных групп к нестероидным противовоспалительным препаратам. Например, S-диклофенак содержит тионовые группы, прикрепленные эфирными связями к молекуле-носителю, которые в растворе играют роль источника сероводорода [13]. Встраивание тиоловых группировок в молекулу силденафила приводит к развитию эффекта, связанного с существенной релаксацией гладкомышечных клеток кавернозных тел [7].
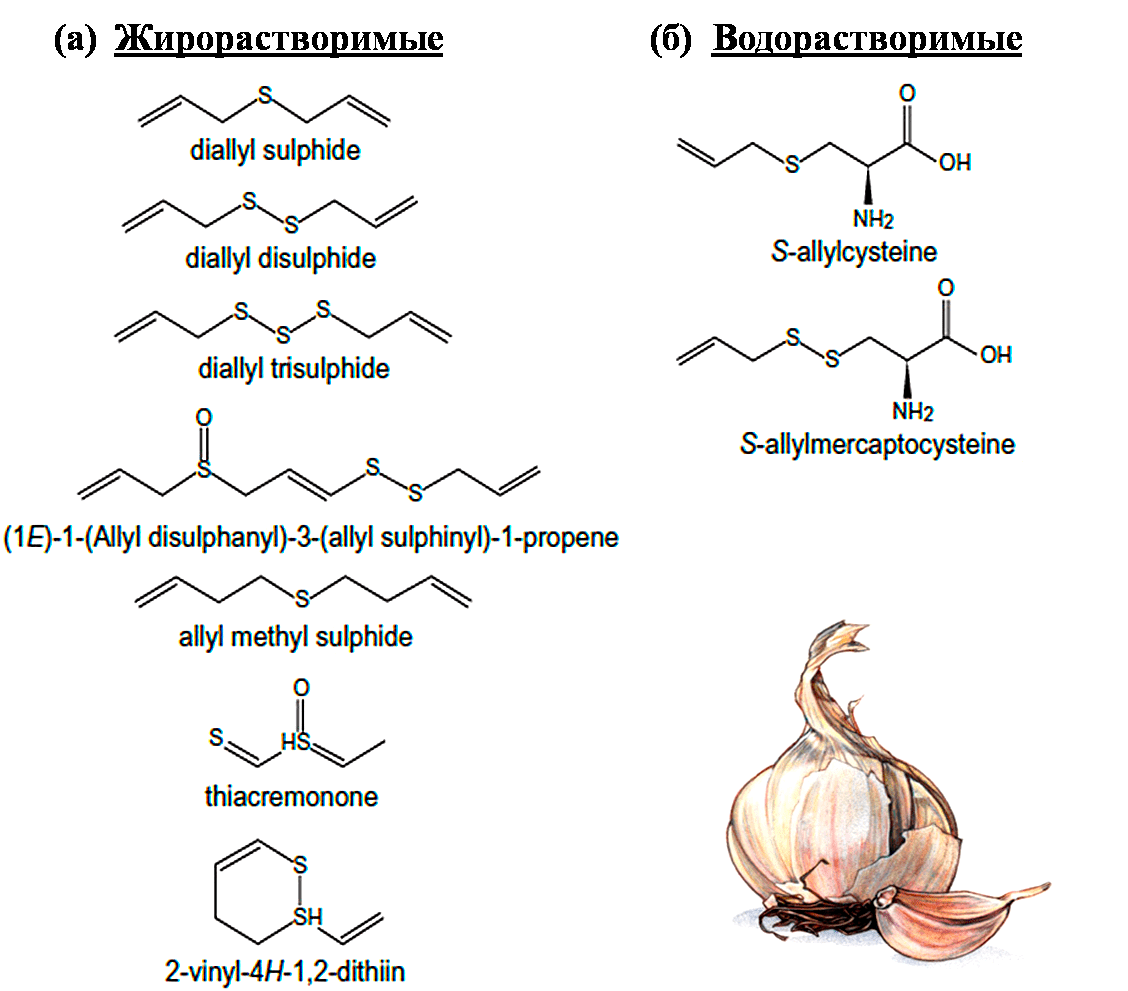
В последние годы большое внимание привлекли полисульфидные соединения чеснока. Были обнаружены их вазоактивные свойства: одно из соединений — диаллил дисульфид (DADS) — вызывало расслабление кольцевых сегментов аорты крысы. Полисульфидные соединения чеснока не только являются предшественниками H2S, но и способны самостоятельно вызывать изменения конформации молекул белков в клеточных мембранах.
Перспективной молекулой-донором сероводорода является получаемый из чеснока S-аллилцистеин, который обладает выраженным кардиопротекторным действием (рис. 5). Однако пока не до конца ясно, является ли он предшественником сероводорода или же модулирует функцию ферментов, связанных с синтезом последнего [26].
Рисунок 5. Серосодержащие соединения чеснока. Из чеснока получают два класса органических соединений серы: жирорастворимые (а) и водорастворимые (б) аллильные соединения серы, образующиеся из гликозида аллиина. Жирорастворимые аллильные соединения серы, такие как диаллил сульфид (DAS), диаллил дисульфид (DADS) и диаллил трисульфид (DATS) освобождаются из аллиина. Эта реакция катализируется ферментом аллииназой, который высвобождается при измельчении чеснока. Водорастворимые соединения серы (S-аллилцистеин (SAC) и S-аллилмеркаптоцистеин) получают при длительной инкубации дробленого чеснока в водных растворах.
С целью снижения патологически высокой концентрации сероводорода можно использовать ингибиторы ферментов его синтеза. К ним относится DL-пропаргилглицин, который, обладая высокими липофильными свойствами, легко проникает через мембрану клетки, не вызывая видимых ее повреждений. Однако DL-пропаргилглицин ингибирует не только CSE-фермент синтеза сероводорода в сердечнососудистой системе, но и CBS, что может стать причиной появления множества нежелательных побочных эффектов, связанных с нарушением регуляции функции других органов [26].
Таким образом, существующие в настоящее время наработки в области создания доноров сероводорода, пригодных для использования в терапевтических целях, находятся на ранней стадии своего развития и явно недостаточны. Разработка, синтез и описание свойств новых доноров сероводорода и селективных ингибиторов ферментов его эндогенного синтеза имеет чрезвычайно важное значение для создания новой группы лекарственных препаратов и, возможно, позволит продвинуться вперед в борьбе с сердечно-сосудистыми заболеваниями [5].
Сероводород (H2S) Свойства, риски и использование
сероводород это общее название сероводорода (H2S). Это можно рассматривать как гидразидную кислоту в растворе (H2S (aq)).
Рассмотрение сульфгидрильной кислоты дано несмотря на низкую растворимость в воде этого химического соединения. Его структура представлена на рисунке 1 (EMBL-EBI, 2005).
H2S возникает практически там, где элементарная сера вступает в контакт с органическим материалом, особенно при высоких температурах. Сероводород представляет собой ковалентный гидрид, химически связанный с водой (H2O), поскольку кислород и сера производятся в той же группе, что и периодическая таблица.
Это часто происходит, когда бактерии разрушают органическое вещество в отсутствие кислорода, например, в болотах и канализации (наряду с процессом анаэробного сбраживания). Это также происходит в вулканических газах, природном газе и некоторых колодезных водах..
Также важно помнить, что сероводород является центральным участником серного цикла, биогеохимического цикла серы на Земле (рисунок 2)..
Как упомянуто выше, восстанавливающие серу и сульфатвосстанавливающие бактерии получают энергию окисления из водорода или органических молекул в отсутствие кислорода путем восстановления серы или сульфата до сероводорода.
Другие бактерии выделяют сероводород из аминокислот, которые содержат серу. Несколько групп бактерий могут использовать сероводород в качестве топлива, окисляя его до элементарной серы или сульфата, используя кислород или нитрат в качестве окислителя..
Чистые серные бактерии и зеленые серные бактерии используют сероводород в качестве донора электронов при фотосинтезе, в результате чего образуется элементарная сера.
Фактически, этот режим фотосинтеза старше, чем режим цианобактерий, водорослей и растений, который использует воду в качестве донора электронов и выделяет кислород (База данных метаболома человека, 2017).
Где производится сероводород?
Сероводород (H2S) встречается в природе в сырой нефти, природном газе, вулканических газах и горячих источниках. Это также может быть результатом бактериальной деградации органического вещества. Это также произведено человеческими и животными отходами.
Бактерии, обнаруженные во рту и желудочно-кишечном тракте, вырабатывают сероводород из бактерий, которые расщепляют материалы, содержащие растительные или животные белки..
Сероводород также может возникать в результате промышленной деятельности, такой как пищевая промышленность, коксовые печи, крафт-бумаги, кожевенные заводы и нефтеперерабатывающие заводы (Агентство по регистрации токсичных веществ и заболеваний, 2011 г.).
Физико-химические свойства
Сероводород реагирует как кислота и как восстановитель. Он взрывается при контакте с дифторидом кислорода, пентафторидом брома, трифторидом хлора, оксидом дихлорида и фульминатом серебра. Он может воспламениться и взорваться под воздействием медного порошка в присутствии кислорода..
Он может реагировать аналогичным образом с другими порошкообразными металлами. Воспламеняется при контакте с оксидами и пероксидами металлов (пероксид бария, триоксид хрома, оксид меди, диоксид свинца, диоксид марганца, оксид никеля, оксид серебра, диоксид серебра, триоксид таллия, пероксид натрия, оксид ртути, оксид кальция).
Зажигается броматом серебра, гипохлоритом свинца (II), хроматом меди, азотной кислотой, оксидом свинца (IV) и оксидом. Он может воспламениться, если пройдет через ржавые железные трубы. Экзотермически реагирует с основаниями.
Реактивность и опасности
H2S считается стабильным соединением, хотя он легко воспламеняется и чрезвычайно токсичен.
Смесь тяжелее воздуха и может перемещаться на значительное расстояние от источника возгорания и обратно. Может образовывать взрывоопасные смеси с воздухом в широком диапазоне.
Он также вступает в взрывную реакцию с пентафторидом брома, трифторидом хлора, трийодидом азота, трихлоридом азота, дифторидом кислорода и хлоридом фенилдиазония.
При нагревании до разложения он выделяет высокотоксичные пары оксидов серы. Несовместим со многими материалами, включая сильные окислители, металлы, сильную азотную кислоту, пентафторид брома, трифторид хлора, трийодид азота, трихлорид азота, дифторид кислорода и хлорид фенилдиазония.
Сероводород (H2S) несет ответственность за многие случаи профессионального токсического воздействия, особенно в нефтяной промышленности. Клинические эффекты Н2S зависит от его концентрации и продолжительности воздействия.
H2S немедленно приводит к смертельному исходу, когда концентрации превышают 500-1000 частей на миллион (ppm), но воздействие более низких концентраций, таких как 10-500 ppm, может вызывать различные респираторные симптомы, начиная от ринита до острой дыхательной недостаточности..
H2S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах..
Представлен случай профессионального воздействия H2Это приводит к поражению нескольких органов, острой дыхательной недостаточности, организации пневмонии и шока, сходных с острым сепсисом. В этом случае у пациента также развилось легкое обструктивное и рестриктивное заболевание легких и периферическая невропатия (Al-Tawfiq, 2010).
ингаляция
В случае вдыхания выносите его на улицу и держите в покое в удобном для дыхания положении. Если не дышите, примените искусственное дыхание. Если дыхание затруднено, обученный персонал должен дать кислород.
Контакт с кожей
При попадании на кожу ее следует промыть большим количеством воды. Жидкость под давлением может вызвать обморожение. В случае воздействия жидкости под давлением зону замораживания следует немедленно нагреть теплой водой, не превышающей 41 ° C..
Температура воды должна быть терпимой к нормальной коже. Прогревание кожи следует поддерживать в течение не менее 15 минут или до тех пор, пока в пораженный участок не вернется нормальная окраска и ощущение. В случае массивного воздействия одежду снимают во время душа теплой водой.
Зрительный контакт
В случае попадания в глаза тщательно промыть глаза водой не менее 15 минут. Держите веки открытыми и подальше от глазных яблок, чтобы убедиться, что все поверхности тщательно промыты..
Проглатывание не считается возможным путем воздействия. Во всех остальных случаях требуется немедленная медицинская помощь (Praxair, 2016).
приложений
1- Производство серы
Установка извлечения серы Claus состоит из печи сгорания, котла-утилизатора, конденсатора серы и ряда каталитических ступеней, каждая из которых использует подогрев, слой катализатора и конденсатор серы. Обычно используются две или три каталитические стадии.
Процесс Клауса превращает сероводород в элементарную серу посредством двухстадийной реакции.
Первая стадия включает контролируемое сгорание исходного газа для превращения приблизительно одной трети сероводорода в диоксид серы и некаталитическую реакцию сероводорода, не сгоревшего с диоксидом серы..
На второй стадии реакции Клауса сероводород и диоксид серы реагируют на катализаторе с образованием серы и воды.
Количество воздуха для горения строго контролируется, чтобы максимизировать извлечение серы, то есть поддержание соответствующей реакционной стехиометрии от сероводорода 2: 1 до диоксида серы через последующие реакторы.
Как правило, извлечение серы может достигать 97% (Национальная медицинская библиотека США, 2011).
2- Аналитическая химия
Уже более века сероводород играет важную роль в аналитической химии, в качественном неорганическом анализе ионов металлов..
В этих анализах ионы тяжелых металлов (и неметаллов) осаждаются (например, Pb (II), Cu (II), Hg (II), As (III)) из раствора после воздействия H2S. Полученный осадок снова растворяется с некоторой селективностью и, таким образом, идентифицируется.
3- Другое использование
Это соединение также используется для отделения оксида дейтерия или тяжелой воды от обычной воды с помощью процесса сульфида Гирдлера..
Ученые из Университета Эксетера обнаружили, что клеточное воздействие небольшого количества сероводорода может предотвратить повреждение митохондрий.
Когда клетка подвергается стрессу из-за болезни, ферменты притягиваются к клетке, образуя небольшое количество сероводорода. Это исследование может иметь больше последствий в профилактике инсультов, болезней сердца и артрита (Stampler, 2014).
Сероводород может обладать антивозрастными свойствами, блокируя разрушительные химические вещества в клетке, имея свойства, подобные ресвератролу, антиоксиданту, обнаруженному в красном вине.