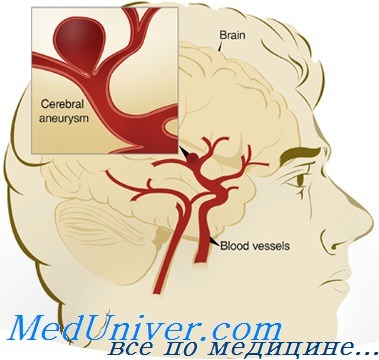
эндоваскулярное удаление аневризмы головного мозга
Эндоваскулярное удаление аневризмы головного мозга
а) Методы эндоваскулярного лечения аневризмы сосуда головного мозга. Попытки окклюзии аневризмы при помощи отделяемого баллона в 1980-х годах сопровождались высокими рисками и не предотвращали повторное кровоизлияние. Введение Guglielmi отделяемых спиралей (GDC) в 1990 г. оказалось намного более безопасной и более эффективной альтернативой. Платиновые спирали вводятся через катетер в дно аневризмы и отделяются электролитически. «Плотная упаковка» аневризмы несколькими спиралями занимает менее одной трети фактического объема, но этого достаточно, чтобы предотвратить повторное кровотечение у большинства пациентов.
Примерно в одной трети случаев радиологи специально оставляют заполнение шейки аневризмы в связи с риском окклюзии спиралью проксимального сосуда, в этом случае риск повторного кровоизлияния выше.
Приблизительно в 5% случаев эмболизация аневризмы не удается. Аневризмы подходят для эмболизации если соотношение дно/ширина шейки больше чем 2:1. Радиологи могут выбирать спирали разного диаметра и ЗЭ-формы. Как правило, требуется от четырех до пяти спиралей, но возможное количество варьируется от одной спирали для 3 мм аневризмы до 20 спиралей для гигантских аневризм.
1. Коррекция с помощью баллона. Этот метод, разработанный Moret, позволяет эмболизировать аневризмы с широкой шейкой. Периодическое раздувание баллона на отдельном катетере в несущем сосуде предотвратцает выпадение спиралей в просвет сосуда. По окончании процедуры спирали сохраняют форму, приданную им баллоном. Некоторые центры используют эту технику в 30-40% случаев эндоваскулярной хирургии.
2. Биоабсорбирующие полимеры. Новые разработки включают в себя использование биоабсорбирующего полимерного покрытия вокруг спирали (Matrix) или в спирали (Cerecyte). Экспериментальные работы на животных показали, что эти полимеры стимулируют регенерацию клеток, способствуют организации тромба в аневризме и стимулируют образование новой интимы. Будут ли эти спирали улучшать общие результаты, остается неопределенным, эта информация будет получена в ходе исследований.
3. Гидрогелевые и волокнистые спирали. Гидрогелевые спирали покрыты гидрофильным полимером, расширяющимся при контакте с кровью, что помогает заполнить просвет аневризмы. Кроме того, спирали с волокнами дакрона или нейлона вызывают более тромбогенную реакцию, чем платина, однако все эти новые технологии ждут дальнейших исследований.
4. Интракраниальные стенты. Введение в практику стентов подходящего размера и достаточной гибкости для прохождения через внутричерепные сосуды предоставило другую альтернативу для аневризм, имеющих широкую шейку, гигантских или веретенообразных аневризм, особенно развивающихся из внутренней сонной артерии или развилки основной артерии. После установки стента микрокатетером можно пройти через стент в полость аневризмы, чтобы разместить в ней спираль без риска окклюзии просвета сосуда. Для предотвращения тромбоза стента назначается пожизненная антитромбоцитарная терапия.
5. Оникс. Оникс — жидкий полимер, который затвердевает при контакте с кровью, может быть введен в аневризму, если ее шейка защищена баллоном или стентом. Теоретически метод весьма привлекателен, но первые исследования показали высокий уровень сложности выполнения, что ограничивает его более широкое применение.
6. Отдаленные результаты эндоваскулярной хирургии. При любых вмешательствах необходимо проведение контрольной ангиографии, как правило, через шесть месяцев после лечения. Реканализация аневризмы за счет уплотнения или миграции спиралей требует повторного вмешательства примерно у 10% пациентов.
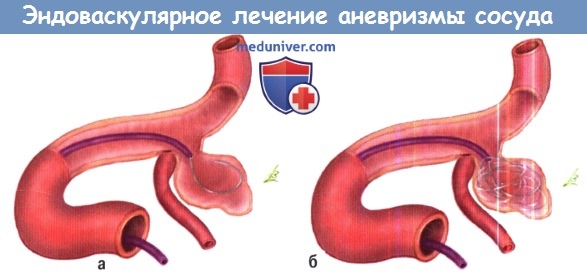
Б. Введение последующих спиралей.
б) Выбор эндоваскулярного метода лечения аневризмы сосуда головного мозга. Изначально, в 1990-х годах эндоваскулярное лечение предназначалось для неоперабельных аневризм. Данная методика лечения чаще используется для тех аневризм, которые трудно лечить открытым путем, в частности, аневризм заднего обращения, несмотря на все убедительные доказательства большей радикальности. Международное исследование аневризматического САК (ISAT)—клипирование против койлинга, началось в 1994 г. Комитет по мониторингу данных остановил сбор информации в 2001 г. после того, как центры изучили данные 2143 пациентов.
Исследование показало, что через один год после эндоваскулярной эмболизации абсолютный риск смерти снизился на 7% (относительный риск снижался на 23%) по сравнению с пациентами, перенесшими клипирование. Значительно больше повторных кровоизлияний и более высокая смертность от повторного кровоизлияния имели место в течение первого года в группе койлинга, однако исследователи по-прежнему выступают за данную методику. Несмотря на отсутствие долгосрочных результатов и то, что пациенты выбранной группы почти всегда имели хороший соматический и неврологический статус, а также небольшую аневризму переднего отдела вилизиева круга, в Великобритании резко сменилась тактика лечения в пользу эмболизации; доля операций внутрисосудистым методом увеличилась с 37 до 54%. Во многих центрах этот показатель в настоящее время превышает 80%.
Последующее семимилетнее наблюдение за пациентами ISAT показало, что выживаемость за это время выше, несмотря на повышенный риск позднего повторного кровоизлияния в эндоваскулярной группе.
Лечение аневризм проводится бригадой специалистов, состоящей из интервенционных радиологов и нейрохирургов. Даже если бы не было разницы в результатах между этими двумя методами лечения, большинство пациентов выбрали бы наименее инвазивный подход. Результаты ISAT подтверждают использование эмболизации в качестве метода первой линии. Тем не менее, не все аневризмы подходят для эндоваскулярного лечения. Следующие факторы делают эмболизацию более трудной или невозможной:
— Аневризма средней мозговой артерии
— Аневризмы с широкой шейкой и соотношением тело/ширина шейки менее чем 2:1
— Аневризмы 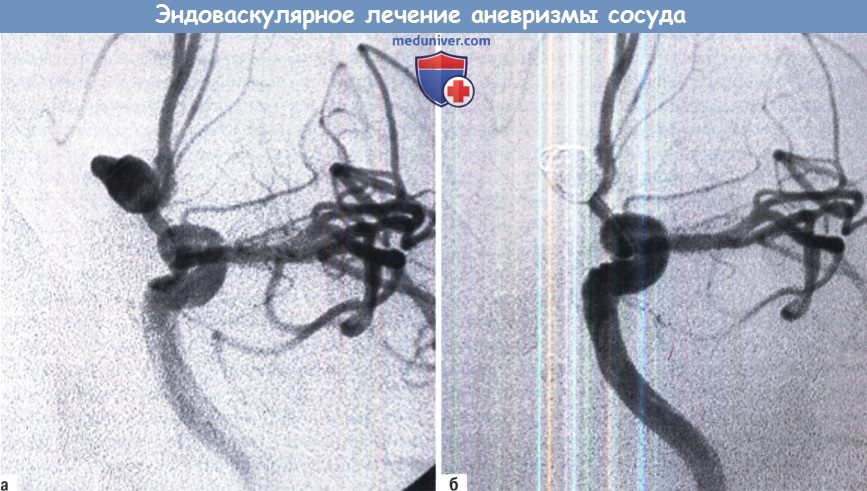
Б. Завершающая стадия эмболизации спиралями, показывающая дно, заполненное спиралями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Резекция аневризмы сонной артерии
О резекции аневризмы сонной артерии
Кратко о методе лечения
Преимущества лечения в ИСЦ
Показания и противопоказания к методу лечения
Противопоказаниями к операции являются:
Подготовка к лечению
Прежде чем приступить к резекции аневризмы сонной артерии, требуется провести комплексное обследование пациента, чтобы выявить зону локализации аневризматического расширения, определить скорость кровяного потока, диаметр просвета артерий и прочие параметры мозгового кровообращения. Необходимые меры диагностики включают:
За неделю до даты проведения операции больному назначают препараты, которые помогают снизить свертываемость крови.
Обезболивание при лечении
Как проходит метод лечения
Возможные осложнения при лечении
При проведении резекции аневризмы сонной артерии могут возникнуть осложнения:
Прогноз после метода лечения
После успешного проведения такого метода лечения как резекция аневризмы сонной артерии прогнозируются следующие улучшения:
В случае операции на правой сонной артерии исчезают общемозговые признаки аневризмы: головная боль, диспепсия, нарушение сознания, психомоторное возбуждение, головокружение,обмороки, судороги в здоровых конечностях.
В случае проведения операции на левой сонной артерии исчезает моторная афазия, парестезия, гемианопсия, эпилептиформные припадки.
Программа наблюдения после метода лечения
Специалисты рекомендуют соблюдать элементарные правила, позволяющие сохранить сосуды здоровыми:
Эндоваскулярное удаление аневризмы головного мозга
С момента появления эндоваскулярной методики выключения аневризм началась конкуренция между внутрисосудистой хирургией и микрохирургией, однако оба этих метода имеют свои достоинства и недостатки, и они могут прекрасно дополнять друг друга. Вопрос о выборе метода лечения аневризм дискутабелен и зависит от множества факторов, таких как тяжесть состояния больного, анатомические особенности аневризмы и ее локализация, наличие гематомы или вентрикулярного кровоизлияния, сроков поступления больного в специализированный стационар.
Кроме медицинских факторов, необходимо принимать во внимание технические и материальные возможности клиники, наличие в ней нейрохирургов, владеющих навыком микрохирургии аневризм, и эндоваскулярных хирургов с достаточной степенью подготовки.
При выборе тактики лечения во главе угла должна быть безопасность операции для пациента: так, при отсутствии надлежащего опыта, оборудования и инструментария риск эндоваскулярной операции, несмотря на ее минимальную инвазивность, может быть значительно больше микрохирургической операции, произведенной опытным хирургом!
Также нельзя проводить эндоваскулярные операции в клинике, где нет экстренной нейрохирургической службы, особенно это касается пациентов в остром периоде разрыва аневризм, так как периодически возникает необходимость в экстренной хирургии при интраоперационном разрыве аневризм.
В настоящий момент основной проблемой является выбор тактики лечения у пациентов с аневризмами сосудов ВББ, которые составляют 5-10% от всех внутричерепных аневризм. Актуальность вопроса объясняется труднодоступностью и сложностью выполнения прямых вмешательств по поводу аневризм этой локализации. Кроме того, по данным ISUIA, вероятность разрыва аневризмы сосудов ВББ в 1,3-1,5 раза превышает аналогичный суммарный показатель (за 5 лет) у больных с аневризмами передних отделов артериального круга большого мозга (АКБМ). Причем чем больше размер аневризмы, тем больше вероятность ее разрыва.
Первый опыт проведения прямых вмешательств по поводу аневризм сосудов ВББ показал крайне неудовлетворительные результаты. От 30 до 50% больных умирали от расстройств кровообращения в стволе мозга или интраопе-рационного разрыва аневризмы. В связи с тем, что вмешательство на аневризме представляло значительные трудности, ряд авторов предпочитали не выполнять открытое вмешательство, а перевязывать или клипировать одну или обе позвоночные артерии. В эпоху до начала использования микрохирургической техники благоприятные исходы таких операций не превышали 5-10% [С. G. Drake и соавт.].
С развитием технической базы нейрохирургии и достижений нейроанестезиологии и нейрореаниматологии ситуация в значительной степени изменилась. Были разработаны методики вмешательств на фоне остановки кровообращения, гипотермии и защиты мозга барбитуратами. По данным С. G. Drake и соавт., которые в 1996 г. анализировали результаты хирургического лечения у 1767 больных с аневризмами ВББ, общая летальность составила 6,6%, неудовлетворительные результаты развились у 9,6% пациентов. Наибольшее количество неудовлетворительных результатов отмечено в группе больных с большими и гигантскими аневризмами — 17,2 и 30,5% соответственно и 9,6% — при аневризмах небольшого размера.
Несмотря на успехи микрохирургии в хирургии аневризм ВББ, эндоваскулярные вмешательства при данной локализации аневризм, а также при аневризмах пара- и инфраклиноидного отделов ВСА являются менее травматичными, позволяют добиться лучшего функционального результата, сохранить трудоспособность пациента.
Как ранее нами упоминалось, результаты исследований ISAT были подвергнуты критике нейрохирургами, имеющими большой опыт микрохирургии аневризм, из-за предвзятости ряда условий исследования и прежде всего из-за выбора аневризм, наиболее подходящих для эндоваскулярного, а не прямого хирургического вмешательства.
Больным в тяжелом состоянии, обусловленном выраженным вазоспазмом, микрохирургическая операция, как правило, противопоказана, так как результаты ее сопоставимы, или даже хуже, чем результаты естественного течения заболевания. Эндоваскулярная операция у больных в тяжелом состоянии (тяжесть состояния III-V степени по Hunt-Hess) наоборот, может быть выполнена, так как она дает возможность проведения химической или баллонной ангиопластики для лечения вазоспазма, и позволяют нетравматично выключить аневризму из кровотока.
Даже частичное выключение аневризмы из кровотока позволяет предотвратить повторное кровоизлияние в остром периоде, риск которого достигает 26%, и в последующем, при компенсации состояния больного аневризма может быть выключена тотально эндоваскулярно или микрохирургически.
Наиболее сложной остается проблема лечения гигантских фузиформных и расслаивающих аневризм. Во многих случаях при этой патологии проведение эндоваскулярных реконструктивных операций невозможно. До настоящего времени в хирургии фузиформных аневризм базилярной артерии используют методики дистальной окклюзии одной или обеих позвоночных артерий (ПА). Однако эти операции опасны развитием грозных ишемических осложнений, которые заранее предусмотреть крайне сложно. Несомненно, что подобные хирургические вмешательства следует проводить только при наличии адекватного коллатерального кровотока по ЗСА из бассейна ВСА.
В тех случаях, когда коллатеральное кровообращение оказывается недостаточным, перед окклюзией ПА возможно создание широкоп-росветных анастозомов между НСА и участком Р ЗМА. Существенный прорыв в решении этой проблемы произошел после появления перенаправляющих поток стентов. В настоящий момент накапливается значительный опыт в применении этого эндоваскулярного инструментария. Радикальность при гигантских и фузиформных аневризмах составила 95-98%. При использовании спиралей, даже в сочетании со стент-ассистенцией, не удавалось достичь такого результата.
При накоплении клинического опыта и изучении отдаленных результатов был выявлен новый тип отдаленных геморрагических осложнений: после тромбоза крупных и гигантских аневризм выделяется большое количество протеолитических ферментов, происходит постепенный лизис как тромба, так и аневризматической стенки, что в сочетании с терапией антикоагулянтами может приводить к отсроченным кровоизлияниям.
В ряде наблюдений такие кровоизлияния были фатальными. Ведется поиск путей профилактики отсроченных кровоизлияний после установки перенаправляющих поток стентов, изучается эффективность сочетанного применения этих стентов со спиралями, либо телескопического стентирования двумя перенаправляющими поток стентами.
Учитывая наш опыт и данные литературы, возможно определить следующие рекомендации по выбору тактики хирургического лечения церебральных аневризм.
Мешотчатые аневризмы передних отделов артериального круга большого мозга у больных в компенсированном состоянии (тяжесть состояния I—II степени по классификации Hunt-Hess) независимо от сроков кровоизлияния могут быть оперированы как с использованием микрохирургической техники, так и эндоваскулярно.
У больных в тяжелом состоянии (тяжесть состояния III—IV степени по классификации Hunt-Hess) предпочтительнее эмболизация с проведением химической или баллонной ангиопластики. При наличии внутримозговой гематомы, вызывающей дислокацию, после проведения эндоваскулярной операции необходимо удалить гематомы, а при наличии вентрикулярного кровоизлияния показано наложение вентрикулярного дренажа. Проведение микрохирургического вмешательства (клипирования аневризмы) должно сопровождаться удалением гематомы и установкой наружного вентрикулярного дренажа. После прямого или эндоваскулярного вмешательства при необходимости устанавливают датчик для измерения внутричерепного давления.
При аневризмах ВББ и аневризмах инфра- и параклиноидного отдела ВСА предпочтительнее эндовазальный метод.
При неразорвавшихся аневризмах можно использовать как прямой микрохирургический, так и эндовазальный метод. Выбор метода операции определяется анатомическими особенностями аневризмы, ее локализацией и доступностью для прямого вмешательства, опытом хирурга, пожеланием пациента. У пациентов пожилого возраста предпочтение следует отдать эндовазальному методу.
При гигантских, фузиформных, диссекционных и расслаивающих аневризмах показана установка перенаправляющего поток стента.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эмболизация аневризмы
Эмболизация — это малоинвазивная процедура, являющаяся альтернативой хирургии. Она показана в случаях, когда выполнение открытого оперативного вмешательства очень травматично или чревато осложнениями. В нейрохирургии эндоваскулярная эмболизация аневризмы головного мозга всё больше вытесняет операции с трепанацией черепа.
Цель эмболизации аневризмы заключается в предотвращении кровотока в аневризматическом мешке путём заполнения его полости специальными спиралями. Это должно предотвратить разрыв и кровотечение. Эндоваскулярная эмболизация аневризмы головного мозга не восстанавливает области уже повреждённого мозга.
Материалами для окклюзии служат спирали, специальные губки или гистоакрил. Для лечения аневризмы обычно используются спирали, либо эмболизирующее вещество.
Спирали бывают разной конфигурации, длины и диаметра. Структурные спирали изготавливают из платины, которая при введении в сосуд сворачивается в трёхмерную фигуру для заполнения полости аневризмы.
Могут потребоваться дополнительные устройства, такие как стент, чтобы помочь удержать спирали внутри аневризмы. Вмешательство с помощью стента подразумевает постоянное размещение его в сосуде, прилегающем к аневризме, для обеспечения поддержки, которая удерживает спирали внутри мешка. Самыми сложными технологиями пользуются для эмболизации аневризм сосудов головного мозга, потому что риски заболевания очень высоки, а доступ к ним, открытым методом очень затруднён.
Подготовка к лечению
 Как проходит лечение
Как проходит лечение
После местной анестезии врач вставляет полую пластиковую трубку (катетер) в в бедренную артерию и продвигает его, используя ангиографию, до места аневризмы.
Используя направляющий катетер,спирали платиновой проволоки или маленькие латексные шарики проводят через катетер и вводят их в аневризму. Они заполняют аневризматический мешок, выключая его из кровообращения, вызывая образование сгустка крови (тромба), который полностью пломбирует полость аневризмы. Мягкость платины позволяет спирали соответствовать причудливой форме мешка. Для полного его заполнения требуется в среднем 5-6 спиралей.
Средняя продолжительность процедуры составляет 1-2 часа.
Когда шейка аневризмы слишком широка иногда требуется установить стент в основной сосуд, чтобы удерживать спирали внутри мешка. Поскольку стент действует как барьер между аневризмой и материнским сосудом, очень маловероятно, что из неё будут выступать катушки.
Возможные осложнения
Прогноз
Эффективны как открытая хирургия, так и эндоваскулярные методы. Выбор лечения зависит от ряда факторов: есть ли риск разрыва аневризмы, её размер, форма и местоположение. Как и все медицинские решения, наилучший вариант лечения следует обсудить с вашим врачом.
Процедуру иногда требуется выполнить несколько раз в течение жизни пациента.
Эндоваскулярное удаление аневризмы головного мозга
Эндоваскулярное вмешательство по поводу церебральных аневризм было выполнено 151 больному, из них у 48% пациентов аневризма располагалась в области артерий ВББ, у 43% — в области ВСА, у 5% — СМА и у 4% больных — в области ПСА. У 132 больных из 151 операции выполнены в первые 14 суток после разрыва аневризмы, т. е. в остром периоде кровоизлияния.
Разрыв аневризмы небольших и крупных размеров проявлялся субарахноидальным кровоизлиянием разной степени выраженности. Гигантские аневризмы чаще имели псевдотуморозное течение.
Всем больным проводили тотальное исследование сосудов головного мозга с использованием субтракционной дигитальной ангиографии на биплановой ангиографической установке Siemens Axiom Artis с возможностью работы в режиме roadmapping (наложение фиксированного изображения сосудов на рабочее изображение). В Институте больным с аневризмами проводят ротационную 3D-ангиографию и параметры аневризм определяют на 3D-станции Leonardo.
Показаниями к проведению эндоваскулярного лечения являлись:
1) труднодоступная локализация аневризмы для прямого нейрохирургического вмешательства (офтальмический сегмент ВСА, кавернозный отдел ВСА и сосуды ВББ);
2) наличие у аневризмы хорошо дифференцированной шейки (соотношение размера шейки и наибольшего поперечного размера тела аневризмы не более чем 1:2);
3) отказ больного или родственников от открытой нейрохирургической операции.
Операции выполняли с использованием трансфеморального доступа. В качестве анестезиологического пособия наиболее часто применяли внутривенную анестезию с ИВЛ. Всем больным с целью профилактики тромботических осложнений проводили болюсную гепаринизацию — 5000 ЕД перед началом операции. После успешного окончания операции большинству больных не требовалось реанимационное пособие и они были выписаны на 4-5-е сутки после операции, не учитывая больных в острой стадии САК и больных с псевдотуморозным течением, которым требовалось проведение симптоматической терапии и более длительное наблюдение.
При выполнении операций использовали инструментарий фирм Bait (France), баллон-катетеры MABD ТЕ, отделяемые баллоны с клапаном BAL, Gold ball, микроспирали MDS; микроспирали Matrix, стенты Neuroform2 фирмы «Boston Scientific» (USA), a также активаторные отделяемые микроспирали Axium и интракраниальные стенты Solitaire (EV3, USA).
На начальном этапе использовали спирали MDS SPID 14 и 18 (BALT, France). Этот тип спиралей был жестким, плотная укладка их в полости аневризмы не всегда удавалась. В последующие годы появились микроспирали SPID 10, которые были существенно мягче предыдущих, а позднее к этой линейке спиралей добавили 3D-спирали (способные формировать объемную фигуру в соответствии с формой аневризмы).
При использовании стентов фактически отпала необходимость вычисления соотношения размера шейки и наибольшего поперечного размера тела аневризмы, что позволило значительно расширить показания для проведения эндоваскулярных операций у больных с аневризмами с широкой шейкой. После установки стента проводили катетеризацию полости аневризмы через ячейки стента, после чего выполняли окклюзию аневризматической полости путем ее плотного заполнения микроспиралями.
Все больные с имплантированными стентами в послеоперационном периоде принимали плавике (75 мг в сутки) в течение 6 мес.
Результаты вмешательства оценивали по данным контрольной ангиографии сразу после окклюзии полости аневризмы микроспиралями. Полное выключение аневризмы из кровотока считали отличным результатом. Осложнения составили 13%, летальность — 7%, инвалидизация — 1,8%.
Реконструктивные операции удалось выполнить у 75,4% больных. Полная окклюзия аневризмы достигнута в 83,7% наблюдений (отличный результат), в структуре реконструктивных вмешательств неблагоприятные исходы наблюдались у 6,8% пациентов.
При проведении эндоваскулярного лечения церебральных аневризм у ряда больных возникли осложнения ишемического и геморрагического характера. Ишемические осложнения развивались в результате миграции микроспирали в сосудистое русло с последующим тромбозом мозговых сосудов и развитием ишемического инсульта. Причиной миграции спирали является неточный подбор размеров имплантируемых микроспиралей и неправильное определение размера шейки аневризмы. К этой же группе относят осложнения, вызванные эмболией мозговых сосудов тромбами из полости аневризмы.
Геморрагические осложнения возникали в результате интраоперационного разрыва аневризмы. Причиной кровотечения при эндоваскулярных операциях в остром периоде субарахноидального кровоизлияния являлось механическое воздействие на стенку аневризмы катетером или проводником. Прекращение кровотечения (из купола аневризмы) происходило в результате обтурации зоны разрыва фибринными тромбами. Процесс тромбообразования протекает как внутри аневризмы, так и за ее пределами.
Репаративные процессы в стенке аневризмы происходят в результате организации фибринного сгустка, окружающего аневризму. Если сгусток, покрытый фибрином, истончается в течение 3 недель после разрыва аневризмы, то возникают повторные кровотечения на месте бывшего разрыва аневризматического мешка. Введение контраста в полость аневризмы может привести к интраоперационному разрыву, так как происходит повышение локального давления на стенку аневризмы, что становится причиной повторного кровотечения. При возникновении подобного осложнения хирург должен стремиться быстрее окклюзировать полость аневризмы.
Анализируя ишемические осложнения, следует отметить, что крайне сложно предположить развитие неблагоприятных исходов при лечении крупных и гигантских аневризм. Резюмируя вышеупомянутые данные, можно сделать следующие выводы:
1. Все манипуляции в полости аневризмы должны быть крайне осторожными, недопустимо использование баллона для окклюзии полости даже частично тромбированной гигантской аневризмы.
2. В случаях, когда в результате эндоваскулярного вмешательства создаются условия для даже минимального стеноза несущего сосуда, в послеоперационном периоде оправдано назначение дезагрегантных препаратов. Однако данная терапия может сыграть отрицательную роль, провоцируя повторное кровотечение из аневризмы в отдаленном периоде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
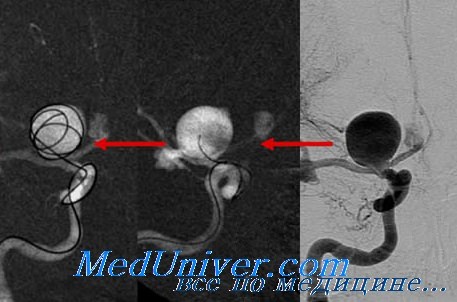
 Как проходит лечение
Как проходит лечение