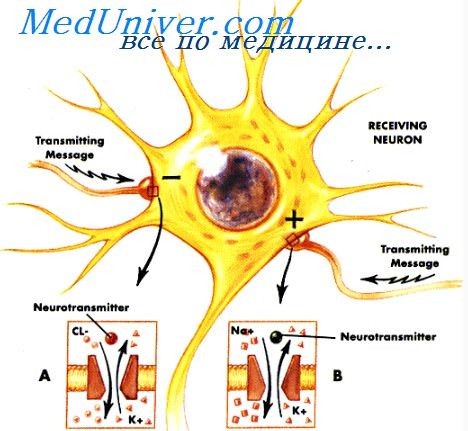
эпилептические приступы при опухоли мозга
Эпилептические приступы при опухоли мозга
Если судорожный эпилептический припадок не подавляется в начальной фазе развития, то включение антиэпилептической системы (т. е. механизмов подавления эпилептической активности) происходит, как правило, постепенно уже в ходе припадка: эпилептический ритм вовлечения сменяется чередованием эпилептических гиперсинхронных разрядов с медленными колебаниями, что знаменует собой переход тонической фазы припадка в более благоприятную — клоническую.
Это проявляется в виде феноменов пик — волн с постепенным замедлением их частоты, т е. нарастанием представленности медленной активности н последующим полным подавлением эпилептических колебаний.
Другая модель, на которой мы изучали взаимоотношение эпилептической и медленной активности, — опухоли центральной области (27 наблюдений).
Установлено, что в периоде, когда единственным клиническим проявлением опухоли служит эпилептический припадок, в большинстве случаев преобладают ирритативные явления: острые волны, пики, пик-волновые разряды. На этом фоне у меньшей части больных обнаруживается фокальная дельта- и тета-актнвность.
В дальнейшем у больных с опухолями центральной области медленная активность вытесняет и, наконец, полностью подавляет эпилептическую, соответственно эпилептические припадки становятся редкими и постепенно исчезают.
Таким образом, медленная активность препятствует прежде всего генерализации эпилептической активности. Это напоминает аналогичные отношения медленной активности и эпилептической активности в дельта-сне, в котором дельта-активность является основной электрографической характеристикой функционального состояния мозга.
Кардинальным фактом является наличие обратной корреляции между ФМС и генерализованными эпилептическими припадками: при эпилепсии бодрствоваиня, при которой припадки не развиваются во время сна, имеют место меньшая латентность периодов н большая длительность дельта-сиз.
Конечно, медленная активность, как и всякая мера компенсации, может иметь определенные границы полезного эффекта.
Н. П. Бехтерева (1980) справедливо указывает, что при активном; очаге эпнлептогенеза пароксизмальная медленная активность не только полностью отражает эффективную защиту, но и приводит к нарушению функций мозга. Усиление распространения, увеличение амплитуды н периода составляющих ее компонентов свидетельствуют о переходе физиологического феномена в патологический со всеми вытекающими отсюда последствиями для деятельности мозга.
Как мы полагаем, ярким примером преобладания уже патологического влияния медленной активности на нервную деятельность является гипсаритмня — электрографический коррелят младенческого спазма, сопровождающегося задержкой психомоторного развития ребенка, а нередко и распадом уже приобретенных навыков.
NSICU.RU neurosurgical intensive care unit
сайт отделения реанимации НИИ им Н.Н. Бурденко
Курсы повышения квалификации
Внутричерепная гипертензия
Асинхронии и графика ИВЛ
Водно-электролитные
нарушения
в нейрореанимации
Книга «Основы ИВЛ»
Рекомендации
по интенсивной терапии
у пациентов
с нейрохирургической патологией
Статьи → Тактика ведения пациентов с впервые возникшими эпилептическими приступами в раннем периоде после удаления опухолей больших полушарий: два наблюдения и обзор литературы
Симптоматическая эпилепсия наблюдается у 20—80% больных с опухолями головного мозга [1, 2]. В подавляющем большинстве случаев эпилептические приступы возникают до операции и к моменту ее проведения больные уже получают противосудорожную терапию, которая продолжается и после нейрохирургического вмешательства. При отсутствии приступов в анамнезе профилактическая противосудорожная терапия в настоящее время не назначается [3]. В этой связи особую проблему представляют эпилептические приступы, которые впервые развиваются после нейрохирургической операции (приступы de novo). С одной стороны, эти приступы могут быть спровоцированы самим фактом операции и самостоятельно прекратиться без противосудорожной терапии, с другой — могут быть дебютом симптоматической эпилепсии, что требует длительной медикаментозной терапии. Единого алгоритма принятия решения в таких ситуациях не существует. Одни авторы предлагают в любом случае начинать противосудорожную терапию [4, 5], другие, в соответствии со стандартами эпилептологии, рекомендуют начинать лечение лишь после постановки диагноза «симптоматическая эпилепсия» [3].
Очевидно, что необоснованное назначение противосудорожной терапии значительно снижает качество жизни пациента. Если же впервые развившийся после операции эпилептический приступ является проявлением симптоматической эпилепсии, то отсутствие терапии приведет к развитию осложнений и ухудшит прогноз [2, 3]. Помощь в принятии решения может оказать видеоэлектроэнцефалографический мониторинг (видео-ЭЭГ-мониторинг).
Мы представляем два клинических наблюдения, в которых видео-ЭЭГ-мониторинг повлиял на выбор тактики дальнейшего ведения больных.
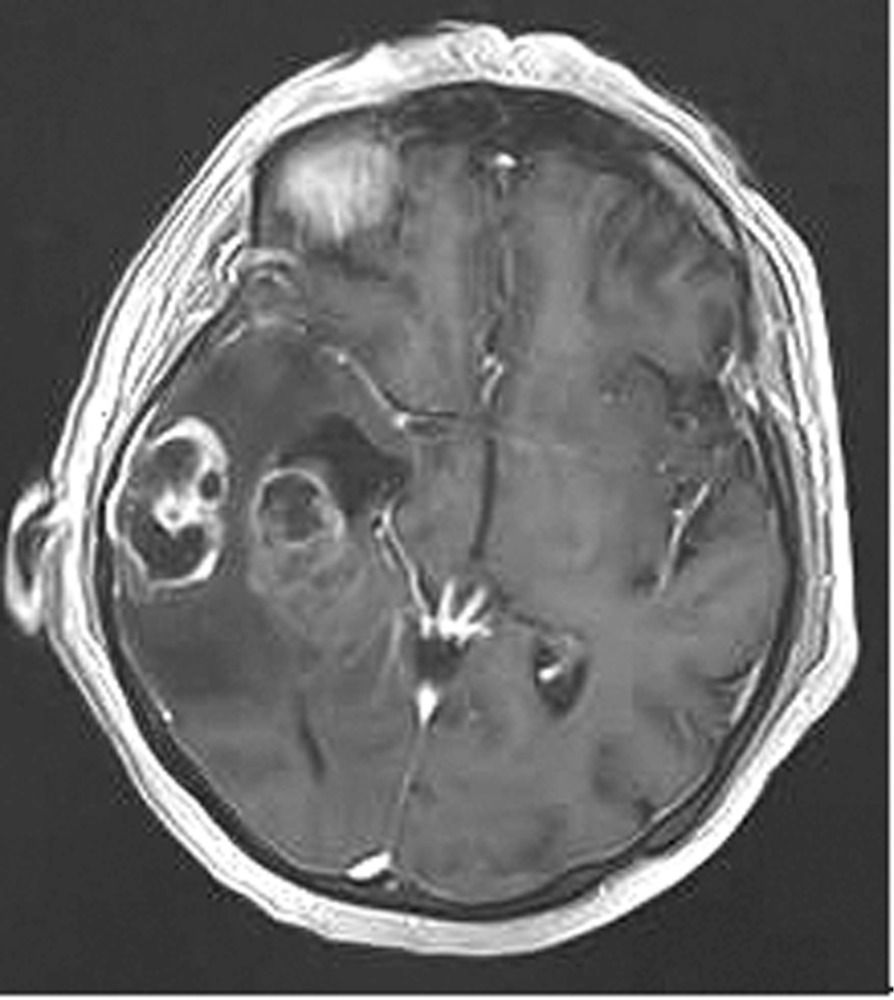
Наблюдение 1. У пациентки 70 лет за 2 мес до госпитализации появилась и стала нарастать слабость в левых конечностях, ухудшилась память на текущие события, снизилась критика собственного состояния. При магнитно-резонансной томографии (МРТ) была диагностирована внутримозговая опухоль правой височной доли с зоной перифокального отека (рис. 1).
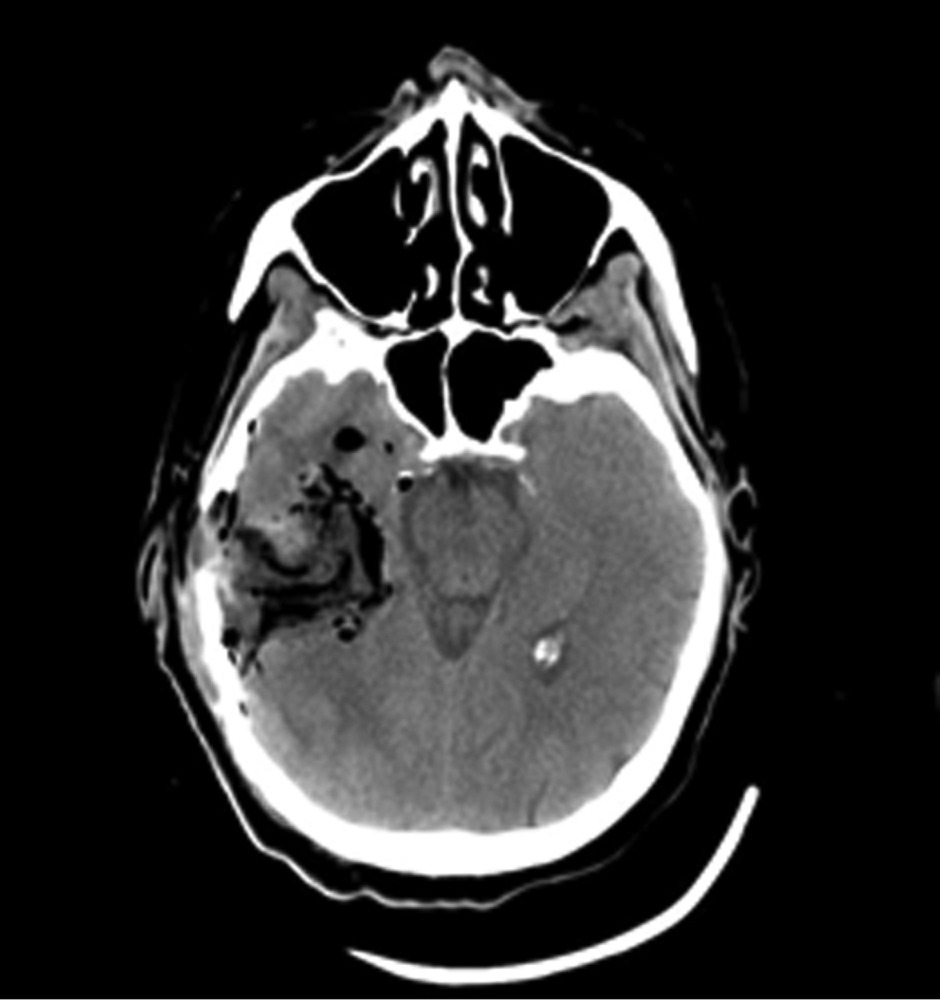
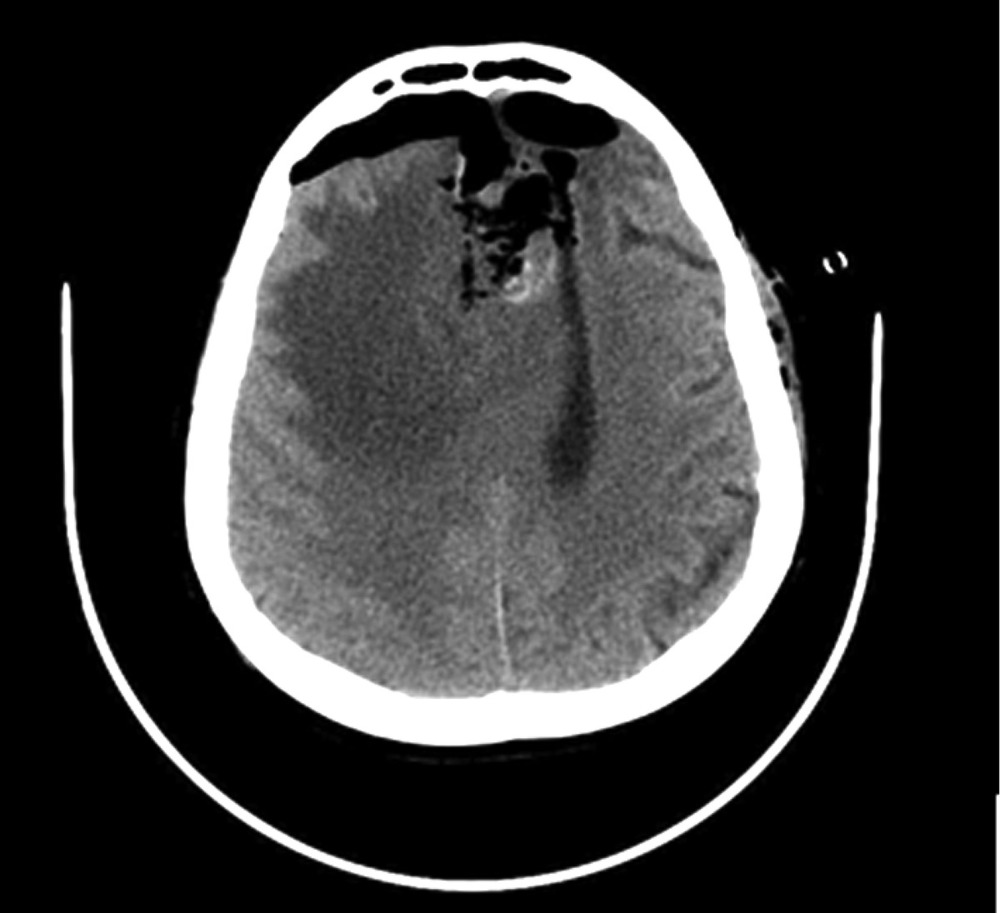
Рис. 1. Наблюдение 1. МРТ перед операцией. Внутримозговая опухоль правой височной доли с зоной перифокального отека. Опухоль, оказавшаяся при гистологическом исследовании глиобластомой (Grade IV), удалена 02.02.16. После операции пациентка была переведена в палату пробуждения отделения реанимации, где спустя 4,5 ч (через 2 ч после экстубации) развился вторичный генерализованный судорожный приступ продолжительностью около 2 мин. Приступ был купирован внутривенным болюсным введением диазепама 10 мг и вальпроевой кислоты (конвулекс) 500 мг. Экстренное КТ-исследование выявило послеоперационные изменения правой височной доли и отсутствие хирургических осложнений (рис. 2).
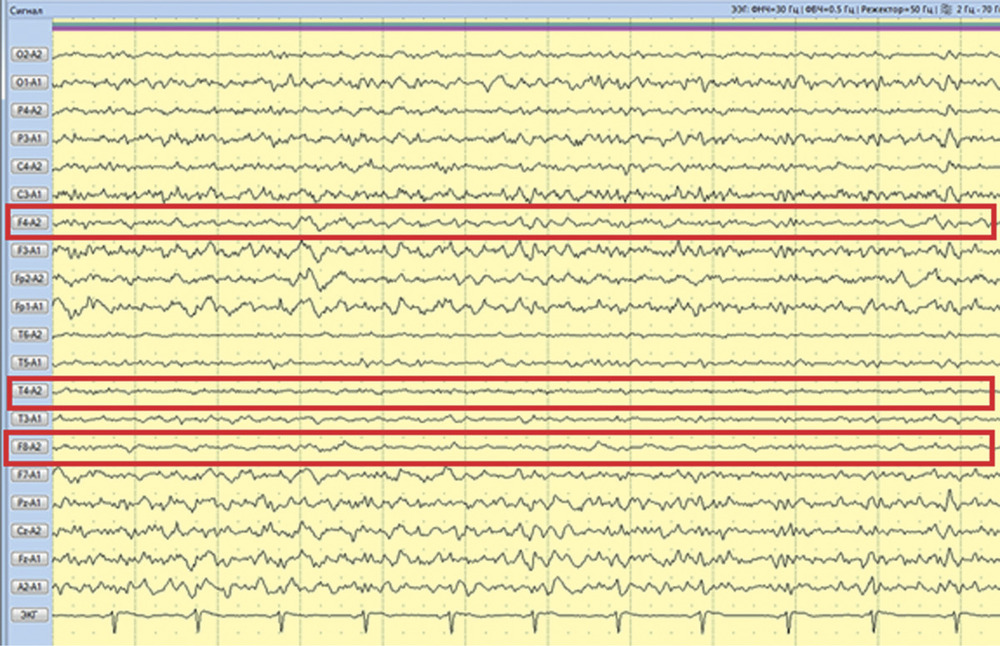
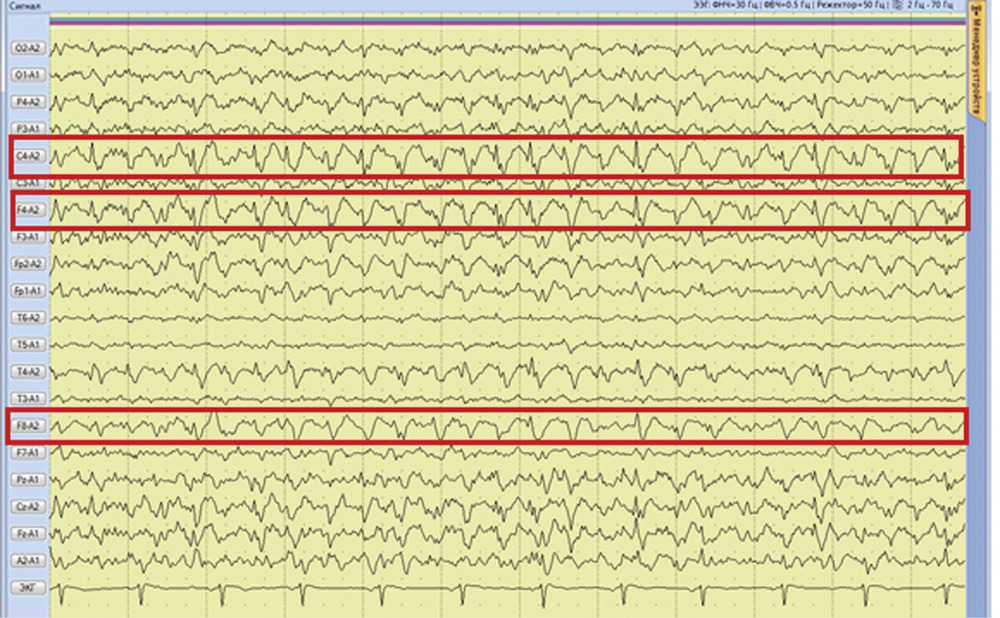
Рис. 2. Наблюдение 1. СКТ в 1-е сутки после удаления опухоли правой височной доли. Выявлены послеоперационные изменения в зоне хирургического вмешательства. Пациентке в 1-е сутки после операции проводился видео-ЭЭГ-мониторинг, где на фоне дезорганизации коркового ритма было выявлено замедление биопотенциалов в правой лобно-височной области (рис. 3). За следующие 13 ч записи было зарегистрировано 7 электроэнцефалографических паттернов длительностью от 2 до 4 мин, сопровождающихся появлением эпилептиформных потенциалов в виде комплексов острая—медленная волна в правой лобно-центрально-височной области (рис. 4). Шесть из семи эпизодов не проявлялись клинически. В 1 случае пароксизмальная симптоматика проявилась кратковременным (около 5 с) тоническим напряжением мышц шеи и поворотом головы вправо.
Рис. 3. Наблюдение 1. Фрагмент 13-часового ЭЭГ-мониторинга. Диффузное снижение амплитуды биопотенциалов мозга. Замедление в правой лобно-височной области на дезорганизованном фоне. Типичная эпилептиформная активность не регистрируется.
Рис. 4. Наблюдение 1. Фрагмент 13-часового ЭЭГ-мониторинга. Эпилептиформные потенциалы в виде комплексов острая—медленная волна в правой лобно-центрально-височной области. Учитывая данные видео-ЭЭГ-мониторинга, пациентке была назначена противосудорожная терапия в виде внутривенного введения вальпроевой кислоты (конвулекс) через перфузор в дозе 1500 мг/сут. На 2-е сутки после операции эпилептиформная активность на ЭЭГ прекратилась, больная переведена в клиническое отделение, где была продолжена противосудорожная терапия вальпроевой кислотой (конвулекс) в таблетированной форме в дозе 2000 мг/сут. Через 11 дней после операции пациентка в удовлетворительном состоянии выписана из клиники с рекомендацией продолжить прием 1500 мг/сут вальпроевой кислоты под контролем ЭЭГ и концентрации препарата в плазме крови.
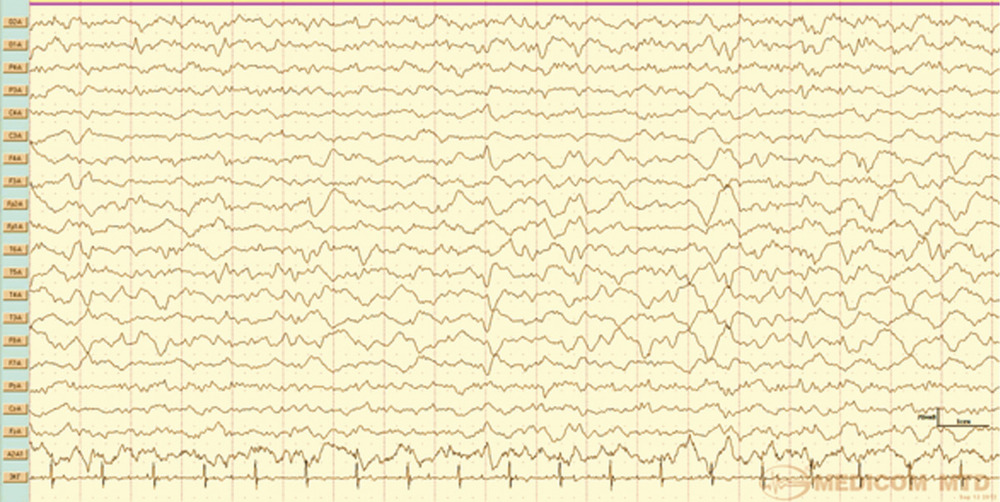
Наблюдение 2. Пациентка 64 лет за 10 мес до настоящей госпитализации была оперирована и проходила комбинированное лечение по поводу глиобластомы (Grade IV) левой лобной доли. В течение всего срока заболевания приступов с нарушением сознания или иных пароксизмальных состояний не наблюдалось. Противосудорожную терапию не получала. При контрольной МРТ за 3 нед до госпитализации выявлено увеличение размеров опухоли. Принято решение о повторном хирургическом вмешательстве. После операции 14.03.16 пациентка была переведена в палату пробуждения, где спустя 1,5 ч на фоне выхода из наркозного сна развился вторичный генерализованный судорожный приступ, который самостоятельно купировался в течение 1 мин. Проведенное КТ-исследование выявило послеоперационные изменения и отсутствие хирургических осложнений (рис. 5). В ходе суточного видео-ЭЭГ-мониторинга были выявлены диффузные изменения биопотенциалов в виде умеренновыраженной дезорганизации корковой активности, при отсутствии типичных эпилептиформных потенциалов (рис. 6). Было принято решение не назначать больной противосудорожную терапию и оставить ее на сутки под наблюдением в отделении реанимации. Клинических приступов или иных пароксизмальных проявлений не отмечено, при видео-ЭЭГ-мониторинге эпилептиформная активность не зафиксирована. После перевода в клиническое отделение приступов также не наблюдалось. Спустя 8 дней после операции пациентка в удовлетворительном состоянии выписана для продолжения химиотерапии по месту жительства.
Рис. 5. Наблюдение 2. СКТ в 1-е часы после удаления опухоли левой лобной доли. Послеоперационные изменения с зоной перифокального отека, скопления воздуха и небольшой зоной имбибиции кровью в области операции.
Рис. 6. Наблюдение 2. Фрагмент ЭЭГ-мониторинга. Умеренновыраженный дезорганизованный фон, с преобладанием медленных форм активности и острых потенциалов в лобно-передневисочной области, больше справа. Обсуждение Впервые возникшие эпилептические приступы (de novo) в зависимости от срока их развития после операции разделяют на ранние (acute postoperative seizures) и поздние [6, 7]. К ранним приступам как правило, относят те, которые возникают в течение 48 ч после операции, но ряд авторов считают, что к ранним эпилептическим приступам следует относить все приступы, возникающие в 1-ю неделю после операции [8].
Частота ранних впервые возникших приступов после удаления опухоли мозга варьирует в разных сериях наблюдений от 4,3 до 23,6% [7, 9] и зависит от локализации, гистологического диагноза, удаленного объема, выраженности отека, геморрагической имбибиции мозга, пневмоцефалии и наличия осложнений [6, 9]. В среднем считается, что вероятность возникновения эпилептических приступов после удаления полушарной опухоли составляет 5—10% [7, 9].
Патогенез впервые возникших в раннем после-операционном периоде эпилептических приступов окончательно не установлен. Одним из механизмов может быть раздражение коры мозга компонентами крови и продуктами распада гемоглобина. Возможно также, что накапливающиеся в очаге повреждения перекисные соединения снижают концентрацию гамма-аминомасляной кислоты, которая ингибирует нейрональную активность коры и таламуса [6]. Наконец, в ишемизированной перитуморозной ткани мозга за счет снижения синтетаз АТФ нарушается трансмембранный транспорт воды и ионов, что приводит к изменению потенциала клеточной мембраны [11]. В любом случае патогенез впервые возникших ранних послеоперационных приступов обусловлен механизмами, действие которых, как правило, прекращается в раннем послеоперационном периоде. Соответственно такие приступы, особенно единичные, не дают оснований диагностировать симптоматическую эпилепсию и должны расцениваться как реакция мозга на хирургическое вмешательство [6, 8].
В ряде исследований [6, 11] показано, что ранние впервые возникшие послеоперационные приступы не повышают риск развития симптоматической эпилепсии и не являются поводом для назначения противосудорожной терапии. Менее распространено мнение о том, что приступы в раннем послеоперационном периоде увеличивают риск развития послеоперационной симптоматической эпилепсии [12].
Профилактическое2 назначение противосудорожных средств после нейрохирургических вмешательств широко практиковалось в ХХ веке и сегодня рутинно осуществляется во многих отечественных и зарубежных клиниках. Вопрос о профилактическом применении противосудорожных препаратов в настоящее время остается дискуссионным. Обзор Американской ассоциации нейрохирургов (AANS) за 2005 г. показал, что чаще противосудорожные препараты для профилактики используют длительно практикующие нейрохирурги [13]. Некоторые авторы [14] предлагают для профилактики ранних приступов назначение противосудорожных препаратов в первую неделю после операции. Комитет качества и стандартизации Американской академии неврологов (AAN) в рекомендациях 2000 г. не рекомендует продолжать противосудорожную терапию дольше одной недели после операции, так как медикаментозная профилактика неэффективна для предотвращения развития позднего приступа [15].
Всего, по данным литературы [17], проведено 5 рандомизированных контролируемых испытаний трех противоэпилептических препаратов: фенитоина, фенобарбитала и вальпроатов. Разницы между действием этих средств и плацебо относительно предотвращения первого приступа у пациентов с опухолями головного мозга не выявлено. Более того, в одном исследовании результаты в группе больных, профилактически получавших фенитоин, оказались хуже, чем в группе плацебо (10 и 8% ранних послеоперационных приступов соответственно), причем побочные эффекты препарата отмечены у 18% получавших его пациентов [17]. Следует подчеркнуть, что исследования высшего уровня доказательности проведены только по трем упомянутым препаратам, и нет оснований предполагать аналогичный результат при изучении новых противосудорожных средств.
В литературе [17, 18] доминирует мнение, что побочные эффекты профилактической противосудорожной терапии превосходят возможную пользу и однозначно снижают качество жизни больных. Очевидно, что в определенных ситуациях ранние послеоперационные приступы бывают первым проявлением симптоматической эпилепсии и промедление с назначением соответствующей терапии может иметь негативные последствия. Дифференциальный диагноз между ранними послеоперационными приступами, возникшими как реакция мозга на повреждение, и ранними приступами, являющимися дебютом симптоматической эпилепсии, затруднен, и однозначного алгоритма принятия решения в такой ситуации в современной литературе не представлено.
Методом, помогающим принять верное решение, служит видео-ЭЭГ-мониторинг. Продолженный видео-ЭЭГ-мониторинг более информативен по сравнению с рутинной записью ЭЭГ [3, 19]. Мы использовали рекомендации ESICM (Европейское общество интенсивной терапии) по проведению видео-ЭЭГ-мониторинга в отделениях нейрореанимации [19]. В соответствии с ними видео-ЭЭГ-мониторинг проводили сразу после выявления приступа.
В настоящее время в нашей клинике используется стандарт терапии продолженного эпилептического приступа и эпилептического статуса [18], согласно которому препаратом первой линии (из зарегистрированных в России) являются бензодиазепины (диазепам 0,1—0,3 мг/кг). Препаратами второй линии могут быть вальпроевая кислота или леветирацетам. Вальпроевая кислота (конвулекс) вводится внутривенно болюсно в дозе 15 мг на 1 кг массы тела, а далее через 30 мин, через перфузор в дозе 1 мг/кг/ч (не более 2500 мг/сут). Леветирацетам (кеппра) вводится в дозе 30 мг/кг/сут внутривенно болюсно, дозу разделяют на три приема (не более 3000 мг/сут). При однократно возникшем эпилептическом приступе, даже самостоятельно прекратившемся, проводится видео-ЭЭГ-мониторинг. Части больных, с учетом результатов мониторинга в дальнейшем назначается противосудорожная терапия на срок не менее 1 года, под контролем ЭЭГ и МРТ. Другая часть пациентов без явной эпилептической активности, по данным ЭЭГ-мониторинга, выписывается под наблюдение невролога без назначения противосудорожной терапии, с последующим динамическим МРТ- и ЭЭГ-контролем. При повторно возникающих приступах назначается противосудорожная терапия.
Заключение
На основании анализа данных литературы можно говорить о том, что развитие эпилептических приступов de novo после нейрохирургических вмешательств — нередкое явление, требующее не только быстрой реакции врача для купирования приступа, но и осмысления ситуации относительно дальнейшего ведения пациента. Развитие симптоматической эпилепсии может привести к ухудшению исходов хирургического лечения, повышению летальности, увеличению срока пребывания пациента в стационаре. С другой стороны, неоправданное использование противоэпилептических препаратов в ситуации, когда единственный приступ является реакцией мозга на операционную травму, существенно снижает в дальнейшем качество жизни пациента. Дискуссия, имеющая место на сегодняшний день в литературе, подтверждает нерешенность этих проблем (это касается и профилактического назначения препаратов, и выбора конкретного противоэпилептического средства, и сроков его использования).
Приведенные нами клинические наблюдения отражают различные варианты подхода к терапии впервые развившихся эпилептических приступов у пациентов после удаления внутримозговой опухоли. По нашему мнению, одним из важных на сегодняшний день критериев для принятия решения о назначении противосудорожной терапии являются данные видео-ЭЭГ-мониторинга, который необходимо проводить после однократно возникшего эпилептического приступа в первую неделю после операции.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Статья посвящена актуальной проблеме — тактике ведения пациентов с эпилептическими приступами denovo после удаления внутримозговых опухолей. Ведение пациентов с так называемыми «острыми симптоматическими приступами» является предметом активных обсуждений в последние годы. Казалось бы все просто: возникли эпилептические приступы у больных с поражением головного мозга — необходимо длительное назначение антиэпилептических препаратов. Однако это далеко не так и не во всех случаях.
Авторы приводят два клинических наблюдения. У обеих пациенток после удаления злокачественных опухолей головного мозга развились билатеральные тонико-клонические эпилептические приступы. В первом случае при проведении видео-ЭЭГ мониторинга (ВЭМ) было выявлено региональное замедление, эпилептиформная активность и множественные ЭЭГ паттерны фокальных приступов. Во втором — лишь однократный приступ с отсутствием эпилептиформной активности на ЭЭГ. В первом случае авторы рекомендовали длительный прием антиэпилептических препаратов, во втором — только наблюдение.
Таким образом, главным достоинством публикации является дифференцированный и комплексный подход к данной категории пациентов. На основании данных анамнеза, клиники, нейровизуализации и проведения ВЭМ в раннем послеоперационном периоде, авторы определяют группу пациентов с высоким риском развития эпилепсии, рекомендуя им длительную терапию, и группу с низким риском, оставляя ее без лечения, но под наблюдением. Такой подход позволяет избавить часть пациентов от необходимости необоснованного длительного приема антиэпилептических препаратов, которые являются потенциально токсичными.
Статья написана хорошим научным языком, является актуальной, обе пациентки обследованы современными методами, выводы адекватны. Авторами представлен обзор современной зарубежной литературы по данной тематике.
Единственное пожелание, касающееся этой работы, — проведение хотя бы минимального катамнестического наблюдения за пациентками.
Эпилептические приступы при опухоли мозга
1. Примерно у 15—30% больных с метастатическими опухолями развиваются эпилептические припадки.
2. Лечение эпилептического статуса у больных этой группы не отличается от стандартной терапии этого состояния другого генеза, т. е. проводится интубация и внутривенное введение противосудорожных препаратов.
3. Препаратом для борьбы с припадками у больных с метастатическими опухолями мозга является фенитоин (дилантин).
Фенитоин пригоден как для внутривенного, так и для перорального применения.
Препарат хорошо переносится больными.
Длительный период полувыведения препарата позволяет применять фенитоин только один раз в сутки.
Большинству больных назначают фенитоин в дозе 300 мг/сут. внутрь.
Если у больного в течение предыдущих нескольких часов неоднократно были эпилептические припадки, необходимо внутривенно ввести фенитоин в дозе 15—20мг/кг (1000—1200 мг) или разделить эту дозу на три—четыре приема внутрь в течение 12—24 ч.
Терапевтические концентрации препарата
— Если препарат вводится внутривенно в дозе 15—20 мг/кг, терапевтический уровень (0,1—0,2 г/л) достигается уже в конце вливания.
— Если препарат в дозе 15-20 мг/кг вводится внутрь за один прием, то терапевтический уровень в крови достигается через 4—6 ч.
— Если пероральную дозу 15—20 мг/кг фенитоина делят на несколько приемов, то терапевтический уровень устанавливается только через 24 ч.
— Если фенитоин назначается в дозе 300 мг/сут., то терапевтический уровень в крови устанавливается только через 4—7 дней.
Если на фоне приема фенитоина припадки продолжаются, то его дозу необходимо увеличивать до тех пор, пока не появятся признаки интоксикации.
Если, несмотря на предпринятые меры у больного отмечаются припадки, необходимо определить уровень препарата в крови. Как правило, он не достигает терапевтического значения.
4. Если припадки не контролируются фенитоином, следует назначить карбамазепин (тегретол, финлепсин), постепенно доводя его дозу до 200 мг 3—4 раза в сутки внутрь, фенобарбитал (90—150 мг/сут.) или вальпроевую кислоту. Можно попробовать одно из новых противосудорожных средств, например, нейронтин или ламиктал. Когда припадки прекращаются, то фенитоин постепенно отменяют, т. к. второй препарат контролирует припадки.
5. За исключением больных меланомой, у 50% из которых развиваются припадки, нет общего мнения насчет необходимости профилактического лечения противосудорожными средствами пациентов с метастазами в головной мозг.
6. При метастазах в полость задней черепной ямки припадков не бывает.
7. Дексаметазон и фенитоин могут вступать в сложные реакции взаимодействия.
Могут потребоваться более высокие дозы препаратов при их совместном приеме.
При одновременном лечении дексаметазоном, фенитоином и облучением головного мозга повышается риск развития мультиформной эритемы или мульти-формной буллезной эритемы (синдрома Стивенса-Джонсона).
Хирургическое лечение метастазов рака в мозг
1. Больной с минимальными неврологическими нарушениями, с единичным ограниченным и доступным для хирургического лечения очагом, отсутствием системной активности болезни, большим промежутком времени между установлением диагноза первичной опухоли и развитием метастаза в мозг — идеальный кандидат для хирургического лечения.
2. При обструктивной гидроцефалии показана операция шунтирования.
3. Примерно у 10% больных раком объемное внутричерепное образование оказывается не метастатической опухолью. Это может быть первичная опухоль ЦНС, абсцесс или артериовенозная мальформация (АВМ). Поэтому при удобной локализации новообразования перед хирургическим вмешательством целесообразно выполнение биопсии.
4. Спорные вопросы
Повторная операция показана в том случае, если метастаз расположен в том же месте, где ранее была опухоль и инвазия вторичного новообразования в паренхиму минимальна.
Иссечение множественных метастатических новообразований. Если один или два из нескольких метастазов вызывают тяжелые симптомы и угрожают жизни больного, необходима паллиативная операция по их удалению. Результат операции такой же, как при иссечении единичного метастаза.
— Вернуться в оглавление раздела «Неврология.»