фиброз мягких оболочек головного мозга
Эпимакулярный фиброз
Автор:
Общие сведения
Эпимакулярный фиброз — медленно прогрессирующая возрастная патология, которая вызывает сильное ухудшение зрения. Характерный признак – наличие эпиретинальной мембраны (тонкой пленки), локализующейся преимущественно в центральной области сетчатки. Из-за этого наиболее характерным симптомом является снижение остроты зрения, однако существуют другие проявления патологии.
Достоверно причина развития эпимакулярного фиброза неизвестна. К факторам риска развития заболевания относятся перенесенные травмы глаза, оперативные вмешательства, патологические системные изменения и др.
Статистические данные указывают, что эпимакулярный фиброз чаще развивается у лиц пожилого возраста.
Так, у выборки пациентов в возрасте до 50 лет частота заболевания не превышает 2%. У лиц возрастом 75 лет — 20%.
Сейчас увеличивается актуальность вопроса о своевременной диагностике и подборе наиболее эффективного метода лечения.
На данный момент адекватной лечебной тактикой с выраженным положительным эффектом является только хирургическое вмешательство.
Этиология
Эпимакулярный фиброз — полиэтиологическое и многофакторное заболевание. Достоверно причина возникновения патологии неизвестна. Однако четко прослеживается зависимость частоты выявления эпимакулярного фиброза от возраста пациентов.
Существует прямая зависимость: чем старше пациент, тем более высокий риск формирования патологической эпимакулярной фиброзной мембраны.
Это связано с физиологическими изменениями глазного яблока, которые происходят с возрастом.
Основная причина развития эпимакулярного фиброза — отсоединение вещества стекловидного тела от поверхности сетчатки. Это сопровождается микротравмами, вследствие чего активизируется формирование соединительной ткани в месте повреждения.
Статистика также показывает, что к факторам риска развития эпимакулярного фиброза относится гиперхолестеринемия. Повышенный уровень липопротеидов низкой и очень низкой плотности в крови способствуют негативным структурным изменениям в сосудистой стенке, в частности в сосудах малого калибра, которые находятся в сетчатке глаза. Это нарушает трофику тканей, способствует появлению микротравм, что вызывает усиленное формирование соединительной ткани.
Показано, что эпимакулярный фиброз развивается чаще у людей с системными заболеваниями, напр. диабет (диабетическая ретинопатия), на фоне офтальмологических патологий (окклюзия вен сетчатки, отслойка сетчатки), после проведенных офтальмохирургических мероприятий.
Выделяют также идиопатическую форму заболевания, этиология которой неизвестна.
Патогенез
Основную массу глазного яблока составляет желеобразная структура — стекловидное тело, которое на 99% состоит из воды и занимает 2/3 от всего объема глаза. Формирует шарообразную структуру глаза и обеспечивает его внутреннее давление.
С возрастом количество воды в стекловидном теле постепенно уменьшается. Это естественный физиологический процесс. При этом может сформироваться небольшое пространство между сетчаткой глаза и стекловидным телом. Зачастую это не приводит к неприятным последствиям и протекает бессимптомно. Но иногда это приводит к микротравмам сетчатки.
Повреждения в сетчатой оболочке активируют процессы регенерации. Интенсивно формируется рубцовая ткань, которая плотно прилегает к сетчатой оболочке.
Отслоение задней стенки стекловидного тела способствует появлению микроразрывов на сетчатке. Постепенно формируется эпимакулярная фиброзная мембрана.
Небольшие повреждения внутренней пограничной мембраны, которые формируются после отслойки стекловидного, являются доступом для астроцитов в полость стекловидного тела. Они интенсивно разрастаются и также принимают участие в формировании эпимакулярной соединительнотканной мембраны.
Также существует идиопатический эпимакулярный фиброз, происхождение которого не выяснено.
В строении эпиретинальной мембраны участвуют:
Соединительнотканные структуры хуже пропускают световые лучи, чем прозрачные среды глаза, поэтому сформировавшаяся мембрана является препятствием прохождения света на пути к сетчатке.
Также, при изменении формы рубцовой ткани, изменяется структура и сетчатой оболочки (т.к. соединительная ткань плотно прилегает к сетчатке). Это искажает изображение, проецируемое на область сетчатки глаза.
Если такая соединительнотканная мембрана формируется в области желтого пятна, то существенно снижается острота центрального зрения.
Ухудшение остроты зрения зависит от плотности фиброзных образований и уровня деформации сетчатки (макулярные искажения).
Симптоматика
Характер и выраженность патологических симптомов при развитии эпимакулярного фиброза, которые испытывает пациент, преимущественно зависят от:
Клинические проявления заболевания развиваются постепенно. Скорость их прогрессирования обусловлена временем формирования мембраны, частотой микротравм сетчатки, их объемом и т.д.
Интенсивность клинических проявлений варьируется от скрытого или стертого течения до тяжелых нарушений со стороны зрения.
В начале развития заболевания возможно незначительное ухудшение зрения, которое проявляется слабым помутнением или искажением изображения. Нередко начальный этап протекает скрыто и бессимптомно, что способствует дальнейшему развитию патологии и нарастанию патологических проявлений.
Вместе с прогрессированием роста эпимакулярной фиброзной мембраны снижается острота зрения, изображение становится более мутным, предметы размыты. Однако это происходит медленно и больной практически не замечает изменений. Частой жалобой является появление незначительного искажения предметов.
В случае одновременного формирования фиброзной мембраны и локальной отслойки макулы значительно страдает острота зрения. Даже после оперативного лечения редко наблюдается полное восстановление остроты зрения.
Динамику нарастания патологической симптоматики разделяют на 3 стадии:
Такой отблеск может быть единственным симптомом начала развития заболевания и диагностируется случайно во время офтальмологического обследования.
В этом случае сморщивание макулы нередко сопровождается ретинальным отеком, мелкими кровоизлияниями, редкими отслойками желтого пятна.
Подобные мембраны носят название «морщинистой мембраны».
Диагностика
Оптическая когерентная томография глаза
Проводится для диагностики эпимакулярного фиброза и определения его стадии. Также позволяет объективно оценить негативные влияния фиброзной мембраны на макулу, напр. утолщение сетчатки в этой области, возможные тракционные влияния стекловидного тела на сетчатку.
Метод применятся в послеоперационном периоде для отслеживания заживления и восстановления архитектоники сетчатой оболочки после оперативного вмешательства.
Для проведения лечения наша клиника предлагает своим пациентам целый комплекс современных аппаратов и методик, позволяющих гарантированно в кратчайшие сроки добиться наилучших результатов.
Лечение

Хирургическое лечение эпимакулярного фиброза — не экстренная операция. Ее проводят в плановом порядке.
Существует много оперативных методик лечения этого заболевания, однако в них выделяют основные этапы:
Преимущества данного этапа:
2. Непосредственное удаление эпиретинальной мембраны. После нахождения внешнего края фиброзной мембраны тонким пинцетом аккуратно приподнимается ее край под углом. Недопустимо приподнятие края перпендикулярно из-за риска появления микроразрывов сетчатки!
Движениями пинцета по кругу хирург осуществляет удаление, постепенно отслаивая мембрану от периферии к центру.
3. Удаление внутренней пограничной мембраны.
4. Лечение микроразрывов сетчатки. После удаления фиброзной мембраны внутренняя поверхность сетчатки тщательно осматривается для выявления ее повреждений и разрывов. После определения их локализации хирург производит лазерную ретинопексию или криоретинопексию (в случае если разрывы не отягощены скоплением субретинальной жидкости).
Если такое скопление есть, то производится внутренний дренаж под газовой тампонадой или давлением воздуха.
В послеоперационном периоде производится бинокулярная повязка, которая обеспечивает благоприятные условия для заживления операционных ран.
Периодически необходимы осмотры и консультации офтальмолога для мониторинга восстановления сетчатки и своевременной диагностики осложнений, если таковые имеются.
О причинах возникновения и лечении эпиретинальной мембраны смотрите в видео
Наши цены
Стоимость лечения зависит от выбранного метода (аппаратное или хирургическое), количества рекомендованных процедур и т.д. Комплексное обследование в нашей клинике от 4 000 руб. С ценами на все виды диагностических исследований, процедур на аппаратах и хирургические вмешательства можно посмотреть здесь.
Уточнить все интересующие подробности, цены на услуги и записаться на консультацию к специалисту Вы можете по телефонам: 8(800)777-38-81 (звонок бесплатный для всех телефонов РФ) и московскому номеру 8(499)322-36-36 или онлайн, воспользовавшись соответствующей формой на сайте.
location_on Семёновский переулок, дом 11 (м.Семеновская)
Фиброз мягких оболочек головного мозга
Специалисты ОСП «НИКИП им.Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова МЗ РФ и Бюро судебно-медицинской экспертизы ДЗМ представили клинический случай синдрома Элерса–Данло в связи с редкостью данной патологии, тяжестью течения болезни, неблагоприятным прогнозом для жизни, а также плохим знанием врачей этого редкого заболевания авторы привели краткую выписку из истории болезни пациента.
Мальчик М., 16,5 лет поступил в клинику впервые с жалобами на утомляемость, периодические боли в верхних и нижних конечностях, особенно после физической нагрузки, повторяющиеся спонтанные разрывы сосудов среднего калибра. В возрасте 15,5 лет разрыву подверглась правая подмышечная артерия. Хирургами, проводившими операцию, было высказано предположение о наличии у ребенка моногенного заболевания соединительной ткани
При анализе родословной установлено, что родителям ребенка по 42 года; они здоровы, профессиональных вредных факторов не имеют. В родословной семьи зарегистрированы случаи ишемической болезни сердца и сахарного диабета 2-го типа. Мальчик от второй беременности, вторых срочных физиологических родов. Первая беременность у женщины закончилась рождением здоровой девочки, которой в настоящее время 21 год. Вторая – настоящая, протекала с угрозой прерывания в 14 нед. Масса тела при рождении ребенка составляла 3050 г, длина тела – 49 см; оценка по шкале Апгар 8/9 баллов. В периоде новорожденности была диагностирована конъюгационная желтуха, перинатальная энцефалопатия, повышенная нервно-рефлекторная возбудимость; в возрасте 1,5 года оперирован по поводу пупочной грыжи. Находился под наблюдением невролога с диагнозом гипертензионно-гидроцефальный синдром. С 9 мес до 4 лет получал лечение по поводу атопического дерматита и обструктивного бронхита. В 5 лет у мальчика был диагностирован неспецифический язвенный колит, подтвержденный морфологически.
С трехлетнего возраста регистрировалась неадекватная реакция организма на полученные травмы: левосторонний травматический средний отит (3 года), гемартроз правого коленного сустава (5 лет), посттравматическая гематома мягких тканей левого бедра (15,5 лет); спустя несколько месяцев во время выполнения физических упражнений на турнике произошел спонтанный разрыв правой подмышечной артерии. Попытки хирургического восстановления разорванной артерии в условиях высокоспециализированной хирургической клиники были безрезультатны. Вследствие продолжающегося массивного кровотечения состояние ребенка становилось критическим, и из-за угрозы жизни хирургами было принято решение о перевязке правой подключичной артерии. Данная операция неизбежно привела к нарушению функции и потери чувствительности правой руки.
Морфологические исследования стенки правой подмышечной артерии выявили ее грубые анатомические дефекты: коллагеновые волокна поврежденного сосуда были представлены в виде тонких немногочисленных нитей. Анализ полученных гистологических срезов явился неоспоримым критерием правильности выбранной тактики хирургического лечения. После проведенного комплекса восстановительной терапии и реабилитационных мероприятий мальчик был направлен в клинику врожденных и наследственных заболеваний НИКИ педиатрии им. акад. Ю.Е. Вельтищева для подтверждения диагноза моногенного заболевания соединительной ткани и уточнения нозологической формы.
При поступлении в отделение состояние ребенка было средней тяжести по совокупности клинических симптомов основного заболевания. Показатели физического развития дисгармоничны: рост 156 см (10–25-й перцентиль), масса тела 51,8 кг (25– 50-й перцентиль).
Обращали внимание следующие фенотипические особенности ребенка: гиперподвижность крупных и мелких суставов (за исключением посттравматических контрактур правой руки), повышенная растяжимость кожи с наличием преимущественно келоидных рубцов, наиболее выраженных в области правого плечевого сустава и верхней части грудной клетки справа, положительный признак Горлина (способность достать языком кончик собственного носа), свидетельствующий о гиперэластичности слизистых оболочек; умеренная деформация грудной клетки, сколиоз грудопоясничного отдела позвоночника I степени, плоско-вальгусная установка стоп. Окулистом диагностированs гиперметропия слабой степени и спазм аккомодации обоих глаз.
Обследование сердца с помощью функциональных методов выявило миграцию водителя ритма, брадиаритмию с частотой сердечных сокращений 55–71 уд/мин. По данным эхокардиографии обнаружены пролапс митрального клапана, дисфункция хорд трикуспидального клапана, дополнительные трабекулы в левом желудочке. При магнитно-резонансной (МР) ангиографии аорты не зарегистрировано аневризматических расширений грудной и брюшной аорты. Данные, свидетельствующие о нарушении целостности интимы, отсутствовали. МР-ангиография артерий головного мозга не выявила аневризматических расширений экстра-/интракраниальных артерий.
По результатам ультразвукового исследования (УЗИ) органов брюшной полости и почек констатированы реактивные изменения сосудов и протоков печени, увеличение желчного пузыря и утолщение его стенок, спленомегалию, косвенные признаки гастродуоденита, диффузные изменения поджелудочной железы и паренхимы почек. Результаты УЗИ правого плечевого сплетения, правых локтевого, срединного и лучевого нервов свидетельствовали о выраженном диффузном внутриствольном тракционном повреждении пучков правого плечевого сплетения без разрыва нервных стволов. По данным электронейромиографии не был зарегистрирован М-ответ в мышцах правого предплечья и кисти. Рентгенологические исследования костей голеней с захватом коленных суставов обнаружили умеренный остеопороз, больше выраженный в метафизах.
Данные анамнеза и совокупность фенотипических признаков свидетельствовали о наличии у ребенка моногенного заболевания соединительной ткани – синдрома Элерса–Данло, представляющего собой генетически-гетерогенную патологию. Тяжелые сосудистые нарушения характерны для сосудистого типа синдрома, однако встречаются и при других типах: гематомы – при мышечно-контрактурном и классико-подобном типах, внутричерепные кровоизлияния – при дерматоспараксис-типе, диссекция артерий – при классическом и кифосколиотическом типах. Менее грозные сосудистые осложнения регистрируются при сердечно-клапанном, артрахалазисном, спондилодиспластическом, периодонтальном типах синдрома. В связи с этим для уточнения диагноза требовался анализ группы генов.
Молекулярно-генетическое исследование, выполненное в лаборатории «Генотек» с использованием панели «Заболевания соединительной ткани», подтвердило наличие у ребенка сосудистого типа синдрома Элерса–Данло. В гене COL3A1 (экзон 35) была обнаружена мутация сайта-сплайсинга c.2445+5G>A p.Gly798_Pro 815 del. Согласно Международной базе данных, детектированная мутация относится к патогенным и ответственна за формирование тяжелой клинической симптоматики. Наличие мутации у ребенка было подтверждено методом прямого секвенирования по Сэнгеру. Отсутствие детектированной мутации у родителей мальчика свидетельствовало о ее возникновении de novo. По результатам генетического анализа членам семьи пробанда было проведено медико-генетическое консультирование.
Оценка клинических данных показала, что у ребенка был только один большой диагностический критерий сосудистого типа синдрома Элерса–Данло (разрывы сосудов в молодом возрасте) и один малый критерий (гипермобильность суставов).
За время пребывания в клинике мальчик получал терапию, направленную на укрепление сосудистой стенки, стимуляцию и нормализацию энергетического и минерального обменов (аскорутин, элькар, коэнзим Q10, метаболиты витамина D, остеогенон), комплекс реабилитационных методов для восстановления функций поврежденной конечности. После выписки из стационара было рекомендовано продолжить курс реабилитационных мероприятий с использованием физиотерапевтических и бальнеопроцедур под наблюдением специалистов: невропатологов, ортопедов, сосудистых хирургов. Через 10–12 мес планировалась повторная госпитализация в клинику. Однако через 10 мес ребенок скоропостижно скончался вследствие диссекции брюшной аорты и правой почечной артерии. В течение последнего месяца мальчик жаловался на повышенную утомляемость.
Вскрытие тела было проведено судебно-медицинским экспертом танатологического отделения №1 г. Москвы. Судебно-гистологический диагноз: продольные расслоения стенок аорты в средней оболочке с фрагментацией волокон и почечной артерии на границе средней и наружной оболочек; кровоизлияния в дефектах и периваскулярных тканях без лейкоцитарной реакции. Отек ткани головного мозга. Очаги фрагментации кардиомиоцитов. Очаги эмфиземы и дистелектаза легкого, бронхоспазм. Неравномерное кровенаполнение внутренних органов; субэпикардиальное мелкоочаговое кровоизлияние; кровоизлияние в окружающей клетчатке надпочечника. Умеренно выраженный фиброз мягкой мозговой оболочки. Фиброз, деформация и дистрофия волокон митрального клапана. Дистрофические изменения кардиомиоцитов. Хронический бронхит. Белковая дистрофия печени. Дистрофия почки. Фолликулярная дистрофия тимуса. Дистрофические изменения надпочечников. Очаговый фиброз дермы в участке кожи.
Судебно-медицинский диагноз. Основное заболевание: системное заболевание соединительной ткани, неуточненное – стрии на кожном покрове, келоидные рубцы, гипермобильность суставов кистей, искривление грудной клетки, участки утолщения стенки аорты, миксоматоз митрального клапана, кровоподтеки туловища и конечностей, внутрикожные кровоизлияния. Осложнения основного заболевания: расслоение брюшной аорты и правой почечной артерии с разрывом; массивная забрюшинная гематома, гемоперитонеум (1000 мл). Малокровие внутренних органов. Дистрофические изменения кардиомиоцитов. Сопутствующие заболевания: арахнофиброз; хронический бронхит; белковая дистрофия печени; дистрофия почки; фолликулярная гиперплазия тимуса.
Таким образом, история болезни ребенка с сосудистым типом синдрома Элерса–Данло продемонстрировала тяжесть течения заболевания, закончившегося скоропостижным летальным исходом из-за разрыва сосудов крупного и среднего калибра – аорты и почечной артерии. Неадекватная реакция организма даже на незначительные физические травмы была очевидной с достаточно раннего возраста (с 3 лет). Больным с сосудистым типом синдрома категорически противопоказаны физические нагрузки. Попытка ушивания разорвавшегося сосуда в условиях высокоспециализированного стационара из-за анатомо-гистологических особенностей сосудистой стенки не могла быть успешной и едва не стоила ребенку жизни. Не исключено, что перевязка по жизненным показаниям крупного сосуда (правосторонней подключичной артерии) повысила нагрузку на другие крупные сосуды, в том числе на аорту, что привело к расслоению ее стенки и обширному, не совместимому с жизнью разрыву.
Сосудистый тип синдрома Элерса–Данло – крайне тяжелое моногенное заболевание соединительной ткани, требующее постоянного динамического наблюдения большой группы медицинских специалистов различного профиля: генетиков, педиатров, терапевтов, кардиологов, пульмонологов, хирургов-ортопедов и сосудистых хирургов, акушеров-гинекологов (для больных женского пола). Результаты представленного наблюдения свидетельствуют, что во избежание пропуска больных целесообразно пересмотреть минимальный набор признаков, необходимых для установления клинического диагноза. Семьям, имеющим больных с сосудистым и другими типами синдрома Элерса–Данло, показано эффективное медико-генетическое консультирование.
К патоморфологии головного мозга при алкогольной интоксикации
Кафедра судебной медицины (зав. — доц. А.Н. Самойличенко) Карагандинского медицинского института и кафедра судебной медицины (зав. — проф. А.П. Громов) I Московского медицинского института им. И.М. Сеченова
К патоморфологии головного мозга при алкогольной интоксикации. Галеева Л.Ш. Суд.-мед. эксперт., 1974, № 3, с. 30.
У лиц, страдавших хроническим алкоголизмом, обнаружены однотипные характерные изменения сосудов, нейронов и глии. Гистологическое исследование головного мозга можно использовать для диагностики хронического алкоголизма в судебно-медицинской практике.
CEREBRAL PATHOMORPHOLOGY IN ALCOHOLIC INTOXICATION
The brains in cases of acute alcoholic intoxication and brains of patients who had died in a state of acute alcoholic delirium were studied histologically. Characteristic features permitting a postmortem nosological medico-legal diagnosis of chronic alcoholics are demonstrated.
библиографическое описание:
К патоморфологии головного мозга при алкогольной интоксикации / Галеева Л.Ш. // Судебно-медицинская экспертиза. — М., 1974. — №3. — С. 30-33.
код для вставки на форум:
Исследовали головной мозг и внутренние органы 41 трупа лиц в возрасте от 22 до 40 лет, страдавших хроническим алкоголизмом, умерших от острого отравления этанолом. Материал разделен на две группы: 1) 30 трупов лиц (22 мужчин и 8 женщин), умерших от острого отравления этиловым спиртом, 2) 11 трупов мужчин, умерших в стационаре в состоянии острого алкогольного делирия. К первой группе отнесены случаи смерти, при которых методом газо-жидкостной хроматографии установлено в крови свыше 4,0‰, в моче — 4,5‰ этилового спирта, гистологическое исследование исключало наличие соматических заболеваний, а следственные материалы свидетельствовали о злоупотреблении спиртными напитками на протяжении 5—7 лет.
Исследовали кору (лобной, теменной, височной, затылочной областей), полосатое тело, зрительный бугор, подбугорье, ножки мозга, варолиев мост, продолговатый мозг, мозжечок, окрашивали по Нисслю, Снесареву, Кахалю, Мийагава — Александровской, Шпильмейеру, ван Гизону, гематоксилин-эозином.
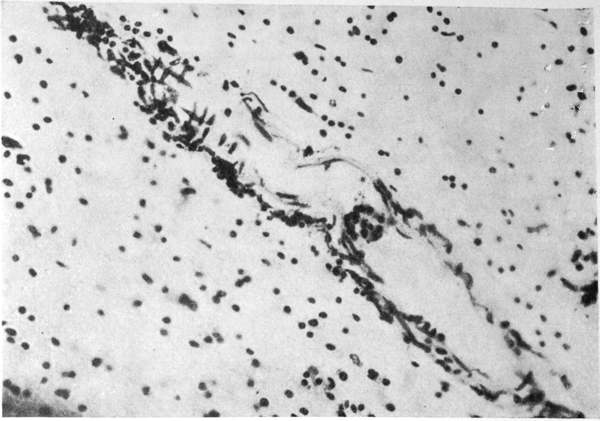
При гистологическом исследовании внутренних органов лиц, умерших от острого отравления этиловым спиртом, не обнаружено закономерно повторяющихся структурных изменений, которые можно было бы связать с хроническим алкоголизмом. В миокарде обнаруживали мелкоочаговые периваскулярные склеротические изменения; в печени — очаговую или диффузную жировую инфильтрацию без выраженного цирроза; в надпочечниках — истончение коры, накопление в ней бурого пигмента и наличие аденоматозных гиперпластических узелков. Более четко и постоянно в этой группе наблюдали острые нарушения гемодинамики — общее венозное полнокровие, точечные кровоизлияния в серозных и слизистых оболочках. В головном мозге всегда находили значительный фиброз мягких мозговых оболочек, острое венозное полнокровие, отек и набухание вещества мозга. Гистологически обнаружили однотипную картину тяжелого диффузно распространенного поражения всех структурных элементов мозга, но главным образом страдали сосуды и нервные клетки. Сосудистые изменения проявлялись хроническими нарушениями проницаемости с исходом в гиалиноз и фиброз, значительной пролиферацией адвентициальных эндотелиальных клеток (рис. 1 см. на вклейке). Наибольшие изменения сосудов обнаружены в молекулярном слое коры больших полушарий, в белом веществе, в зоне зубчатых ядер мозжечка.
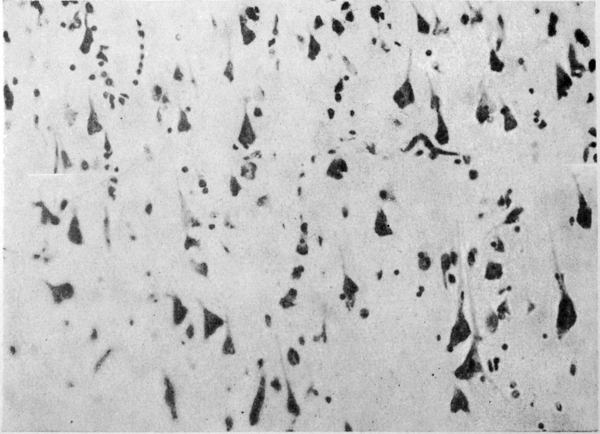
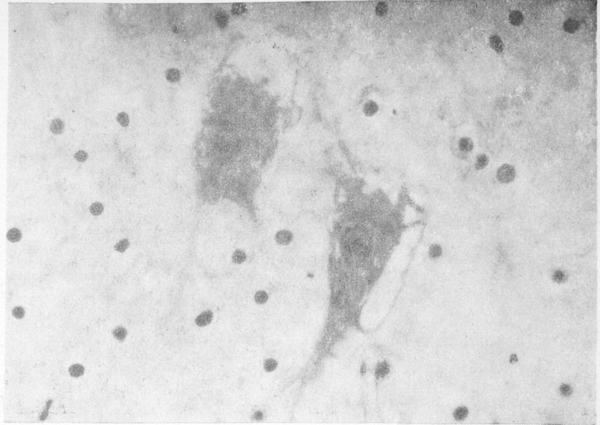
Изменения нервных клеток прослеживались на всех уровнях головного мозга, но преобладали в коре больших полушарий, зубчатых ядрах мозжечка, полосатых телах, в ретикулярной формации стволовых отделов. Среди изменений доминировали разновидности хронического повреждения: простое и липоидное сморщивание, интенсивная пигментная дистрофия. Наблюдалась резкая разреженность нервных клеток коры больших полушарий, особенно вокруг сосудов, обусловленная интенсивным кариоцитолизом (рис. 2 см. на вклейке), она отчасти маскировалась заместительным размножением глиальных клеток. Реже встречалось гидропическое изменение и острое набухание нейронов. Вблизи сосудов располагались небольшие группы ишемически измененных нейронов, а в зубчатых ядрах мозжечка — резко измененные нейроны с деформированным неравномерно окрашенным вакуолизированным телом, угловатым базофильным ядром, плохо различимым ядрышком (рис. 3 см. на вклейке). В целом тяжесть и распространенность сосудистых и нервноклеточных изменений соответствовали друг другу. В миелиновых оболочках, аксонцилиндрах и внутриклеточных нейрофибриллах грубых и закономерных изменений не выявлено.
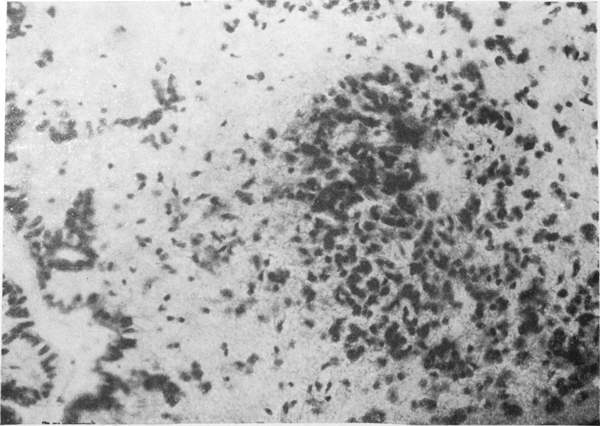
Реакцию нейроглии можно охарактеризовать как продуктивную, поскольку постоянно обнаруживали размножение всех видов глиальных клеток. Наиболее интенсивно пролиферировала олигодендроглия и астроцитарная глия, особенно по ходу сосудов и вблизи ликвороносных путей мозга — стенок желудочков мозга, молекулярного слоя коры (рис. 4 см. на вклейке).
Таким образом, при остром отравлении этиловым спиртом на фоне хронического алкоголизма в головном мозге развивается тяжелая диффузная хроническая токсикогипоксическая энцефалопатия (П.Е. Снесарев, 1950).
Она обладает настолько яркой и закономерной морфологической картиной, что ее можно использовать в сочетании с клиническими данными для установления хронического алкоголизма.
При изучении 11 наблюдений алкогольного делирия также не обнаружили интеркуррентных заболеваний. Непосредственной причиной смерти явилась быстро нарастающая сердечно-сосудистая недостаточность.
Гемодинамические расстройства во внутренних органах проявлялись множественными стазами, диапедезными кровоизлияниями и глубокими острыми дистрофическими изменениями. В печени была резко выражена жировая дистрофия с множественными мелкими очагами острого некроза. В надпочечниках имелся выраженный делипоидоз коры, в гипофизе — распространенный лизис, дегрануляция и вакуолизация базофилов. В остальных органах обнаружена картина мутного набухания.
Состояние головного мозга характеризовалось глубокими гемо- и ликвородинамическими нарушениями. Мягкие оболочки и ткань мозга были резко застойно полнокровны. В белом веществе больших полушарий обнаружены свежие точечные кровоизлияния. Во всех случаях найден умеренный фиброз мягких оболочек. В 7 случаях вещество мозга было резко отечным, в 4 — набухшим. Никаких свежих и давних очаговых изменений головного мозга не найдено.
При сравнении изменений в головном мозге при алкогольном делирии и остром отравлении этиловым спиртом общими в обеих группах оказались сосудистые и нервноклеточные изменения: гиалиноз, фиброз, хронические нарушения сосудистой проницаемости, продуктивные изменения сосудов; простое и липоидное сморщивание нейронов, перегрузка липофусцином, резкая разреженность нервных клеток коры, продуктивные изменения глии.
В отличие от острого алкогольного отравления при делирии на первый план выступали морфологические признаки острой токсикогипоксической энцефалопатии. Острые изменения сосудов составляли наиболее яркую сторону гистопатологии мозга. Отмечалась чрезвычайная интенсивность нарушений тонуса и проницаемости стенок сосудов, «фибриноидная» трансформация сосудистой стенки с резким набуханием и базофилией межуточного вещества, гибелью клеточных элементов, обильной транссудацией белка за пределы сосудов. Острые изменения нервных клеток заключались в резком кариоцитолизе, выраженном остром набухании нейронов с признаками ишемии (нарастающая базофилия и деформация ядра с обесцвечиванием цитоплазмы). Следует отметить постоянство и распространенность типично ишемических изменений нейронов. Все эти острые и хронические нейрональные сдвиги распространены диффузно. Вместе с тем всегда наиболее тяжело повреждались кора больших полушарий, полосатые тела, зубчатые ядра мозжечка, некоторые области ретикулярной формации. В нейроглии на фоне пролиферации возникали грубые дистрофические изменения: амебоидоз, зернистоглыбчатый распад и вакуолизация астроцитов, варикозность и фрагментация отростков микроглии и олигодендроглии. Совокупность этих признаков при алкогольном делирии свидетельствует о тяжелой острой токсикогипоксической энцефалопатии (В.П. Курковский, 1946, 1955; М.М. Александровская, 1950, 1955; В.А. Неговский, 1954).
Следовательно, для алкогольного делирия характерно явное преобладание паренхиматозных изменений над сосудистыми.
При алкогольном делирии отмечены характерные изменения гипоталамической области. В 7 наблюдениях найдена повышенная активность секреторных нейронов переднего подбугорья: хроматолиз, набухание цитоплазмы, круглоячеистая ее вакуолизация, увеличение размеров и просветвление ядер. В 4 случаях преобладали признаки угнетения этих клеток или их инертность — клетки не менялись в размерах, содержали обычное или повышенное количество тигроида, ядра были мелкими с тенденцией к базофилии. Всегда обнаруживали гибнующие нейросекреторные нейроны и дистрофически измененные — с мелкой ячеистой вакуолизацией краевых отделов цитоплазмы, с базофилией или пикнозом ядра. Вне зависимости от того, преобладала ли активность нейросекреторных нейронов с их истощением или торможение секреторного процесса и дистрофия клеток, можно говорить о глубокой недостаточности нейросекреторных элементов. Возможно, эта патология лежит в основе тяжелых гемодинамических и вегетативных расстройств, характерных для алкогольного делирия.
Таким образом, при алкогольном делирии на фоне хронических структурных изменений, свойственных хроническому алкоголизму, в головном мозге развиваются тяжелые острые токсикогипоксические нарушения, характер которых свидетельствует о ведущей роли прямого или опосредованного гистотоксического воздействия алкоголя. Эти же данные говорят о том, что в танатогенезе алкогольного делирия решающую роль играют глубокие морфофункциональные изменения адаптационных систем организма (И.В. Стрельчук, 1970).
Выводы
Рис. 1. Фиброз стенки мелкой артерии и периваскулярная лимфоидная инфильтрация в белом веществе лобной доли. Окраска по Нисслю. Ув. 200×.
Рис. 2. Резкое разрежение коры лобной доли, сморщивание и лизис нервных клеток. Окраска по Нисслю. Ув. 200×.
Рис. 3. Тяжелое изменение клеток зубчатого ядра мозжечка с расплавлением цитоплазмы. Окраска по Нисслю. Иммерсия.
Рис. 4. Очаговая пролиферация глии в субэпендимальном отделе продолговатого мозга. Окраска по Нисслю. Ув. 300×.
похожие статьи
Патоморфологические изменения внутренних органов при сочетанной интоксикации алкоголем и наркотиками / Гиголян М.О., Штарберг А.И., Черемкин М.И. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2019. — №18. — С. 58-61.