fish исследование костного мозга
Fish исследование костного мозга
Современный метод цитогенетического анализа, позволяющий определять качественные и количественные изменения хромосом (в том числе транслокации и микроделеции) и используемый для дифференциальной диагностики злокачественных заболеваний крови и солидных опухолей.
Флуоресцентная гибридизация in situ
Fluorescence in-situ hybridization
Флуоресцентная гибридизация in situ.
Какой биоматериал можно использовать для исследования?
Образец ткани, образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Флуоресцентная гибридизация in situ (FISH, от англ. fluorescence in—situ hybridization) – это один из самых современных методов диагностики хромосомных аномалий. Он основан на использовании ДНК-проб, меченных флуоресцентной меткой. ДНК-пробы представляют собой специально синтезированные фрагменты ДНК, последовательность которых комплементарна последовательности ДНК исследуемых аберрантных хромосом. Таким образом, ДНК-пробы различаются по составу: для определения разных хромосомных аномалий используются разные, специфические ДНК-пробы. ДНК-пробы также различаются по размеру: одни могут быть направлены к целой хромосоме, другие – к конкретному локусу.
В ходе процесса гибридизации при наличии в исследуемом образце аберрантных хромосом происходит их связывание с ДНК-пробой, которое при исследовании с помощью флуоресцентного микроскопа определяется как флуоресцентный сигнал (положительный результат FISH-теста). При отсутствии аберрантных хромосом несвязанные ДНК-пробы в ходе реакции «отмываются», что при исследовании с помощью флуоресцентного микроскопа определяется как отсутствие флуоресцентного сигнала (отрицательный результат FISH-теста). Метод позволяет оценить не только наличие флуоресцентного сигнала, но и его интенсивность и локализацию. Таким образом, FISH-тест – это не только качественный, но и количественный метод.
FISH-тест обладает рядом преимуществ по сравнению с другими методами цитогенетики. В первую очередь, исследование FISH может быть применено как к метафазным, так и к интерфазным ядрам, то есть к неделящимся клеткам. Это основное преимущество FISH по сравнению с классическими способами кариотипирования (например, окрашиванием хромосом по Романовскому-Гимзе), которые применяются только к метафазным ядрам. Благодаря этому исследование FISH является более точным методом для определения хромосомных аномалий в тканях с низкой пролиферативной активностью, в том числе в солидных опухолях.
Так как в FISH-тесте используется стабильная ДНК интерфазных ядер, для исследования могут быть использованы самые различные биоматериалы – аспираты тонкоугольной аспирационной биопсии, мазки, аспираты костного мозга, биоптаты и, что немаловажно, сохраненные фрагменты ткани, например гистологические блоки. Так, например, FISH-тест может быть с успехом выполнен на повторных препаратах, полученных из гистологического блока биоптата молочной железы при подтверждении диагноза «аденокарцинома молочной железы» и необходимости определения HER2/neu-статуса опухоли. Следует особо подчеркнуть, что в данный момент исследование FISH рекомендовано в качестве подтверждающего теста при получении неопределенного результата иммуногистохимического исследования опухоли на онкомаркер HER2/neu(ИГХ 2+).
Другим преимуществом FISH является его способность определять микроделеции, которые не выявляются с помощью классического кариотипирования или ПЦР. Это имеет особое значение при подозрении на синдром Ди Джорджи и велокардиофациальный синдром.
FISH-тест широко используется в дифференциальной диагностике злокачественных заболеваний, в первую очередь в онкогематологии. Хромосомные аномалии в сочетании с клинической картиной и данными иммуногистохимического исследования являются основой классификации, определения тактики лечения и прогноза лимфо- и миелопролиферативнх заболеваний. Классическими примерами являются хронический миелолейкоз – t (9;22), острый промиелоцитарный лейкоз – t (15;17), хронический лимфолейкоз – трисомия 12 и другие. Что касается солидных опухолей, наиболее часто FISH-исследование применяется при диагностике рака молочной железы, мочевого пузыря, толстой кишки, нейробластомы, ретинобластомы и других.
Исследование FISH также может быть использовано в пренатальной и преимплантационной диагностике.
FISH-тест часто проводят в сочетании с другими методами молекулярной и цитогенетической диагностики. Результат этого исследования оценивают в комплексе с результатами дополнительных лабораторных и инструментальных данных.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Что может влиять на результат?
Кто назначает исследование?
Онколог, педиатр, акушер-гинеколог, врач-генетик.
Fish исследование костного мозга
Цитогенетическое исследование — это микроскопический анализ хромосом, результаты которого весьма важны для постановки диагноза, классификации, лечения и научного исследования заболеваний системы крови, прежде всего — онкогематологических. Значение цитогенетических методов для диагноза и лечения определяется доступностью опухолевых клеток для кариотипирования и их гетерогенностью, а с научной точки зрения — возможностью изучения изменений в структуре и функции генетических локусов, ассоциированных со злокачественной трансформацией.
Морфология хромосом сильно варьирует во время клеточного цикла. Для микроскопического анализа хромосомы должны быть визуализированы как дискретные структуры. Наилучшим образом это достигается на стадии прометафазы митоза, когда каждая хромосома видна как две идентичные хроматиды, и особенно на стадии метафазы, когда хромосомы максимально конденсированы и располагаются в одной плоскости в центре клетки отдельно одна от другой.
Нормальные клетки человека содержат 22 пары аутосом и одну пару половых хромосом: две Х-хромосомы у женщин и по одной копии половых хромосом (X и Y) у мужчин.
Для цитогенетического анализа лейкозов, миелодиспластических синдромов и хронических миелопролиферативных заболеваний исследуют клетки костного мозга. При невозможности их получения может быть исследована кровь (если она содержит бласты). Цитогенетический анализ лимфом выполняется в клетках ткани лимфатического узла. Культивирование клеток из опухоли повышает митотический индекс (пропорцию клеток, находящихся в фазе митоза) и способствует пролиферации злокачественных клеток.
Сравнительное кариотипирование нормальных клеток проводят в Т-лимфоцитах периферической крови, которые предварительно культивируют в среде с митогеном растительного происхождения — фитогемагглютинином.
Окрашивание хромосом в гематологии
В конце 1960-х годов была разработана методология дифференциального окрашивания метафазных хромосом, а в 1971 г. создана номенклатура хромосомных сегментов, позволяющая точно описывать хромосомные аномалии. Позднее были внедрены методики окрашивания менее конденсированных и, соответственно, более длинных профазных и прометафазных хромосом, которые обладают более высоким разрешением, так как позволяют визуализацию 500-2000 сегментов (метафазное окрашивание визуализирует только 300 сегментов).
Достаточно большое количество профазных и прометафазных клеток для анализа получают путем синхронизации клеточного цикла, культивируя клетки в среде, содержащей антиметаболит (например, метотрексат), который ингибирует синтез ДНК. Подавление синтеза ДНК останавливает клеточный цикл в интерфазе. Затем клетки переносят в среду без метотрексата, обогащенную тимидином, где они одновременно входят в фазу митоза. Обработка клеточной культуры колхицином останавливает митоз одновременно во всех клетках на стадии профазы или прометафазы.
Первая стойкая хромосомная аномалия при злокачественной опухоли человека была выявлена в 1960 г. у больных хроническим миелолейкозом и получила название филадельфийской хромосомы (Ph), по имени города, в котором было сделано это открытие. Применение технологии хромосомного окрашивания позволило выявить множество хромосомных аномалий, большая часть которых встречается при онкогематологических заболеваниях. Некоторые красители окрашивают различные участки хромосом с вариабельной интенсивностью в зависимости от структуры хроматина в этих участках, их нуклеотидного и белкового состава.
В результате такого окрашивания получают уникальный паттерн чередования светлых и темных поперечных полос, специфичный для каждой хромосомы.
В настоящее время существуют несколько видов дифференциального окрашивания хромосом. При Q-окрашивании акрихин-ипритом (quinacrine) или акрихиндигидрохлоридом выявляется особый тип флюоресценции каждой хромосомы с образованием Q-исчерченности (Q-banding) — поперечных флюоресцентных полос, называемых Q-полосами (Q.-bands). Это позволяет идентифицировать отдельные хромосомы. Анализ Q-полос выполняют с помощью флюоресцентного микроскопа.
При окрашивании по Гимзе (G-banding) хромосомы приобретают вид серии темных и светлых полос или бэндов (bands). G-окрашивание применяется чаще, чем Q-окрашивание, так как анализ выполняется с помощью светового микроскопа, а G-полосы, в отличие от Q-полос, не выцветают со временем. Наиболее широко применяется методика, называемая GTG-окрашиванием (G bands by trypsin using Giemsa), с предварительной обработкой трипсином.
R-бэндинг (обработка хромосом горячим спиртовым раствором перед окрашиванием по Гимзе) выявляет полосы, которые обратны G-полосам и называются R-полосами (reverse of G bands).
Помимо Q-, G- и R-окрашивания, позволяющих выявлять полосы вдоль всей длины хромосомы, существуют методики, специализированные для исследования отдельных хромосомных структур, в том числе конститутивного гетерохроматина (С-окрашивание — от англ. constitutive), теломерного района (Т-окрашивание) и района ядрышкового организатора (NOR-окрашивание — от англ. nucleolus organizing region). Размеры и положение С-полос уникальны для каждой хромосомы, но преимущественно они включают центромерныи район и используются при исследовании хромосомных транслокаций, вовлекающих центромерные районы хромосом.
Цитогенетический анализ опухолевых клеток затруднен в связи с неясной морфологией хромосом и слабой различимостью полос. Если в исследование взяты наиболее удобные для анализа метафазные пластинки, образец может быть ошибочно охарактеризован как цитогенетически нормальный.
С развитием методов рекомбинантной ДНК стало возможным использование гибридизации in situ для определения местоположения на хромосомах или в клеточном ядре любой ДНК- и РНК-последовательности. С ее помощью можно изучать и диагностировать онкологические и наследственные генетические болезни. Молекулярная гибридизация in situ является важным инструментом цитогенетических исследований, позволяет выявлять хромосомные перестройки, идентифицировать маркерные хромосомы, проводить быстрое кариотипирование клеточных линий. Важно, что подобный анализ можно проводить не только на метафазных хромосомах, но и на интерфазных ядрах.
Разрешающая способность «интерфазной цитогенетики» на два порядка выше, чем классической цитогенетики.
Несмотря на многоцелевое использование молекулярной гибридизации ДНК-ДНК (РНК) in situ, все модификации метода выполняются в соответствии с общими принципами. Существуют несколько вариантов, которые включают в себя несколько этапов: подготовка и мечение ДНК (РНК)-зонда, приготовление препаратов хромосом, собственно гибридизация, детекция гибридных молекул.
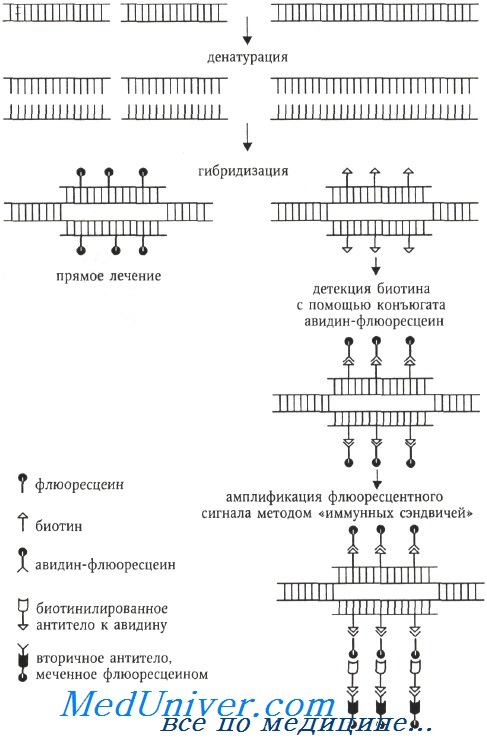
В 1980-х годах цитогенетическая методология обогатилась молекулярно-цитогенетическим методом, называемым флюоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), который вскоре стал наиболее популярным. Суть этого метода заключается в гибридизации ДНК-зондов к специфическим последовательностям ДНК, меченных флюорохромами, с метафазными или интерфазными хромосомами, которые визуализируются флюоресцентной микроскопией. Определение нуклеотидной последовательности методом FISH выполняется непрямым способом, путем гибридизации синтетического олигонуклеотида (зонда) с анализируемой ДНК (называемой также матричной ДНК или ДНК-мишенью).
Если зонд синтезирован с включением флюоресцентных или антигенных молекул, которые распознаются флюоресцирующими антителами, становится возможной визуализация относительного положения зонда на анализируемой ДНК.
Флюорохром может быть связан с ДНК ковалентно (прямое мечение) или посредством иммуноцитохимических реакций, когда ДНК-зонд метят гаптеном (биотин, дигоксигенин), а флюорохром связан с алкалоидом авидином (стрептавидином), обладающим сильным сродством к биотину (или с антителами против биотина или дигоксигенина). При использовании гаптенов возможна амплификация флюоресцентного сигнала с помощью биотинилированных антител к авидину и вторичных антител, специфичных предыдущему слою антител и окрашенных флюорохромом.
Для амплификации флюоресцентного сигнала применяется метод «иммунных сэндвичей». Например, на препарат, изображенный на схеме, наносят биотинилированные антитела к авидину, а затем снова комплекс авидин-флюоресцеин. При необходимости цикл может быть повторен. Антитела в свою очередь выявляются с помощью ферментативного (например, авидинпероксидазы) или флюоресцентного детектора.
Метод FISH предназначен для выявления:
1) гибридных клеток;
2) транслокаций и других, в том числе числовых, хромосомных аномалий;
3) меченых хромосом в интерфазных и метафазных клетках.
Высококонтрастная флюоресцентная гибридизация достигается благодаря использованию флюоресцентных красителей разного цвета. С помощью двуцветной FISH выявляются тонкие структурные аномалии, например хромосомные транслокации, в том числе и неразличимые при дифференциальном окрашивании.
В настоящее время возможно выполнение многоцветной гибридизации in situ для одновременного окрашивания всех хромосом в сложном кариотипе с множественными числовыми и структурными аномалиями. Комбинация разных модифицирующих агентов и флюорохромных красителей позволяет одновременно выявлять несколько последовательностей ДНК в одном ядре (флюоресцеин дает зеленую флюоресценцию, техасский красный и родамин — красную, гидроксикумарин — голубую и т. д.). Сочетание пяти флюорохромов в разных пропорциях и компьютерный анализ изображений позволяет одновременно окрасить разным цветом все хромосомы и визуализировать 27 различных ДНК-зондов, которые служат уникальной меткой для каждой хромосомы. Эта методика называется многоцветной FISH (multicolor, или multiplex, fluorescence in situ hybridization, M-FISH).
Значение цитогенетических методов неодинаково при разных онкогематологических заболеваниях. Миелоидные клетки обычно легко кариотипируются при дифференциальном окрашивании, и FISH лишь подтверждает результаты рутинной цитогенетики. Лимфоидные клетки у больных хроническим лимфолейкозом и, особенно, множественной миеломой кариотипировать значительно сложнее из-за низкого уровня пролиферации (даже при использовании В-клеточных митогенов). В этом случае FISH демонстрирует в несколько раз большую частоту анеуплоидии, чем обычные цитогенетические методики.
Клиническое значение цитогенетических исследований
Диагноз. Потомство клетки с приобретенной цитогенетической аномалией может иметь пролиферативное преимущество и давать начало клону — клеточной популяции, происходящей от одной клетки-предшественницы. Обнаружение клональных хромосомных аномалий способствует постановке диагноза клонального поражения костного мозга. Например, цитогенетический анализ позволяет установить диагноз миелодиспластического синдрома у пациентов с умеренной цитопенией или при наличии в аспирате костного мозга минимально выраженных качественных нарушений гемопоэза.
Присутствие специфических хромосомных аномалий помогает выделить подгруппы пациентов, которым требуется специфическая терапия. Например, транслокация t(15;17)(q22;qll-21) подтверждает диагноз острого промиелоцитарного лейкоза (ОМЛ — МЗ), в комплексном лечении которого используется ретиноевая кислота.
Прогноз. Результаты цитогенетического анализа имеют не только диагностическое, но и прогностическое значение. Например, обнаружение множественных хромосомных аномалий у больных острыми лейкозами до начала лечения является прогностически неблагоприятным и служит основанием для выполнения трансплантации костного мозга или стволовых клеток периферической крови в первой полной ремиссии.
Контроль результатов лечения. Цитогенетический анализ костного мозга пациентов после проведенного лечения помогает контролировать степень элиминации опухолевого клона и, следовательно, полноту ремиссии. Выявление хромосомных аномалий, характерных для опухолевых клеток данного пациента, является ранним признаком, свидетельствующим о приближающемся рецидиве.
Цитогенетический анализ имеет большое значение в диагностике и лечении гематологических заболеваний, которое все возрастает по мере совершенствования методологии и накопления знаний об этиологической и патогенетической роли хромосомных аномалий в развитии этих болезней.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Fish исследование костного мозга
Флуоресцентная гибридизация in situ (FISH) – новейший молекулярно-цитогенетический метод исследования, в процессе которого детектируется наличие и локализация специфических ДНК-последовательностей на хромосомах. В данном исследовании, основанном на методе FISH, выявляются генетические аберрации, характерные для следующих онкогематологических заболеваний: хронический лимфолейкоз, MALT-лимфома и лимфома Беркитта.
Флуоресцентная гибридизация in situ, молекулярная диагностика онкогематологических заболеваний, хронический лимфолейкоз, лимфома Беркитта, лимфопролиферативные заболевания.
Analysis of all specific aberrations on paraffin slides (FISH Histology, quantitative), Lymphoproliferative disorders, Chronic lymphocytic leukemia (CLL), MALT lymphoma, Burkitt’s lymphoma.
Флуоресцентная гибридизация in situ (FISH)
Какой биоматериал можно использовать для исследования?
Образец ткани в парафиновом блоке
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется. Для исследования используется уже предварительно подготовленный биологический материал (парафиновый блок с образцом биоматериала).
Преимущества исследования
Общая информация об исследовании
Анализ с помощью флюоресцентной in situ гибридизации (fluorescence in situ hybridization, FISH) – молекулярно‐цитогенетический метод для идентификации генетических аберраций (отклонений от нормы). Изначально данный метод использовался как исследовательский для выявления наличия или отсутствия специфической ДНК последовательности в хромосомах, но благодаря прогностической и предсказательной ценности был внедрен в клиническую практику.
Метод основан на использовании флуоресцентно меченых ДНК-зондов, которые представляют собой искусственно синтезированные фрагменты ДНК (олигонуклеотиды), последовательность которых комплементарна последовательности ДНК исследуемых аберрантных хромосом. ДНК-зонды различаются по специфичности: для каждой хромосомной аномалии используются свои ДНК-зонды. Также зонды различаются по размеру: одни могут быть направлены к целой хромосоме, другие – к конкретному локусу (фрагменту хромосомы или гена).
После специальной процедуры – денатурации – молекула ДНК приобретает вид одноцепочечной нити. ДНК-зонд гибридизуется (связывается) с комплементарной ему нуклеотидной последовательностью и может быть обнаружен при помощи флуоресцентного микроскопа. Данное состояние интерпретируется как положительный результат FISH-теста. При отсутствии аберрантных хромосом несвязанные ДНК-зонды в ходе реакции «отмываются», что при исследовании с помощью флуоресцентного микроскопа определяется как отсутствие флуоресцентного сигнала (отрицательный результат FISH-теста). Метод позволяет оценить не только наличие флуоресцентного сигнала, но и его интенсивность и локализацию. Таким образом, FISH-тест – это еще и количественный метод.
FISH имеет широкие возможности в клинической онкологии для обнаружения хромосомных аномалий в опухолевых клетках. Метод позволяет исследовать генетический состав клетки, как во время митоза, так и в интерфазе. FISH имеет высокую чувствительность – позволяет обнаружить индивидуальные гены, кроме того, в одном препарате могут быть использованы несколько зондов с различными красителями.
FISH-анализ широко применяется при лимфопролиферативных заболеваниях, являясь в ряде случаев определяющим фактором для подтверждения диагноза.
Хронический лимфолейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых. Характеризуется пролиферацией и увеличением в периферической крови количества морфологически зрелых лимфоцитов на фоне лимфоцитарной инфильтрации костного мозга, лимфатических узлов, селезенки и других органов. Клеточный субстрат хронического лимфолейкоза представлен чаще В-популяцией (около 30 %) и значительно реже — Т-лимфоцитами (около 70 %). В-лимфоциты при ХЛЛ не развиваются до плазматических клеток вследствие изменений в клеточном геноме. Это ведет к резкому уменьшению выработки иммуноглобулинов, к которым относятся все антитела. Заболевание чаще возникает у лиц старше 65 лет, у 10-15 % больных в возрасте чуть старше 50 лет. До 40 лет хронический лимфолейкоз возникает крайне редко. Мужчины болеют примерно в 2 раза чаще, чем женщины.
Симптомы обычно развиваются медленно, чаще выявляется случайно при обследовании по поводу других причин. При ХЛЛ наблюдаются следующие симптомы: кровоподтеки (если тромбоциты снижены), увеличение лимфатических узлов, печени или селезенка, чрезмерное потоотделение, ночная потливость, усталость, лихорадка, реинфекции, потеря аппетита, потеря веса.
Лимфома маргинальной зоны, ассоциированная со слизистыми (MALT, mucosa-associated lymphoid tissue) является третьим по распространенности подтипом неходжкинской лимфомы и составляет
Процесс может возникать в любых экстранодальных зонах (вне лимфатических узлов), но большую часть (85 % всех MALT-лимфом) составляют лимфомы желудка. Далее по частоте поражения следуют околоушные и слюнные железы (18-26 %), легкие (около 14 %), придаточный аппарат глаза (12 %), кожа (11 %), голова и шея (11 %), щитовидная (4-6 %) и молочная железа (2-3 %). Достаточно редко поражаются лимфатические узлы, селезенка или печень. Рецидивы MALT-лимфом часто случаются в других MALT-ассоциированных областях.
Показано, что приблизительно 90 % случаев МАLT-лимфом желудка связано с инфицированием H. рylori. У 70–80 % больных под влиянием эрадикационной (антихеликобактерной) терапии наблюдается регрессия MALT- лимфомы. Дифференциальная диагностику проводят с H. pylori-ассоциированным гастритом.
Симптомы варьируются в зависимости от типа: лихорадка, потеря веса, вздутие живота, искажение лицевых костей, ночная потливость, кишечная непроходимость, увеличенная щитовидная железа, увеличенные миндалины.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Отсутствие аберрантных хромосом в исследуемом образце
Хромосомные аномалии, характерные для лимфопролиферативных заболеваний:
Прогностически значимыми являются следующие аберрации: делеция длинного плеча хромосомы 13 (13q-), трисомия 12 хромосомы, делеция длинного плеча хромосомы 11 (11q-). Делеция короткого плеча хромосомы 17 (17p-) является главным цитогенетическим маркером, непосредственно влияющим на терапевтическую тактику. Рекомендуется проводить скрининг на делецию 17p у всех пациентов, имеющих показания к началу терапии и/или при неэффективности стандартной терапии, особенно пациентам моложе 55 лет, которым может быть проведена аллогенная трансплантация.
Второй наиболее частой транслокацией, идентифицированной с MALT-лимфомой, является t (14;18)(q32; q21).Приблизительно в 4 % MALT-лимфомы желудка и 8 % MALT-лимфомы легких выявляется t(1;14) (p22;q32).Характерным для MALT-лимфом является также нарушение нормальной активности важного супрессора опухоли — гена BCL10, что наблюдается при t(1;14)(p22;q32).
Важно отметить, что лимфомы MALT не несут транслокацию t (11; 14) (q13; q32), типичную для лимфомы мантийных клеток.
Выявление цитогенетического маркера лимфомы Беркитта – перестройки локуса гена C-MYC и транслокации t(8,14)(q24,q32) или ее вариантов t(2,8)(pl2,q24) или t(8,22)(q24,q11) позволяет диагностировать лимфому Беркитта. Перестройки гена C-MYC выявляется в 100 % случаев лимфомы Беркитта и является одним из главных диагностических критериев этого заболевания. В 80 % случаев встречается t(8;14)(q24;q32) перестройка локусов генов c-myc (8q24) и тяжелых цепей иммуноглобулинов Ig (14q32).
Изменения кариотипа являются независимым прогностическим фактором. При выявлении аберрации (13q-) можно прогнозировать стабильное состояние или медленное течение болезни и благоприятный ответ на терапию, если она является единственной (медиана выживаемости – 11 лет), в то время как остальные аберрации, в особенности (11q- ) и (17p- ) крайне неблагоприятны в прогностическом отношении (медианы выживаемости больных с трисомией 12 – 9,5 лет, ( 11q-) – 6,5 лет, (17p- ) – меньше 3 лет.
Кто назначает исследование?
1. Иммуногистохимические методы: Руководство / Ed. by George L. Kumar, Lars Rudbeck.: DAKO / Пер. с англ. под ред. Г.А.Франка и П.Г.Малькова. – М., 2011. – 224 с.
2. Wan TS, Ma ES. Molecular cytogenetics: an indispensable tool for cancer diagnosis. Chang Gung Med J. 2012. Mar-Apr: 35(2): 96-110. Review. PubMed PMID: 22537925.
5. М. Ж. Алексанян, Е. А. Асеева, А. И. Удовиченко, Е. В. Домрачева. Цитогенетические исследования в гематологии. Организационные аспекты. Гематология и трансфузиология, 2012, т. 57, № 4. С.23 – 27.
6. Хронический лимфолейкоз у взрослых. Клинические рекомендации. Национальное гематологическое общество Российское профессиональное общество онкогематологов. 2016г.
7. И.А. Крячок, Е.О. Ульянченко, Т.В. Кадникова, И.Б. Титоренко и др. MALT-лимфома: причины возникновения, патогенез, классификация, клиническая картина. Клиническая онкология, № 1 (25), 2017.