фистула в головном мозге
Фистула в головном мозге
Дуральные артериовенозные фистулы (ДАВФ) являются уникальным сосудисто-нервным пороком, встречающимся в 10-15% всех внутричерепных артериовенозных поражений. Они состоят из одного или нескольких истинных артериовенозных свищей, без промежуточного капиллярного русла, локализованных в листках твердой мозговой оболочки. Это анатомическое расположение четко отличает дуральные артериовенозные фистулы (ДАВФ) от артерио-венозных мальформаций (АВМ) мягкой мозговой оболочки.
Кроме того, общепризнано, что ДАВФ являются приобретенными, в отличие от АВМ мягкой мозговой оболочки, которые считаются врожденными. По этой причине, хотя в литературе во многих случаях дуральные артериовенозные фистулы (ДАВФ) также называют «пороками», в данном тексте во избежание путаницы выбран термин «фистулы».
Дуральные артериовенозные фистулы (ДАВФ) редко выявлялись до 1960 г., однако благодаря успехам ангиографии, таким как увеличение, техника субтракции и селективной артериальной катетеризации, их стали рассматривать как отдельную нозологическую единицу. Хотя случаи были описаны уже в 1930 г., первая концепция спонтанной ДАВФ появилась только в 1951 г. (Fincher).
Вначале дуральные повреждения расценивали как доброкачественные, по сравнению с АВМ мягкой мозговой оболочки. В начале 1970-х годов первопроходцы Aminoff, Newton и Djindjian расширили анатомические и клинические представления об дуральной артериовенозной фистуле (ДАВФ). В 1972 г. возникла концепция, согласно которой картина венозного оттока может быть связана с клиническими признаками и симптомами, однако до 1975 г. риск кровоизлияния определен не был, особенно при наличии венозного коркового дренажа.
Djindjian et al. создали первую классификацию на основе этой концепции, заявив, что дуральные артериовенозные фистулы (ДАВФ) со свободным оттоком в синусы относительно безвредны, в то время как поражения с наличием венозного коркового дренажа могут привести к серьезным осложнениям.
В 1984 г. Malik et al. опубликовали свои наблюдения 223 случаев с сообщением, что нарушение венозного оттока является ключевым фактором, однако они не подчеркнули важность венозного коркового дренажа. Lasjaunias et al. в мета-анализе 191 случая указали, что очаговые неврологические симптомы зависели от топографии дренирующих вен и венозный корковый дренаж дает высокий риск интрадуральных кровоизлияний.
Третий отчет, представленный Awad et al. на основании 377 случаев, в основном взятых из литературы, ввел понятие «агрессивного» поражения, ассоциированного с кровоизлиянием или очаговым неврологическим дефицитом, а также подчеркнул важность венозного коркового дренажа, венозных эктазий и дренирования в вену Галена.
а) Патогенез. Этиология черепных дуральных артериовенозных фистул (ДАВФ) неизвестна, хотя опубликовано немало гипотез. Уже отмечено, что эти повреждения, как правило, являются приобретенными, описаны после операции, после травмы головы, и в связи с тромбозом синусов, однако точный путь никогда не был однозначно доказан.
Предлагаются две гипотезы патогенеза. Первая утверждает, что черепные дуральные артериовенозные фистулы (ДАВФ) возникают из существующих «спящих» каналов между системой циркуляции наружной сонной артерии и венозными путями твердой мозговой оболочки. Гистопатологические и радиоанатомические исследования показали, что эти связи, как правило, присутствуют в твердой мозговой оболочке. Эти каналы открываются вследствие венозной гипертензии, связанной с тромбозом синусов или обструкцией оттока по синусу.
Есть сообщения о существовании тонкостенных венозных мешков в твердой мозговой оболочке, закрытых для мелких артерий. Разрыв этих хрупких мешков легко вызывает артериовенозные коммуникации внутри оболочки.
Вторая гипотеза предполагает, что дуральные артериовенозные фистулы (ДАВФ) являются результатом вновь выросших сосудистых каналов в связи с действием факторов ангиогенеза. Эти факторы, такие как VEGF и bFGF, выделяются либо непосредственно при возникновении тромбоза синуса или косвенно вследствие индуцированного повышения венозного давления через механизм тканевой гипоксии.
Истинная артериовенозная фистула не имеет промежуточного капиллярного русла и состоит из небольших венул с диаметром около 30 мкм. Эти сосуды были названы «сосуды по типу трещин», потому что они выглядят как трещины в стенке синусов твердой мозговой оболочки после гистологического окрашивания. Кроме того, не наблюдается утолщения интимы как твердой мозговой артерии, так и вен твердой мозговой оболочки. Несмотря на то, фистулы изначально были описаны при тромбозе синуса, общепризнано, что свищ находится в пределах стенки синуса.
Это также объясняет существование такого типа ДАВФ, при котором происходит отток непосредственно в пи-альную венозную сеть, без дренажа в синусы.
Существует несколько схем классификации дуральных артериовенозных фистул (ДАВФ), наиболее известные варианты Borden и Cognard. Несмотря на то, что трехступенчатая классификация Borden относительно проста в применении, классификация Cognard (пересмотр классификации Djindjia) является теоретически более полной, так как она включает в себя дополнительный эффект направления потока в синусы твердой мозговой оболочки. Обе классификации были утверждены в литературе.
Классификация дуральных артериовенозных фистул (ДАВФ) по Borden:
1. Венозный дренаж непосредственно в синус или менингеальные вены.
2. Венозный дренаж в синус твердой мозговой оболочки с корковым венозным рефлюксом.
3. Венозный дренаж непосредственно в субарахноидальные вены.
1. Доброкачественные дуральные артериовенозные фистулы (ДАВФ). Отсутствие коркового венозного рефлюкса можно рассматривать как прогностический фактор доброкачественного естественного течения и отсутствие осложнений. О доброкачественных дуральных артериовенозных фистул (ДАВФ) было опубликовано несколько статей, сообщающих о клинических и ангиографических отдаленных результатах. Davies et al. сообщили о своем опыте, основанном на 54 случаях без коркового венозного рефлюкса, средний период наблюдения составил 33 месяца.
Только один пациент (2%) умер после паллиативного эндоваскулярного лечения, без ангиографических признаков нарушения коркового венозного рефлюкса. Такое необычное течение доброкачественного заболевания объясняется венозной гипертензией вследствие функционального препятствия оттоку в верхний сагиттальный синус. В остальных случаях исследованной группы Davies et al. установили, что большинство краниальных дуральных артериовенозных фистул (ДАВФ) без венозного рефлюкса имели доброкачественное течение и что при необходимости терапевтических вмешательств усилия должны быть сосредоточены на паллиативном, а не на ангиографическом лечении.
Cognard et al. описали семь пациентов с изначальными ДАВФ без коркового венозного рефлюкса, но после лечения, в среднем через семь лет, произошло ухудшение клинической симптоматики. В более позднем исследовании Satomi et al., были оценены хронологические изменения клинической симптоматики и ангиографических особенностей у 117 пациентов с доброкачественными ДАВФ. Не было ни одного случая внутричерепного кровоизлияния или ухудшения неврологической симптоматики; таким образом, основной стратегией при этих поражениях было наблюдение.
Паллиативная терапия, не направленная на лечение, применялась у пациентов, для которых симптомы были невыносимы или при наличии офтальмологических показаний. При использовании консервативного лечения 98% пациентов достигли допустимого качества жизни.
2. Агрессивные дуральные артериовенозные фистулы (ДАВФ). Краниальные ДАВФ с наличием коркового венозного рефлюкса следует считать агрессивными поражениями. Течение заболевания связано с высоким риском внутричерепного кровоизлияния, нарастанием неврологического дефицита и смерти при манифестации. Тем не менее, долгое время естественное течение заболевания после агрессивного начала было не совсем понятно, с публикациями в течение 1990-х годов ряда противоречивых сообщений.
Все эти публикации имели ограничения, начиная от краткого периода наблюдения до путаницы доброкачественных и агрессивных форм. В 2002 г. Van Dijk et al. сообщили о проспективном исследовании ДАВФ с наличием коркового венозного рефлюкса со средним сроком наблюдения 4,3 года. Было установлено, что при естественном течении болезни ежегодная смертность достигала 10,4%. Кроме того, ежегодный риск последующего внутричерепного кровоизлияния или ухудшения неврологической симптоматики после манифестации составил 8,1% и 6,9% соответственно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фистула в головном мозге
а) Методы диагностики дуральных артериовенозных фистул (ДАВФ):
1. КТ. В связи с отсутствием коркового венозного рефлюкса доброкачественные ДАВФ почти никогда не видны при КТ. В случае агрессивных ДАВФ при бесконтрастной КТ могут быть выявлены гиподенсные зоны, представляющие собой области отека или венозной ишемии. Могут визуализироваться аномально увеличенные пиальные вены, в связи с их повышенной плотностью по сравнению с паренхимой мозга. При контрастной КТ видна сеть корковых вен.
2. МРТ/МРА. На МРТ очень сложно обнаружить доброкачественные ДАВФ. МР-ангиография является более чувствительным методом, хотя по-прежнему имеет ограничения в визуализации фистул. В случае агрессивных ДАВФ МРТ лучше визуализирует очаги, характеризующиеся «пустым» потоком в расширенных сосудах мягкой мозговой оболочки. В режиме Т2 паренхима мозга дает сигнал повышенной плотности в белом веществе из-за вторичной гипертензии, особенно в глубоких отделах белого вещества.
Венозная гипертензия, в конечном итоге, приведет к глиозу, с характеристиками сигнала как при отеке в режиме Т2. Дифференциальная диагностика при Т2 гиперинтенсивности включает в себя синус-тромбоз, демиелинизирующие процессы и новообразования. Тем не менее, сочетание Т2 гиперинтенсивности и избыток пиальных сосудов наводит на мысль о сосудистых пороках и необходимости проведения ангиографии.
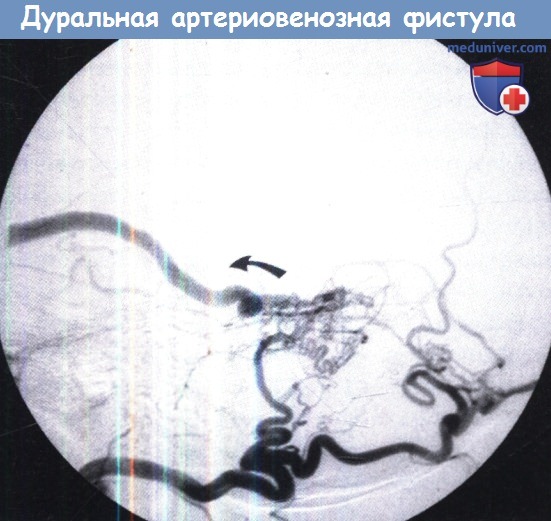
3. Цифровая субтракционная ангиография (ДСА). Ангиография является обязательной для подтверждения диагноза ДАВФ и планирования лечения. Селективное введение контрастного вещества в различных отделах наружной сонной артерии покажет быстрое артериовенозное шунтирование через фистулу в церебральную венозную систему.
Время прохождения контрастного вещества с селективным введением во внутреннюю сонную артерию обычно запаздывает по сравнению с венозным накоплением. Основной целью получения изображения ДАВФ является, безусловно, тщательное изучение венозной фазы при наличии коркового венозного рефлюкса. К другим важным результатам относится окклюзия венозного синуса, которая может привести к экстракраниальному дренированию, в том числе через систему назо-глазничного анастомоза, и увеличивает риск ретроградного потока в корковых и мозжечковых венах.
Наконец, при диагностической визуализации возможно обнаружение нескольких ДАВФ у одного пациента, что описывается в 7-8% случаев.
б) Лечение дуральных артериовенозных фистул (ДАВФ). В принципе лечение проводится в случае, если ожидается его эффект на естественное течение заболевания. Естественное течение связано с венозным оттоком, особенно с существованием коркового венозного рефлюкса.
При доброкачественных краниальных дуральных артериовенозных фистулах (ДАВФ) описывается 98% случаев с хорошим течением без радикального лечения, и это наблюдение подтверждает адекватность варианта наблюдения с периодической ангиографической оценкой. Только в случае непереносимости симптомов показано проведение паллиативного лечения для уменьшения выраженности симптоматики — паллиативная артериальная эндоваскулярная эмболизация. Ни в коем случае нельзя жертвовать венозным синусом.
Агрессивные ДАВФ приводят к серьезным осложнениям при их естественном течении, таким образом, должны применяться инвазивные методы лечения. Отключение коркового венозного рефлюкса обязательно для защиты от последствий внутричерепного кровоизлияния или нарастания неврологического дефицита. Частичное лечение не приводит к снижению рисков, важное значение имеет достижение излечения коркового венозного рефлюкса.
Лечение дуральных артериовенозных фистул (ДАВФ) возможно как при эндоваскулярной эмболизации, так и при хирургическом вмешательстве. Раньше золотым стандартом в лечении дуральных артериовенозных фистул (ДАВФ) являлась хирургия, но с введением в практику жидкого клея (NBCA), дающего хорошие результаты без реканализации, эти методы рассматриваются как равные. Нет необходимости полной резекции или уничтожения свища, для получения того же результата будет достаточно простого отключения корковых вен паренхимы мозга.
Несмотря на периодически появляющиеся сообщения, радиохирургия не играет роли в лечении черепно-мозговых дуральных артериовенозных фистул (ДАВФ), с наличием коркового венозного рефлюкса или без него. Доброкачественные черепные ДАВФ не нуждаются в лечении, а любые дополнительные риски от радиохирургии слишком велики. Агрессивные ДАВФ имеют плохое течение после манифестации, часто приводя к тяжелой инвалидности или смерти. Ожидаемое действие радиохирургии развивается только через несколько лет после лечения, а такая задержка недопустима.
— Краниальные дуральные артериовенозные фистулы (ДАВФ) можно классифицировать как доброкачественные и агрессивные, в зависимости от наличия коркового венозного рефлюкса в паренхиму мозга.
— Дуральные артериовенозные фистулы (ДАВФ) без коркового венозного рефлюкса имеют благоприятный прогноз и течение, поэтому возможно наблюдение и лишь паллиативное лечение в случае непереносимых признаков и симптомов.
— Имеется небольшой шанс перерождения доброкачественных ДАВФ в агрессивные опухоли, поэтому обязательна своевременная клиническая и ангиографическая переоценка.
— При отсутствии лечения агрессивных дуральных артериовенозных фистул (ДАВФ) имеется ежегодный риск ухудшения 15%, при этом ежегодная смертность составляет 10,4%.
— Выборочное отключение коркового венозного рефлюкса путем эндоваскулярной эмболизации или хирургического вмешательства является методом выбора для агрессивных ДАВФ.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фистула в головном мозге
а) Терминология:
1. Сокращения:
• Артериовенозная фистула (дАВФ)
2. Синонимы:
• Дуральный артериовенозный шунт (дАВШ)
3. Определение:
• Гетерогенная группа поражений с общей ангиоархитектоникой (артериовенозные шунты в стенке синусов твердой мозговой оболочки)
1. Общие характеристики дуральной артериовенозной фистулы:
• Лучшие диагностические критерии:
о МР/КТ ангиография: сеть крошечных (в виде трещин) сосудов в стенке тромбированного синуса твердой мозговой оболочки
о ЦСА: преобладающее артериальное питание из менингеальных артерий
о КТ, костное окно: расширенные чрескостные сосудистые каналы свода черепа, увеличенное остистое отверстие
• Локализация:
о Задняя черепная ямка >> супратенториальная область
о Любой синус твердой мозговой оболочки:
— Наиболее часто (35-40%) = поперечный синус (ПС) + сигмовидный синус (СС)
— Другие частые места = кавернозный синус (КС), верхний сагиттальный синус (ВСС), верхний каменистый синус (ВПС)
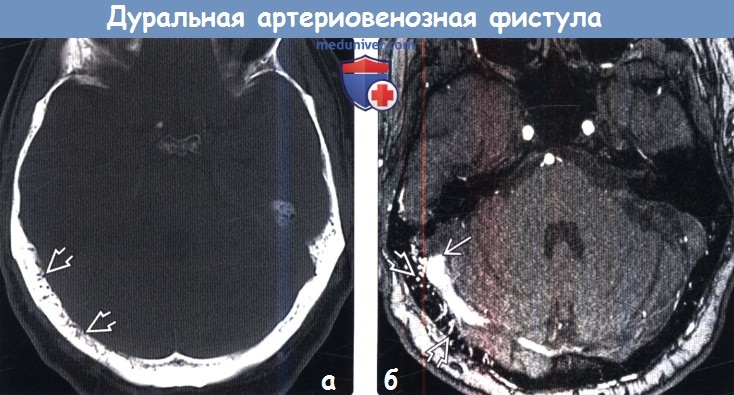
(б) Контрастная МР-ангиография: у этого же пациента определяется тромбоз правого синуса твердой мозговой оболочки, контрастирование множественных чрескостных сосудистых каналов, что характерно для дАВФ задней черепной ямки.
2. КТ при дуральной артериовенозной фистуле:
• Бесконтрастная КТ:
о В черепе могут выявляться расширенные сосудистые каналы от чрескостных питающих артерий
о Ипсилатеральное расширение остистое отверстие:
— Содержит среднюю менингеальную артерию, которая в большинстве случаев питает дАВФ
о Выполните поиск осложнений: субарахноидальное кровоизлияние, отек головного мозга (венозная гипертензия)
• Контрастная КТ:
о Могут визуализироваться извитые питающие артерии ± гемодинамические аневризмы (редко), дренирующие вены
о Тотальное/частичное тромбирование или стенозирование синуса твердой мозговой оболочки
• КТ-ангиография:
о Стандартная 3D КТ-ангиография может быть полезна в визуализации макроангиоархитектоники
о 320-срезовая динамическая 4D-КТ-ангиография обеспечивает возможность объемной визуализации, детальное пространственное/временное разрешение
3. МРТ при дуральной артериовенозной фистуле:
• Т1-ВИ:
о Изоинтенсивные тромбированные синусы твердой мозговой оболочки ± участки потери сигнала за счет эффекта потока
• Т2-ВИ:
о Изоинтенсивные тромбированные синусы твердой мозговой оболочки ± участки потери сигнала за счет эффекта потока
о Фокальные гиперинтенсивные зоны в смежном веществе мозга:
— Исследуйте изображение на наличие признаков ретроградного лептоменингиального венозного дренажа
— Исследуйте изображение на наличие аномалий венозной перфузии
• FLAIR:
о Изоинтенсивный тромбированный синус ± прилегающий отек при венозной гиперемии или ишемии
• Т2* GRE:
о Участки «выцветания» изображения в тромбированном синусе твердой мозговой оболочки
• Редко: паренхиматозное кровоизлияние:
— Обычно наблюдается при наличии коркового венозного дренажа
— Исследуйте изображение на наличие признаков тромбоза дренирующих вен
• DTI (диффузионно-тензорная МРТ):
о Изменения выявляются только в случае венозного инфаркта или ишемии
• Постконтрастное Т1-ВИ:
о Обычно наблюдается контрастирование хронически тромбированного синуса
• МР-ангиография:
о Полезна для грубой визуализации ангиоархитектоники, динамики
• МР-венография:
о Визуализация окклюзированных синусов и коллатералей
о Используя 3D фазо-контрастную МР-ангиографию с низким VENC (кодирование скорости движущихся в потоке спинов) возможно идентифицировать фистулу, питающие артерии, реверсию кровотока в дренирующих венах
4. Ангиография при дуральной артериовенозной фистуле:
• Традиционная ангиография:
о Типично наличие множественных питающих артерий:
— Наиболее часто-дуральные/чрескостные ветви от НСА
— Тенториальные/дуральные ветви от ВСА, ПА
— Паразитирование на кровоснабжении мягкой мозговой оболочки при более крупных дАВФ
о Часто отмечается наличие артериального притока в параллельный венозный сосуд
о Часто наблюдается тромбоз или стеноз вовлеченного в патологический процесс синуса
о Регургитация в венозном синусе/корковых венах коррелирует с прогрессированием симптомов и риском кровоизлияния
о Извитые переполненные пиальные вены («псевдофлебитический» паттерн) с венозным застоем/гипертензией (клинически агрессивное течение)
о Флебопатия, вызванная интенсивным кровотоком → прогрессирующий стеноз, окклюзия, кровоизлияние
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о ЦСА ± суперселективная катетеризация дуральных, чрескостных питающих артерий
• Советы по протоколу исследования:
о МРТ скрининг, контрастная МР-ангиография
о ЦСА для визуализации артериального питания, венозного оттока
в) Дифференциальная диагностика:
1. Пиальная АВМ:
• Врожденное поражение сосудов, наличие внутримозгового ядра АВМ и отсутствие вовлечения в патологический процесс нормальной паренхимы мозга
• Преобладающее пиальное артериальное питание, возможно паразитирование на дуральном кровоснабжении (в противоположность дАВФ)
2. Псевдоповреждение сигмовидного синуса — остистого отверстия:
• Медленный или асимметричный кровоток создает переменный сигнал на МР последовательностях
• Используйте МР-венографию с несколькими градиентами кодирования для уточнения визуализируемых изменений
3. Тромбоз синуса твердой мозговой оболочки:
• Наличие коллатерального/застойного венозного оттока может имитировать дАВФ
• Может быть спонтанным, травматическим, инфекционным (тромбофлебит)
4. Стеноз синуса твердой мозговой оболочки:
• Могут иметься заметные коллатеральные дренирующие вены
1. Общие характеристики дуральной артериовенозной фистулы (дАВФ):
• Этиология:
о У взрослых дАВФ обычно приобретенного, не врожденного генеза:
— Часто идиопатические
— Могут возникать в ответ на травму, тромбоз венозного синуса
о У новорожденных дАВФ являются врожденными и, как правило, связаны с расширением синусов твердой мозговой оболочки
о Патологическая активация неоангиогенеза:
— Облитерация организованным тромбом пролиферирующих капилляров внутри грануляционной ткани в венозном синусе
— Почкование/пролиферация микрососудистой сети во внутренней части твердой мозговой оболочки и ее соединение со сплетением тонкостенных венозных сосудов, что формирует микрофистулу
— Наблюдается высокая экспрессия bFGF, VEGF при дАВФ
• Ассоциированные аномалии:
о Корковый венозный дренаж связан с отеком, энцефалопатией
о Венозная гипертензия может привести к задержке развития у детей
о Артериализированный кровоток в корковых венах/синусах твердой мозговой оболочки → флебопатия, вызванная интенсивным кровотоком, ↑ риск ВЧК, энцефалопатии
3. Макроскопические и хирургические особенности:
• Множественные увеличенные дуральные артерии сходятся на стенке тромбированного синуса твердой мозговой оболочки
• Корковые дренирующие вены расширены (± стеноз, дилатация, извитость)
4. Микроскопия:
• Артериализированные вены с неравномерным утолщением интимы, непостоянная потеря внутренней эластической мембраны
д) Клиническая картина:
1. Проявления дуральной артериовенозной фистулы (дАВФ):
• Наиболее частые признаки/симптомы:
о Клинические проявления зависятотлокализации, наличия/от-сутствия венозной гипертензии:
— ПС-СС = пульсирующий шум в ушах
— Кавернозный синус = пульсирующий экзофтальм, невропатия III, IV, VI ЧН
— Младенческая дАВФ: задержка развития, ↑ длины окружности головы
о Редко: симптомы энцефалопатии (венозная гипертензия, ишемия/тромбоз):
— Прогрессирующая деменция
• Клинический профиль:
о Пациенты среднего возраста с шумом в ушах, синхронным с пульсом
2. Демография:
• Возраст:
о Взрослые >> дети:
— Обычно наблюдается у пациентов среднего возраста
— Педиатрические дАВФ встречаются редко, характеризуются высокой летальностью
• Эпидемиология:
о 10-15% всех цереброваскулярных мальформаций с артериовенозным шунтированием
3. Течение и прогноз:
• Зависит от локализации, паттерна венозного оттока:
о 98% дАВФ без ретроградного венозного дренажа имеют доброкачественное течение
о дАВФ с ретроградным венозным дренажем имеют агрессивное клиническое течение
4. Лечение:
• Консервативное: наблюдение ± каротидная компрессия
• (1) существует риск кровоизлияния; (2) при типах 1 и 2А с изнуряющим пациента пульсирующим шумом в ушах:
о Эмболизация питающих артерий при помощи дисперсного или жидкого эмболизационного материала, «coil-эмболизация» венозного мешка/синуса
о Хирургическое скелетирование пораженного синуса твердой мозговой оболочки
е) Диагностическая памятка:
1. Обратите внимание:
• Используйте ДЦА для окончательного исключения дАВФ у пациента с объективным пульсирующим шумом в ушах
2. Советы по интерпретации исследований:
• При дАВФ малых размеров изменения на MPT + МР-ангиографии могут не выявляться
• При выполнении ДЦА всегда проверяйте ВСА, PICA и позвоночные артерии с обеих сторон для исключения дАВФ
ж) Список литературы:
— Вернуться в оглавление раздела «Лучевая медицина»
Редактор: Искандер Милевски. Дата публикации: 25.3.2019
Хирургическое лечение спинальных дуральных артериовенозных фистул.
Евзиков Г.Ю*., Кондрашин С.А.**, Синицын В.Е.***
Хирургическое лечение спинальных дуральных артериовенозных фистул. *Клиника нервных болезней первого МГМУ им. И.М. Сеченова. Москва
**Кафедра лучевой диагностики и лучевой терапии первого МГМУ им.И.М.Сеченова. Москва.
***Центра лучевой диагностики ФГУ «Лечебно-реабилитационный центр» Минздравсоцразвития РФ, Москва.
Спинальные дуральные артериовенозные фистулы (СДАВФ) являются наиболее распространенным видом спинальных артериовенозных мальформаций. Патологический артериовенозный сброс из СДАВФ в перимедуллярную венозную сеть приводит к развитию венозной гипертензионной миелопатии и при отсутствии лечения сопровождается тяжелой инвалидизацией пациента. Выявляемость СДАВФ в России очень низка. Для лечения СДАВФ могут выполняться эндовазальные и открытые хирургические вмешательства. Рациональный выбор метода вмешательства до настоящего времени остается предметом дискуссии. В России уже имеется большой опыт эндовазальных операций, но открытые операции практически не применяются. Целью данной работы явилось определение эффективности открытых операций при лечении СДАВФ.
Материал и методы. Проведено обследование и оперативное лечение 5 больных со СДАВФ, расположенными на уровне нижне-грудного и верхне-поясничного отделов позвоночника. Обследование включало МРТ спинного мозга, спинальную МР — ангиографию, селективную спинальную рентгеновскую ангиографию. В ходе операций проводили коагуляцию и пересечение дренирующей вены соустья. Вмешательств на корешковой манжетке не проводилось. Тяжесть состояния оценивалась по шкале M.J. Aminoff 1974г. перед вмешательством и через 3 мес. после операции.
Результаты. На момент проведения операций все больные были тяжело инвалидизированы. После операций во всех случаях отмечен регресс болевого синдрома и положительная динамика в неврологическом статусе, но выраженных
положительных изменений, которые позволяют вернуться к полностью независимому существованию, не отмечено. Осложнений после проведенных операций не отмечалось.
Заключение. Коагуляция дренирующей вены соустья является технически простым и эффективным способом лечения больных со СДАВФ. Для достижения высоких функциональных результатов необходима ранняя диагностика фистул и проведение операций до момента развития грубой неврологической симптоматики.
Ключевые слова : спинальная артериовенозная мальформация, спинальная дуральная артериовенозная фистула (СДАВФ).
Единая международно признанная и рекомендуемая к использованию классификация артериовенозных мальформаций (АВМ) и артериовенозных фистул (АВФ) спинного мозга отсутствует. Последняя из предложенных и наиболее подробная классификация спинальных АВМ и АВФ принадлежит Ю.А. Зозуле, И.С. Слынько 2005г.(2), но
наиболее распространенными в настоящее время являются классификации R.F. Spetlzer 1992г., 2002г. (8,14). Простая и широко используемая в отечественной литературе классификация 1992г. разделяет сосудистые мальформации спинного мозга на 4 типа: I тип — спинальная дуральная артериовенозная фистула (СДАВФ), II тип –
гломусная АВМ, III тип – ювенильная АВМ, IV тип — перимедуллярная АВФ. В 2002г. R.F. Spetlzer предложил новую, значительно более сложную редакцию этой классификации. Согласно классификации 2002г. АВФ спинного мозга делятся на экстрадуральные и интрадуральные. Мальформации I типа он отнес к группе интрадуральных фистул, обозначил как дорзальные интрадуральные фистулы и отказался от использования термина СДАВФ. Однако, большинство авторов не отказывается от использования данного термина, и он остается широко употребляемым в иностранной литературе.
СДАВФ редкое заболевание, но среди сосудистых мальфомаций спинного мозга они составляют большинство. СДАВФ формируются в ткани твердой мозговой оболочки (ТМО), на дорзальной поверхности корешковых манжеток в проекции межпозвонковых отверстий в месте впадения в ТМО корешковых вен, сопровождающих задние корешки и дренирующих кровь от спинного мозга в эпидуральное пространство. Приносящим сосудом для соустья является радикуломенингеальная артерия. Радикуломенингеальные артерии входят в ТМО практически на уровне всех
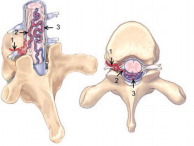
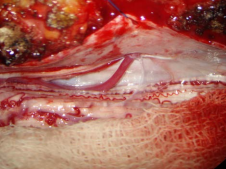
Рис 1(а,б.)
(рисунок взят из статьи
R.F. Spetzler et al. Modfied
classification of spinal
cord vascular lesions.
радикуломенингеальная артерия (приносящия артерия соустья), 2 –
корешковая вена (дренажная вена соустья). 3 – серпантинная вена
(задняя центральная вена спинного мозга).
Б) Интраоперационный вид дренажной вены (1) и серпантинной
В отличие от прочих сосудистых мальформаций спинного мозга клиническая манифестация СДАВФ отмечается у лиц 50 – 60лет. Течение заболевания, как правило, медленно проградиентное. Прогрессирование симптоматики в большинстве наблюдений в течение 5 лет приводит к грубому неврологическому дефициту, включающему утрату способности к самостоятельному передвижению и сфинктерные расстройства. Острое ухудшение состояния встречается в 5 – 18% наблюдений и связано с острой ишемией спинного мозга. Развитие гематомиелии для этой патологии нехарактерно. Во всех работах, посвященных изучению СДАВФ, подчеркивается, что синдромы обкрадывания и сдавления спинного мозга не являются для этих больных значимыми патогенетическими факторами. Предположить возможность развития ишемии мозга за счет синдрома обкрадывания при СДАВФ можно только в случае быстрого формирования большого соустья на уровне крупной радикуломедуллярной артерии при магистральном типе кровоснабжения спинного мозга, что представляется маловероятным (16).
Для лечения СДАВФ могут выполняться эндовазальные и открытые хирургические вмешательства. Рациональный выбор метода вмешательства до настоящего времени остается предметом дискуссии. В России уже имеется большой опыт эндовазальных операций, но открытые операции практически не применяются (5,6). В связи с этим целью данной работы явилось определение эффективности открытых операций при лечении СДАВФ.
Материал и методы исследования.
В течение 2011г. в нейрохирургическом отделении клиники нервных болезней им. А.Я. Кожевникова первого МГМУ им. И.М. Сеченова по поводу СДАВФ было оперирована 5 больных (3 женщины, 2 мужчин). Средний возраст пациентов составил 63года. В неврологическом статусе у всех пациентов отмечалось сочетание двигательных, чувствительных и сфинктерных нарушений. Расстройства чувствительности были представлены нарушениями проводникового типа в ногах и нижней половине туловища и неприятными для пациентов болезненными парестезиями в нижних конечностях. Верхняя граница расстройств чувствительности только в одном наблюдении совпадала с сегментарным уровнем расположения фистулы. Тяжесть двигательных и сфинктерных нарушений оценивалась по шкале M.J. Aminoff 1974 (10), которая была предложена для оценки степени инвалидизации при этой патологии (таблица 1). Длительность развития симптоматики составила в среднем 3,6 года. К моменту проведения операции четверо из пяти пациентов уже
утратили способность к самостоятельному передвижению, у троих из пяти использовалась постоянная катетеризация мочевого пузыря (таблица № 2). Во всех наблюдениях отмечалось медленное проградиентное течение заболевания, в двух случаях на этом фоне имели место эпизоды острого ухудшения состояния. Ни в одном из наблюдений диагноз СДАВФ на амбулаторном этапе или при стационарном обследовании в неврологических стационарах не был установлен. Диагноз устанавливался в ходе стационарного обследования в клинике. Для установления диагноза использовался следующий алгоритм исследований: на первом этапе — МР исследование спинного мозга на томографе с мощностью магнитного поля 3Т, на втором этапе — спинальная МР ангиография (выполнена 3 пациентам), на третьем этапе – селективная спинальная рентгеновская ангиография. Уровень и сторона расположения фистулы представлены в таблице №2.
Операции проводились в положении пациента на боку (на стороне противоположной расположению фистулы). В ходе вмешательства выполнялась ламинэктомия двух смежных позвонков на уровне расположения фистулы. ТМО вскрывалась срединным разрезом. Проводилась арахноидальная диссекция дренажной вены, которая коагулировалась и пересекалась. Коагуляция и иссечение серпантинной вены не производились. Рассечение корешковой манжеты с целью коагуляции соустья не производилось. В одном наблюдении, в связи с большим диаметром дренажной вены, на нее в месте выхода из ТМО был наложен клипс. После клипирования вена была коагулирована и пересечена. Динамика состояния пациентов оценивалась через 3мес после операции.
Результаты и их обсуждение.
СДАВФ составляют 60 – 80% от всех сосудистых мальформаций спинного мозга (10). Абсолютное большинство СДАВФ располагается в нижне-грудном – поясничном отделах позвоночника. СДАВФ на уровне шейного отдела позвоночника составляют около 2%, крестца – 4%. Истинная частота встречаемости СДАВФ неизвестна. Ретроспективный анализ, проведенный в Германии, показал, что предполагаемая частота заболевания может составлять 5-10/1 млн. населения в год (17). Углубленное исследование группы пациентов с диагнозом миелопатия неясной этиологии позволило выявить СДАВФ среди них в 28% наблюдений (16). Очевидно, что встречаемость СДАВФ значительно выше, чем их современная выявляемость. Для течения СДАВФ нехарактерны спинальные субарахноидальные кровоизлияния или гематомиелия, сопровождающиеся яркими клиническими проявлениями. Течение
СДАВФ, как правило, хроническое с медленно прогрессирующим миелопатическим синдромом, что снижает их выявляемость даже в сравнении с другими видами спинальных сосудистых мальформаций, которые в популяции встречаются значительно реже. Большинство пациентов со СДАВФ становятся тяжелыми инвалидами с неустановленным диагнозом. Оперированные нами больные были направлены в клинику с диагнозами: интрамедуллярные опухоли — 2 пациента, сосудистая миелопатия вследствие атеросклероза – 2 пациента, спинальный инсульт – 1 пациент. К моменту госпитализации все пациенты уже были тяжелыми инвалидами, но ни в одном из приводимых случаев не высказывалось подозрений на наличие сосудистой мальформации спинного мозга. Низкая выявляемость СДАВФ связана с поздними сроками дебюта заболевания (средний возраст пациентов составляет 50 – 60лет) и отсутствием специфических клинических проявлений. В дебюте заболевания отмечаются боли и парестезии в нижних конечностях, к которым постепенно присоединяются расстройство чувствительности в ногах (чаще в дистальных отделах) и двигательные расстройства в форме нижнего парапареза. Указанные проявления могут носить симметричный и асимметричный характер, усиливаться (наиболее часто парестезии) на фоне длительной ходьбы, стояния или иных видах физической нагрузки и ослабевать в покое. Учитывая неспецифичность клинических проявлений и возраст пациентов, первично они лечатся с диагнозами: полинейропатия, поясничный стеноз, компрессионные радикулопатии. Один из наших пациентов был дважды без эффекта оперирован по поводу грыж поясничных дисков.
Скриннинговым методом, который позволяет заподозрить у больного наличие СДАВФ, является МРТ исследование. При МРТ исследовании спинного мозга в 67 – 100% случаев выявляется повышение интенсивности МР — сигнала от центральных отделов паренхимы спинного мозга в режиме Т2 (11,13,16). Повышение интенсивности сигнала носит гомогенный характер, распространяется на 5 – 7 сегментов спинного мозга и, как правило, распространяется в пределах нижне грудного отдела мозга, поясничного утолщения и конуса. Причиной повышения интенсивности сигнала вероятно является вазогенный отек паренхимы мозга, связанный с венозной гипертензией (13). Типичное повышение МР сигнала в режиме Т2 отмечено у всех наших больных (рис.2). Распространенное центральномедуллярное повышение МР — сигнала в Т2 режиме может приводить к ошибочной диагностике инфаркта спинного мозга в бассейне передней спинальной артерии или интрамедуллярной опухоли. Гиперинтенсивный в Т2 участок паренхимы выглядит изо- или слегка гипоинтенсивным при сканировании в режиме Т1 и при
контрастировании может отмечаться равномерное незначительное накопление контраста в участках с патологическим МР — сигналом, что косвенно подтверждает ошибочное предположение о наличии интрамедуллярной опухоли (11,13). Из 5 наших пациентов в 2 случаях после МР – исследования был выставлен диагноз интрамедуллярная опухоль, в 1 случае — спинальный ишемический инсульт. При анализе томограмм и проведении дифференциальной диагностики мы обратили внимание на то, что патологические изменения в спинном мозге при СДАВФ захватывают большое количество сегментов, а расширение мозга в поперечнике при этом выражено не очень значительно, либо отсутствует. Подобная картина нехарактерна для интрамедуллярной опухоли.
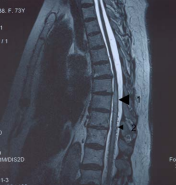
Рисунок 2. МРТ – исследование грудного отдела
позвоночника и спинного мозга в режиме Т2.
Сагиттальный срез. Выявляется зона
патологического усиления МР-сигнала в нижне
грудных сегментах (1) и “flow voids” (2).
Вторым признаком фистулы, который может быть обнаружен при МР – исследовании, является наличие на сагиттальных срезах точечных гипоинтенсивных образований, расположенных преимущественно на дорзальной поверхности спинного мозга. Эти образования, носящие в англоязычной литературе название “flow voids” (области с выпадением МР-сигнала из-за эффектов кровотока) представляют собой попавшие в срез резко расширенные извитые (серпантинные) перимедуллярные вены. Только у одного из пяти наших пациентов на момент поступления в клинику на томограммах, выполненных предварительно в других учреждениях, выявлялся феномен “flow voids”, хотя частота встречаемости данного феномена по литературным данным составляет 45- 90% (15). Всем больным МР-исследование было повторено на аппарате с мощностью магнитного поля 3Т. При исследовании с помощью высокопольного магнита феномен “flow voids” был выявлен у всех пациентов (рис.2). При анализе литературных данных также видно, что показатель встречаемости “flow voids” значительно возрос в работах последнего десятилетия, что, вероятно, связано с
более широким клиническим использованием высокопольных МРТ — аппаратов (11). МР – исследование является не только важным этапом в предварительной диагностике СДАВФ и отборе пациентов на ангиографическое исследование, оно также помогает в дифференциальной диагностике СДАВФ и других видов сосудистых аномалий спинного мозга. При СДАВФ на томограммах отсутствует патологический сосудистый клубок (гнездо) и признаки гемосидероза в паренхиме спинного мозга, что характерно для гломусных АВМ (IIтип класификации 1992), а также гипоинтенсивные сигналы от крупных сосудов, характерные для ювенильных АВМ (IIIтип классификации 1992) (3,5).
Рентгенговская ангиография остается золотым стандартом диагностики СДАВФ, но процедура поиска артерии, питающей фистулу, является сложной задачей. Так как большинство фистул располагается в нижне-грудном и верхне-поясничном отделах позвоночника, в большинстве случаев фистулу удается обнаружить в ходе исследования межреберных и поясничных сегментарных артерий. Известно, что характерные изменения МР-сигнала от паренхимы спинного мозга могут обнаруживаться в нижне-грудных сегментах и поясничном утолщении, а фистула располагаться выше или ниже. При наличии МРТ признаков СДАВФ и отсутствии приводящей артерии в бассейнах межреберных и поясничных сегментарных артерий, необходимы дополнительные исследования общих и внутренних подвздошных, сакральных, вертебральных артерий, глубоких и восходящих шейных артерий, а также восходящей фарингеальной артерии, менингогипофизарного ствола и даже ветвей затылочной артерий (3,5,13). Учитывая возможность большого по объему ангиографического исследования, с целью предварительной локализации фистулы и уменьшения объема селективной рентгеновской ангиографии, 3 больным перед проведением рентгеновской ангиографии была выполнена спинальная МР — ангиография (МРА). МРА проводилась с болюсным введением гадолиния и выполнением исследования в артериальную и венозную фазы в 3-мерном режиме «градиентного эхо» с тонкими срезами, что позволило выявлять эту сосудистую аномалию. Во всех случаях удалось ориентировочно определить расположение фистулы, что значительно сократило объем рентгеновской ангиографии.
При рентгеновской селективной ангиографии выявлено, что в 4 наблюдениях СДАВФ заполнялись из межреберных и в 1 наблюдении из поясничной сегментарной артерии. Сосудистый клубок, характерный для гломусных АВМ или гигантские сосуды, характерные для ювенильных АВМ отсутствовали. Расположение
собственно самой фистулы по ангиограммам определить затруднительно. Хорошо определялись дренажная вена (корешковая вена с ретроградным кровотоком) и серпантинная вена. При использовании ¾ проекций было хорошо видно, что патологическая сосудистая сеть преимущественно располагается на дорзальной поверхности мозга. Зону операции определяли по месту расположения дренажной вены. Ангиографический рисунок серпантинной вены и ход дренажной вены в спинальном субарахноидальном пространстве были аналогичны патологическому сосудистому рисунку, выявляемому в ходе операции (рис.3).
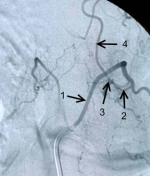
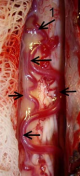
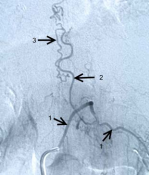
Рисунок 3.Селективная спинальная рентгеновская ангиография (DSA).
А) Контрастирование СДАВФ из сегментарной поясничной артерии. 1- сегментарная артерия, 2 — дренажная вена соустья, 3 — серпантинная вена спинного мозга.
Б) Макроснимок зоны соустья. 1- сегментарная артерия, 2 – радикуломенингеальная артерия, 3 — зона соустья, 4 – дренажная вена соустья.
В) Макроснимок зоны впадения дренажной вены в серпантинную вену. Ангиографическая картина и интраоперационная картина. Отмечается совпадение рисунка хода дренажной и серпантинной вен. 1 — собственно зона слияния вен.
Тактика лечения СДАВФ до настоящего момента остается противоречивой. В качестве операции выбора предлагают использовать эндоваскулярные окклюзии (5,6,8,10) и открытые операции (2,4,7,14). Выбор тромбирующего материала при эндовазальном вмешательстве и методика выполнения открытой операции также не стандартизированы. Трудности в определении оптимальной лечебной тактики связаны с тем, что значительный набор клинического материала при этой патологии произведен главным образом в течение последних 20 лет. Крупные серии наблюдении насчитывают только несколько десятков больных. Наиболее крупные принадлежат Слынько Е.И., Золотоверху А.М. 2010 г. – 92 пациента (4), Atkinson et al. 2001г. – 94 пациента(9). Проспективных рандомизированных сравнительных исследований с
анализом эффективности эндовазальных и открытых операций не проведено. Целью оперативного лечения является предупреждение прогрессирования миелопатии и возможный регресс неврологических расстройств. Преимуществом эндовазальной операции является малоинвазивность, недостатком — сравнительно высокая частота рецидивов и риск послеоперационной ишемии спинного мозга, связанный с проникновением тромбирующего вещества в перимедуллярную венозную сеть. Преимущество открытой операции — высокая степень радикализма, недостаток — риск послеоперационных осложнений в виде псевдоменингоцеле, нагноений раны и возможной нестабильности позвоночника при использовании ламинэктомий.
Метаанализ литературных данных показывает, что частота стабильного положительного эффекта после эндоваскулярного вмешательства составляет в среднем — 46% (вариабельность этого показателя у разных авторов очень высока, он колеблется от 30 до 100%), а после открытых операций — 98%. Нарастание неврологического дефицита после эндоваскулярных вмешательств отмечается в 3,7%, после открытых операций в 1,9%. (15).
Первоначально, операции, проводимые по поводу СДАВФ, предполагали пресечение дренирующей вены и максимально широкое иссечение серпантинной вены по задней поверхности спинного мозга (12). С момента установление современных взглядов на анатомию СДАВФ и патогенез венозной гипертензионной миелопатии эти операции перестали использоваться. Серпантинная вена при СДАВФ более не рассматривается как потенциальный источник компрессии спинного мозга. По настоящим представлениям серпантинная вена представляет собой патологически расширенную заднюю центральную вену спинного мозга, усиление кровотока в ней связано только со сбросом артериальной крови через фистулу. Иссечение этой вены может приводить к усилению ишемии мозга за счет нарушения венозного оттока от него. Современные операции представляют собой два варианта вмешательств, направленных на устранение патологического артериовенозного сброса. Первый вариант — вскрытие дуральной манжетки в проекции фистулы с коагуляцией непосредственно зоны соустья, во втором варианте — коагуляция (с возможным клипированием) и пересечение дренажной вены в субарахноидальном пространстве. Вмешательств на перимедуллярной венозной сети не производится. Вскрытие дуральной манжетки сопряжено с риском послеоперационного радикулярного болевого синдрома т.к. существует риск повреждения корешка (в результате прямой травмы или последующего рубцевания) и псевдоменингоцеле вследствие
трудностей послеоперационная герметизация манжетки. В связи с этим более рациональным представляется доступ к дренажной вене в субарахноидальном пространстве (само соустье в ходе данной операции остается за пределами операционного поля). Подобные операции просты в техническом отношении и отличаются наличием четких анатомических ориентиров (4). Мы использовали именно эту технику операции. Для доступа может быть использована ламинэктомия 2 смежных позвонков, гемиламинэктомия или даже широкий интерламинарный доступ. Во всех случаях нами использовалась ламинэктомия. Ламинэктомический доступа позволял проследить дренажную вену на всем протяжении (от ТМО до впадения в серпантинную вену) и серпантинную вену на протяжении 5 – 6 см. Широкая визуализация давала возможность идентифицировать ангиографическую и интраоперационную картину, коагулировать дренажную вену на всем ее протяжении и при необходимости иссечь, контролировать состояние кровотока по серпантинной вене после пересечения дренажной вены. Контроль за состоянием серпантинной вены позволяет интраоперационно отследить уменьшение напряжения стенки вены и изменение цвета крови, протекающей через нее. После пересечения дренажной вены кровь в серпантинной вене становится более темной и соответствует цвету венозной крови (1,2,4). После пересечения дренажной вены в 4 из 5 наших наблюдений отмечены вышеперечисленные изменения состояния серпантинной вены. Главным недостатком доступа является риск послеоперационной нестабильности.
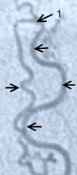
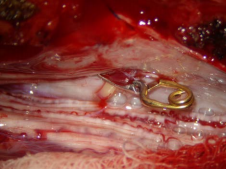
А) Интраоперационная фотография. Место выхода дренажной вены соустья в субарахноидальное пространство.
Б) Дренажная вена после клипирования и пересечения.
Ведущими факторами, позволяющими прогнозировать исход лечения у пациентов со СДАВФ, являются степень выраженности неврологического дефицита и длительность неврологических расстройств (6,11,15). Учитывая выраженность неврологических расстройств у оперированных нами больных, в этой группе трудно было ожидать драматического улучшения состояния и качества жизни. Установка диагноза и проведение оперативного лечения до момента развития грубой инвалидизации позволяет предупредить прогрессирование гипертензионной венозной миелопатии и сохраняет хорошее функциональное состояние больного (4,15). Поэтому для улучшения качества жизни пациентов необходима ранняя диагностика и проведение лечения до момента развития грубых неврологических нарушений.
СДАВФ являются наиболее частой формой сосудистых мальформаций спинного мозга, но при этом остается малоизвестной патологией. Поражение спинного мозга при СДАВФ связано с развитием хронической ишемии мозга вследствие снижения перфузии мозговой ткани. Патологический процесс в спинном мозге носит название —
гипертензионная венозная миелопатия.
Оптимальным скринниговым методом для выявления больных со СДАВФ является МРТ исследование спинного мозга. Признаками СДАВФ являются: наличие протяженной зоны гиперинтенсивного сигнала от паренхимы мозга в Т2 режиме расположенной в нижне-грудных сегментах и поясничном утолщении и феномен “flow
voids”, хорошо выявляемый при исследовании с помощью высокопольных магнитов. При наличии этих признаков диагностический алгоритм должен включать спинальную МР-ангиографию (для возможного уточнения зоны расположения фистулы) и ренгеновскую селективную ангиографию для визуализации приносящей сегментарной артерии, дренажной вены и серпантинной вены.
Целью оперативного лечения является предупреждение прогрессирования миелопатии и возможный регресс неврологических расстройств.
Коагуляция и пересечение дренажной вены соустья является технически простым и эффективным методом лечения больных со СДАВФ, позволяющим добиться улучшения состояния большинства больных, но не приводит к значимому восстановлению функции у пациентов, которые на момент проведения операции уже нуждаются в постороннем уходе. Для улучшения качества жизни пациентов необходима ранняя диагностика и проведение лечения до момента развития грубых неврологических нарушений.
Шкала оценки тяжести состояние больных со СДАВФ M.J. Aminoff 1974г.
| Тяжесть двигательных расстройств | Баллы | Тяжесть сфинктерных расстройств | Баллы |
| Норма. | 0 | Норма | 0 |
| Слабость в ногах, нарушение походки, нет нарушений повседневной активности. | 1 | Императивные позывы, но без эпизодов неудержания мочи или задержек мочеиспускания | 1 |
| Нарушена повседневная активность, но ходит без дополнительной опоры и без посторонней поддержки. | 2 | Эпизоды неудержания мочи или задержек мочеиспускания | 2 |
| Ходит с дополнительной опоры, но без костылей и посторонней поддержки. | 3 | Постоянное неудержание мочи или задержка мочеиспускания | 3 |
| Ходит на костылях или с дополнительной опорой на обе руки. | 4 | ||
| Передвигается только в кресле. | 5 |
Тяжесть клинических проявлений по шкале M.J. Aminoff 1974г., длительность заболевания и уровень расположения фистул у оперированных больных.
фистулы
заболевания
расстройства
расстройства
Динамика неврологических расстройств и функционального статуса после операций.
| Больной | Состояние по шкале M.J. Aminoff 1974г перед операцией | Динамика операции* | Состояние по шкале M.J. Aminoff 1974г после операций | ||||
| двигательные | сфинктерные | Двигатель ные | Чувстви терные | двигательные | сфинктерные | ||
| №1 | 5 | 3 | + | + | + | 5 | 2 |
| №2 | 5 | 3 | = | = | = | 5 | 3 |
| №3 | 4 | 2 | + | + | + | 3 | 2 |
| №4 | 5 | 2 | = | + | + | 5 | 2 |
| №5 | 5 | 3 | + | + | = | 5 | 3 |
1. Зозуля Ю.А., Слынько Е.И. Спинальные сосудистые опухоли и мальформации / Киев. 2000г.
3 Скоромец А.А., Скоромец А.П., Скоромец, Тиссен Т.П.. Спинальная ангионеврология/ Москва. 2003г.
4.Слынько Е.И., Золотоверх А.М. Хирургическое лечение спинальных дуральных артериовенозных фистул // Украинский нейрохирургический журнал. 2010. №4. С. 41 – 45.
5. Тиссен Т.П. Рентгенодиагностика и эндоваскулярное лечение артериовенозных аневризм спинного мозга/ Автореф. Дисс. Доктора мед. Наук. Москва. 1992г.
6. Тиссен Т.П. Эндоваскулярное лечение артериовенозных мальформаций спинного мозга/ Москва. 2006г.
8.Anson JA, Spetzler RF: Classification of spinal arteriovenous malformations and implications for treatment//BNI Quarterly. 1992. Vol. 8. P.2–8.
9.Atkinson JLD,Miller GM, KraussWE, Marsh WR, Piepgras DG, Atkinson PP, et al. Clinical and radiographic features of dural arteriovenous fistula, a treatable cause of myelopathy // Mayo Clin. Proc. 2001. Vol. 76. P. 1120–30.
10. Geibprasert S., Pereira V., Krings T. et al. Dural Arteriovenous Shunts A New Classification of Craniospinal Epidural Venous Anatomical Bases and Clinical Correlations // Stroke. 2008. Vol. 39. P. 2783-2794
11.Jelema K., Tijssen C.C., van Gijn J. Spinal dural arteriovenous fistulas: congestive mielopathy that initially mimics a peripheral nerve disorder// Brain. 2006. Vol. 129. P. 3150 – 3164.
12. Krayenbuhl H, Yasargil MG, McClintock HG. Treatment of spinal cord vascular malformations by surgical excision // J. Neurosurg. 1969. Vol. 30. P. 427–35.
14.Spetzler R, Detwiler P, Riina H, Porter R. Modified classification of spinal vascular lesions// J. Neurosurg. 2002, Vol.96. P. 145–56.
15.Steinmetz MP, Chow MM, Krishnaney AA, Andrews-Hinders D, Benzel EC, Masaryk TJ, et al. Outcome after the treatment of spinal dural arteriovenous fistulae: a contemporary single-institution series and meta-analysis// Neurosurgery. 2004. Vol. 55. P. 77–87.
16. Strom R.G. Derdeyn C.P., Moran C.J. et al. Frequency of spinal arteriovenous malformations in patients with unexplained mielopathy // Neurology. 2006. Vol.66. P. 928 – 931.
17. Thron A. Spinal dural arteriovenous fistulas // Radiologie. 2001. Vol. 41. P. 955 – 960.