фокальная кортикальная дисплазия головного мозга у детей
Фокальная кортикальная дисплазия головного мозга у детей
Хотя отдельные фокальные дисплазии включают участки полимикрогирии (ПМГ), большинство из них обычно не являются полимикрогирии с гистологической точки зрения, поэтому предпочтительнее неоднозначное определение фокальная корковая дисплазия, включающее аномалии как миграции, так и организации, а в отдельных случаях нарушения пролиферации и дифференцировки нейробластов. Значительное число сообщений в литературе об эпилепсии появилось за последние 20 лет (см. Janota и Polkey, 1992, Guerrini и Filippi, 2005). Очаговые дисплазии могут быть обнаружены в любой области коры. Нередко встречается оперкулярная дисплазия (Ambrosetto, 1992, Sebire et al., 1996).
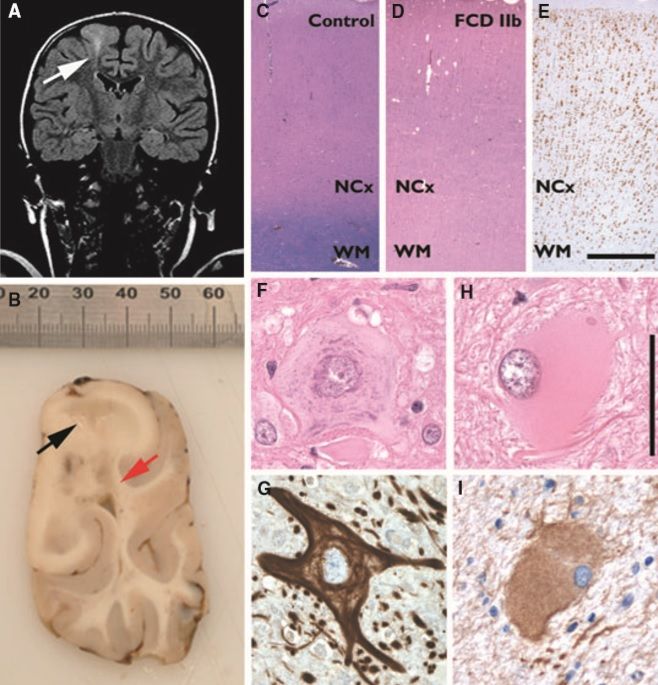
Действительно, многие случаи локализованной кортикальной дисплазии избирательно поражают эту область. В области корковой дисплазии кора уплотнена, а извилины увеличены. Гистологическая картина варьирует от простой дезорганизации пластинок или колонок с субкортикальными гетеротопическими нейронами до более сложных аномалий с гигантскими нейронами и клетками, подвергшимися баллонной дистрофии, а также гигантскими многоядерными астроцитами (Taylor et al; 1971, Tassi et al., 2002; Alonso-Nanclares et al., 2005).
Классификация этих мальформаций с патологической точки зрения остатеся предметом дискуссий (Palmini et al., 2004). Выделено по меньшей мере два типа, известные как тейлоровская и не-тейлоровская кортикальная дисплазия. В недавней классификации (Tassi et al., 2002) выделено три типа: архитектоническая дисплазия, при которой нарушается корковая структура, но гигантские нейроны или аномальные клетки отсутствуют; цитоархитектоническая дисплазия, где в дополнение к патологически организованной коре имеются гигантские и/или дисморфические нейроны; и тейлоровский тип дисплазии, при котором также присутствуют «баллонные клетки», напоминающие повреждения при туберозном склерозе.
Эти клетки окрашиваются как нейрональными, так и глиальными маркерами и являются следствием раннего нарушения клеточной дифференцировки. Кортикальные дисплазии могут поражать любую часть коры и рассматриваются в качестве основной причины очаговой эпилепсии, часто трудно поддающейся лечению. Тейлоровский тип обычно преобладает в лобных и теменных долях, тогда как другие типы чаще встречаются в височных долях (Kuzniecky et al., 1994). Основным клиническим проявлением являются очаговые судороги (Hamiwka et al; 2005, Fauser et al., 2006) часто, но не всегда устойчивые к медикаментозному лечению (см. главу 15). У четырех детей сообщалось о небольших участках корковой дисплазии, которые могли отвечать за очаговый корковый миоклонус и фокальные двигательные судороги (Kuzniecky et al., 1986). Подобные повреждения были обнаружены в случае с эпилептическим статусом (Desbiens et al., 1993).

Большие нейроны неправильно расположены в пределах коры.
Отдельные нейроны с характерной периферической конденсацией хроматина.
В недавних исследованиях микроанатомии, молекулярного патогенеза и патофизиологии этих повреждений описана подробная структура с демонстрацией присущего им эпилептогенного потенциала (Bentivoglio et al., 2003; Alonso-Nanclares et al., 2005; Crino, 2005).
Визуализация данной патологии основывается на MPT исследовании, но выявление может оказаться непростым и потребовать новейших методов МР. Тем не менее, значительная часть случаев может остаться нераспознанной. Тейлоровский тип дисплазии может иметь отличительные МР признаки в виде особенно высокого сигнала в белом веществе под повреждением, иногда распространяющегося до желудочка (так называемая трансмантийная корковая дисплазия) (Barkovich et al., 1997). Архитектонические и цитоархитектонические дисплазии чаще проявляются истонченной корой на MPT (Tassi et al., 2002).
Фокальная кортикальная дисплазия может сопровождаться опухолями дисэмбриогенеза (ганглиоглиомами и нейроэпителиальными опухолями) в этой же области мозга.
Хирургическое лечение эпилепсии в результате очаговой дисплазии возможно в значительной доле случаев и способно купировать судороги (Tassi et al., 2002; Cascino et al., 2004; Fauser et al., 2004, 2006; Hamiwka et al., 2005).
Большинство случаев кортикальной дисплазии относятся к спорадическим, но встречаются и семейные случаи (Kuzniecky et al., 1994).
Некоторые редкие синдромы проявляются напоминающей пахигирию корой в сочетании с внемозговыми аномалиями: врожденный нефроз у мужских сиблингов (Robain и Deonna, 1983; Palm et al., 1986), семейная лимфэдема и агенезия червя мозжечка (Hourihane et al., 1993), врожденная короткая кишка (Nezelof et al., 1976), и семейная пахигирия с диссеминированной кальцификацией мозга и атаксией (Harbord et al., 1990).
Основной интерес при очаговой корковой дисплазии заключается в перспективах хирургического лечения. Этот вопрос будет обсуждаться в отдельной статье на сайте.
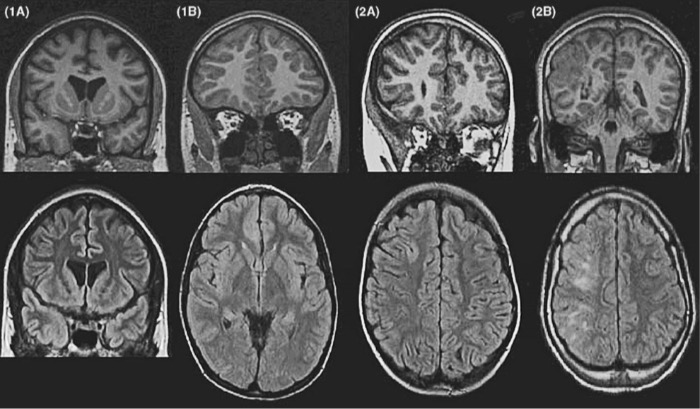
Т2-взвешенная МРТ: определяются области патологической коры в правой лобной доле с высоким сигналом в подлежащей аномальной коре.
После резекции патологического участка был достигнут контроль над судорогами, (в центре) МРТ:
(другой мальчик с судорогами) заметны диспластические участки в возрасте шести месяцев, которые в 18 месяцев стали более очевидными (справа).
— Вернуться в оглавление раздела «Неврология.»
Редактор: Искандер Милевски. Дата публикации: 29.11.2018
Фокальная кортикальная дисплазия головного мозга у детей
Пороки развития коры (ПРК), также известные, как нарушения нейрональной миграции или кортикальная дисплазия, включают гетерогенную группу заболеваний в результате изменения трех эмбриологических периодов, происходящих между 8-й и 16-й неделями внутриутробной жизни: клеточная пролиферация зародышевых листков, миграция нейронов и организация клеток в коре головного мозга.
Такой измененный кортикогенез может быть генетически детерминированным или возникнуть в результате экзогенной травмы (внутриутробные и/или даже перинатальные причины), хотя его этиопатогенез часто неясен. Сложный и многофакторный этиопатогенез пороков развития коры (ПРК) объясняется их возможную связь с некоторыми неврологическими синдромами.
Пороки развития коры (ПРК) являются одними из ведущих причин детской ФРЭ (до 40% детей с ФРЭ и половина из тех, кто подвергается хирургическому лечению эпилепсии при воздействии ПРК). Даже если электрокортикография демонстрирует эпилептизацию диспластической коры, внутренние механизмы начала припадков по-прежнему остаются практически неизвестными. Последние молекулярные исследования на животных и человеческих клетках указывают на роль NMDA и АМРА-рецепторы глутамата.
Различные формы порока развития коры (ПРК) отличаются макроскопически, но имеют ряд общих микроскопических особенностей, как серого, так и белого вещества. Они включают:
1. Кортикальную деламинацию (корковая ламинарная и столбчатая дезорганизация).
2. Плохую дифференциацию серого/белого вещества.
3. Отсутствие миелинизации.
4. Глиоз.
5. Микроскопическая нейрональная гетеротопия (островки неправильно расположенных нейронов).
6. Волокона Розенталя (периваскулярные эозинофильные тельца и волокна в результате дегенерации астроглии).
7. Баллонные клетки (аномальные и сильно увеличенные в размере клетки, со стекловидной и эозинофильной цитоплазмой и эксцентричным ядром, имеющие иногда положительный ответ на глиальные маркеры, а иногда и на нейронные).
8. Гигантские нейроны (увеличение размеров нейронов с центральными ядрами и нормальной морфологией).
9. Незрелые нейроны (нормального размера, круглой формы и однородными нейронами, с большим и незрелым ядром, небольшой цитоплазмой и нормальной морфологией).
10. Дисморфоз нейронов (нервные клетки с аномальным размером, формой, ядром, цитоплазмой и дендритами, имеющие тигроид и цитоплазматические нейрофиламенты).
Порок развития коры (ПРК) может включать в себя только некоторые области коры (фокальная корковая дисплазия) или несколько долей (квадрантная дисплазия) до целого полушария (гемимегалэнцефалия).
а) Очаговые пороки развития. Фокальная кортикальная дисплазия (ФКД). ФКД является локализованным ПРК, наиболее часто связанным с ФРЭ в детском возрасте. Она включает в себя целый спектр изменений, начиная от легкой корковой деструкции до более тяжелых форм. По данным Palmini et al., она может быть разделена на два типа. Тип IA/B нелегко обнаружить при МРТ, его клиническая картина варьирует от отсутствия эпилепсии до ФРЭ и когнитивных нарушений. Тип ПА/В, как правило, хорошо распознается при МРТ (см. ниже), часто связан с плохо поддающейся лечению и катастрофической эпилепсией, и имеет, соотвественно, худший прогноз.
Приступы и неврологические симптомы варьируют в зависимости от расположения ФКТ, которая, как правило, имеет вневисочную локализацию (и часто располагается около роландовой борозды). Фокальные двигательные припадки и генерализованный эпилептический статус, о которых сообщается в 30% случаев в детстве и подростковом возрасте, с течением времени становятся более отягощенными. Раннее начало припадков связано с худшими результатами и более высокой частотой неврологических нарушений и умственной отсталости. Сенсорно-моторный дефицит описывается у 50-75% пациентов, у половины из которых уровень IQ ниже 80.
Паттерны ЭЭГ обычно состоят из изолированных эпилептиформных разрядов и фокальных замедлений, часто вовлекая более протяженные участки мозга, чем анатомические границы патологического очага, и /или серий повторяющихся эпилептиформных разрядов (4-10 Гц ритмические спайк-волны или 2-7 Гц ритмические острые волны), как правило, более ограниченных, чем размер поражения по данным нейровизуализации.
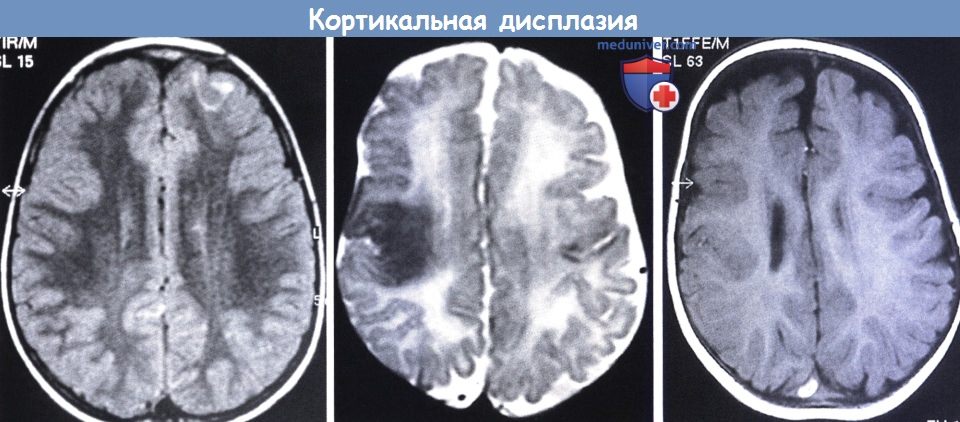
ФКД, выявляемая при МРТ, характеризуется очаговым утолщением коры головного мозга, затенением на границе серого и белого вещества, повышением сигнала на Т2-взвешенных и протонной плотности последовательностях (от поверхности коры до желудочка в случае фокальной трансмантийной дисплазии), иногда повышением после введения контрастного вещества. Примерно в одной трети случаев данные МРТ в норме.
Тотальное хирургическое иссечение очагов дисплазии является одним из наиболее важных прогностических факторов. Результат зависит от правильного предоперационного планирования на основе нейровизуализации и по интраоперационным находкам, выявляемым хирургом. Достижение контроля над припадками ожидается в 60-75% случаев. Такой уровень имеет тенденцию к снижению со временем, так что требуется длительное наблюдение.
1. Шизэнцефалия. Шизэнцефалия является заболеванием, характеризующимся односторонним или двусторонним расщеплением, обычно от мягкой мозговой оболочки лобной или теменной доли до бокового желудочка, с выстилкой дизламинированной и полимикроглиальной корой головного мозга. При варианте с «закрытыми (или сомкнутыми) краями» стенки расщепления накладываются друг на друга, а при форме с «открытыми краями» они разделены, соединяя полость желудочков и субарахноидальное пространство. Могут присутствовать другие аномалии, такие как гетеротопия серого вещества, склероз гиппокампа, мозолистого тела и/или агенезия прозрачной перегородки.
Эпилепсия поражает 35-85% пациентов с шизэнцефалией, как правило, начиная с первых двух десятилетий жизни и, обычно, проявляется более ранним началом и худшими результатами при двусторонних и/или открытых формах. Часто присутствуют задержка психического развития и двигательный дефицит. Хирургическое лечение малоэффективно.
2. Склероз гиппокампа (СГ). Атрофии гиппокампа (50-85%) и миндалевидного тела (30-60%), которые часто встречаются у детей с пороком развития коры (ПРК) височной доли, а также у лиц с вневисочными мальформациями (до 35%), но они могут возникнуть также изолированно (чистый СГ). Нет особых различий между чистым СГ и СГ с сопутствующим пороком развития коры (ПРК) относительно анамнеза, приступов и прогноза, а приступы исчезают после операции у 90% пациентов.
3. Гетеротопия серого вещества. Это неправильное положение массы серого вещества, локализованной перивентрикулярно или в подкорковом белом веществе, часто двустороннее, в результате нарушения процесса миграции. Картина эпилептических припадков разнообразна; лучший результат наблюдается при изолированных формах (как правило, при вовлечении области желудочкового треугольника).
б) Диффузная полушарная мальформация:
Гемимегалэнцефалия (ГМЭ). ГМЭ является прототипом врожденного полушарного порока развития коры (ПРК) с диспластической гипертрофией одного полушария, в то время как второе полушарие не поражается вообще или только в легкой степени. Действительно, последние гистологические, нейрофизиологические исследования и нейровизуализации предполагают постоянное, хотя незначительное вовлечение «здорового» полушария. Несмотря на многочисленные теории, этиопатогенез ГМЭ остается неизвестным. Ее можно рассматривать как сложную аномалию развития в результате нарушения нейронной пролиферации (первичное событие, с 3 по 4 неделю беременности), возможно последующее нарушение миграции (вторичное событие, между 12 и 20 неделями). Специфические гены не идентифицированы.
Гемимегалэнцефалия (ГМЭ) возникает с частотой 1-3/1000 у детей, страдающих эпилептическими припадками и составляет 1-14% всех пороков развития коры (ПРК) и 30-50% аномалий, требующих выполнения гемисферэктомии. Заболевание может проявляться как изолированная аномалия (спорадическая и наиболее распространенная) или может быть связано с частичным или полным гемигигантизмом тела и/или нейрокожным синдромом (например, синдром невуса Ядассона, синдром Протея, гипомеланоз Ито, синдром Клиппеля-Треноне-Вебера). При «тотальной ГМЭ» вовлекаются также гомолатеральные структуры задней черепной ямки.
Микроскопические особенности ГМЭ отчасти или полностью совпадают с описанными для других пороков развития коры (ПРК). Макроскопически определяются увеличенные полушария, гиперваскуляризация и широкий спектр аномалий развития коры (например, агирия, пахигирия, полимикрогирия, лиссэнцефалия). Такие изменения могут включать в себя все полушарие или его часть (как правило, задние отделы), в височной доле часто отмечается атрофия.
Асимметричная макрокрания, как правило, не проявляющаяся повышенным внутричерепным давлением, является типичным внешним проявлением.
Гемимегалэнцефалия (ГМЭ) является наиболее тяжелой формой ПРК, а у большинства пациентов в течение нескольких недель или месяцев с момента рождения развивается КЭ. Типичная клиническая триада состоит из ФРЭ, контралатерального медленно прогрессирующего гемипареза и гемианопсии, с (тяжелой) задержкой психомоторного развития. Припадки возникают почти у 90% пациентов, могут наблюдаться большинство из синдромов, представленных в таблице ниже. Эпилепсия обычно начинается в раннем послеродовом периоде, как мягкие парциальные припадки и/или асимметричные спазмы и/или латерализованные миоклонические подергивания, часто превращаясь в синдром Ота-хара или синдром Веста. Впоследствии могут появляться синдром Леннокса-Гасто или тяжелые моторные парциальные припадки/кортикальная эпилепсия. Ранняя резистентность к противосудорожной терапии является практически правилом.
Ранняя межприступная ЭЭГ обычно показывает односторонний паттерн «вспышка-подавление», способный измениться или смениться гемигипсаритмией. Поздний ЭЭГ-паттерн состоит из еще более дезорганизованой и непрерывной активности над пораженным полушарием, возможно распространение на противоположную сторону. Указанные макроскопические диспластические состояния, такие как увеличение полушария, аномалии развития извилин, дисплазия коры, плохая дифференцировка серого/белого вещества и гетеротопии, могут быть выявлены при МРТ.
Гомолатеральная желудочковая система, как правило, расширена, с прямым фронтальным рогом и расширенным затылочным, но она также может быть нормальной или уменьшенной. На поздних стадиях болезни пораженное полушарие может атрофироваться.
Даже сопряженная с высокой смертностью и инвалидизацией гемисферэктомия является выбором при лечении ГМЭ. На самом деле, практически у 80-90% пациентов, подвергнутых гемисферэктомии, отмечается длительный период без судорог, с таким же уровнем показателей, как при менее тяжелой форме ФРЭ, требующей гемисферэктомии. Тем не менее, двигательные и когнитивные результаты могут оставаться плохими у значительной доли оперированных пациентов.
Мультилобарная кортикальная дисплазия включает полушарную ПРК, которая не может быть классифицирована как ГМЭ из-за менее распространенных диспластических областей и довольно больших неизмененных регионов. Заднеквадрантная дисплазия, в соответствии с определением, данным D’Agostino et al., является своеобразным ПРК, вовлекающим височную, затылочную и теменную доли (постцентральная извилина исключена). Этиопатогенетическая гипотеза будет такой же, как при ГМЭ, с частичным вовлечением полушария чем можно объяснить мозаичность. Гистологические, клинические характеристики и нейровизуализации похожи на ГМЭ, за исключением вовлечения структур передних отделов полушария и более легкого клинического течения. Можно выполнять мультилобарные резекции вместо гемисферэктомии, получая такие же хорошие результаты с небольшим хирургическим риском, если только нет предоперационного моторного дефицита и/или ЭЭГ аномалии не являются гологемисферическими.



Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фокальная кортикальная дисплазия
Фокальная кортикальная дисплазия (ФКД) является одной из основных причин развития резистентных к терапии фокальных эпилептических приступов.
О резистентности к терапии говорят в тех случаях, когда приступы сохраняются после применения двух базовых, одобренных для данной формы эпилепсии антиэпилептических препаратов (АЭП) в максимально переносимых дозах последовательно (в виде монотерапии) или в комбинации.
Стоит отличать резистентность от «псевдорезистентности», к которой могут привести: неправильно установленный диагноз (например, психогенные приступы), неправильно выбранные АЭП (например, карбамазепин при абсансах или миоклонических приступах), не адекватную возрасту дозировку АЭП, несоблюдение пациентом предписаний врача и др. Термин «фокальная кортикальная дисплазия» был впервые употреблен Дэвидом Тейлором, описавшим 10 больных с резистентной к терапии эпилепсией, у которых были обнаружены нарушения кортикального развития. Сегодня его именем (тейлоровская кортикальная дисплазия) называют дисплазии IІ типа.
В настоящее время ФКД относят к разновидностям обширной группы патологий под названием нарушения кортикального развития (НКР).

Напомним, что в пределах коры наблюдается чередование слоев, содержащих преимущественно тела нервных клеток, со слоями, образованными в основном их аксонами, и поэтому, например, на свежем срезе кора головного мозга выглядит «полосатой». На основании формы и расположения нервных клеток в коре с типичным строением можно выделить шесть слоев, некоторые из них подразделяются на два или более вторичных слоя.
В соответствии со строением коры выделяют следующие основные зоны: новую кору (неокортекс), старую кору (архикортекс), древнюю кору (палеокортекс) и межуточную кору (периархикортикальную и перипалеокортикальную). Неокортекс является наиболее обширной зоной коры и занимает дорсальную и латеральную поверхность больших полушарий, в то время как палеокортекс находится на базальной и медиальной поверхности полушарий.
В неокортексе различают следующие слои:
I. Молекулярный. В этом слое имеется множество волокон, образующих густое тангенциальное (т. е. с направлением волокон по касательной относительно коры) поверхностное сплетение. Клеток незначительное количество, в основном это звездообразные мелкие клетки, которые осуществляют местную интеграцию деятельности эфферентных нейронов.
II. Наружный зернистый. Содержит мелкие нейроны различной формы, которые имеют синаптические связи с нейронами молекулярного слоя на всем поперечнике коры. В глубине располагаются малые пирамидные клетки.
III. Наружный пирамидный. Этот слой состоит из пирамидных клеток малой и средней величины. Некоторые отделы коры в этом слое содержат крупные пирамидные клетки. Часть отростков этих клеток достигает первого слоя, участвуя в формировании тангенциального подслоя, другие погружаются в белое вещество полушарий мозга.
IV. Внутренний зернистый. Характеризуется рыхлым расположением мелких нейронов различной величины и формы с преобладанием звездчатых, имеющих дугообразные возвратные аксоны. Аксоны клеток проникают в выше- и нижележащие слои.
V. Внутренний пирамидный. Состоит в основном из средних и больших пирамидных клеток (клеток Беца). Эти нейроны обладают длинными апикальными дендритами, достигающими молекулярного слоя, а также базальными дендритами, распространяющимися более или менее тангенциально по отношению к поверхности. Эти слои четко выражены в передней центральной извилине и незначительно — в других участках коры. Из этого слоя в основном формируются двигательные произвольные пути (проекционные эфферентные волокна).
VI. Полиморфный. В этом слое расположены преимущественно веретеновидные нейроны с короткими извитыми верхушечными дендритами, заканчивающимися в V и IV слоях коры. Аксоны многих клеток слоя объединяются в возвратные волокна, проникая в V слой. Наиболее глубокая часть этого слоя переходит в белое вещество.
Гистопатология и этиология
Нарушения коркового развития представляют собой различные изменения в строении коры головного мозга в результате патологии внутриутробного развития (конкретнее — нарушения клеточного формирования коры). Они могут быть локальными или диффузными, а также могут сочетаться с другими аномалиями головного мозга (патологиями мозжечка, гиппокампа, сосудистыми мальформациями, опухолями ЦНС и др.). Их этиология до конца неизвестна.
К возможным этиологическим факторам можно отнести генетические изменения, химические мутагены, ионизирующую радиацию, вирусные инфекции. Вид порока зависит не от природы повреждающего агента, а от возраста эмбриона.
Пороки головного мозга могут развиться на всех этапах эмбрионального и частично в фетальном периоде. Если «поломка» происходит во время формирования прозэнцефалона (2–3-й месяц внутриутробного развития), то возникают грубые пороки, например, голопрозэнцефалия, формирующаяся в строго фиксированные для ее развития сроки — 22–24-й дни внутриутробного развития. Наибольший интерес для клинициста представляют пороки развития головного мозга, формирующиеся вследствие аномальных процессов развития мозга с 6-й по 20-ю неделю внутриутробного развития:
ФКД гистологически проявляется:
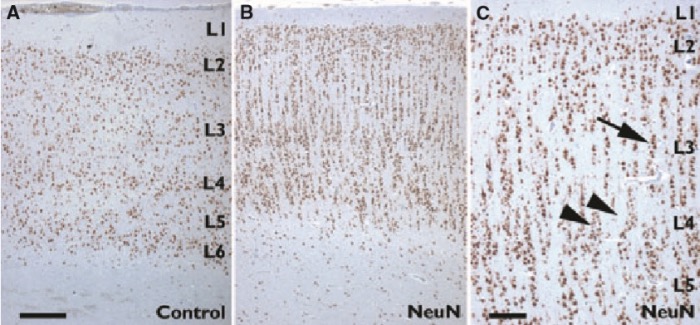
Кортикальная дисламинация в той или иной степени выражена при всех типах ФКД, однако наиболее выражена она при ФКД I типа, причем может нарушаться как радиальная (горизонтальная) архитектоника, так и тангенциальная, а при Iс типе наблюдаются оба варианта. Также при первом типе может возникать цитомегалия.
Эктопированные нейроны в белом веществе могут встречаться при различных НКР и имеют невысокий эпилептогенный потенциал.
Второй тип ФКД характеризуется (в дополнение к нарушениям цитоархитектоники коры) появлением диспластических нейронов при типе IIa, а при типе IIb — диспластических нейронов и баллонных клеток.
Диспластические нейроны имеют следующие отличия от нормальных нейронов:
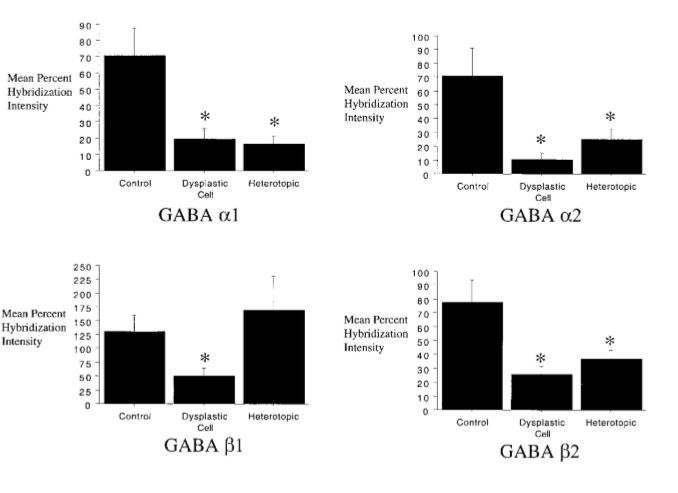
Такие дисморфичные нейроны формируют скопления, что приводит к локальному утолщению коры, иногда такие скопления «выпячиваются» в белое вещество.Также стоит заметить, что эти нейроны обладают крайне высоким эпилептогенным потенциалом. В сравнении с неизмененными корковыми клетками эти клетки формируют большее количество синаптических связей при заметном снижении количества «тормозных» ГАМКергических интернейронов.
Скопление диспластических клеток представляет собой патологическую нейрональную сеть, в которой постоянно циркулируют процессы возбуждения. В дополнение к этому у больных с дисплазией IIb типа отмечено нарушение деятельности ГАМКергической системы с изменением количества разных подтипов рецепторов. Этот факт важно учитывать при назначении препаратов, имеющих влияние на ГАМК-рецепторы.
Баллонные клетки при ФКД встречаются во всех слоях коры (включая первый) и отличаются увеличенными ядрами, часто — несколькими ядрами с «мостиками» между ними, опалесцирующей цитоплазмой и отсутствием субстанции Ниссля. Интересно, что баллонные клетки также можно найти в кортикальных туберах больных туберозным склерозом.
Клиническая картина
ФКД могут быть диагностированы только по данным нейровизуализационного (МРТ) исследования, верифицированы — гистологически. Клиническая картина позволяет заподозрить данное нарушение, однако специфического клинического паттерна у ФКД нет.
Основным проявлением ФКД является эпилепсия. Реже в качестве основного проявления выступают различные двигательные и когнитивные нарушения.
Эпилепсия при ФКД обычно характеризуется резистентностью к терапии и ранним дебютом. Наиболее частый возраст появления клинических проявлений — в интервале от первых месяцев до 4-х лет. ФКД II типа дебютирует достоверно позже, в диапазоне от младенческого до подросткового возраста. Дебют эпилепсии во взрослом возрасте — редкое, но не казуистическое явление. Описаны случаи начала приступов в возрасте после 50 лет. Нет явного превалирования по признаку пола.
ФКД может проявляться практически всеми видами эпилептических приступов, а также эпилептическими энцефалопатиями. Общими чертами приступов являются:
ФКД I типа
Довольно характерным проявлением являются инфантильные спазмы. В этиологии 30 % инфантильных спазмов участвует тот или иной тип нарушения кортикального развития.
При ФКД инфантильным спазмам часто предшествуют другие, чаще фокальные «вегетативные» приступы: миоклонические, тонические, окулотонические. Эти приступы иногда можно заметить с первых дней жизни ребенка. Инфантильные спазмы присоединяются после 4‒6 месяцев. Для ФКД более характерны несимметричные спазмы: неравномерное вовлечение конечностей, поворот головы и глаз в сторону, нистагм (очаг располагается контрлатерально быстрому компоненту нистагма).
Характерно нарушение поведения перед приступом, что является проявлениями «ауры»: «замирание» и «сосредотачивание» ребенка, он как будто прислушивается к своим ощущениям; улыбка, смех, реже — внезапный плач, испуг. При локализации очага в затылочной области (наиболее частая локализация Iа типа) аура проявляется зрительными галлюцинациями и иллюзиями, при этом ребенок может закрывать глаза руками, пытаясь избавиться от неприятных ощущений. Дебют любых приступов до 3 месяцев жизни — фактор будущей резистентности и крайне неблагоприятного прогноза.
Периодические спазмы обычно дебютируют в более позднем возрасте. Их характеризует неизменность (приступы не меняют проявлений, не исчезают и не перетекают в другие формы эпилепсии на протяжении многих лет). Приступы возникают серийно, причем каждой серии предшествуют фокальные приступы и нарушения сознания разной степени. Собственно спазмы проявляются серийными приступами с короткими нарушениями аксиальной мускулатуры: кивок, наклон туловища, сведение и разведение рук. Можно заметить ассиметричность спазмов и фокальные проявления в виде наклона глаз и головы в сторону или одностороннего спазма лицевой мускулатуры. Фокальные приступы могут возникать до, после серии спазмов и в серии между «основными» приступами. Длительность серии обычно составляет от 3 до 30 минут.
Среди других проявлений можно отметить фокальные моторные и диалептические приступы, а также вторично-генерализованные приступы. При обширных дисплазиях нередки псевдогенерализованные приступы: атипичные абсансы, эпилептический миоклонус, генерализованные тонические и атонические приступы.
Для ФКД Ia типа характерны: ранний дебют эпилепсии, тяжелая умственная отсталость (что коррелирует с возрастом начала приступов) и врожденные двигательные нарушения (церебральный паралич). Типичная локализация — задневисочно-теменно-затылочная область.
Характерен также феномен распространения эпилептической активности с патологического очага на всю гемисферу или «переброс» на здоровую гемисферу — феномен вторичной билатеральной синхронизации, что обуславливает вторично-генерализованные приступы. Клиническая картина может напоминать синдромы Ленокса-Гасто и Дозе.
Для ФКД Ib типа характерен более поздний дебют и менее тяжелое течение.
ФКД II типа
Заболевание дебютирует, как правило, в более позднем возрасте. Наиболее часто возникают тонические приступы, симметричные или асимметричные, возможно, с дополнительным моторным компонентом. Характерны также приступы, связанные со сном (в т.ч. эпилепсия с электрическим эпилептическим статусом медленного сна).
При вовлечении сенсомоторной коры может развиваться картина Кожевниковской эпилепсии.
Лучевые признаки
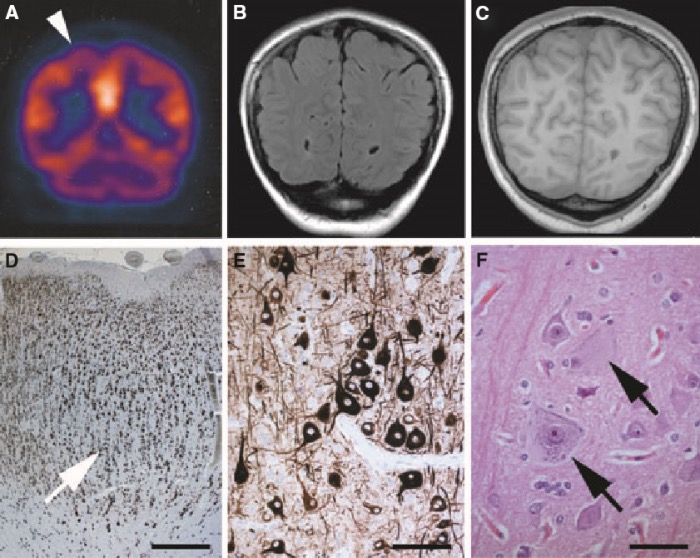
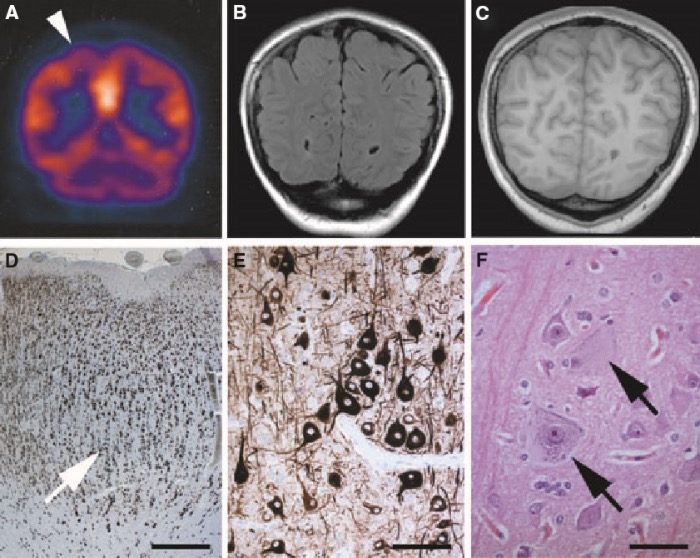
Стандартом визуализации ФКД является МРТ. Иногда (чаще в случае предоперационного планирования) используется ПЭТ- и ОФЭКТ-КТ, однако их доступность крайне невысока.
МР-исследование должно проводиться на аппарате с индукцией магнитного поля не менее 1,5 Тесла. Протокол сканирования при подозрении на ФКД должен включать в себя:
Крайне желательно, чтобы протокол поиска ФКД, как и любой вариант “эпилептического протокола”, включал в себя хотя бы одну из названных последовательностей в режиме тонких срезов (1–2мм).
Режим FLAIR не имеет диагностической ценности для детей до 1 года, пока процессы миелинизации волокон головного мозга не завершены. У различных типов фокальной кортикальной дисплазии существует много схожих черт, а отдельные типы при МРТ могут не иметь выявляемых изменений.
Основные черты фокальной кортикальной дисплазии включают:
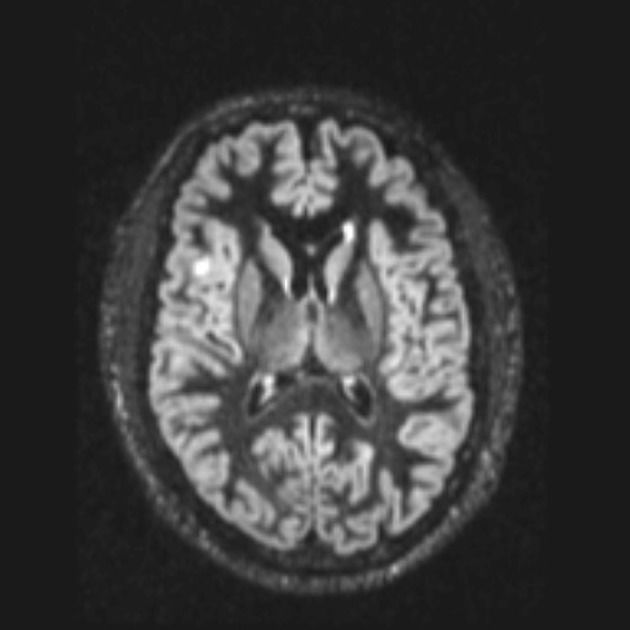
Трансмантийная дисплазия (трансмантийный признак) — высокая интенсивность сигнала на T2/FLAIR, который простирается от желудочков к коре. Он также связан с другими особенностями фокальной кортикальной дисплазии, такими как утолщение коры, размытие границы между серым и белым веществом и снижение сигнала на Т1-ВИ.
МР-изображение в DIR-последовательности: заметное повышение сигнала и утолщение коркового слоя правой лобной области
В отличие от патологов, использующих классификацию Барковича, радиологи чаще пользуются классификацией фокальной кортикальной дисплазии Blumcke (2011), которая учитывает, в первую очередь, локализацию (так как различить гистологические типы по данным МРТ не представляется возможным):
I тип
Локализация
Структура
размытость границ серого и белого вещества (менее выражена, чем при II типе ФКД), выраженная “сегментарная” или долевая атрофия/гипоплазия с локальной потерей объема белого вещества.
МР сигнал
белое вещество: промежуточно повышенный МР сигнал на T2/FLAIR взвешенных изображениях, сниженный МР сигнал на T1 взвешенных изображениях.
II тип
Локализация
часто встречается в лобных долях, менее часто, по сравнению с ФКД I типа, в височных долях.
Структура
изменение структуры борозд и извилин, выраженная размытость границ серого и белого вещества, утолщение коры.
МР сигнал
кора остается гипоинтенсивной по отношению к повышеному сигналу от белого вещества, на Т2 взвешенных изображениях — более выраженный, чем при I типе
III тип
Фокальная кортикальная дисплазия III типа характеризуется наличием ряда сочетанных нарушений
Учитывая наличие разных классификаций, необходимо указывать, какая именно была использована при формировании заключения (например, “ФКД Iа типа по Blumcke”).
Лечение
Лекарственная терапия
Медикаментозное лечение при ФКД часто неэффективно, причем, если после назначения первого АЭП не произошло улучшения, это говорит о высокой вероятности дальнейшей резистентности к терапии.
При эпилептических спазмах у детей младенческого возраста рекомендуется начинать лечение с вигабатрина или кортикостероидов, при фокальных приступах — с карбамазепина, при псевдогенерализованных — с вальпроатов. При эпилептических спазмах (включая периодические спазмы) у больных ФКД стероиды могут работать хуже, чем вигабатрин. При этом предпочтительнее использовать вигабатрин в высоких дозах в комбинированной терапии (обычно с вальпроатом).
При частых приступах и высоком индексе эпилептиформной активности на ЭЭГ у больных ФКД I типа рекомендуют применение фенитоина и вигабатрина. Поскольку у больных ФКД IIb типа нарушено функционирование ГАМКергических систем с незрелостью ГАМК-рецепторов, следует с осторожностью назначать препараты из группы транквилизаторов и другие вещества, влияющие на ГАМК-рецепторы.
К сожалению, даже при эффективности терапии возможно ухудшение состояния больных. У пациентов с ФКД описаны рецидивы приступов после 2–11 лет лекарственной ремиссии.
Хирургическое лечение
У 50–60 % больных ФКД после хирургического вмешательства эпилептические приступы прекращаются, причем исходы по приступам не зависят от возраста оперированных пациентов.
Исходы оперативного вмешательства существенно хуже у больных ФКД I типа, чем у больных ФКД II типа: 50 % и меньше — достижение ремиссии после операции у 1-й категории пациентов, 70–90 % — во 2-й. Наилучшие результаты хирургического лечения достигаются у больных с ФКД IIb типа. Исходы операции при ФКД I типа во многом зависят от объема резекции. При выполнении фокальных кортикальных или мультилобарных резекций ремиссия приступов наступает лишь у 21 % больных ФКД I типа, а при выполнении гемисферэктомии — у 70 % в течение первых 6 месяцев после операции и у 60 % — в течение 5 лет.
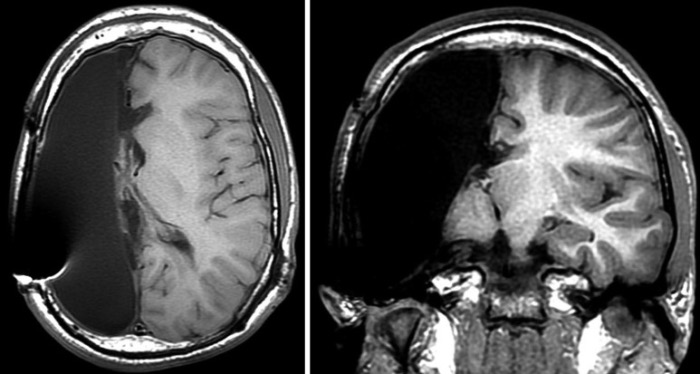
При обширных ФКД I типа при отсутствии гемипареза у детей возможно проведение операции в объеме «все, кроме двигательной коры» («everything, but motor»): диссекция всего полушария, за исключением моторной коры и ее связей. Это позволяет максимально «изолировать» диспластическую кору и избежать развития гемипареза. При неудаче данной операции и продолжении приступов выполняется уже полная диссекция пораженного полушария.