gdp надлежащая дистрибьюторская практика
Gdp надлежащая дистрибьюторская практика
от 3 ноября 2016 года N 80
3. Настоящее Решение вступает в силу по истечении 10 календарных дней с даты вступления в силу Протокола, подписанного 2 декабря 2015 года, о присоединении Республики Армения к Соглашению о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, но не ранее чем по истечении 10 календарных дней с даты официального опубликования настоящего Решения.
Члены Совета Евразийской
экономической комиссии:
От Республики Армения
В.Габриелян
От Республики Беларусь
В.Матюшевский
От Республики Казахстан
А.Мамин
От Кыргызской Республики
О.Панкратов
От Российской Федерации
И.Шувалов
УТВЕРЖДЕНЫ
Решением Совета
Евразийской экономической комиссии
от 3 ноября 2016 года N 80
Правила надлежащей дистрибьюторской практики в рамках Евразийского экономического союза
I. Общие положения
1. Настоящие Правила являются частью системы обеспечения качества и устанавливают правила в отношении дистрибьюции лекарственных средств.
2. Требования настоящих Правил применяются в отношении всех лиц, участвующих в дистрибьюции лекарственных средств в соответствии с выполняемыми ими функциями, включая дистрибьюторов и производителей лекарственных средств, независимо от ведомственной принадлежности и формы собственности.
Целью надлежащей дистрибьюторской практики является соблюдение надлежащих условий хранения, транспортировки и распространения, необходимых для обеспечения качества, безопасности и эффективности лекарственных средств по всей цепи поставки, а также предотвращения риска проникновения фальсифицированных лекарственных средств в цепь поставки.
Соблюдение требований настоящих Правил обеспечит контроль цепи поставки и позволит сохранить качество и целостность лекарственных средств.
II. Определения
4. Для целей настоящих Правил используются понятия, которые означают следующее:
«качество» совокупность свойств и характеристик лекарственного средства, влияющих на его способность действовать по назначению;
Для целей настоящих Правил:
понятия «ключевой этап» и «значимое изменение» применяются в отношении любого процесса, который способен повлиять на показатели качества лекарственного средства либо изменить стабильность их сохранения с учетом вида номенклатурных позиций (лекарственной дефектуры), с которыми работает конкретный дистрибьютор;
понятия «значимый», «надлежащий» и «достаточный» применительно к любому процессу или элементу системы дистрибьюции лекарственных средств означают, что данный процесс или элемент способен обеспечить выполнение требований настоящих Правил и гарантировать работу системы обеспечения качества таким образом, чтобы своевременно установить любое отклонение от показателей качества лекарственного средства либо изменения стабильности их сохранения с учетом вида номенклатурных позиций (лекарственной дефектуры), с которыми работает конкретный дистрибьютор;
под клиентами понимаются поставщики, аутсорсинговые организации, получатели (покупатели) лекарственных средств, а также все субъекты сферы обращения лекарственных средств, с которыми дистрибьютор находится в договорных отношениях (вне зависимости от того, оформлен договор в устной или письменной форме), и др.;
понятие «расследование» означает установление причинно-следственной связи между возникшим отклонением в дистрибьюторской цепи и возможными факторами, лежащими в его основе, выполненное дистрибьютором или аутсорсинговой организацией.
III. Основная часть
1. Управление качеством
1.1. Принцип
5. Дистрибьюторы создают и поддерживают систему качества, определяющую обязанности, процессы и принципы управления рисками в отношении осуществляемой ими деятельности. Все действия, связанные с дистрибьюцией, должны быть однозначно определены и проанализированы. Ключевые этапы процесса оптовой реализации (включая наиболее значимые изменения) должны быть обоснованы и при необходимости валидированы. Ответственность за функционирование системы качества несет руководитель организации. Персонал организации должен надлежащим образом исполнять обязанности, связанные с функционированием системы качества.
1.2. Система качества
6. Система управления качеством включает в себя организационную структуру, процедуры, процессы и ресурсы, а также действия, необходимые для обеспечения сохранения качества и целостности поставляемых лекарственных средств и невозможности их фальсификации в процессе хранения и (или) транспортировки.
7. Система качества должна быть полностью документирована, ее эффективность должна подвергаться мониторингу и анализу. Действия персонала, относящиеся к системе качества, должны быть описаны в соответствующих письменных процедурах. Необходимо внедрить и поддерживать в актуальном состоянии руководство по качеству.
8. Руководством организации назначается ответственное лицо, наделенное полномочиями и обязанностями для обеспечения внедрения и поддержания в актуальном состоянии системы качества.
Все части системы качества должны быть надлежащим образом обеспечены компетентным персоналом, достаточным количеством помещений, оборудования и технических средств.
9. При создании, поддержании или изменении системы качества необходимо учитывать организационную структуру, объем выполняемых работ и услуг и многоплановость деятельности дистрибьютора.
10. У дистрибьютора должна быть внедрена система управления изменениями, которая должна быть пропорциональной и эффективной, а также основанной на принципах управления рисками для качества.
11. Система качества должна гарантировать следующее:
а) лекарственные средства приобретаются, хранятся, транспортируются, поставляются или экспортируются с соблюдением требований настоящих Правил;
б) обязанности руководства организации четко определены;
в) лекарственные средства доставляются надлежащим получателям в согласованный период времени;
г) документальное оформление действий осуществляется в ходе выполнения или непосредственно после завершения соответствующих действий;
д) отклонения от установленных процедур документально оформляются и в их отношении проводятся расследования;
е) необходимые корректирующие и предупреждающие действия предпринимаются для устранения отклонений и предупреждения их появления в соответствии с принципами управления рисками для качества.
1.3. Управление деятельностью, передаваемой для выполнения другому лицу (аутсорсинг)
12. Система качества включает в себя контроль и анализ деятельности, переданной на аутсорсинг и относящейся к приобретению, хранению, транспортировке, поставке или экспорту. Деятельность по аутсорсингу должна учитывать возможные риски для качества и содержать:
а) оценку пригодности и компетентности исполнителя выполнить обязательства по договору должным образом, а также проверку наличия у исполнителя необходимых разрешительных документов в соответствии с законодательством государств-членов;
б) определение ответственности, порядка взаимодействия сторон и обмена информацией о действиях в рамках мероприятий, относящихся к качеству;
в) мониторинг и анализ деятельности исполнителя, а также определение и внедрение на регулярной основе мер, необходимых для улучшения.
1.4. Мониторинг и анализ со стороны руководства
13. Руководство организации должно установить формализованный процесс периодического обзора системы качества. Обзор должен включать в себя:
а) оценку степени достижения целей системы качества;
б) оценку показателей эффективности, которые могут быть использованы для мониторинга эффективности таких процессов системы качества, как количество претензий, отклонений от установленных норм, эффективность корректирующих и предупреждающих действий, изменения в процессах, отзывы о деятельности по аутсорсингу, процессы самопроверки (включая анализ рисков и аудиты), результаты внешнего контроля (включая инспекции и аудиты), выявленные несоответствия, аудиты клиентов;
в) изменения, внесенные в нормативные правовые акты, руководства, а также возникновение новых обстоятельств, связанных с качеством, которые могут оказать влияние на систему управления качеством;
г) инновации, которые могут повысить эффективность системы качества;
д) изменения в деловой среде и поставленных целях.
14. Результаты обзора системы качества со стороны руководства должны быть своевременно документально оформлены и доведены до сведения персонала.
Сертификат GMP: подтверждение качества лекарственных средств
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
Принятие решения о выдаче заключения по результатам инспекционного отчета
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Сектор здравоохранения Курс по надлежащей дистрибьюторской практике (GDP) в фармацевтической отрасли
Этот курс знакомит участников с системой обеспечения качества для складских предприятий и оптовых баз в сфере обращения лекарственных средств.
Надлежащая дистрибьюторская практика свидетельствует о приверженности качеству во всех аспектах деятельности организации по отношению к заказчикам и фармацевтической отрасли.
Курс по GDP знакомит участников с требованиями надлежащей дистрибьюторской практики в фармацевтической отрасли и ее роли в обеспечении безопасности средств медицинского применения при транспортировке и хранении. Соответствие требованиям GDP является доказательством того, что организация поставляет продукцию высокого качества, как и полагается производителям лекарственных средств, и, следовательно, представляет собой надежного партнера в цепи поставок фармацевтической продукции.
Нормативно-правовые требования GDP оказывают большое влияние на фармацевтическое производство. Наш курс дает слушателям возможность поделиться опытом и мыслями по поводу GDP в отношении производства лекарственных средств с коллегами и ведущими специалистами отрасли.
В ходе тренинга рассматриваются вопросы, связанные с цепью поставок лекарственных средств для человека: начиная с изготовления сырья и заканчивая производством готовой продукции. Особое внимание уделяется процессам складирования и оптовой реализации.
Содержание курса:
К окончанию курса участники смогут:
Курс включает лекции и семинарские занятия.
Свяжитесь с нами прямо сейчас, чтобы узнать больше о предлагаемых SGS тренингах по надлежащей дистрибьюторской практике.
Сектор здравоохранения Сертификация на соответствие надлежащей дистрибьюторской практике (GDP) в фармацевтической отрасли
Сохранение безопасности и качества продукции в ходе ее оптовой реализации имеет исключительно важное значение в фармацевтической отрасли.
Сертификация на соответствие надлежащей дистрибьюторской практике (GDP) в фармацевтической отрасли свидетельствует о вашем ответственном отношении к требованиям этого стандарта и качеству всех направлений вашей деятельности.
Надлежащая дистрибьюторская практика (GDP) — это система обеспечения качества для складских предприятий и оптовых баз в сфере обращения лекарственных средств. Согласно принятым на международном уровне правилам GDP дистрибьюторы фармацевтической продукции должны привести свою деятельность в соответствие с этими стандартами. Реализация правил GDP обеспечивает наличие во всей цепи поставок согласованных систем менеджмента качества: начиная с доставки сырья на производственные предприятия и заканчивая отгрузкой готовой продукции конечным пользователям. Независимая оценка — самый эффективный способ подтверждения соответствия вашей системы менеджмента качества международным требованиям GDP.
SGS является признанным во всем мире лидером в сфере сертификации предприятий фармацевтического сектора. В процессе сертификации на соответствие требованиям GDP в фармацевтической отрасли наши высококвалифицированные аудиторы проанализируют процессы и методы, применяемые на вашем предприятии, а также у ваших партнеров по цепи поставок, чтобы убедиться в постоянном высоком качестве поставляемой вами продукции.
Действующий сертификат GDP, выданный компанией SGS, продемонстрирует стремление вашей организации к поддержанию высокого качества всех аспектов своей деятельности и ее надежности и незаменимости в цепи поставок средств медицинского применения. Свяжитесь с нами, чтобы узнать больше о сертификации на соответствие надлежащей дистрибьюторской практике в фармацевтической отрасли.
Gdp надлежащая дистрибьюторская практика
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.
Программа разработана совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 80 “Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза”
В соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года, статьей 11 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, пунктом 85 приложения № 1 к Регламенту работы Евразийской экономической комиссии, утвержденному Решением Высшего Евразийского экономического совета от 23 декабря 2014 г. № 98, и Решением Высшего Евразийского экономического совета от 23 декабря 2014 г. № 108 «О реализации Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза» Совет Евразийской экономической комиссии решил:
1. Утвердить прилагаемые Правила надлежащей дистрибьюторской практики в рамках Евразийского экономического союза.
2. Правила, утвержденные настоящим Решением, вступают в силу по истечении 1 года с даты вступления в силу Протокола, подписанного 2 декабря 2015 г., о присоединении Республики Армения к Соглашению о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года.
3. Настоящее Решение вступает в силу по истечении 10 календарных дней с даты вступления в силу Протокола, подписанного 2 декабря 2015 года, о присоединении Республики Армения к Соглашению о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, но не ранее чем по истечении 10 календарных дней с даты официального опубликования настоящего Решения.
Члены Совета Евразийской экономической комиссии:
От Республики Армения
В. Габриелян
От Республики Беларусь
В. Матюшевский
От Республики Казахстан
А. Мамин
От Кыргызской Республики
О. Панкратов
От Российской Федерации
И. Шувалов
Правила
надлежащей дистрибьюторской практики в рамках Евразийского экономического союза
(утв. решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 80)
I. Общие положения
1. Настоящие Правила являются частью системы обеспечения качества и устанавливают правила в отношении дистрибьюции лекарственных средств.
2. Требования настоящих Правил применяются в отношении всех лиц, участвующих в дистрибьюции лекарственных средств в соответствии с выполняемыми ими функциями, включая дистрибьюторов и производителей лекарственных средств, независимо от ведомственной принадлежности и формы собственности.
Целью надлежащей дистрибьюторской практики является соблюдение надлежащих условий хранения, транспортировки и распространения, необходимых для обеспечения качества, безопасности и эффективности лекарственных средств по всей цепи поставки, а также предотвращения риска проникновения фальсифицированных лекарственных средств в цепь поставки.
Соблюдение требований настоящих Правил обеспечит контроль цепи поставки и позволит сохранить качество и целостность лекарственных средств.
II. Определения
4. Для целей настоящих Правил используются понятия, которые означают следующее:
Для целей настоящих Правил:
понятия «ключевой этап» и «значимое изменение» применяются в отношении любого процесса, который способен повлиять на показатели качества лекарственного средства либо изменить стабильность их сохранения с учетом вида номенклатурных позиций (лекарственной дефектуры), с которыми работает конкретный дистрибьютор;
понятия «значимый», «надлежащий» и «достаточный» применительно к любому процессу или элементу системы дистрибьюции лекарственных средств означают, что данный процесс или элемент способен обеспечить выполнение требований настоящих Правил и гарантировать работу системы обеспечения качества таким образом, чтобы своевременно установить любое отклонение от показателей качества лекарственного средства либо изменения стабильности их сохранения с учетом вида номенклатурных позиций (лекарственной дефектуры), с которыми работает конкретный дистрибьютор;
под клиентами понимаются поставщики, аутсорсинговые организации, получатели (покупатели) лекарственных средств, а также все субъекты сферы обращения лекарственных средств, с которыми дистрибьютор находится в договорных отношениях (вне зависимости от того, оформлен договор в устной или письменной форме), и др.;
понятие «расследование» означает установление причинно-следственной связи между возникшим отклонением в дистрибьюторской цепи и возможными факторами, лежащими в его основе, выполненное дистрибьютором или аутсорсинговой организацией.
III. Основная часть
1. Управление качеством
1.1. Принцип
5. Дистрибьюторы создают и поддерживают систему качества, определяющую обязанности, процессы и принципы управления рисками в отношении осуществляемой ими деятельности. Все действия, связанные с дистрибьюцией, должны быть однозначно определены и проанализированы. Ключевые этапы процесса оптовой реализации (включая наиболее значимые изменения) должны быть обоснованы и при необходимости валидированы. Ответственность за функционирование системы качества несет руководитель организации. Персонал организации должен надлежащим образом исполнять обязанности, связанные с функционированием системы качества.
1.2. Система качества
6. Система управления качеством включает в себя организационную структуру, процедуры, процессы и ресурсы, а также действия, необходимые для обеспечения сохранения качества и целостности поставляемых лекарственных средств и невозможности их фальсификации в процессе хранения и (или) транспортировки.
7. Система качества должна быть полностью документирована, ее эффективность должна подвергаться мониторингу и анализу. Действия персонала, относящиеся к системе качества, должны быть описаны в соответствующих письменных процедурах. Необходимо внедрить и поддерживать в актуальном состоянии руководство по качеству.
8. Руководством организации назначается ответственное лицо, наделенное полномочиями и обязанностями для обеспечения внедрения и поддержания в актуальном состоянии системы качества.
Все части системы качества должны быть надлежащим образом обеспечены компетентным персоналом, достаточным количеством помещений, оборудования и технических средств.
9. При создании, поддержании или изменении системы качества необходимо учитывать организационную структуру, объем выполняемых работ и услуг и многоплановость деятельности дистрибьютора.
10. У дистрибьютора должна быть внедрена система управления изменениями, которая должна быть пропорциональной и эффективной, а также основанной на принципах управления рисками для качества.
11. Система качества должна гарантировать следующее:
а) лекарственные средства приобретаются, хранятся, транспортируются, поставляются или экспортируются с соблюдением требований настоящих Правил;
б) обязанности руководства организации четко определены;
в) лекарственные средства доставляются надлежащим получателям в согласованный период времени;
г) документальное оформление действий осуществляется в ходе выполнения или непосредственно после завершения соответствующих действий;
д) отклонения от установленных процедур документально оформляются и в их отношении проводятся расследования;
е) необходимые корректирующие и предупреждающие действия предпринимаются для устранения отклонений и предупреждения их появления в соответствии с принципами управления рисками для качества.
1.3. Управление деятельностью, передаваемой для выполнения другому лицу (аутсорсинг)
12. Система качества включает в себя контроль и анализ деятельности, переданной на аутсорсинг и относящейся к приобретению, хранению, транспортировке, поставке или экспорту. Деятельность по аутсорсингу должна учитывать возможные риски для качества и содержать:
а) оценку пригодности и компетентности исполнителя выполнить обязательства по договору должным образом, а также проверку наличия у исполнителя необходимых разрешительных документов в соответствии с законодательством государств-членов;
б) определение ответственности, порядка взаимодействия сторон и обмена информацией о действиях в рамках мероприятий, относящихся к качеству;
в) мониторинг и анализ деятельности исполнителя, а также определение и внедрение на регулярной основе мер, необходимых для улучшения.
1.4. Мониторинг и анализ со стороны руководства
13. Руководство организации должно установить формализованный процесс периодического обзора системы качества. Обзор должен включать в себя:
а) оценку степени достижения целей системы качества;
б) оценку показателей эффективности, которые могут быть использованы для мониторинга эффективности таких процессов системы качества, как количество претензий, отклонений от установленных норм, эффективность корректирующих и предупреждающих действий, изменения в процессах, отзывы о деятельности по аутсорсингу, процессы самопроверки (включая анализ рисков и аудиты), результаты внешнего контроля (включая инспекции и аудиты), выявленные несоответствия, аудиты клиентов;
в) изменения, внесенные в нормативные правовые акты, руководства, а также возникновение новых обстоятельств, связанных с качеством, которые могут оказать влияние на систему управления качеством;
г) инновации, которые могут повысить эффективность системы качества;
д) изменения в деловой среде и поставленных целях.
14. Результаты обзора системы качества со стороны руководства должны быть своевременно документально оформлены и доведены до сведения персонала.
1.5. Управление рисками для качества
15. Управление рисками для качества является систематическим процессом оценки, контроля, обмена информацией и обзора рисков для качества лекарственных средств. Этот процесс может проводиться как перспективно, так и ретроспективно.
Управление рисками для качества предполагает, что оценка рисков для качества основывается на научных знаниях, практическом опыте работы и направлена на защиту здоровья пациента. Объем работ по управлению рисками для качества и документальное оформление результатов оценки рисков должны быть соизмеримыми с уровнем риска. Примеры процессов и инструментов по управлению рисками приведены в правилах надлежащей производственной практики Евразийского экономического союза, утверждаемых Евразийской экономической комиссией.
2. Персонал
2.1. Принцип
16. Выполнение требований надлежащей дистрибьюторской практики зависит от человеческого фактора. Дистрибьютор должен иметь достаточное количество квалифицированного персонала для решения всех задач, за которые отвечает организация. Каждый работник должен знать и понимать требования надлежащей дистрибьюторской практики в части, касающейся его деятельности. Каждый работник должен понимать индивидуальную ответственность, которая должна быть документирована.
2.2. Ответственное лицо
18. Ответственное лицо должно выполнять свои обязанности лично. Доступ к контактам с ответственным лицом должен быть обеспечен в постоянном режиме. Ответственное лицо может делегировать часть своих обязанностей, но не ответственность.
19. Полномочия ответственного лица по принятию решений в рамках своих должностных обязанностей, а также необходимые ресурсы для их выполнения должны быть определены должностной инструкцией. Ответственное лицо должно быть наделено четко определенными полномочиями, ресурсами и зонами ответственности, необходимыми для выполнения возложенных на него обязанностей.
20. Ответственное лицо должно выполнять свои обязанности таким образом, чтобы дистрибьютор мог подтвердить соблюдение надлежащей дистрибьюторской практики.
21. К обязанностям ответственного лица относятся:
а) обеспечение внедрения и поддержания системы управления качеством;
б) концентрация на управлении установленной деятельностью и на обеспечении точности и качества записей;
в) обеспечение внедрения и поддержания программ первичного и последующего обучения для всего персонала, вовлеченного в процесс дистрибьюции;
г) координирование и своевременная организация отзыва лекарственных средств из обращения;
д) обеспечение эффективной работы с претензиями покупателей (получателей);
е) утверждение поставщиков и получателей;
ж) утверждение передачи на аутсорсинг деятельности, потенциально влияющей на соблюдение надлежащей дистрибьюторской практики;
з) обеспечение проведения самоинспекций в соответствии с установленной периодичностью и подготовленной программой, а также принятия необходимых корректирующих мер;
и) хранение необходимых записей, относящихся к делегированным обязанностям;
к) принятие решений относительно возвращенных, отозванных, отклоненных, признанных недоброкачественными, фальсифицированных лекарственных средств;
л) одобрение возвращения лекарственных средств в категорию пригодных для реализации;
м) обеспечение соблюдения любых дополнительных требований, установленных в отношении определенной продукции законодательством государств-членов.
2.3. Прочий персонал
22. Дистрибьютор должен иметь достаточное количество квалифицированных работников, вовлеченных в деятельность по дистрибьюции лекарственных средств на всех ее этапах. Количество работников определяется объемами выполняемых работ и требованиями законодательства государств-членов.
23. Организационная структура дистрибьютора оформляется в виде схемы и утверждается руководителем. Функции, обязанности и взаимодействие работников должны быть четко обозначены.
24. На работников, занимающих ключевые должности, должны быть составлены должностные инструкции, в которых определяются их должностные обязанности, а также порядок их замещения другими работниками.
2.4. Обучение
25. Все работники, вовлеченные в деятельность по дистрибьюции лекарственных средств, должны пройти обучение по вопросам, касающимся надлежащей дистрибьюторской практики, иметь необходимую квалификацию до начала выполнения своих должностных обязанностей.
Работники должны проходить первичное и последующее обучение в соответствии с выполняемыми ими обязанностями на основании письменно оформленных процедур и программы обучения. Ответственное лицо должно поддерживать компетентность персонала в области надлежащей дистрибьюторской практики посредством регулярного обучения.
Дополнительно обучение должно включать аспекты идентификации продукции и предотвращения попадания в цепь поставки фальсифицированных лекарственных средств.
26. Персонал, работающий с продукцией, в отношении которой установлены более жесткие условия обращения, должен пройти специальную подготовку. Примерами такой продукции являются огнеопасные, взрывоопасные, легковоспламеняющиеся, легкогорючие, радиоактивные материалы, лекарственные средства, подлежащие особому контролю в соответствии с законодательством государств-членов, термолабильные лекарственные средства).
27. Записи о проведении обучения подлежат хранению, а эффективность обучения должна периодически оцениваться и документироваться.
2.5. Гигиена
28. Должны быть установлены и должны соблюдаться соответствующие процедуры по гигиене труда и личной гигиене работников, применимые к осуществляемой деятельности. Эти процедуры должны включать требования, относящиеся к здоровью, гигиене и одежде.
3. Помещения и оборудование
3.1. Принцип
29. Дистрибьютор должен иметь пригодные помещения, оборудование для обеспечения надлежащего хранения и распространения лекарственных средств. Помещения должны быть чистыми, сухими, в них должны поддерживаться требуемые температурный режим и влажность.
3.2. Помещения
30. Помещения должны быть спроектированы или приспособлены таким образом, чтобы обеспечить соблюдение требуемых условий хранения. Они должны быть защищенными, прочными и обладать достаточной вместимостью для безопасного хранения лекарственных средств и обращения с ними. Для обеспечения точности и безопасности всех проводимых операций зоны хранения должны иметь надлежащую освещенность.
31. В случае если помещение не принадлежит непосредственно дистрибьютору, данное помещение может использоваться дистрибьютором по договору аренды (субаренды) либо на основании иного вещного (имущественного) или обязательственного права. Помещения, используемые для хранения лекарственных средств, должны вводиться в эксплуатацию в соответствии с законодательством государств-членов.
32. Лекарственные средства должны храниться соответствующим образом в выделенных и четко обозначенных зонах, доступ в которые разрешен только персоналу, имеющему на это право. Любая система, заменяющая физическое разделение зон хранения (например, компьютеризированная система), должна обеспечивать эквивалентный уровень безопасности и быть валидирована.
Лекарственные средства, в отношении которых не принято окончательное решение об обращении или обращение которых приостановлено, должны быть изолированы либо физически, либо с применением электронной системы, обеспечивающей эквивалентное разделение. Данное требование относится, например, к любой продукции с подозрением на фальсификацию и к возвращенной продукции.
Любая фальсифицированная продукция, продукция с истекшим сроком годности, отозванная продукция, а также забракованная (отклоненная в цепи поставки) продукция должна быть немедленно физически изолирована и размещена в специально выделенной зоне, отделенной от других лекарственных средств, пригодных для дистрибьюции. Лекарственные средства, полученные из третьих стран и не предназначенные для обращения на рынке Союза, также должны быть физически изолированы.
Предпринятые меры безопасности должны гарантировать, что данные зоны обеспечивают хранение продукции отдельно от лекарственных средств, пригодных для дистрибьюции, и в условиях, исключающих их поступление в свободное обращение. Данные зоны должны быть идентифицированы (обозначены) надлежащим образом и защищены от неправомерного доступа.
Радиофармацевтические и другие опасные лекарственные средства, а также огнеопасные и взрывоопасные лекарственные средства (например, медицинские газы, легковоспламеняющиеся жидкости и твердые вещества) должны храниться в специально отведенных зонах в соответствии с законодательством государств-членов с применением соответствующих мер безопасности и должны быть защищены от неправомерного доступа.
33. В зонах приемки и отгрузки должны быть обеспечены защита от воздействия погодных условий, адекватное разделение зон приемки, отгрузки и хранения, а также должны быть разработаны процедуры, определяющие порядок осуществления контроля за входящими и исходящими потоками лекарственных средств. Должны быть специально определены и обеспечены надлежащим оборудованием зоны приемки, используемые для проверки полученной продукции.
В зоне приемки должна быть предусмотрена очистка тары.
34. Необходимо обеспечить наличие охранной системы, позволяющей предотвращать неправомерное проникновение в любые помещения с контролируемым доступом. Предупредительные меры, как правило, должны включать в себя охранную сигнализацию с системой мониторинга и пропускной режим. Посетители не должны находиться в помещениях без сопровождения.
35. Помещения и оборудование для хранения должны быть чистыми, в них не должны накапливаться пыль и мусор. Должны быть в наличии программы, документированные процедуры, записи по очистке помещений и оборудования. Оборудование, инвентарь и материалы, используемые для уборки (очистки), а также моющие и дезинфицирующие средства должны выбираться, использоваться и храниться таким образом, чтобы они не явились источником контаминации.
36. Помещения должны быть спроектированы и оснащены таким образом, чтобы обеспечить защиту от проникновения насекомых, грызунов или других животных. Должна быть разработана программа профилактического контроля вредителей.
37. Комнаты отдыха, гардеробные комнаты, душевые и туалеты для работников должны быть надлежащим образом отделены от зон хранения. Наличие пищевых продуктов, напитков, табачных изделий, а также лекарственных средств для личного использования в помещениях склада запрещено.
3.2.1. Контроль за температурой и условиями производственной среды помещения
38. Должны быть в наличии соответствующее оборудование, а также регламентирующие процедуры документы (например, стандартные операционные процедуры) для контроля за условиями производственной среды помещения.
К условиям производственной среды помещения, которые могут потребовать контроля, относятся температура, освещенность, влажность и чистота в помещениях.
39. Необходимо выполнить первоначальное изучение распределения температуры (температурное картирование) в помещениях для хранения перед началом их использования с соблюдением условий, отражающих параметры эксплуатации. Оборудование для контроля температуры должно быть размещено в соответствии с результатами анализа температурного картирования в точках наиболее значительного колебания температуры.
Температурное картирование необходимо повторять в соответствии с результатами анализа рисков или в случае существенных изменений в устройстве помещения или оборудовании для контроля температуры.
В случае если площадь помещений, используемых для хранения при комнатной температуре, не превышает нескольких квадратных метров, должен быть проведен анализ потенциальных рисков (например, наличия отопительных приборов) и оборудование для контроля температуры должно быть размещено в соответствии с результатами анализа.
3.3. Оборудование
40. Оборудование, оказывающее влияние на хранение и реализацию лекарственных средств, проектируется, размещается и обслуживается согласно инструкциям по его использованию (эксплуатации). Должен быть утвержден план технического обслуживания наиболее значимого для выполнения соответствующих операций оборудования.
41. Оборудование (средства измерений), используемое для контроля или мониторинга условий хранения лекарственных средств, должно быть поверено в порядке, установленном законодательством государств-членов, и откалибровано в определенные межповерочные интервалы исходя из анализа рисков и надежности оборудования.
При калибровке оборудования должна быть обеспечена метрологическая прослеживаемость используемых эталонов к национальным или международным эталонам единиц величин.
42. Для оперативного выявления отклонений от требуемых условий хранения необходимо использовать соответствующие системы сигнализации. Уровень оповещения должен быть установлен соответствующим образом. Системы сигнализации должны периодически тестироваться для обеспечения их надлежащего функционирования.
43. Операции по ремонту, обслуживанию, поверке и калибровке оборудования должны осуществляться таким образом, чтобы качество лекарственных средств не подвергалось негативному влиянию. При необходимости должен быть создан резервный фонд пригодных оборудования и средств измерений для использования во время ремонта, обслуживания или поверки.
44. Операции по ремонту, обслуживанию и калибровке наиболее значимого оборудования должны быть соответствующим образом документально оформлены, документация должна быть сохранена.
К наиболее значимому оборудованию относятся кондиционеры, холодильные камеры (холодильники) или устройства, охранная и пожарная сигнализация, системы контроля доступа, вентиляционная система, система увлажнения и (или) осушения воздуха, термогигрометры (психрометры) или иное оборудование, используемое для регистрации температуры и влажности, а также оборудование, используемое для транспортировки.
3.3.1. Компьютеризированные системы
45. Перед началом использования компьютеризированной системы необходимо продемонстрировать с помощью валидации или верификации, что система способна получать заданные результаты точно, единообразно и воспроизводимо.
46. Должно быть в наличии письменное детальное описание компьютеризированной системы (включая по возможности диаграммы). Такое описание должно поддерживаться в актуальном состоянии и должно включать в себя принципы, цели, меры безопасности, область применения и основные функциональные особенности, а также порядок использования и интерфейс для взаимодействия с другими системами.
47. Ввод данных в компьютеризированную систему или их изменение должны осуществляться только работниками, ответственными за данный вид работы. Компьютеризированная система должна регистрировать все изменения в системе с указанием пользователя, совершающего эти изменения.
48. Должны быть предусмотрены физические или электронные средства для защиты данных от случайного или неправомерного внесения изменений. Доступность сохраненных данных должна регулярно проверяться. Необходимо на регулярной основе создавать резервные копии сохраненных данных. Резервные копии данных, введенных в компьютеризированную систему, должны храниться в соответствии со сроками, установленными законодательством государств-членов, но не менее 5 лет, в изолированном и безопасном месте.
49. Должны быть предусмотрены процедуры, определяющие порядок действий в случае сбоев в работе системы или выхода ее из строя, а также меры по восстановлению данных.
3.3.2. Квалификация и валидация
50. Организация должна определить ключевое оборудование и процессы, которые подлежат квалификации и (или) валидации с целью подтверждения надлежащего монтажа и эксплуатации. Объем проводимых работ по квалификации и (или) валидации (например, хранение, подготовка к отгрузке и упаковка) определяется на основе документально оформленного анализа рисков.
Оборудование и процессы должны быть квалифицированы и (или) валидированы до начала эксплуатации или после любого значительного изменения (например, после ремонта или технического обслуживания).
Проведение валидации или квалификации оформляется отчетами, в которых должны быть обобщены полученные результаты, а также даны объяснения выявленным отклонениям.
51. Отклонения от установленных процедур документально оформляются, разрабатываются меры, направленные на их устранение, а также на предотвращение их появления в будущем (корректирующие и предупреждающие действия). Необходимость осуществления корректирующих и предупреждающих действий определяется на основе статистического прогнозирования (применение Байесовских моделей прогнозирования), применения концепции анализа фармацевтических рисков и инструментов по управлению рисками, приведенных в правилах надлежащей производственной практики Евразийского экономического союза. Должны быть получены доказательства успешной валидации и приемлемости процесса или оборудования, которые утверждаются соответствующими работниками.
4. Документация
4.1. Принцип
52. Надлежащая документация является неотъемлемой частью системы качества. Задачами документации являются предотвращение ошибок, которые могут возникать вследствие устной коммуникации, и отслеживание отдельных операций в процессе дистрибьюции лекарственных средств.
4.2. Общие требования
53. К документации относятся: письменные процедуры, инструкции, договоры, записи, отчеты, протоколы испытаний и другие бумажные или электронные носители информации, на которых регистрируются данные. Документация должна быть легко доступна для персонала дистрибьютора и восстанавливаема.
54. Обработка персональных данных работников дистрибьютора, лиц, направивших претензии, а также любых других физических лиц осуществляется в соответствии с требованиями законодательства государств-членов, предусматривающими порядок обработки, хранения персональных данных, включая передачу персональных данных третьим лицам.
55. Документация должна в достаточной степени охватывать все процессы, выполняемые дистрибьютором, и быть понятной работникам. Текст документов должен быть однозначным, не допускающим двусмысленных толкований и ошибок.
56. Процедуры должны быть утверждены, подписаны и датированы ответственным лицом. Документация должна быть утверждена, подписана и датирована специально назначенными лицами, согласно установленным требованиям. Документация не должна оформляться от руки. В тех случаях, когда внесение рукописных записей необходимо, должно быть предусмотрено наличие необходимых полей.
57. Любые исправления, внесенные в документацию, должны быть датированы и подписаны, исправления должны быть внесены таким образом, чтобы сохранялась возможность прочтения первоначальных записей. При необходимости следует указывать причины внесения исправлений.
58. Документация подлежит хранению в течение срока, установленного законодательством государств-членов, но не менее 5 лет. Персональные данные работников должны быть уничтожены или обезличены, как только их хранение перестает требоваться для целей дистрибьюции лекарственных средств.
59. Каждый работник должен иметь оперативный доступ к документации, необходимой для выполнения своих должностных обязанностей.
60. Особое внимание должно уделяться использованию действующих и утвержденных в установленном порядке процедур. Должны быть четко обозначены наименование и цель документа. Документы должны регулярно пересматриваться и поддерживаться в актуальном состоянии. К процедурам необходимо применять контроль версий. Должна существовать система, предотвращающая непреднамеренное использование утратившей силы редакции документа. Устаревшие и утратившие силу редакции документов, регламентирующих процедуры, должны изыматься из документооборота и архивироваться.
61. Должны сохраняться записи, относящиеся к выполнению всех действий, касающихся полученной или поставленной продукции, а также записи по оказанию брокерских услуг (например, заявки, счета, товарные накладные) или другие записи в электронном виде или иной форме.
Записи должны включать как минимум следующую информацию: дата, наименование лекарственных средств, количество приобретенных или поставленных лекарственных средств, наименование и адрес поставщика, получателя или грузополучателя (в зависимости от того, что применимо), а также номер серии.
Записи должны быть сделаны непосредственно в момент осуществления соответствующих операций.
5. Процесс дистрибьюции лекарственных средств
5.1. Принцип
62. Все действия дистрибьютора должны осуществляться таким образом, чтобы не была утрачена идентичность лекарственных средств и соблюдались требования, указанные на упаковке лекарственных средств. Дистрибьютор должен принимать необходимые меры для минимизации риска проникновения фальсифицированных лекарственных средств в цепь реализации.
63. Дистрибьюции подлежат следующие лекарственные средства:
а) зарегистрированные в соответствии с законодательством государств-членов;
б) зарегистрированные в соответствии с актами, входящими в право Союза;
в) незарегистрированные и (или) ввозимые (вывозимые) в соответствии с законодательством государств-членов и актами, входящими в право Союза.
64. Дистрибьютор, кроме держателя (владельца) регистрационного удостоверения (торговой лицензии), который приобретает лекарственное средство в другом государстве-члене, обязан уведомить о своем намерении держателя (владельца) регистрационного удостоверения, а также уполномоченный орган государства-члена, в которое предполагается поставить лекарственное средство.
65. Любые действия, выполняемые согласно положениям настоящего подраздела, должны быть полностью описаны в соответствующей документации системы качества.
5.2. Оценка поставщиков
66. Дистрибьютор обязан получать лекарственные средства только от организаций, имеющих разрешение на осуществление деятельности по производству или дистрибьюции лекарственных средств, выданное уполномоченным органом.
Дистрибьютор, приобретающий лекарственные средства у другого дистрибьютора, должен удостовериться, что поставщик лекарственных средств соблюдает требования надлежащей дистрибьюторской практики и имеет разрешение на осуществление данного вида деятельности, выданное уполномоченным органом.
Если поставка лекарственных средств осуществляется при участии брокера, дистрибьютор должен удостовериться, что брокер зарегистрирован в установленном порядке.
67. Мероприятия по оценке и одобрению поставщиков должны быть выполнены дистрибьютором до приобретения лекарственных средств. Данные мероприятия должны осуществляться в соответствии с утвержденной процедурой, их результаты должны оформляться документально и периодически проверяться.
68. При подписании договоров с новыми поставщиками организация должна проводить надлежащую проверку поставщика с целью подтверждения его компетентности, надежности и соответствия установленным требованиям. Особое внимание необходимо уделять следующим факторам:
а) репутация и (или) надежность поставщика;
б) предложения по поставке лекарственных средств, наиболее подверженных фальсифицированию;
в) предложения по поставке большой партии лекарственных средств, обычно доступных только в ограниченном количестве;
г) ценовые предложения, не соответствующие рыночным.
5.3. Оценка заказчиков (получателей)
69. Дистрибьютор обязан удостовериться, что поставка лекарственных средств осуществляется только организациям, имеющим разрешение (лицензию) или иные законные основания для осуществления деятельности, относящейся к обращению лекарственных средств на рынке Союза.
70. К первоначальной и последующим периодическим оценкам выполнения указанных требований относятся следующие действия:
а) получение копий соответствующих разрешений (лицензий);
б) оценка подлинности сведений, содержащихся в документах, опубликованных на сайтах соответствующих органов государственной власти в информационно-телекоммуникационной сети «Интернет»;
в) запрос документов, подтверждающих квалификацию получателя или наличие права на осуществление деятельности, относящейся к обращению лекарственных средств на рынке Союза, в соответствии с законодательством государств-членов.
71. Дистрибьютор отслеживает осуществляемые сделки и проводит расследования в отношении любых отклонений в цепочке реализации наркотических средств, психотропных веществ и других опасных веществ. При выявлении отклонений от прописанной процедуры реализации, которые могут означать использование лекарственных средств не по назначению, должны проводиться расследования. О результатах расследований должны быть уведомлены уполномоченные органы государств-членов.
72. Дистрибьютором должны быть приняты меры по обеспечению выполнения требований в отношении обращения лекарственных средств на рынке Союза, установленных законодательством государств-членов и актами, входящими в право Союза.
5.4. Приемка лекарственных средств
73. Основными задачами операции по приемке лекарственных средств являются следующие:
а) проверка соответствия принимаемых лекарственных средств товаросопроводительной документации;
б) проверка получения лекарственных средств от утвержденного поставщика;
в) проверка отсутствия видимых повреждений, которые могли возникнуть в процессе транспортировки.
74. Лекарственные средства, требующие специальных условий хранения или мер безопасности, должны приниматься в первую очередь и после выполнения необходимой проверки должны быть незамедлительно перемещены в соответствующую зону хранения.
75. Серии лекарственных средств, предназначенные для реализации в рамках Союза, не должны направляться в зону реализации до того, как в соответствии с письменными процедурами будет удостоверено выполнение всех требований, установленных законодательством государств-членов и актами, входящими в право Союза. Для серий, поступающих из другого государства-члена, доказательства допуска на рынок Союза до их помещения в зону реализации должны быть тщательно проверены персоналом, обученным надлежащим образом.
5.5. Хранение
76. Лекарственные средства и при необходимости другая медицинская продукция должны храниться отдельно от других продуктов, способных оказать на них влияние, и должны быть защищены от вредного воздействия света, температуры, влажности и других внешних факторов. Особое внимание следует уделять лекарственным средствам, требующим специальных условий хранения.
77. Транспортная тара с лекарственными средствами при необходимости должна быть очищена перед размещением лекарственных средств на хранение.
78. Складские операции должны обеспечивать требуемые условия хранения, а также меры безопасности.
80. При хранении лекарственных средств и обращении с ними должны быть приняты меры, направленные на предотвращение рассыпания, нарушения целостности упаковки, контаминации и перепутывания. Лекарственные средства не должны храниться непосредственно на полу, за исключением случаев, когда упаковка специально разработана для такого хранения (например, баллоны с медицинским газом).
81. Лекарственные средства, срок годности которых истек, должны быть незамедлительно изъяты из категории пригодных для поставки либо физически (изолированы в специальном помещении или зоне хранения), либо с помощью электронных средств, обеспечивающих эквивалентную изоляцию.
Анализ складских запасов должен проводиться регулярно в соответствии с требованиями законодательства государств-членов. Выявленные отклонения должны быть документально оформлены, и в их отношении должно быть проведено расследование.
5.6. Уничтожение
82. Лекарственные средства, предназначенные для уничтожения, должны быть надлежащим образом промаркированы, храниться отдельно в специальном помещении или зоне, доступ в которые ограничен, при этом операции с ними должны осуществляться в соответствии с письменными процедурами.
83. Уничтожение должно осуществляться в соответствии с законодательством государств-членов или применимыми международными требованиями в отношении обращения, транспортировки и уничтожения лекарственных средств.
Записи об уничтожении должны храниться в течение срока, установленного законодательством государств-членов.
5.7. Подготовка к отгрузке
84. Необходимо контролировать, чтобы к отгрузке были подготовлены затребованные лекарственные средства. На момент подготовки к отгрузке лекарственные средства должны иметь согласованный получателем и отправителем остаточный срок годности.
5.8. Поставка
85. Поставка лекарственных средств должна сопровождаться документами, предусмотренными законодательством государств-членов (счет-фактура, товарно-транспортная накладная, международная накладная, инвойс, авианакладная и др.). В сопроводительных документах лекарственных средств указываются следующие сведения: дата, наименование лекарственного средства, номер серии (партии), поставляемое количество, лекарственная форма, дозировка, наименование и адрес поставщика, наименование и адрес грузополучателя (адрес места нахождения оптового склада, если он отличается от адреса юридического лица), а также условия транспортировки и хранения.
Записи о поставке подлежат хранению таким образом, чтобы была обеспечена прослеживаемость движения лекарственных средств.
5.9. Экспорт
86. Организация, экспортирующая лекарственные средства, должна иметь лицензию или иные законные основания в соответствии с законодательством государств-членов для осуществления деятельности по дистрибьюции лекарственных средств или лицензию на производство лекарственных средств.
87. Настоящие Правила применяются к экспорту лекарственных средств в полном объеме. Если экспортируемые лекарственные средства не зарегистрированы на территории Союза, организация, экспортирующая лекарственные средства, должна предпринять необходимые меры, направленные на предотвращение поступления данных лекарственных средств на рынок Союза.
При экспорте лекарственных средств организация, экспортирующая лекарственные средства, должна удостовериться, что поставка осуществляется в адрес лиц, имеющих законные основания получать лекарственные средства в соответствии с законодательством соответствующего государства для дистрибьюции данных лекарственных средств.
6. Претензии, возврат, подозрения в фальсификации и отзыв лекарственных средств из обращения
6.1. Принцип
88. Все претензии, случаи возврата, подозрения в фальсификации, а также отзыв лекарственных средств из обращения должны быть документально оформлены и проанализированы в соответствии с установленными процедурами. Соответствующие записи должны быть доступны уполномоченным органам государств-членов.
89. Оценка возвращенных лекарственных средств должна осуществляться до принятия решения об их одобрении для повторной поставки. Для успешной борьбы с фальсификацией должны быть согласованные действия всех участников цепи реализации.
6.2. Претензии
90. Претензии должны быть зарегистрированы с указанием следующей информации: дата получения претензии, наименование организации или фамилия, имя, отчество (при наличии) лица, предъявившего претензию, контактные данные (номер телефона и факса (при наличии), электронная почта, адрес), наименование лекарственного средства, лекарственной формы, дозировка, номер серии и (или) партии, объем, причина претензии и пр.
При этом необходимо различать претензии в отношении качества лекарственных средств и претензии в отношении соблюдения требований и условий дистрибьюции.
91. В случае если претензия относится к качеству лекарственных средств или предполагается наличие недоброкачественных (фальсифицированных) лекарственных средств, производитель и (или) держатель регистрационного удостоверения должны быть уведомлены об этом незамедлительно.
92. В отношении претензий по соблюдению требований и условий дистрибьюции должно быть проведено расследование с целью установления источника (субъекта) или причины предъявления претензии.
93. Для работы с претензиями должно быть назначено специальное лицо, а также могут привлекаться другие работники дистрибьютора в необходимом количестве.
94. По результатам расследования и анализа в отношении претензий при необходимости должны быть предприняты соответствующие меры, включая корректирующие и предупреждающие действия, в том числе уведомление, если это необходимо в соответствии с установленными требованиями уполномоченных государственных органов государств-членов.
6.3. Возвращенные лекарственные средства
95. Операции с возвращенными лекарственными средствами должны осуществляться в соответствии с документированными процедурами, основанными на оценке рисков, с учетом специфики лекарственных средств, специальных условий хранения, а также времени, прошедшего с момента первоначальной отгрузки. Возврат осуществляется в соответствии с законодательством государств-членов и договорными обязательствами между сторонами, участвующими в возврате продукции.
96. Лекарственные средства, которые ранее были отгружены, могут быть возвращены в категорию пригодных для поставки только в том случае, если выполнены все следующие условия:
целостность вторичной (потребительской) упаковки лекарственных средств не нарушена, отсутствуют следы повреждений, отсутствует маркировка, непредусмотренная производителем, срок годности не истек, продукция не отозвана из обращения;
получатель представил документы, подтверждающие соблюдение специальных условий хранения и транспортировки;
лекарственные средства были проверены и оценены компетентным лицом, назначенным для выполнения данных действий;
дистрибьютор располагает доказательствами того, что лекарственные средства были поставлены данному получателю (согласно приложенным копиям соответствующих сопроводительных документов): номер серии и (или) партии совпадает с указанным в документах, отсутствуют основания полагать, что данные лекарственные средства фальсифицированы.
Лекарственные средства, требующие особых температурных условий хранения, могут быть возвращены в категорию пригодных для поставки, если имеются документальные доказательства того, что они хранились и транспортировались в надлежащих условиях в течение всего времени.
97. В случае выявления любых отклонений необходимо провести оценку рисков, позволяющую установить сохранность лекарственных средств. Должны быть собраны и оценены доказательства по следующим этапам:
а) поставка получателю;
б) проверка продукции (идентификация);
в) вскрытие транспортной упаковки (контейнера для поставки);
г) возврат лекарственных средств в транспортную упаковку (контейнер для поставки);
д) сбор и возврат лекарственных средств дистрибьютору;
е) помещение лекарственных средств в специальную зону хранения дистрибьютора.
98. Приемка возвращенной продукции без документального оформления запрещается.
99. Лекарственные средства, возвращенные в категорию пригодных для поставки, должны быть размещены таким образом, чтобы система отгрузки продукции с меньшим сроком годности в первую очередь (FEFO) функционировала эффективно.
100. Похищенные лекарственные средства, которые были обнаружены, не могут быть возвращены в категорию пригодных для поставки и поставлены получателям.
6.4. Фальсифицированные лекарственные средства
101. Дистрибьютор должен незамедлительно информировать уполномоченный орган государства-члена, а также держателя регистрационного удостоверения лекарственного препарата о случае выявления фальсифицированного продукта или о наличии подозрений в такой фальсификации. Данная информация должна быть зафиксирована документально в соответствии с установленными процедурами с сохранением всех исходных данных, и в ее отношении должно быть проведено расследование.
102. Фальсифицированные лекарственные средства, обнаруженные в цепи реализации, должны быть незамедлительно физически изолированы и помещены на хранение отдельно от другой продукции в специально выделенном помещении или зоне, доступ в которые ограничен.
103. Все операции с фальсифицированными лекарственными средствами должны быть документально оформлены, с сохранением записей.
6.5. Отзыв из обращения
104. Эффективность действий по отзыву лекарственных средств из обращения должна регулярно оцениваться (не реже чем 1 раз в год).
105. Должна существовать возможность инициировать действия по отзыву из обращения лекарственных средств в кратчайшие сроки в любой момент времени.
106. Дистрибьютор должен следовать указаниям информационного письма об отзыве из обращения, которое при необходимости должно быть утверждено уполномоченным органом государства-члена.
107. Действия по отзыву и изъятию из обращения должны документально оформляться в момент их осуществления в соответствии с установленными процедурами. Документация по отзыву должна быть доступной уполномоченным органам государств-членов.
108. Записи, относящиеся к дистрибьюции, должны быть доступны для лица, ответственного за отзыв лекарственных средств из обращения, и должны содержать достаточную информацию о дистрибьюторах лекарственных средств и о прямых получателях (адрес, номер телефона и номер факса (при его наличии), которые должны быть доступны в рабочие и нерабочие часы), включая данные в отношении экспортированных лекарственных средств и их образцов (номер серии и (или) партии, наименование, лекарственная форма, дозировка, а также поставленное количество).
109. Последовательность выполнения действий, осуществляемых при отзыве и изъятии серии и (или) партии лекарственного средства из обращения, должна быть документально оформлена и отражена в итоговом отчете.
7. Деятельность, передаваемая на аутсорсинг
7.1. Принцип
110. Любая деятельность, на которую распространяются настоящие Правила, переданная на аутсорсинг, должна быть надлежащим образом определена и согласована, должна контролироваться во избежание разночтений, способных привести к нарушению сохранности лекарственных средств. Должен быть заключен письменный договор между дистрибьютором-заказчиком и исполнителем, в котором четко определены обязанности каждой из сторон.
7.2. Заказчик
111. Заказчик несет ответственность за деятельность, переданную на аутсорсинг.
Заказчик должен убедиться в компетентности исполнителя для выполнения обязательств по договору и обеспечить соблюдение исполнителем требований надлежащей дистрибьюторской практики посредством установления в договоре соответствующих условий и проведения проверок.
Проверка правомочности, компетентности и возможности исполнителя выполнять условия договора должна проводиться до начала осуществления деятельности, переданной на аутсорсинг, а также в случае существенных изменений такой деятельности. Периодичность проведения проверок деятельности, переданной на аутсорсинг, должна определяться на основании анализа рисков. Сроки и условия проведения проверок должны быть согласованы сторонами.
112. Заказчик предоставляет исполнителю всю информацию, необходимую для выполнения деятельности, переданной на аутсорсинг, в соответствии с требованиями, применимыми к лекарственным средствам, а также любыми другими применимыми требованиями.
7.3. Исполнитель
113. Исполнитель должен иметь необходимые помещения и оборудование, документированные процедуры, знания и опыт, а также квалифицированный персонал для надлежащего выполнения работ (услуг) по договору.
114. Исполнитель не должен передавать третьей стороне выполнение работ (услуги), выполнение которых поручено ему по договору, без предварительной оценки и одобрения такой передачи заказчиком, а также до проведения проверки третьей стороны заказчиком или исполнителем. Договор между исполнителем и третьей стороной должен гарантировать, что информация о выполняемых работах представляется в соответствии с договором между заказчиком и исполнителем.
115. Исполнитель не должен осуществлять какие-либо действия, которые могут привести к потере качества лекарственных средств заказчика.
116. Исполнитель должен сообщать заказчику любую информацию, относящуюся к качеству лекарственных средств заказчика, в соответствии с условиями договора.
8. Самоинспекция дистрибьюторов
8.1. Принцип
117. Самоинспекции должны проводиться для контроля за внедрением и соблюдением требований надлежащей дистрибьюторской практики лекарственных средств, а также с целью разработки необходимых корректирующих мер.
8.2. Самоинспекция
118. Должна быть внедрена программа проведения самоинспекций, охватывающая в рамках определенного периода все аспекты надлежащей дистрибьюторской практики, требований законодательства государств-членов, руководств и процедур.
119. Самоинспекции могут быть разделены на несколько самостоятельных проверок, охватывающих отдельные стороны деятельности организации. Самоинспекции должны проводиться специально назначенным квалифицированным персоналом беспристрастно и тщательно. Допускаются аудиты, проводимые независимыми внешними экспертами, однако они не могут заменять самоинспекцию.
120. Результаты самоинспекций должны оформляться документально. Отчеты должны содержать всю информацию, полученную в ходе инспекции. Копия отчета должна быть представлена руководству дистрибьютора, а также иным заинтересованным лицам.
В случае выявления недостатков или отклонений необходимо выяснить их причину, а также разработать и документально оформить корректирующие и предупреждающие действия и проконтролировать их выполнение.
9. Транспортировка
9.1. Принцип
121. Дистрибьютор, поставляющий лекарственные средства, обязан осуществлять транспортировку в условиях, обеспечивающих их сохранность и целостность, защиту от воздействия факторов окружающей среды, соблюдение необходимого температурного режима (условий хранения), а также защиту от фальсификации.
122. Независимо от способа транспортировки необходимо обеспечить возможность подтверждения того, что качество и целостность лекарственных средств не были подвергнуты негативному воздействию в процессе транспортировки.
123. Планирование транспортировки должно быть осуществлено на основании анализа возможных рисков.
9.2. Транспортировка
124. Требуемые условия хранения лекарственных средств должны соблюдаться в течение всего времени транспортировки в соответствии с указаниями производителя или информацией на упаковке.
В случае возникновения таких отклонений, как нарушение температурного режима или порча лекарственных средств в процессе транспортировки, информация о них должна быть сообщена отправителю и получателю. Должна быть разработана и документально оформлена процедура, определяющая порядок действий при возникновении отклонений и расследовании данных фактов.
125. Дистрибьютор должен обеспечить условия, при которых транспортные средства и оборудование, используемые для транспортировки лекарственных средств, соответствовали бы целям их использования и были надлежащим образом укомплектованы для защиты от нежелательного воздействия, которое может привести к потере качества лекарственных средств или нарушить целостность упаковки.
126. Транспортное средство и его оборудование, используемые для транспортировки лекарственных средств, должны содержаться в чистоте и подвергаться очистке и уборке по мере необходимости в соответствии с требованиями санитарных норм, установленных законодательством государств-членов. Должны быть разработаны письменные процедуры по обслуживанию и эксплуатации транспортных средств и оборудования, используемых для дистрибьюции лекарственных средств, включая очистку и меры безопасности.
127. Определение необходимости контроля температуры должно основываться на анализе рисков, связанных с транспортировкой лекарственных средств по выбранному маршруту. Оборудование, используемое для контроля температуры в процессе транспортировки, установленное на транспортном средстве или в контейнере, должно проходить периодическое техническое обслуживание, поверку и калибровку в соответствии с законодательством государств-членов.
128. При обращении с лекарственными средствами следует по возможности использовать специализированные транспортные средства и оборудование. Если используются неспециализированные транспортные средства и оборудование, должны быть разработаны и приняты в форме письменного документа процедуры, обеспечивающие сохранение качества лекарственных средств.
129. Лекарственные средства должны быть доставлены по адресу, указанному в документах на поставку, и переданы непосредственно в помещение получателя. Лекарственные средства не должны оставляться в каких-либо других помещениях.
Для организации экстренных доставок в нерабочие часы должен быть назначен специализированный персонал, действующий на основании документированных процедур.
130. Транспортировка третьими лицами должна осуществляться на основании договора, содержащего требования, установленные в подразделе 7 настоящего раздела. Транспортные компании должны быть уведомлены о требованиях к условиям транспортировки лекарственных средств.
Ответственность за соблюдение условий транспортировки лекарственных средств возлагается на дистрибьютора.
131. В случаях когда транспортировка сопровождается операциями по разгрузке и обратной загрузке или включает в себя транзитное хранение, необходимо обеспечить надлежащие условия производственной среды помещений и безопасность хранения на транзитных складах. К условиям производственной среды помещений, которые должны контролироваться, относятся: температурный режим, освещенность, влажность воздуха и чистота.
Должны быть предприняты меры для сокращения продолжительности временного хранения перед следующим этапом транспортировки.
9.3. Тара, упаковка и маркировка
132. Лекарственные средства должны транспортироваться в транспортной таре, которая не оказывает негативного влияния на их качество и обеспечивает надежную защиту от внешнего воздействия, в том числе предотвращает возможность контаминации.
Выбор транспортной тары и упаковки должен основываться на требованиях к условиям хранения и транспортировки лекарственных средств, на объеме, необходимом для размещения требуемого количества, предполагаемых колебаниях температуры окружающей среды, предполагаемой максимальной длительности транспортировки, включая временное хранение на таможенных складах.
133. Для обеспечения надлежащего обращения с лекарственными средствами и уровня безопасности на транспортную тару должна быть нанесена маркировка, содержащая необходимую информацию о требованиях по обращению и хранению данной транспортной тары с лекарственным средством, а также о необходимых мерах предосторожности. Информация на транспортной таре должна обеспечивать возможность идентификации содержимого и источник его происхождения.
9.4. Лекарственные средства, требующие особого обращения
Должны быть созданы дополнительные системы контроля в отношении поставок указанных лекарственных средств. Должна быть разработана и документально оформлена процедура, определяющая порядок действий в случае их хищения. Любые случаи хищений должны быть документированы.
135. Опасные (высокоактивные) и радиоактивные лекарственные средства должны транспортироваться в защищенных, специализированных и надежных транспортных средствах. Принимаемые меры безопасности должны соответствовать законодательству государств-членов и международным договорам.
136. Для обеспечения требуемых условий транспортировки при транспортировке термолабильных лекарственных средств должны быть использованы специальное оборудование или средства (изотермическая упаковка, контейнеры), а также транспортные средства, обеспечивающие поддержание требуемого температурного режима.
Транспортные средства, обеспечивающие поддержание требуемого температурного режима, и оборудование, используемое для контроля температуры в процессе транспортировки термолабильных лекарственных средств, должны проходить периодическое техническое обслуживание, поверку и калибровку. Необходимо проводить анализ температурного картирования с соблюдением условий, отражающих параметры эксплуатации, и с учетом сезонных колебаний.
По запросу получателя должны быть представлены данные, подтверждающие соблюдение температурного режима при хранении и транспортировке термолабильных лекарственных средств.
137. Хладоэлементы в изотермических контейнерах должны быть размещены таким образом, чтобы отсутствовал прямой контакт с лекарственными средствами. Персонал должен быть обучен требованиям процедур по подготовке изотермических контейнеров (с учетом сезонных особенностей), а также требованиям к повторному использованию хладоэлементов.
Должны быть разработаны меры, направленные на предотвращение повторного использования недостаточно охлажденных хладоэлементов. Должна быть обеспечена надлежащая физическая изоляция охлажденных и замороженных хладоэлементов.
Процесс доставки термолабильных лекарственных средств с учетом контроля сезонных колебаний температур должен быть описан в документированной процедуре.
Обзор документа
Утверждены правила надлежащей дистрибьюторской практики в рамках ЕАЭС. Они являются частью системы обеспечения качества и устанавливают требования в отношении дистрибьюции лекарственных средств.
Требования применяются в отношении всех лиц, участвующих в дистрибьюции лекарственных средств в соответствии с выполняемыми ими функциями, включая дистрибьюторов и производителей, независимо от ведомственной принадлежности и формы собственности.
Целью надлежащей дистрибьюторской практики является соблюдение надлежащих условий хранения, транспортировки и распространения, необходимых для обеспечения качества, безопасности и эффективности лекарственных средств по всей цепи поставки, а также предотвращения риска проникновения фальсифицированных препаратов в цепь поставки.
Соблюдение требований обеспечит контроль цепи поставки и позволит сохранить качество и целостность лекарственных средств.
Правила вступают в силу по истечении 1 года с даты вступления в силу Протокола о присоединении Армении к Соглашению о единых принципах и правилах обращения лекарственных средств в рамках ЕАЭС.
Решение вступает в силу по истечении 10 календарных дней с даты вступления в силу Протокола о присоединении Армении к Соглашению о единых принципах и правилах обращения лекарственных средств в рамках ЕАЭС, но не ранее чем по истечении 10 календарных дней с даты официального опубликования решения.

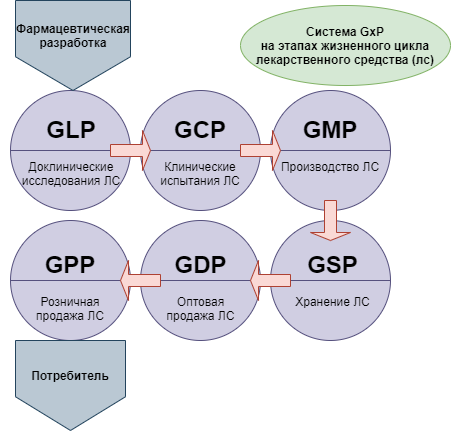
(1).jpg)
