гепарины применяются в клинической практике как антикоагулянты потому что
Основы антикоагулянтного лечения острого венозного тромбоэмболизма
Ежегодно в мире у 0,1% населения регистрируется венозный тромбоэмболизм (ВТЭ). С практической точки зрения, по современным представлениям, ВТЭ объединяет венозный тромбоз (ВТр) — тромбообразование в венозном русле кровообращения и венозную эмболию — пер
Ежегодно в мире у 0,1% населения регистрируется венозный тромбоэмболизм (ВТЭ). С практической точки зрения, по современным представлениям, ВТЭ объединяет венозный тромбоз (ВТр) — тромбообразование в венозном русле кровообращения и венозную эмболию — перенос части тромба в вены, дистальнее кровотока. Наиболее часто ВТЭ оказывается представлен тромбозом глубоких вен голени (ТГВ) и тромбоэмболией легочной артерии (ТЭЛА).
ТЭЛА — это одно из самых катастрофических осложнений, которое внезапно обрывает жизнь многих больных, унося каждый год только в США 150–200 тыс. жизней [1]. Существенное влияние на снижение риска фатального исхода ТЭЛА оказывают своевременно начатые диагностика и лечение. Неадекватная антикоагулянтная терапия может послужить причиной развития посттромбофлебитического синдрома, рецидивирующего тромбоэмболизма и тромбоэмболической легочной гипертензии. Без антикоагулянтной терапии в 11–26% случаев ВТЭ может осложниться ТЭЛА со смертельным исходом [2]. Поэтому после постановки диагноза ВТЭ целью лечения являются устранение симптомов болезни, предупреждение увеличения размеров тромба, эмболизации и ретромбозов.
Стандартная практика лечения больных с ТГВ и ТЭЛА принципиально не различается, так как наличие самой эмболии иногда служит единственным признаком того, что у больного имеется латентно протекающий эмбологенный тромбоз.
Стартовая терапия
Терапия ВТЭ начинается с 4–7-дневного введения гепаринов (нефракционированного или низкомолекулярного).
В таблице 1 представлены варианты выбора гепаринотерапии для стартового лечения.
Нефракционированный гепарин (НФГ). Гепарин — непрямой ингибитор тромбина, для осуществления антикоагулянтного действия которого необходим ко-фак-тор — антитромбин III. Комплекс гепарин-антитромбин III инактивирует несколько факторов свертывания: тромбин (II), Xa, XIIa, XIa, IXa. Среди них наибольшей чувствительностью к инактивации отличаются факторы Xa и IIa (тромбин). Кроме антикоагулянтного эффекта, НФГ, соединяясь с остеобластами, активирует остеокласты, ускоряя потерю костной ткани [3].
Определить концентрацию НФГ в крови невозможно, так как в свободном состоянии в циркуляции он отсутствует, поэтому дозу препарата необходимо подбирать, ориентируясь на оценку гипокоагуляции, вызываемой им. Наиболее приемлемым является тест определения активированного частичного тромбопластинового времени (АЧТВ). Рекомендованное терапевтическое удлинение АЧТВ основано на экспериментальных данных, показавших, что клинический эффект достигается при таком терапевтическом уровне НФГ, который удлиняет АЧТВ в 1,5–2,5 раза.
НФГ не обладает специфическим связыванием с определенными плазменными или клеточными белками, что предопределяет его различное гипокоагулянтное воздействие на пациентов. У 25% больных с ВТЭ, несмотря на получаемые ими дозы НФГ — более 35 000 ЕД в сутки, удлинение АЧТВ не достигает терапевтических значений. Данный феномен связан с так называемой резистентностью к НФГ [4]. Большинство из «резистентных» пациентов имеют достаточный уровень НФГ в крови, но повышенную концентрацию прокоагулянтов [5]. Не так часто встречаются случаи, когда у пациентов не удлиняется АЧТВ и не поддерживается достаточная концентрация НФГ, несмотря на вводимые высокие дозы препарата. Данный эффект является следствием нейтрализации гепарина белками плазмы крови, эндотелиальными клетками и повышенным клиренсом гепарина. Редко резистентность к НФГ вызвана низким уровнем антитромбина III. Основными причинами дефицита антитромбина являются гепатит, цирроз печени, нефротический синдром, беременность, прием оральных контрацептивов, синдром диссеминированного внутрисосудистого свертывания, острое воспаление и др. С практической точки зрения в данных клинических случаях определяющим фактором эффективности лечения НФГ является доза препарата, а не показатели АЧТВ [6].
При назначении НФГ с лечебной целью следует отдавать предпочтение внутривенному непрерывному способу его введения, который позволяет поддерживать оптимальные значения АЧТВ на протяжении суток. Для стартового лечения ВТЭ НФГ вводится путем внутривенной постоянной инфузии (1200–1300 ЕД/ч или 18 ЕД/кг/ч) после болюсной дозы 5000 ЕД или 80 ЕД/кг [5].
Для подбора дозы гепарина в зависимости от показателей АЧТВ используются алгоритмы, предложенные Американской ассоциацией сердца [7]. Алгоритм, представленный в таблице 2, следует задействовать в тех случаях, когда используются одинаковые реактивы АЧТВ и контрольное АЧТВ находится в одинаковых пределах. Первая доза одинакова для всех больных, дальнейшая скорость инфузии (32 000 ЕД/24 ч) относится только к первым 6 ч лечения, по прошествии этого времени необходимо корригировать дозу в соответствии с номограммой, исходя из значений АЧТВ.
В других случаях может быть применена номограмма, приведенная в таблице 3, в которой использованы не абсолютные величины АЧТВ, а его изменения по отношению к контрольному АЧТВ, определенному конкретной лабораторией.
Большие кровотечения при данном терапевтическом подходе составляют 2% и зависят от дозы препарата, возраста пациента, функционального состояния почек и печени, недавно перенесенных операций, травм и инвазивных процедур, злоупотребления алкоголем, сопутствующей терапии — тромболитических препаратов, антагонистов тромбоцитарных гликопротеинов IIb/IIIa, ацетилсалициловой кислоты [5].
Метаанализ результатов клинических исследований показал, что подкожное применение НФГ для лечения венозных тромбозов сопоставимо по эффективности и безопасности с внутривенным путем введения при условии подбора адекватных доз и надлежащего лабораторного контроля. Поскольку биодоступность НФГ при подкожном пути введения ниже (30%), чем при внутривенном, начальные дозы НФГ должны быть больше. Обычный режим для подкожного метода лечения НФГ включает начальный внутривенный болюс 5000 ЕД, далее подкожно дважды в сутки с последующим подкожным введением 17 500 ЕД и коррекцией дозы на основании АЧТВ [4, 8]. Для подбора дозы в зависимости от веса пациента и величины АЧТВ используют алгоритм, приведенный в таблице 4, при этом контроль АЧТВ проводится через 6 ч и далее по указанному протоколу.
Имеются результаты единичных исследований, в ходе которых изучалась эффективность подкожного введения НФГ для лечения ТЭЛА. Однако с достаточной уверенностью рекомендовать данный метод терапии не представляется возможным из-за небольшого количества достоверных клинических данных [10].
Гепарины низкого молекулярного веса (ГНМВ).
ГНМВ различаются по физико-химическим, биологическим, фармакологическим свойствам и нейтрализующей активности в отношении активного фактора Х (Ха) и тромбина (IIа), т. е. соотношения анти-Ха/анти-IIа-активности. Указанная гетерогенность имеет практическое значение: одинаковые дозы различных препаратов ГНМВ оказывают неодинаковое действие на фактор Ха и, как следствие, вызывают различный антикоагулянтный эффект. В связи с этим невозможно экстраполировать эффективность лечебного действия одного из ГНМВ на другие. Практически это разные препараты. Для контроля над эффективностью и безопасностью лечебного действия ГНМВ метод АЧТВ не применим, так как он не отражает антикоагулянтную активность используемых препаратов.
С этой целью применяется оценка инактивации активного фактора Х [5]. Доза низкомолекулярных гепаринов выражается в условных единицах (ЕД/кг массы тела), отражающих антифактор Ха-активность препаратов, определенную фирмой-производителем. В рутинной клинической практике лабораторный контроль за эффективностью ГНМВ не производится. Следует помнить, что подобранные по весу дозы ГНМВ адекватны для больных, чей вес не превышает 150 кг. Данной категории больных, а также беременным и пациентам с нарушенной функцией почек целесообразно определять анти-фактор Ха-активность вводимого препарата.
Анализ результатов исследований по оценке эффективности и безопасности подкожного применения фиксированных доз ГНМВ для лечения больных с ВТЭ в сравнении с НФГ, вводимым внутривенно в дозах, подобранных по АЧТВ, показал, что ГНМВ столь же эффективны в лечении и предупреждении рецидивов ТГВ/ТЭЛА как и НФГ, но реже вызывают геморрагические осложнения [11]. Это открыло путь к успешному изучению лечения неосложненных ТГВ и субмассивной ТЭЛА в амбулаторных условиях. Подтверждено превосходство ГНМВ над НФГ (доказана эффективность для надропарина кальция (фраксипарина) и эноксапарина натрия (клексана), что улучшает качество жизни больных и снижает стоимость лечения [12]. Однако у лиц с массивной ТЭЛА и высоким риском кровотечений (пожилой возраст, недавнее хирургическое вмешательство, кровотечения в анамнезе, заболевания почек и печени) данный вариант терапии не приемлем [5].
При использовании гепаринов более 5–7 сут возможно развитие гепарининдуцированной тромбоцитопении, которая обычно развивается между 3-м и 15-м днями после начала лечения, с частотой в среднем 2,4% при терапевтическом применении гепарина и 0,3% при назначении его с профилактической целью.
Необходимо подозревать гепарининдуцированную тромбоцитопению всякий раз, когда у пациента развиваются необычные изменения в клинико-лабораторных показателях в течение или вскоре после терапии гепарином. К таковым относятся: уменьшение количества тромбоцитов менее 100 000 в 1 мкл либо на 50% и более от исходного уровня на 5–10-е сутки от начала введения гепарина.
Оральные антикоагулянты-антивитамины К (ОАК–АВК). Для предотвращения дальнейшего увеличения размеров тромба и вторичных тромбоэмболических осложнений применяются ОАК–АВК. В зависимости от химической структуры молекулы антикоагулянта различают производные монокумарина и дикумарина, циклокумарины и индандионы.
Наиболее широко в мире применяются производные монокумарина — варфарин (кумадин) и аценокумарол (синтром, никумадин, синкулар), что обусловлено их оптимальной продолжительностью действия и хорошей переносимостью. Варфарин является препаратом выбора, так как время его нахождения в организме больного обеспечивает более стабильное воздействие на процесс свертывания крови, чем во время терапии аценокумаролом. Назначение весьма популярных в России фенилина и пелентана ограничивается токсичностью первого и неустойчивым антикоагулянтным эффектом второго (табл. 5).
При использовании ОАК для предупреждения рецидива ВТЭ его дозу рекомендуется подбирать таким образом, чтобы поддерживать значение Международного нормализованного отношения (МНО) на уровне 2,0–3,0 [13]. Терапия варфарином в период ее проведения редуцирует риск ретромбозов на 90–95% [14]. ОАК обычно назначается пациентам с ВТЭ одновременно с гепаринами непосредственно после эпизода тромбообразования. При достижении уровня МНО более 2,0 гепарин можно отменить.
Терапию ОАК рекомендуется начинать с поддерживающих доз: 2,5–5 мг для варфарина, 0,75–3 мг для маркумара, 1–4 мг для синкумара. Более низкие стартовые дозы показаны лицам старше 60 лет, уроженцам Азии, в особенности лицам китайского происхождения, пациентам с нарушением функции почек и печени, артериальной гипертензией, застойной сердечной недостаточностью, а также при сопутствующей терапии препаратами, усиливающими антикоагулянтный эффект ОАК.
Перед приемом препарата необходимо оценить общий анализ крови, протромбиновое время, АЧТВ, общий анализ мочи, определить функциональное состояние печени и почек. При рецидивирующем венозном тромбозе целесообразно провести скрининг на предмет тромбофилий. Среди наследственных факторов наиболее распространенными являются: генетическая мутация фактора V свертывания крови (фактор V Лейдена), мутация 20210А гена протромбина, а также мутация гена метилентетрагидрофолатредуктазы, приводящая к развитию гипергомоцистеинемии. Препарат принимается 1 раз в день в фиксированное время после еды. Контроль МНО проводится через 10–12 ч после приема препарата. На протяжении первой недели определение МНО рекомендуется производить ежедневно, затем 1 раз в неделю. Следует подчеркнуть, что расчет МНО производится в плазме, т. е. в венозной крови.
 |
| Таблица 6. Дневник приема ОАК |
Перед началом терапии больному необходимо разъяснить особенности антикоагулянтной терапии ОАК. Пациент должен вести дневник по приведенному образцу (табл. 6), в котором отмечаются значения МНО, доза принимаемого препарата, сопутствующая терапия. Пациент должен сообщать врачу о любых заболеваниях, возникших во время лечения ОАК–АВК. Врачу рекомендуется вести специальную форму, в которой целесообразно записывать показания, по которым производится прием ОАК–АВК, планируемые значения МНО, предполагаемая продолжительность терапии, факторы риска кровотечения.
В таблице 7 приведен алгоритм подбора дозы в начале лечения варфарином [15]. Тактика лечения иными ОАК должна быть аналогичной под контролем МНО.
 |
| Таблица 7. Алгоритм стартового лечения варфарином |
После достижения необходимого уровня МНО алгоритм дальнейшего наблюдения должен быть следующим: первое определение МНО — через 5–10 дней, второе — через 2 нед, третье — через 3 нед, четвертое и все последующие — через 4 нед.
После диагностики тромбоза при определении длительности применения ОАК должны учитываться причины и выраженность тромбофилического состояния. Согласно существующим рекомендациям, терапия ОАК должна составлять не менее 3 мес у больных с симптоматическим тромбозом на фоне очевидных «обратимых» факторов, провоцирующих гиперкоагуляцию (травмы, операции и др.). Пациенткам с венозными тромбозами, возникшими на фоне гормональной заместительной терапии, лицам с «синдромом экономического класса» терапия продлевается до полугода. Не менее 1 года должны получать превентивное лечение ОАК пациенты со спонтанным венозным тромбозом [17, 18]. Больные с рецидивирующими венозными тромбозами, рецидивирующими тромбозами на фоне выявленных генетических тромбофилий нуждаются в постоянном приеме ОАК. Пациентам без эпизодов ВТЭ в прошлом, но с подтвержденным гетерозиготным дефицитом протеинов С и S, антитромбина III, с мутацией факторов V Лейден или протромбина G20210A некоторые специалисты [19] рекомендуют профилактическое назначение антикоагулянтов только при наличии выраженных приобретенных факторов риска тромбообразования, например при подготовке к оперативным вмешательствам. Такое лечение, по сообщениям этих авторов, предупреждает половину возможных тромбозов.
Применение ОАК при инвазивных процедурах. У пациентов группы низкого риска тромбоэмболий (венозный тромбоз более чем 3 мес назад, неосложненная системными тромбоэмболиями мерцательная аритмия) терапия ОАК прекращается за 3–4 дня до операции до достижения значений МНО менее 1,5. Если операция сопровождается риском тромбозов, кратковременно показаны профилактические дозы гепаринов, затем возобновление терапии ОАК.
У пациентов группы среднего риска тромбоэмболий ОАК отменяются за 4 дня до операции до достижения МНО 1,5. За 2 дня до операции назначаются либо низкие дозы НФГ (5000 ЕД подкожно) либо профилактические дозы ГНМВ. После операции — низкие дозы НФГ (или ГНМВ) и затем ОАК.
У пациентов группы высокого риска тромбоэмболий (венозный тромбоз менее 3 мес назад, рецидивы венозного тромбоза в анамнезе, протезы клапанов сердца в митральной позиции) ОАК отменяются за 4 дня до операции до достижения МНО 1,5. За 2 дня до операции назначаются терапевтические дозы гепаринов. Гепарины отменяются за 12–24 ч до операции.
Пациентам, у которых возникает необходимость удаления зуба, перед процедурой необходимо определить значения МНО. Если показатели остаются в пределах терапевтических значений, то процедуру можно проводить без коррекции терапии. Если значения МНО превышают 3,5, нужно пропустить один-два приема препарата. Следующие стоматологические процедуры не требуют коррекции дозы ОАК: пломбировка, установка коронки, мостов, чистка канала, снятие зубного камня [20].
Литература
Т. В. Козлова, доктор медицинских наук, доцент
Т. В. Таратута, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Современные антикоагулянтные препараты
(лекция)
Modern anticoagulants (lecture)
Благовестова А.П., Дуюнова Е.В., Эрметов В.К
Самарский государственный медицинский университет
Тольяттинский медицинский консилиум. 2017, № 5-6
Резюме
В статье представлен обзор антикоагулянтов, использующихся в современной медицине, представлены классификация, механизмы действия, показания, противопоказания к использованию и режимы дозирования.
Ключевые слова: антикоагулянты, антагонисты витамина К, низкомолекулярные гепарины, варфарин
Антикоагулянты – препараты, блокирующие реакции плазменного гемостаза – в настоящее время очень широко используются в клинической медицине. Современная классификация, предложенная в 2013 году рабочей группой по тромбозам Европейского общества кардиологов [1], в первую очередь подразделяет все антикоагулянты по пути введения в организм человека – парентеральные или для приёма per os. Далее, согласно механизму действия, внутри каждой из этих групп выделяются непрямые и прямые антикоагулянты. Препараты, которые не оказывают непосредственного действия на факторы свёртывания крови, а являются кофакторами антитромбина или блокаторами витамина К, относятся к антикоагулянтам непрямого действия. Лекарственные средства, обладающие способностью непосредственно блокировать активные центры IIа или Xа факторов свёртывания крови (F), и не требующие для реализации антитромботического действия дополнительных веществ, являются прямыми антикоагулянтами. Подробно механизмы действия представителей каждой из перечисленных групп препаратов будут рассмотрены ниже.
Таким образом, современная классификация антикоагулянтов выглядит следующим образом:
В Российской Федерации в настоящее время наиболее широко распространены парентеральные непрямые и оральные (как непрямые, так и прямые) антикоагулянты.
Парентеральные непрямые антикоагулянты
В 1916 году J.M. Lean выделил из печени собак антикоагулянтную субстанцию, которая в первое время использовалась в качестве лабораторного реактива для предотвращения свертывания крови. Впоследствии этот антикоагулянт был назван гепарином (греч. hepar – печень). C. Best (1930) разработал метод экстракции гепарина из легких крупного рогатого скота, L. Roden (1935) окончательно установил его структуру.
Первое клиническое испытание гепарина провел Masson (1924) у волонтера, получив значительное удлинение времени свертывания крови. Однако в качестве лекарственного препарата для предотвращения тромбозов гепарин стал широко использоваться лишь в годы Второй Мировой войны. В 1949 году в институте Choay (Франция) на основе гепарина был разработан антитромботический препарат «кальципарин», высокая концентрация которого позволяла вводить его подкожно (п/к). Тем не менее, в течение многих лет гепарин назначался внутривенно и только в начале 70-х годов исследования, выполненные сотрудниками института Choay доказали эффективность использования препарата в малых дозах у большого числа пациентов в послеоперационном периоде.
Нефракционированный гепарин (НФГ) – гликозаминогликан, содержащийся почти во всех тканях и органах организма и состоящий из смеси фракций полисахаридов с молекулярной массой в пределах от 3 000 до 30 000 Да. Основным свойством НФГ является «прямое» антикоагуляционное действие на систему свертывания крови, заключающееся в потенцировании ингибиторного действия антитромбина (АТ) на F II, F IXa, F Xa, F XIa и F XIIa. Активность АТ в присутствии НФГ возрастает в 1 000-100 000 раз. Основой антикоагуляционного эффекта является образование тройных комплексов: [F IIa : АТ : НФГ] и [F Xa : АТ : НФГ]. Проявление антикоагуляционной активности НФГ возможно только при достаточном уровне АТ. В случае снижения концентрации последнего в крови введение НФГ бесполезно без возмещения потерь АТ.
НФГ в больших дозах угнетает агрегацию тромбоцитов. Помимо этого, НФГ принимает участие во многих процессах метаболизма, влияя на углеводный, белковый и жировой обмен. НФГ обладает сосудорасширяющим действием, улучшает микроциркуляцию, оказывает гипогликемическое и местное противовоспалительное действие. Он опосредованно тормозит реакцию антиген-антитело, обладает антиаллергическими свойствами. НФГ способен регулировать ангиогенез и пролиферацию эндотелиальных клеток [2].
Для медицинского использования гепарин выпускается в виде натриевой и кальциевой соли. Активность препарата выражается в единицах действия. Раствор гепарина для инъекций выпускается с активностью 5 000, 10 000 и 20 000 МЕ в 1 мл. НФГ действует быстро, но кратковременно. Метаболизируется НФГ главным образом печенью, но около 20% выводится почками. При дозе 100 ЕД/кг T1/2 составляет один час, при более высоких дозах его содержание снижается нелинейно. Выраженность эффекта зависит от пути введения препарата. При инфузионном введении эффект развивается сразу же, поддерживается непрерывно на необходимом уровне. При прекращении введения или уменьшении его скорости, эффект НФГ быстро угасает. При болюсном в/в введении действие препарата длится 4-5 часов, а после п/к инъекции эффект развивается через 40-60 минут и продолжается 8-12 часов.
При использовании терапевтических доз препарата антикоагулянтный эффект НФГ мониторируется с помощью активированного парциального тромбинового времени (АПТВ), которое рекомендуется увеличивать в 1,5-2,5 раза по сравнению с нормальной плазмой. Определение АПТВ должно проводиться каждые 6 часов с коррекцией скорости введения гепарина до тех пор, пока два последующих измерения не будут соответствовать целевым значениям, а состояние больного не будет стабильным. После этого АПТВ определяется 1 раз в 12-24 часа. Для оценки эффективности проводимой терапии возможно определение уровеня D-димера [3].
В условиях массивной гепаринизации во время операций с искусственным кровообращением или вмешательств на коронарных артериях применение высоких доз НФГ основано на стандартных протоколах, учитывающих массу тела больного и вид хирургического вмешательства. В таких ситуациях мониторинг за действием НФГ осуществляется с помощью активированного времени свертывания (АВС) [3, 4].
Наиболее серьёзными осложнениями при применении НФГ являются кровотечения и гепарин-индуцированная тромбоцитопения. Основными причинами развития кровоточивости могут быть иммуноопосредованная тромбоцитопения, а также факторы риска, обусловленные сопутствующими заболеваниями (заболевания печени, почек, инвазивные вмешательства, септические состояния, травма).
В 1-5% случаев при применении НФГ развивается гепарин-индуцированная тромбоцитопения (ГИТ), которая возникает на 4-6 сутки лечения гепарином и в 30% случаев осложняется рикошетными тромбозами. Различают два типа тромбоцитопении, обусловленной гепарином:
I тип – развивается у больных, ранее получавших НФГ. ГИТ-1 встречается в 5-6% случаев лечения НФГ, характеризуется бессимптомным течением, ранним снижением количества тромбоцитов до 100·109 /л. Препараты гепарина при этом типе тромбоцитопении не противопоказаны, однако рекомендуется более тщательный дальнейший контроль за динамикой числа тромбоцитов крови.
II тип – развивается у больных, ранее не получавших НФГ. ГИТ-2 обусловлена выработкой аутоантител к комплексу [НФГ : тромбоцитарный фактор 4] и возникает обычно через 6-14 дней лечения, при этом доза НФГ может быть минимальной, как, например, при промывании гепарином венозных катетеров. ГИТ-2 характеризуется выраженным и стабильным снижением числа тромбоцитов в крови (на 30% и более от исходного) и проявляется коагулопатией с высоким риском развития как кровотечений, так и тромбоэмболических осложнений. При возникновении ГИТ-2 противопоказано продолжение лечения гепарином во всех его формах. Если продолжение антитромботической терапии необходимо, то назначают антикоагулянты, не образующие комплекс с фактором 4 тромбоцитов (пентасахариды, гликозаминогликаны, производные гирудина, пептидные антитромбины). Риск развития ГИТ-2 значительно возрастает при наличии у пациента фонового иммунного заболевания (антифосфолипидный синдром (АФС), системная красная волчанка, узелковый периартериит и др.).
Низкомолекулярные гепарины (НМГ) – фрагменты НФГ, полученные путем химической или ферментативной деполимеризации со средней молекулярной массой 4 000-8 000 дальтон. В 1976 году V. Kakkar [5] установил, что уменьшение молекулярной массы гепарина приводит к снижению его способности ингибировать тромбин. Именно блокада тромбина является основной причиной развития кровоточивости при гепаринотерапии. При этом уменьшение молекулярной массы не влияет на основной механизм антикоагулянтного действия гепарина – способность блокировать F Xa. Патент на низкомолекулярный гепарин (надропарин кальция) был получен институтом Choay в 1978 году, его успешная клиническая апробация была выполнена V. Kakkar в 1982 году и с 1985 года было разрешено производство этого препарата с торговым названием «Фраксипарин». В настоящее время известны около десяти препаратов этого класса.
Уменьшение молекулярной массы НМГ способствует улучшению их фармакокинетических характеристик: НМГ имеют большую биодоступность и быструю всасываемость из депо по сравнению с НФГ, более длительный T0,5, выводятся из организма преимущественно почками. При этом НМГ меньше влияют на тромбоциты, что сопровождается снижением частоты геморрагических осложнений. У препаратов этой группы более удобный режим введения (дважды в сутки, фраксипарин форте – один раз в сутки), при их использовании отсутствует необходимость лабораторного мониторинга. Недостатком НМГ является их высокая стоимость. Однако необходимо помнить, что различные представители НМГ различаются по физико-химическим, биологическим и фармакокинетическим характеристикам, то есть не являются взаимозаменяемыми. Каждый представитель НМГ имеет свой спектр антитромботического действия, показания к клиническому использованию. Поэтому необходимым является соблюдение конкретного способа применения, рекомендованного для каждого препарата.
Вводятся НМГ п/к в участок живота снаружи от края прямой мышцы ниже пупка. Введение в/в допустимо, однако такую методику используют редко – в случае необходимости получения срочного антитромботического эффекта. Внутримышечное введение НМГ запрещено.
Контроль за терапией НМГ осуществляется по их способности к блокированию F Xa – анти-Xa активность плазмы по Международному стандарту низкомолекулярных гепаринов. При этом важно соблюдать время получения пробы – через 3-4 часа после инъекции для профилактических доз при однократном введении и в середине между двумя инъекциями при двукратном терапевтическом применении. Исследование анти-Xa активности должно быть проведено в течение 1-2 часов с момента забора крови. Однако проведение исследования анти-Xa активности для большинства лабораторий недоступно в связи с высокой стоимостью исследования, поэтому обычно используются терапевтические дозы НМГ в соответствии с весом больного на основании рекомендаций фирмы-производителя.
Контроль за уровнем тромбоцитов крови обязателен при использовании любых гепаринов и проводится до начала введения препарата, а затем – один раз в 3-5 дней. Эффект от применения НМГ оценивается по купированию признаков тромбинемии (D-димер) [4, 6].
Фондапаринукс (торговое название – «Арикстра», производитель – GlaxoSmithKline) по химической структуре относится к группе синтетических пентасахаридов, механизм действия которого заключается в угнетении активности F Xа. Связываясь с АТ, пентасахариды приблизительно в 300 раз усиливают нейтрализацию F Xa, что прерывает цепь реакций свертывания крови и, следовательно, предотвращает тромбообразование. В отличие от гепаринов пентасахариды не конъюгируют с другими белками, в том числе с 4 фактором тромбоцитов, в связи с чем они не способны провоцировать ГИТ. Пентасахариды также не инактивирует тромбин.
Фондапаринукс рекомендован к использованию для:
Препарат выпускается в шприцах по 0,5 мл, содержащих 2,5 мг фондапаринукса. В этой дозе препарат не влияет на показатели коагулограммы и не требует лабораторного контроля. После п/к введения фондапаринукс быстро и полностью всасывается, максимальная концентрация в плазме достигается через 2 часа после введения, T1/2 составляет около 17-20 часов. Выведение препарата осуществляется почками.
Курс лечения продолжается, как правило, 5-9 суток.
С осторожностью препарат следует использовать у пациентов с повышенным риском развития кровотечений. Не рекомендуется одновременное применение с другими средствами, вызывающими гипокоагуляцию (фибринолитиками, блокаторами рецепторов IIb-IIIa, НФГ, НМГ). При сочетании с АСК, тиенопиридинами, НПВС необходимо соблюдать осторожность и проводить соответствующий контроль.
Парентеральные прямые антикоагулянты
Механизм действия прямых антикоагулянтов, как уже было указано ранее, заключается в целенаправленной блокаде активных центров факторов свёртывания крови (IIа или Xа), что приводит к нейтрализации их коагуляционных свойств и развитию состояния гипокоагуляции.
Прямые ингибиторы тромбина (F IIа). Прототипом для этих препаратов послужил нативный гирудин. С лечебной целью пиявки (Hirudo medicinalis) использовались ещё в Древней Греции, однако антикоагулянтное действие их слюны впервые было описано J.Haycraft в 1884 году. В 1955 году F.Markwardt удалось выделить в чистом виде вещество, названное “гирудин”, а в 80-е годы XX века, после определения его химической структуры, стало возможным промышленное производство этого препарата в культуре дрожжей ДНК-рекомбинантным методом. Дальнейшие исследования, базировавшиеся на изучении структуры гирудина, привели к появлению семейства гирудино-подобных пептидов (гиругенов и гирулинов). Синтетическим путём были получены аргатробан и производные бороаргинина.
Однако, вопреки ожиданиям, представители данного лекарственного класса не оказывают существенного влияния на результаты терапии и прогноз у пациентов с острыми коронарными синдромами в сравнении с гепарином. Значимое снижение частоты неблагоприятных исходов при терапии прямыми ингибиторами тромбина наблюдается только в раннюю фазу и практически не распространяется на период после прекращения введения препаратов. При этом высокая стоимость прямых ингибиторов тромбина существенно ограничивает их применение в клинике.
Прямые ингибиторы F X. Отамиксабан – экспериментальный прямой селективный ингибитор фактора свёртываемости крови Ха с быстрым началом/окончанием действия в форме инъекций. В исследовании III фазы ТАО проводилась сравнительная оценка эффективности отамиксабана с НФГ +/- ингибитор GP IIb/IIIa в отношении снижения риска смерти или нового инфаркта у пациентов с ОКС бп ST. Однако, согласно последним данным, клинические испытания отамиксабана прерваны из-за его неэффективности – в ходе клинических испытаний выяснилось, что он не имеет существенного преимущества перед традиционной терапией [7].
Таким образом, прямые антикоагулянты для парентерального введения к настоящему моменту не нашли широкого применения в клинической практике.
Оральные непрямые антикоагулянты
Антагонисты витамина К – препараты этой группы угнетают синтез факторов свертывания крови, не вмешиваясь непосредственно в коагуляционный процесс. Именно поэтому их ещё называют антикоагулянтами непрямого действия. По механизму действия они являются антагонистами витамина К (АВК), активная форма которого участвует в заключительных стадиях синтеза факторов свертывания крови II, VII, IX и X, а также естественных антикоагулянтов протеина C и S (ПрС, ПрS). АВК блокируют фермент витамин К-редуктазу, восстанавливающую окисленную форму витамина К в его активную форму (рис. 1). Нарушение активации витамина К сопровождается синтезом неактивных форм витамин К-зависимых факторов свертывания крови, способность которых к коагуляционным реакциям значительно снижена (PIVKA-протеины – Proteins, Induced in Vitamin K Absence). Развивается состояние гипокоагуляции, препятствующее образованию тромбина, формированию фибринового сгустка и, следовательно, развитию и прогрессированию тромбообразования.
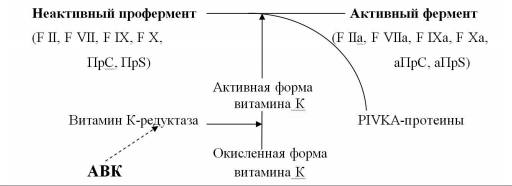 |
| Рис. 1 Механизм действия антикоагулянтов непрямого действия трансформация, активация, ингибиция (Вавилова Т.В., 2005, в модификации |
Скорость снижения активности факторов свертывания крови под влиянием АВК неодинакова. Первым уменьшается активность F VII, T1/2 которого в плазме составляет 4-6 часов; затем – F IX и F X, T1/2 которых равен 48 часам; последней снижается активность F II – примерно через 3-4 суток от начала приема препарата. В том же порядке происходит и восстановление уровня факторов после отмены АВК: быстро нормализуется F VII, позже – F IX и F X, и только через несколько дней – F II. В настоящее время установлено, что для получения выраженного антитромботического эффекта первостепенное значение имеет снижение содержания в плазме именно F II. Поэтому при переводе больного с НФГ или НМГ на терапию АВК, последние важно назначать за 4-5 дней до отмены гепарина. В противном случае возникает промежуток времени, в течение которого больной остается без воздействия антикоагулянтов, что сопровождается усилением процессов тромбообразования.
При назначении АВК необходимо помнить, что уже на начальном этапе лечения развивается выраженное снижение активности естественных антикоагулянтов – ПрС и его кофактора ПрS. Затем наступает стабилизация их активности и даже частичное восстановление ее уровня, в то время как депрессия факторов свертывания крови продолжается. Исходя из этого, следует воздерживаться от назначения АВК при тромбофилиях, обусловленных дефицитом указанных антикоагулянтов, а также при ДВС-синдроме, когда активность ПрС снижена иногда до очень низкого уровня [8].
Основным преимуществом препаратов этой группы перед прямыми антикоагулянтами является наличие таблетированных форм, что делает удобным длительное использование АВК. Их достоинством является и отсутствие необходимости взаимодействия с АТ для проявления гипокоагуляционного действия, поэтому применение АВК возможно на фоне дефицита АТ.
В настоящее время в мировой практике и в России наиболее широко применяется препарат группы монокумаринов – варфарин (кумадин). В 2001 г. препарат зарегистрирован в России фирмой Nikomed. Форма выпуска – пластиковые флаконы, каждый из которых содержит 50 или 100 таблеток Варфарин Никомед по 2,5 мг.
АВК применяются при необходимости длительной (иногда пожизненной) и непрерывной антикоагулянтной профилактики и терапии при наличии высокого риска развития тромбозов и системных тромбоэмболий, в том числе кардиогенных. Однако использование этих препаратов требует регулярного контроля за показателями протромбинового времени (ПВ), соблюдения определенных правил питания, осторожности при наличии сопутствующих заболеваний и их лечении.
Успех применения АВК зависит от адекватности дозы препарата и грамотной организации лабораторного контроля за уровнем гипокоагуляции. Перед назначением АВК необходимо оценить противопоказания к его приему; выявить факторы, влияющие на колебания антикоагулянтного эффекта и предполагаемую продолжительность терапии; исследовать общий анализ крови (включая подсчет тромбоцитов), общий анализ мочи, ПВ, АПТВ, функциональное состояние печени (билирубин, активность трансаминаз) и почек (мочевина, креатинин).
Если во время терапии варфарином возникло кровотечение, необходимо оценить степень его тяжести, показания МНО, уточнить режим приема препарата и других лекарств. Развившееся кровотечение может быть купировано введением свежезамороженной плазмы или использованием препаратов витамина К1 (не викасола!). Сложность купирования кровотечения в такой ситуации заключается в том, что в России не производится и не зарегистрирован препарат витамина К1. В настоящее время доступен препарат «Протромплекс 600», содержащий факторы протромбинового комплекса (II, VII, IX, X) и антикоагулянты (ПрC и АТ) в точных дозировках.
Величина поддерживающей дозы варфарина и стабильность гипокоагуляционного эффекта зависят от ряда врожденных и приобретенных факторов:
Снижение чувствительности к варфарину отмечается при микседеме, хроническом алкоголизме, АФС.
Таким образом, применение препаратов из группы АВК требует обучения пациента и постоянного контакта с ним, тщательного выявления факторов риска развития кровотечений и регулярного лабораторного контроля за уровнем гипокоагуляции. В целях оптимизации применения АВК в масштабах страны целесообразным представляется организация выпуска препарата витамина К1 или закупка последнего у фирм-производителей.
Оральные прямые антикоагулянты
Несколько лет назад, благодаря инновационным разработкам ведущих мировых фармацевтических компаний, в арсенале врачей появились прямые антикоагулянты для приёма per os. Эти препараты избирательно ингибируют только один фактор свертывания крови – или F IIа (тромбин), или F Xа. Возможность их использования в широкой клинической практике – прорыв в современной медицине, так как впервые за многие десятилетия появилась реальная альтернатива варфарину [9]. При этом прямые пероральные антикоагулянты (ПОАК) имеют целый ряд преимуществ перед антагонистами витамина К: не требуют рутинного лабораторного контроля и соблюдения диеты, демонстрирует ограниченное число взаимодействий с другими лекарственными средствами [10]. Вследствие этого ПОАК всё более широко используются во врачебной практике [11, 12, 13]. Кроме того, этим лекарственным средствам, в отличие от гепаринов и фондапаринукса, для осуществления антикоагулянтного действия не нужно образовывать комплекс с антитромбином. Кроме того, данные препараты, в отличие от гепаринов, не связываются с 4-м тромбоцитарным фактором, не являются антигенами и не вызывают иммунную тромбоцитопению [10].
В Российской Федерации в настоящий момент для применения зарегистрированы следующие ПОАК – апиксабан, дабигатрана этексилат и ривароксабан. Данные препараты применяются в следующих клинических ситуациях [14, 15, 16, 17]:
Однако практическим врачам необходимо чётко понимать, что названные выше лекарственные средства принципиально различаются между собой:
| Таблица 1 Режим дозирования ПОАК в зависимости от клинической ситуации |
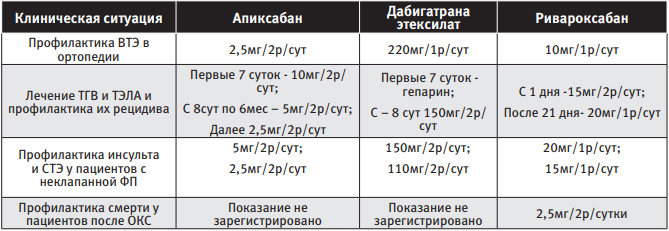 |
Блокатор F IIа – дабигатрана этексилат (торговое название – «Прадакса ® », производитель – Boehringer Ingelheim International) – пролекарство, которое после приёма внутрь быстро трансформируется сывороточной эстеразой в дабигатран – прямой ингибитор F II (тромбина). Фармакокинетический профиль дабигатрана в плазме крови здоровых добровольцев характеризуется быстрым увеличением концентрации в плазме с достижением максимальной концентрации (Сmax) в пределах 0,5-2 часов. После достижения Cmax плазменные концентрации дабигатрана снижаются биэкспоненциально, конечный T1/2 в среднем составляет около 14-17 часов у молодых людей и 12-14 часов у пожилых. При этом T1/2 не зависит от дозы. Пища не влияет на биодоступность дабигатрана этексилата. Биодоступность дабигатрана составляет 6,5%. При назначении данного препарата очень важно учитывать состояние почек пациента, так как дабигатран экскретируется преимущественно почками (80% от принятой дозы), и его накопление в организме повышает риск кровоточивости.
Блокаторы F Xа
Апиксабан (торговое название – «Эликвис ® », производитель – Bristol-Myers Squibb Company). Препарат обратимо и селективно блокирует активный центр F X. Апиксабан не оказывает непосредственного прямого влияния на агрегацию тромбоцитов, но опосредованно ингибирует агрегацию, индуцированную тромбином. Абсолютная биодоступность апиксабана достигает 50% при его применении в дозах до 10 мг. После приёма внутрь апиксабан быстро всасывается из ЖКТ, Cmax в крови достигается в течение 3–4 часов. Приём пищи не оказывает влияния на показатели Cmax апиксабана. Приблизительно 25% принятой дозы выводится в виде метаболитов. Основной путь выведения – через кишечник. Почечная экскреция апиксабана составляет приблизительно 27% от его общего клиренса, T1/2 – около 12 часов. Нарушение функции почек, возраст (≥80 лет) и вес пациента (≤60 кг) – это те факторы, наличие которых требует снижения дозы у пациентов с ФП.
Заключение
Таким образом, на современном этапе развития медицины практическому врачу доступен целый ряд антикоагулянтов, блокирующих процессы тромбообразования. При их использовании, в первую очередь, необходимо соблюдать существующие показания и противопоказания к их применению, а также ориентироваться в особенностях фармакодинамики и фармакокинетики каждого из этих препаратов. Кроме того, чрезвычайно важным является выявление индивидуальных особенностей пациента (возраст, вес, наследственность, личный анамнез, сопутствующая патология), что позволяет применять данные лекарственные препараты не только эффективно, но и безопасно.