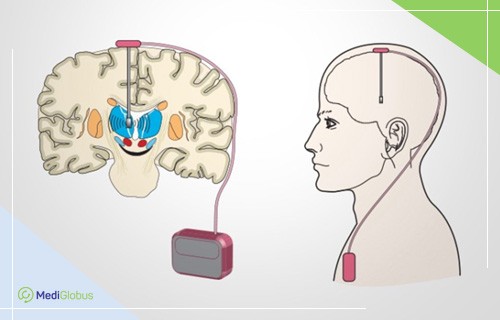
глубокая стимуляция мозга что это
Неинвазивная, но глубокая стимуляция мозга: новый прорыв?
Электрическая стимуляция зон, участвующих в управлении движением – успешный метод терапии болезни Паркинсона. Но этот подход требовал имплантации в мозг пациента электродов – сложной процедуры с определенными рисками (мы подробно писали об этом методе в цикле материалов, посвящённых болезни Паркинсона).
Электроды для лечения болезни Паркинсона, как правило, размещаются в субталамическом ядре – структуре, расположенной под таламусом глубоко внутри мозга. Электростимуляция этой области может улучшить состояние многих пациентов, но и операция по имплантации электродов несет в себе риски, в том числе — кровоизлияние в мозг и инфекции.
Команда из Массачусетского технологического института в сотрудничестве с исследователями медицинского центра Диакониссы Бет Израель (Beth Israel Deaconess Medical Center, BIDMC) и фонда IT’IS разработала способ неинвазивной электрической стимуляции областей глубоко внутри мозга через электроды, помещаемые на кожу головы, благодаря очень красивой физике процесса. В методе электроды, расположенные за пределами мозга, генерируют два высокочастотных электрических поля, частоты которых различаются лишь на очень небольшую величину (в эксперименте на мышах авторы применяли поля с частотой колебаний 2,01 КГц и 2 КГц ровно). Суть в том, что столь высокочастотные поля не оказывают никакого стимулирующего эффекта на нейроны, которым для стимуляции нужны частоты на два порядка меньше.
И здесь на помощь приходит явление интерференции. Два этих близких по частоте поля перекрываются глубоко в мозге, их частоты со сдвигом накладываются друг на друга и взаимно вычитаются. Так в этой области возникает низкочастотное поле, стимулирующее только нейроны в области перекрытия. Согласитесь, некое подобие (по принципу получения рабочей зоны перекрытием нескольких лучей или полей, не влияющих на мозг) гамма-ножа. Получившееся поле стимулирует активность нейронов, в то время как ток высокой частоты проходит через окружающие ткани при отсутствии эффекта.
Меняя частоту тока, количество и расположение электродов, ученые могут контролировать размер и расположение области головного мозга, которая получит низкочастотную стимуляцию. Они могут настраиваться на места в глубине мозга, не затрагивая окружающие структуры. А также регулировать расположение без перемещения электродов, просто изменяя частоту тока. Таким образом можно стимулировать участки мозга как в терапии, так и для научных исследований.
Исследователи протестировали этот метод на мышах и обнаружили, что могут стимулировать небольшие области в глубине мозга, включая гиппокамп. Они также были в состоянии переместить место стимуляции, что позволяет им активировать разные участки моторной коры и побудить мышь переместить свои конечности, уши или усы.
«Я предполагаю, что эта технология может стать портативной для неинвазивной глубокой стимуляции мозга в качестве терапии. Если работа может быть осуществлена на более крупных животных, чем мыши, я буду еще более оптимистичен”, — заявил Типу Азиз (Tipu Aziz), профессор нейрохирургии в Оксфордском университете, который не был вовлечен в исследование.
Примечательно, что в экспериментах на гиппокампе мыши метод вообще не затронул нейроны в коре головного мозга — области, лежащей между электродами на черепе и цели глубоко внутри мозга. Исследователи также не обнаружили никаких вредных воздействий ни в одной части головного мозга.
Врачи также предполагают использовать свой метод для лечения некоторых пациентов с обсессивно-компульсивным расстройством, эпилепсией и депрессией, и изучают возможность ее использования для лечения других заболеваний – например, аутизма. Благодаря новому неинвазивному подходу, возможно, будет легче адаптировать глубокую стимуляцию мозга для лечения многих неврологических заболеваний.
Текст: Любовь Пушкарская
Noninvasive Deep Brain Stimulation via Temporally Interfering Electric Fields. Nir Grossman et al, Cell, June 1, 2017
Что такое глубокая стимуляция мозга (DBS)? Интервью с нейрохирургом из клиники Коч
Процедура глубокой стимуляции мозга или DBS – одно из самых впечатляющих достижений нейрохирургии. Она помогает там, где медикаментозное лечение бессильно и возвращает человека к прежней жизни даже при сильных проявлениях нарушений движения. Компания MediGlobus провела эксклюзивное интервью с нейрохирургом и профессором Сельчук Пеккером из университетской клиники Коч. Доктор подробно рассказал нам о процедуре DBS, сферах ее применения и эффективности лечения.
Здравствуйте, доктор Пеккер. Вы зарекомендовали себя как опытного нейрохирурга и провели множество процедур глубокой стимуляции мозга. Расскажите нам, что такое DBS?
DBS означает глубокую стимуляцию мозга. Мы используем этот метод хирургического вмешательства при болезни Паркинсона, дистонии и треморе. При процедуре DBS мы имплантируем электрод в небольшой участок мозга и подаем туда электрические сигналы, которые должны дойти до субталамического ядра. Они меняют активность нейронов на этом участке. После этой процедуры пациентам становится лучше и они реже жалуются на симптомы.
При каких заболеваниях вы проводите глубокую стимуляцию мозга?
Чаще всего мы используем DBS при болезни Паркинсона, треморе и дистонии. Конечно, другие заболевания также лечатся с помощью глубокой стимуляции мозга. Например, обсессивно-компульсивное расстройство, депрессия, иногда – эпилепсия. Однако, таких пациентов немного, в основном пациенты обращаются с первыми тремя диагнозами.
Доктор Пеккер, Вы не раз упомянули, что с помощью DBS ослабляются симптомы болезни Паркинсона. Эта процедура назначается на любой стадии болезни, или только на последних?
При болезни Паркинсона, дистонии и треморе пациент в первую очередь должен получить медикаментозное лечение. И если пациенту не помогают препараты, тогда на консилиуме рассматривается его случай и принимается решение о хирургическом лечении. Безусловно, не каждому пациенту показана операция, но большинству пациентов хирургическое лечение действительно помогает.
Вы очень интересно рассказываете о процедуре. Насколько она эффективна для пациентов? Улучшается ли их жизнь после DBS?
Цель DBS при болезни Паркинсона – сохранить качество жизни. Мы не можем полностью вылечить болезнь Паркинсона – пациент должен жить с ним всю жизнь. Но после лечения мы получаем намного меньше жалоб на симптомы болезни. При дистонии и треморе симптомы лечат из соображений эстетики. Поэтому большинство пациентов, более 80%, довольны результатом глубокой стимуляции мозга.
Доктор Пеккер, а Вы не могли бы привести пример реального человека, чье качество жизни выросло после процедуры DBS?
Много лет назад я оперировал пациента с тремором. Это была молодая девочка, 14 лет. У нее был тремор левой части тела с большой частотой и амплитудой дрожания. Для нее это было очень тяжело. Мы приняли решения провести глубокую стимуляцию мозга. После операции прошло 15 лет. Теперь у нее дела идут лучше, чем тогда. Она работает, ведет интересный блог в Интернете и она счастлива. Конечно, я тоже становлюсь счастливее, когда вижу ее.
Это чудесная история. Мы рады за эту девушку. Думаю, нашим читателям будет интересно узнать, какие этапы операции она прошла. Расскажите нам весь процесс, начиная от подготовки к DBS.
При расстройствах движения: болезни Паркинсона или треморе (в этих случаях нарушена функция движения) решение о проведении DBS принимается консилиумом. В его состав входят врачи разных специальностей: нейрохирург, невролог, психиатр, психолог, физиотерапевт. На консилиуме оценивается состояние пациента. Если клиническое состояние пациента подходит для хирургического вмешательства и он прошел курс медикаментозного лечения – мы решаем продолжить лечение с помощью DBS хирургии.
Затем мы госпитализируем пациента и в течение дня проводим операцию. В течение суток после операции пациент должен оставаться в отделении интенсивной терапии. Затем пациент пребывает в госпитале на протяжении 4 – 5 дней. После он может отправиться домой. Через 2-3 недели мы начинаем электрическую стимуляцию конкретных участков мозга. Если пациент страдает от тремора, мы можем увидеть результат на начальных стадиях лечения. При брадикинезии или при трудностях ходьбы во время болезни Паркинсона результаты очевидны позже: только через несколько месяцев.
Если Вы хотите получить программу лечения от университетской клинике Коч – напишите координаторам MediGlobus. Мы поможем Вам организовать лечение в Турции!
PsyAndNeuro.ru
Эффективность глубокой стимуляции мозга: результаты французского исследования (1978-2017 г.)
В августе 2017 года были представлены результаты двадцатилетнего исследовательского наблюдения эффективности глубокой стимуляции мозга при болезни Паркинсона, эссенциальном треморе (болезнь Минора) и различных форм дистонии, проведённого в университетском госпитале Гренобля (CHU de Grenoble). Пациентам проводилась глубокая стимуляция головного мозга (ГСМ, DBS) в связи с резистентностью к лечению тремора лекарственными средствами.
Во время ГСМ в выявленные с помощью МРТ участки мозга пациента подводятся электроды, соединенные с электростимулятором. Затем с помощью высокочастотных импульсов приводятся в раздражение базальные ганглии головного мозга с целью снизить неконтролируемые движения пациента.
В цели постоперационного наблюдения входила фиксация выраженности тремора у пациентов в течение первого года исследования. Также требовалось выявить уменьшение общего тремора и непроизвольного движения рук через год после операции и на протяжении более десяти лет. Эффективность ГСМ высчитывалась с учётом числа обследуемых, в соответствии со шкалой TRS (Fahn-Tolosa-Marì Tremor Rating Scale) и с универсальной шкалой оценки тремора (UPDRS, III Motor Examination: 2021).
В наблюдении участвовали 98 пациентов с болезнью Паркинсона, эссенциальнымтремором (болезнью Минора) и с наследственной дистонией. Первые две группы обследуемых показали положительную динамику: через год после операции эффективность ГСМ оценена в 70% среди пациентов с болезнью Паркинсона и в 66% среди пациентов с эссенциальным тремором. Удовлетворительные показатели сохранились на уровне 63% и 48% соответственно спустя 10 лет после операции.
Однако у пациентов с наследственной дистонией выявлено лишь небольшое улучшение в течение первого года после операции: с учётом оценки тремора и числа участников эффективность ГСМ оценена в 41% по результатам обследования через год и в 30% спустя пять лет.
В ходе всего исследования 48 человек испытали незначительные негативные послеоперационные осложнения. Так, всего у двоих пациентов была обнаружена геморрагическая болезнь и инфекция головного мозга. В целом, было подтверждено позитивное влияние глубокой стимуляции головного мозга для лечения заболеваний Паркинсона и эссенциального тремора спустя год и в течение 10 лет после операции. Однако в отношении наследственной дистонии эффект операции был признан менее значительным и краткосрочным.
Подготовила: Мартемьянова Е.О.
2) Zhang Q, Kim Y-C and Narayanan NS – Zhang Q, Kim Y-C and Narayanan NS (2015) Disease-modifying therapeutic directions for Lewy-Body dementias. Front. Neurosci. 9:293. doi: 10.3389/fnins.2015.00293
Глубокая стимуляция мозга (DBS)
1. Что такое DBS
2. Как проходит вмешательство
3. Аппарат стимуляции мозга
4. Ведущие клиники
5. Прогнозы лечения
6. Цена лечения
7. Жизнь после DBS
8. Отзывы
Глубокая стимуляция головного мозга (Deep Brain Stimulation) — это нейрохирургическая процедура, с помощью которой в определенную зону мозга посылается электроимпульс с целью терапии неврологических заболеваний. Она проходит без осложнений у 99% пациентов. Более 160,000 человек во всем мире выполнили DBS. Для лечения каких заболеваний показан этот метод, где он проводится и сколько стоит – читайте в статье MediGlobus.
Слушать статью:
Что такое глубокая стимуляция мозга и когда она показана
Глубокая стимуляция мозга (DBS) – одно из самых важных достижений в клинической нейробиологии за последние 2 десятилетия. Процедура подразумевает использование электрических импульсов для устранения патологической активности мозга. Она обеспечивает регулируемую стимуляцию поврежденных участков мозга для достижения положительного терапевтического эффекта при неврологических и психических расстройствах.
DBS – нейрохирургическое вмешательство, которое включает имплантацию электродов в определенные участки головного мозга. С помощью таких имплантатов высокочастотные импульсы воздействую на нейронные цепи. Это дает возможность успешно лечить двигательные расстройства, устранять проблемы с памятью и восстанавливать когнитивные функции.
Глубокую стимуляцию мозга (DBS) назначают при таких расстройствах:
эндогенная депрессия;
ДЦП (детский церебральный паралич);
Для проведения DBS за границей обращайтесь к нам. Жмите на кнопку ниже и оставляйте свои контакты. Мы перезвоним Вам в ближайшее время.
Подготовка к операции глубокой стимуляции мозга
Перед процедурой пациенту следует пройти ряд рутинных обследований:
лабораторные анализы.
За неделю до проведения глубокой стимуляции мозга (DBS) следует прекратить прием противовоспалительных лекарств, употребление алкоголя и отказаться от курения. За 8 часов до операции следует прекратить прием пищи и жидкости. Перед процедурой врач выясняет наличие аллергии на анестезию и проводит инструктаж.
Как проходит операция?
Первый этап операции проводит целая команда докторов: нейрохирург, радиолог, анестезиолог, психиатр и невролог. Процедура длится от 5 до 7 часов. Большая часть этого времени отведена для настройки устройства.
Пациент, находясь в сознании, выполняет указания доктора: двигает конечностями, глазами, говорит. Это необходимо для того, чтобы доктор убедился в правильности установки стимулятора. При этом пациент не испытывает дискомфорта, т.к. головной мозг не имеет нервных окончаний. Данные передаются на компьютер и когда врачи уверены в том, что электроды стимулируют именно тот участок мозга, который необходимо, операционное поле закрывается специальной пластиной и сшивается.
Вторым этапом процедуры является фиксация проводов и вживление генератора под кожей пациента. Здесь используют общий наркоз. Этот этап обычно проводят сразу после первого или через несколько дней. Госпитализация длится 2-3 дня.
Врачи-координаторы международной медицинской платформы MediGlobus помогут Вам с организацией поездки в иностранную клинику для проведения процедуры: “Глубокая стимуляция мозга (DBS)”. Оставляйте свою заявку!
Как проходит послеоперационный период?
После операции DBS пациент на протяжении нескольких недель амбулаторно посещает клинику. За это время врач производит окончательные настройки нейростимулятора с помощью специального программатора. На протяжении двух недель после операции запрещен прием алкоголя. Реабилитация длится 3-4 дня и заключается в заживлении операционного поля (диаметром не более 1 см).
Послеоперационные осложнения DBS имеют вероятность всего в 1% случаев:
Кратковременные побочные эффекты после операции по установке стимулятора:
Что собой представляет аппарат стимуляции мозга?
Аппарат DBS — устройство, которое состоит из электрода, удлинителя и нейростимулятора. Электрод помещается в необходимую зону головного мозга, удлинитель проводится под кожей к генератору.
Стимулятор имеет размер не больше спичечного коробка и работает от аккумулятора или батареи. Он герметичен и устанавливается в животе пациента или в груди. Пациент может самостоятельно управлять устройством при помощи пульта.
При получении команды, стимулятор отправляет электрический импульс в головной мозг, контролируя таким образом двигательные симптомы. Длительность работы аккумулятора составляет около двух недель. Срок службы аккумулятора — от 1,5 до 9 лет. Аппарат может быть перезаряжаемым или не перезаряжаемым. От этого зависит его стоимость.
Где проводят процедуру глубокой стимуляции мозга?
Университетский госпиталь Наварры
Клиника Медикана Аташехир
Больница Хаима Шибы
Университетская клиника Кельна
Университетский госпиталь Коч
Медицинский центр Хадасса
Клиника Аполло
Госпиталь СунЧонХян
Госпиталь Мотол
Венская Частная Клиника
Эффективность при разных заболеваниях
Следует отметить, что DBS не излечивает патологию, а лишь устраняет симптомы неврологического дефицита, развившиеся вследствие прогрессирования болезни. Метод значительно улучшает качество жизни пациентов, но не может заменить медикаментозную терапию (но уменьшает количество принимаемых препаратов) и наблюдения у невролога.
Эффективность Deep Brain Stimulation при терапии болезни Паркинсона составляет порядка 98%. Самочувствие пациентов улучшается уже в первые часы после операции. Речь становится более связной, исчезает тремор, восстанавливается координация.
После нескольких дней пациенты отмечают улучшение общего самочувствия, нормализацию сна и отсутствие болевых ощущений. При лечении эпилепсии с помощью DBS у 80% пациентов вдвое сокращается количество приступов. При лечении тремора около 90% пациентов отметили значительное улучшение своего состояния. Из них у 60% тремор исчез полностью.
Сколько стоит установка нейростимулятора?
Жизнь после установки нейростимулятора мозга
Устройство должно быть включено круглосуточно. Пациент сам контролирует работу нейростимулятора, задавая устройству нужный режим. Стимулятор не причиняет неудобств — он незаметен под одеждой. Разрешается применение нейростимулятора вместе с кардиостимулятором. Следует отметить, что никакие гаджеты, а также электромагнитные волны и микроволновая печь никак не влияют на работу стимулятора.
При прохождении контроля в аэропорту, металлодетектор отреагирует на ваш нейростимулятор. Предъявите служащему аэропорта свою карточку, которая свидетельствует о нахождении устройства в вашем теле.
Отзывы о DBS
Людмила Валентиновна: “Я безумно благодарна своему сыну за то, что он привез меня на лечение в Германию. Метод стимуляции мозга стал для меня спасением, ведь мало кто представляет себе, как для больных Паркинсоном тяжело изо дня в день не только физически, но и психологически. Люди смотрят на тебя, показывают пальцем. Мне надоело доставлять неудобства родным и я рада, что могу теперь самостоятельно передвигаться по городу. Спасибо немецким врачам, что дали мне возможность провести свою старость достойно.”
Резюме
Чтобы узнать больше информации о применении глубокой стимуляции мозга в иностранных клиниках, а также уточнить стоимость этой процедуры, обращайтесь к специалистам медицинской платформы MediGlobus. Мы ответим на все Ваши вопросы!
Глубинная стимуляция в нейрохирургии
Полный текст
Аннотация
Методика глубинной стимуляции головного мозга применяется для лечения пациентов с различными заболеваниями центральной нервной системы, которые не поддаются консервативной терапии, а открытые вмешательства сопряжены с высоким риском осложнений. В обзоре оценивается эффективность глубинной стимуляции различных участков головного мозга при некоторых фармакорезистентных формах заболеваний.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
Рис. Эксперимент Х. Дельгадо, проведенный в 1963 г. [1]
Примечание. Иллюстрация опыта, где нападающий бык останавливается (а) и поворачивает в противоположную сторону (б).
Х. Дельгадо занимался проблемой лечения эпилепсии, болезни Паркинсона, психических расстройств; изобрел устройства, напоминающие нимб и шлем, через которые электромагнитные импульсы раздражали различные участки головного мозга.
Впервые методику глубинной стимуляции головного мозга в клиническую практику внедрил A. Benabid. В 1987 г. после стимуляции пациенту с болезнью Паркинсона промежуточного ядра таламуса (Vim) автор получил обнадеживающие результаты.
Точный механизм действия глубинной стимуляции до настоящего времени неизвестен, однако существует мнение, что стимуляция нейронов электрическим током вызывает выброс аденозинтрифосфата, который активирует аденозиновые А1-рецепторы, что в свою очередь через цепь реакций приводит к угнетению возбуждения и проведения в нервной ткани [2].
В настоящее время глубинная стимуляция является одним из эффективных методов лечения фармакорезистентных форм заболеваний, таких как эпилепсия, паркинсонизм, эссенциальный тремор, дистония, детский церебральный паралич, синдром Туретта (табл.).
Таблица. Заболевания и анатомические структуры, подвергающиеся глубинной стимуляции
Заболевания
Анатомические структуры
Центральное срединное ядро таламуса, базальные ганглии (скорлупа, хвостатое ядро), субталамическое ядро, черная субстанция, гиппокамп, миндалевидное тело, червь мозжечка [3–18]
Субталамическое ядро, бледный шар, педункулопонтийное ядро [19–29]
Вентральное промежуточное ядро таламуса, субталамическое ядро, zona incerta, prelemniscal radiation [30–37]
Внутренняя часть бледного шара, вентральное промежуточное и вентральное заднее ядро таламуса, субталамическое ядро [38–44]
Детский церебральный паралич
Вентролатеральное ядро таламуса, медиальная часть бледного шара, верхние ножки мозжечка [45–50]
Медиальные таламические ядра, бледный шар [51–53]
Ежегодно в Российской Федерации необходимое количество подобных операций достигает 56 000 [54]. К преимуществу данной методики следует отнести малую инвазивность, возможность подбора настроек для каждого пациента, что снижает количество побочных эффектов и улучшает прогнозы заболевания, а также высокую зону покрытия (т.е. модулируя один участок, можно изменять активность других).
ГЛУБИННАЯ СТИМУЛЯЦИЯ ГОЛОВНОГО МОЗГА КАК МЕТОД ЛЕЧЕНИЯ ФАРМАКОРЕЗИСТЕНТНЫХ ФОРМ ЗАБОЛЕВАНИЙ
Фармакорезистентная форма эпилепсии
В Российской Федерации ежегодно около 1400 больных нуждаются в проведении хирургического лечения фармакорезистентной формы эпилепсии [54]. Глубинная стимуляция является одним из методов коррекции активности эпилептогенной зоны. Она применяется для лечения как темпоральной, так и экстратемпоральной формы фармакорезистентной эпилепсии, при которых открытое хирургическое вмешательство сопряжено с высокими рисками осложнений.
В настоящее время для лечения эпилепсии используется глубинная стимуляция центрального срединного ядра таламуса, базальных ганглиев, субталамического ядра, черной субстанции, гиппокампа, миндалевидного тела и мозжечка. Однако доказанную эффективность имеет только двусторонняя стимуляция передних ядер таламуса. Переднее ядро таламуса является частью круга Пейпеца, в который также входят гипоталамус, поясная извилина, гиппокамп и мамиллярные ядра гипоталамуса [55]. Образовавшийся нервный импульс в нейронах коры головного мозга или в амигдалогиппокампальном комплексе поступает в мамиллярные ядра гипоталамуса, откуда через сосцевидно-таламический тракт в передние таламические ядра. Из ядер таламуса нервный импульс распространяется на столбы свода, поясную извилину, базальные ганглии, по таламостриарным волокнам — в хвостатое ядро, по таламокорковым путям — в моторную область коры головного мозга. Существует множество различных цепей распространения патологического нервного импульса, однако он всегда поступает в таламус, поэтому данная анатомическая структура является мишенью при лечении эпилепсии.
В 1972 г. J. Kusske провел эксперимент, в котором впервые показал, что повреждение передней ядерной группы таламуса сопровождается сокращением частоты и продолжительности эпилептических приступов [3]. M. Mirski с соавт. выявили, что разрушение, стимуляция или инъекция ГАМКергических агонистов в переднее ядро таламуса, а также разрушение сосцевидно-таламического тракта обладают противосудорожным эффектом [4, 5].
Первое клиническое наблюдение стимуляции переднего ядра таламуса описали I. Cooper и соавт. [6]. При лечении 6 пациентов с фармакорезистентной формой эпилепсии было выявлено снижение частоты судорог более чем на 50% у 5 больных, а у 1 пациента бессудорожный период длился около двух лет. В других исследованиях указывается, что при глубинной стимуляции переднего ядра таламуса происходит снижение частоты приступов на 46–76% [7, 8].
В 2010 г. проведено крупное многоцентровое исследование SANTE (Stimulation of the Anterior Nucleus of Thalamus for Epilepsy study), показавшее обнадеживающие результаты при двусторонней стимуляции переднего ядра таламуса. Было обследовано 110 пациентов: у 54% произошло улучшение в виде сокращения количества приступов на 56%; у 13% приступы полностью отсутствовали на протяжении 6 мес, еще у 13 частота приступов снизилась на 90% и более [9]. К примеру, стимуляция блуждающего нерва сопровождается уменьшением количества приступов более чем на 50% у 30% больных [10].
Центральное срединное ядро таламуса является самым крупным ядром таламуса, имеет связи с корой полушарий головного мозга, базальными ганглиями (хвостатым ядром, скорлупой). Так, согласно данным A. Velasco и соавт. и A. Valentín и соавт., частота приступов снижается на 73–92% [11, 12].
A. Biraben и соавт. показали, что развитие эпилепсии происходит в результате уменьшения количества дофамина в базальных ганглиях, а именно в скорлупе и хвостатом ядре [13]. Глубинная стимуляция хвостатого ядра приводит к снижению частоты приступов на 50% и более у 92% пациентов [14]. Стимуляция амигдалогиппокампального комплекса была впервые предложена M. Velasco и соавт. Другие авторы также отметили, что установка электродов в данную область сопровождается урежением частоты приступов на 50% и более у 50–90% больных [15, 16]. A. Cukiert и соавт. сообщили результаты наблюдения 9 пациентов с фармакорезистентной эпилепсией, которым проводили стимуляцию гиппокампа с помощью установленного в него электрода. У 97% больных было выявлено снижение частоты приступов на 80% [17].
Стимуляция мозжечка в качестве терапии пациентов с фармакорезистентной формой эпилепсии впервые была предложена в 1973 г. I. Cooper и соавт. Снижение частоты приступов выявляется у 33% больных [6].
Болезнь Паркинсона
Болезнь Паркинсона является вторым по распространенности нейродегенеративным заболеванием после болезни Альцгеймера и второй причиной инвалидизации после инсульта головного мозга. Этиологическим фактором для развития заболевания является снижение концентрации дофамина в черной субстанции и полосатом теле. В Российской Федерации хирургическое лечение при болезни Паркинсона требуется приблизительно в 2800 случаях в год [54]. Эффективность лечения болезни Паркинсона зависит от точности постановки диагноза, которая варьирует в пределах 73,8–82,7% [56].
Впервые стимуляцию субталамического ядра произвел P. Pollak в 1993 г. при лечении пациента с фармакорезистентной формой болезни Паркинсона. В последующем для этой цели стали использовать установку электродов в бледный шар. Так, согласно V. Odekerken и соавт., глубинная стимуляция как субталамического ядра, так и бледного шара в равной степени является эффективным методом лечения фармакорезистентной формы болезни Паркинсона [19]. Однако глубинная стимуляция бледного шара сопряжена с меньшими побочными эффектами [20].
По данным Р. Pahwa и соавт., у всех принявших участие в исследовании пациентов (n=19), которым проводили глубинную стимуляцию субталамических ядер, отметили снижение выраженности двигательных расстройств на 85–100%. Авторы определили, что двусторонняя стимуляция сопровождалась лучшими результатами лечения, чем односторонняя [21]. Согласно представленным результатам С. Акшулакова и соавт., из 48 пациентов с болезнью Паркинсона, которым проводили глубинную стимуляцию субталамического ядра или бледного шара, улучшение двигательных функций на 80% отметили все исследуемые. Постуральная неустойчивость, нарушения походки и автономные симптомы регрессировали в меньшей степени, однако всем пациентам уменьшена доза допаминергических препаратов на 30% и больше, что привело к полному регрессу лекарственных дискинезий. У 7 пациентов прием препаратов был полностью прекращен [22].
По мнению G. Abbate-Daga и соавт., глубинная стимуляция субталамического ядра уменьшает не только двигательные расстройства, но и выраженность психических нарушений, которые наблюдаются у 50% пациентов (психозы, депрессия, галлюцинации) [23]. Есть мнение, что глубинная стимуляция у пациентов с болезнью Паркинсона может провоцировать развитие когнитивных нарушений [24–26]. Однако, A. Romann и соавт. в своем исследовании опровергли вышеуказанные наблюдения [27].
В 2005 г. для лечения больных с фармакорезистентной формой болезни Паркинсона Р. Mazzone с соавт., а затем P. Plaha с соавт. предложили стимуляцию педункулопонтийного ядра. Выраженность моторных нарушений снижалась в значительной мере [28, 29]. Однако до настоящего времени эффективность стимуляции данного анатомического образования активно обсуждается.
Эссенциальный тремор
Эссенциальный тремор — полиэтиологическое заболевание, характеризующееся развитием дрожательных гиперкинезов. Одним из патогенетических звеньев развития заболевания является нарушение возбуждения в таламусе и нижних оливах, что приводит к дезинтеграции нервного импульса в церебеллоталамокортикальной петле. Наряду с этим происходит повышение содержания глутамата и снижение уровня гамма-аминомасляной кислоты, глицерина и серина в ликворе, повышение активности норадренергической системы и увеличение содержания в крови циклического аденозинмонофосфата. До 50% пациентов являются резистентными к консервативной терапии эссенциального тремора, наибольшую доказательную базу имеет глубинная стимуляция вентрального промежуточного ядра таламуса, однако постоянно проводятся исследования, в которых проверяется роль ядер таламуса (zona incerta, prelemniscal radiation) [30, 31].
Так, известно, что глубинная стимуляция вентрального промежуточного ядра таламуса снижает выраженность тремора по шкале Fahn–Tolosa–Marin на 85% [32]. В ряде других исследований при глубинной стимуляции вентрального промежуточного ядра таламуса выраженность тремора рук может уменьшаться на 50–91%, а головы и голоса — на 15–100% [33, 34]. В. Тюрников и соавт. представили опыт эффективного лечения пациента с медикаментозно-резистентной формой эссенциального тремора. Авторы провели хроническую стимуляцию вентрального промежуточного ядра таламуса со стороны тремора, на фоне которой симптоматика полностью регрессировала [35].
D. Huss и соавт. оценили эффективность различных методов терапии больных с фармакорезистентной формой эссенциального тремора, а именно одно- или двусторонней глубинной стимуляции вентрального промежуточного ядра или односторонней таламотомии. Авторы выявили, что анализируемые методы лечения в равной степени улучшают прогноз заболевания, однако два первых продемонстрировали относительную безо-пасность и были сопряжены с меньшим числом побочных эффектов [36]. T. Chen с соавт. оценили эффективность глубинной стимуляции у пациентов, которых погружали в наркоз, и тех, кто был в сознании во время проведения операции. Про-анализировав показатели 89 участников, исследователь не выявил разницы в исходах заболевания у бодрствующих и спящих больных: снижение выраженности тремора составило 48,6 и 45,5% соответственно [37].
Дистония
Дистония — группа синдромов, характеризуемых постуральными непроизвольными двигательными расстройствами, при которых задействованы как мышцы-агонисты, так и мышцы-антагонисты. Существует первичная и вторичная форма дистонии, характерным отличием является наличие структурных изменений в головном мозге при вторичной форме. По этой причине наиболее часто производится глубинная стимуляция первичных форм. Распространенность первичных форм дистонии варьирует от 11 до 300 на 100 000 населения, а точность постановки диагноза — от 60 до 70% [54]. Патогенез дистонии до конца не ясен. Возможной причиной является нарушение синтеза и переработки нейромедиаторов (серотонина, норадреналина, глутамина и гамма-аминомасляной кислоты), что ведет к изменению взаимо-связи между базальными ганглиями, таламусом и корой головного мозга. Наличие гена DYT также сопровождается развитием дистонии. Доказанную эффективность имеет глубинная стимуляция внутренней части бледного шара, хотя существуют работы, в которых показана эффективность стимуляции вентрального промежуточного и вентрального заднего ядра таламуса, а также субталамического ядра.
Так, B. Sun и соавт. отметили, что стимуляция субталамического ядра по сравнению со стимуляцией бледного шара является наиболее эффективной: улучшение наступает сразу, параметры стимуляции ниже, длительнее срок службы батареи [38]. L. Cif и соавт. обследовали и пролечили 53 пациента с дистонией. Авторы выявили снижение выраженности симптомов и улучшение исходов заболевания на 71–74% при двусторонней глубинной стимуляции внутренней части бледного шара [39]. Согласно M. Vidailhet и соавт., у 22 пациентов, которым выполнили стимуляцию внутренней части бледного шара, улучшение моторных функций по шкале Burke-Fahn-Marsden Dystonia Rating Scale-motor (BFMDRS) произошло на 54%, а уровень инвалидизации по шкале BFMDRS уменьшился на 44% [40]. В проведенном многоцентровом исследовании 40 больных с первичной сегментарной и генерализованной дистонией было выявлено улучшение моторных функций в первые три месяца после глубинной стимуляции бледного шара по шкале BFMDR на 39% [41].
Ограничением для глубинной стимуляции является возраст детей 7 лет, однако в литературе описывается случай успешного лечения дистонии у пятилетнего ребенка, страдающего эпилепсией. После двусторонней стимуляции внутренней части бледного шара выраженность моторных нарушений снизилась на 81%, что благоприятно сказалось на качестве жизни [42]. R. Yadav и соавт. опубликовали результаты лечения дистонии с помощью глубинной стимуляции медиальной части бледного шара. Авторы отметили снижение выраженности дистонии в туловище и конечностях на 50%, а в шее — более чем на 90% [43]. Существующее мнение, согласно которому у пациентов после глубинной стимуляции происходит нарушение психики, было опровергнуто исследованиемS. Meoni и соавт. [44].
Детский церебральный паралич
Детский церебральный паралич — совокупность неврологических синдромов, возникающих в результате повреждения головного мозга плода или новорожденного. Детский церебральный паралич является вторичной формой дистонии, при которой происходит снижение тормозного влияния коры головного мозга на стволовые центры и вестибулярные ядра. Согласно результатам некоторых исследований, наибольшее количество повреждений у больных детским церебральным параличом выявляется со стороны чечевицеобразного ядра; у 69% пациентов — в скорлупе, у 68% — в субталамических ядрах, у 62% — в таламусе, у 20% — в бледном шаре, у 13% — в хвостатом ядре.
Наиболее часто используется стимуляция вентролатерального ядра таламуса, медиальной части бледного шара и верхних ножек мозжечка. Глубинная стимуляция применяется для коррекции двигательных и речевых нарушений, уменьшения выраженности координаторных нарушений при различных формах детского церебрального паралича: положительный эффект от данных операций достигает 50% [45]. Доказано, что глубинная стимуляция медиальной части бледного шара улучшает двигательные функции, уменьшает выраженность контрактур и спазма [46]. L. Romito и соавт. представили результаты лечения 15 пациентов с детским церебральным параличом, которым проводили двустороннюю стимуляцию медиальной части бледного шара. Авторы выявили снижение выраженности двигательных нарушений на 49,5%, а степени инвалидизации — на 30% [47]. Аналогичные данные получил J. Keen с соавт. [48]. Однако ранее M. Vidailhet с соавт. не отметили способности глубинной стимуляции влиять на исходы заболевания у пациентов с детским церебральным параличом [49]. J. Kim и соавт. представили исследование, в котором провели сравнительную оценку глубинной стимуляции внутренней части бледного шара с/без деструкции вентролатерального ядра таламуса. В ходе исследования авторы не выявили значимых отличий [50].
Болезнь Туретта
Заболевание, характеризуемое моторными и во-кальными тиками, а у некоторых больных — копролалией. В США насчитывается около 2 млн больных с подобным заболеванием. Лечение фармакорезистентной формы болезни Туретта заключается в глубинной стимуляции медиальных таламических ядер и бледного шара. Так, по мнению V. Visser-Vandewalle и соавт., глубинная стимуляция медиальных таламических ядер сопровождается снижением частоты тиков на 66% [51]. M. Welter и соавт. обосновывают лучшую эффективность глубинной стимуляции внутренней части бледного шара снижением частоты тиков на 78% в сравнении с 45% при стимуляции медиальных ядер таламуса [52]. Аналогичные результаты получены J. Zhang с соавт.: ученые отметили снижение частоты тиков на 51,2% при стимуляции внутренней части бледного шара [53]. Несмотря на множество исследований, концепция лечения больных с фармакорезистентной формой болезни Туретта до настоящего времени не определена.
ЗАКЛЮЧЕНИЕ
Таким образом, глубинная стимуляция является перспективным и эффективным методом лечения пациентов с различными заболеваниями центральной нервной системы, которые не поддаются консервативной терапии, а открытые вмешательства сопряжены с высоким риском осложнений. Имеется сообщение, что глубинная стимуляция может использоваться в качестве метода лечения злокачественной формы артериальной гипертензии, болезни Альцгеймера, нарушения зрения и речи после инсульта или травмы, ожирения, наркомании, шизофрении. Несмотря на это, до настоящего времени нет единой концепции применения глубинной стимуляции. Также неясен механизм его действия, не выявлены эффективные анатомические ориентиры и необходимые параметры стимуляции. Множество нерешенных вопросов обусловливает проведение дальнейших исследований эффективности глубинной стимуляции в лечении больных с различными заболеваниями головного мозга.