хвостатое ядро мозга функции
Психотические расстройства
Психотические расстройства в виде галлюцинаторного или параноидного синдромов, экстракампильных феноменов (ощущений присутствия или прохождения), иллюзий, синдромов нарушения идентификации, эпизодов спутанности сознания и делирия особенно характерны для деменции с тельцами Леви и болезни Гентингтона, но возможны и при других экстрапирамидных заболеваниях (гепатолентикулярной дегенерации, спиноцеребеллярных атаксиях, болезни Крейтцфельдта–Якоба) [2, 7]. При болезни Паркинсона психотические нарушения чаще возникают на поздней стадии, на фоне выраженных когнитивных нарушений, и провоцируются противопаркинсоническими средствами [7]. Вместе с тем психотические нарушения не следует рассматривать лишь как осложнение лекарственной терапии. Решающее значение имеют клинические предпосылки, возникающие по мере прогрессирования когнитивного процесса. Одной из таких предпосылок является когнитивное снижение. При этом более важное значение, по-видимому, имеет не столько степень общего снижения когнитивных функций, сколько определенный профиль нейропсихологических нарушений, включающий выраженные зрительно-пространственные и лобные дизрегуляторные нарушения [4]. С другой стороны, исследования деменции с тельцами Леви, при которой психотические нарушения возникают в 80% случаев, указывают на значение в развитии психозов дисфункции структур височной доли, особенно ее медиальных отделов, имеющей решающее значение в распознавании зрительных образов [17]. Несомненна связь с поражением медиальных отделов височных долей и бредовых расстройств [3, 17].
В последние годы особую популярность приобрела нейрохимическая гипотеза происхождения психотических расстройств, согласно которой их причиной служит дисбаланс между холинергическими и моноаминергическими восходящими системами. Этот дисбаланс может характеризоваться недостаточностью холинергической системы (обычно вследствие дегенерации базального ядра Мейнерта) и относительным преобладанием дофаминергической и серотонинергической систем либо усилением функции последних вследствие гиперстимуляции дофаминовых или серотониновых рецепторов в коре и лимбической системе [2, 19]. Соответственно, для лечения психотических нарушений могут применяться не только блокаторы дофаминовых рецепторов (нейролептики), но и антисеротониновые препараты и центральные холиномиметики. При некоторых заболеваниях (например, мультисистемной атрофии, прогрессирующем надъядерном параличе, кортикобазальной дегенерации) психотические нарушения возникают исключительно редко, возможно, из-за отсутствия выраженного холинергического дефицита в лимбической системе и/или коре [2, 23]. В любом случае психотические нарушения можно рассматривать как своего рода маркер нейродегенеративных заболеваний, связанных с формированием телец Леви.
Таким образом, при патологии базальных ганглиев, тесно связанных с корковыми и лимбическими структурами, помимо двигательных нарушений возникает сложный комплекс когнитивных, эмоционально-личностных, а иногда и психотических расстройств, которые оказывают существенное влияние на жизнедеятельность больного. Своевременная диагностика психических расстройств имеет важное значение для оценки трудоспособности больного, прогноза заболевания, планирования лечебных и реабилитационных программ.
Общие подходы к лечению
Лечение большинства пациентов с экстрапирамидными заболеваниями на сегодняшний день, к сожалению, сводится к чисто симптоматической терапии, в первую очередь предполагающей воздействие на определенные нейромедиаторные системы. Хотя коррекция когнитивных и других психических расстройств является важнейшим резервом повышения качества жизни пациентов с экстрапирамидными заболеваниями и ухаживающих за ними лиц, в целом подходы к ней остаются недостаточно разработанными [21]. Для коррекции когнитивных нарушений, достигших степени деменции, показано применение ингибиторов холинэстеразы (галантамина, ривастигмина, донепезила) и мемантина, однако их эффективность установлена лишь при болезни Паркинсона и деменции с тельцами Леви [18]. Для коррекции депрессии и тревожных расстройств (включая обсессивнокомпульсивный синдром) могут применяться антидепрессанты различных фармакологических групп. Коррекция поведенческих нарушений, помимо антидепрессантов, может включать применение атипичных нейролептиков (таких как клозапин или кветиапин) и малых доз антиконвульсантов, обладающих нормотимическим действием (например, карбамазепина) [17]. В некоторых случаях коррекция нейропсихиатрических симптомов невозможна без изменения схемы лечения моторных расстройств. С другой стороны, адекватная коррекция психических нарушений может позволить довести дозу средств для лечения двигательных симптомов до эффективного уровня. Подобные коллизии особенно типичны для поздней стадии болезни Паркинсона. В любом случае терапия когнитивных и нейропсихиатрических расстройств должна быть сугубо индивидуальной и учитывать переносимость и достигаемый клинический эффект.
Литература
* Неврология, нейропсихиатрия, психосоматика. – 2012. – Спецвыпуск №2. – С. 22–30.
Хвостатое ядро мозга функции
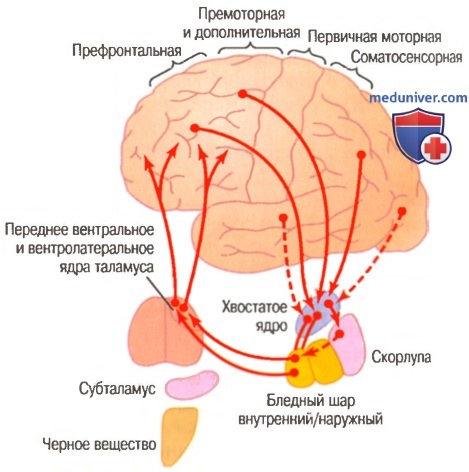
а) Роль базальных ганглиев в когнитивном контроле двигательных актов. Контур хвостатого ядра. Понятие «когнитивная способность» означает мыслительные процессы мозга, использующие как сенсорную информацию, поступающую в мозг, так и информацию, уже накопленную в памяти. Большинство наших двигательных актов являются следствием реализации генерируемых в мозге мыслей — процесса, который называют когнитивным контролем двигательной активности. Главную роль в этом контроле играет хвостатое ядро.
Нервные связи между хвостатым ядром и кортикоспинальной моторной системой, показанные на рисунке ниже, слегка отличаются от связей контура скорлупы.
Отчасти это связано с тем, что хвостатое ядро, как видно на рисунке ниже, распространяется во все доли большого мозга, начинаясь впереди в лобных долях, затем проходя через теменные и затылочные доли и, наконец, загибаясь снова вперед в височные доли, образуя подобие буквы «С».
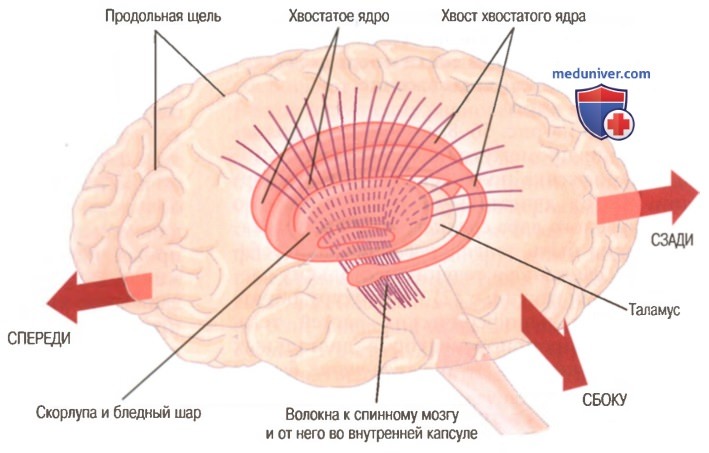
Кроме того, хвостатое ядро получает основную часть своего «входа» из ассоциативных областей коры большого мозга, лежащих над хвостатым ядром, главным образом из областей, которые объединяют разные типы сенсорной и моторной информации в соответствующие мыслительные программы.
После того как сигналы из коры большого мозга достигают хвостатого ядра, они передаются к внутренней части бледного шара, затем к релейным ядрам переднего вентрального и вентролатерального таламуса и в итоге — назад к префронтальной, премоторной и дополнительной моторной областям коры большого мозга.
Однако практически ни один из возвращающихся сигналов не идет непосредственно к первичной моторной коре. Вместо этого сигналы идут к тем вспомогательным моторным регионам в премоторной и дополнительной моторной областях, которые имеют дело не с возбуждением отдельных мышечных движений, а с организацией программ последовательных движений, длящихся 5 сек или более.
Хорошей иллюстрацией сказанного будет мгновенная и автоматическая реакция человека, увидевшего приближение льва. Он:
(1) отворачивается от льва;
(3) даже пытается влезть на дерево.
Без когнитивных функций у человека не может быть интуитивного знания, позволяющего без слишком длительного размышления реагировать быстро и соответствующим образом.
Таким образом, когнитивный контроль двигательной активности определяет подсознательно и в течение секунд, какой комплекс движений будет полезен для достижения сложной цели, хотя само двигательное поведение в этом случае может продолжаться в течение многих секунд.
б) Участие базальных ганглиев в изменении временных характеристик и масштабного соотношения движений. В процессе регуляции движений реализуются две важные способности мозга:
(1) определять, как быстро движение должно выполняться;
(2) контролировать должную амплитуду движения.
Например, человек может писать букву «а» медленно или быстро. Так же он может написать маленькую «а» на листке бумаги или большую «а» на классной доске. Независимо от выбора пропорции буквы остаются примерно одинаковыми.
У больного с тяжелым поражением базальных ганглиев эти функции распределения во времени и масштабного соотношения движений недостаточны; иногда они практически отсутствуют. Базальные ганглии и здесь функционируют не в одиночку, а в тесной связи с корой большого мозга.
Особенно важной областью коры является задняя теменная кора, представляющая собой локус пространственных координат для регуляции движений всех частей тела, а также для соотношения тела и его частей со всем его окружением. На рисунке ниже показано, как человек, лишенный левой задней теменной коры, может рисовать лицо другого человека, изображая правильно пропорции с правой стороны, но почти игнорируя левую сторону (которая в его правом поле зрения).

Такой человек также не будет пытаться пользоваться своей правой рукой, правой кистью или другими правыми частями тела для выполнения задач, почти не осознавая, что эти части его тела существуют.
Поскольку хвостатое ядро системы базальных ганглиев функционирует в основном в связи с ассоциативными областями коры большого мозга, например задней теменной корой, по-видимому, определение скоростных характеристик и масштабных соотношений движений является функциями этого контура когнитивного двигательного контроля хвостатого ядра.
Однако наше понимание функции базальных ганглиев все еще так неопределенно, что многое из того, что обсуждается в нескольких последних разделах, является предположением, логическим умозаключением, а не доказанным фактом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Патогенез
Наиболее значимым фактором риска поражения мелких сосудов головного мозга является артериальная гипертензия [23]. При дисциркуляторной энцефалопатии встречаются как первичные сосудистые, так и вторичные дегенеративные изменения вещества головного мозга.
Выделяют несколько видов патологических изменений вещества головного мозга, ассоциированных с хроническим ишемическим повреждением [2,29,42].
Атеросклероз поражает артерии эластического и крупные артерии мышечного типа. В большинстве случаев атеросклероз приводит к развитию острых нарушений мозгового кровообращения с быстрым развитием выраженных очаговых симптомов. В патогенезе хронических сосудистых заболеваний головного мозга основное значение имеет поражение микроциркуляторного русла. Оно образовано терминальными ветвями крупных артерий каротидного и вертебрально-базилярного бассейна, а также притоками церебральных вен. Артерии микроциркуляторного русла подвержены изменениями при резких перепадах артериального давления поскольку на этом уровне не образуются анастомозы.
Болезнь мелких сосудов или микроангиопатия может иметь различной этиологии:
В ряде случаев, нарушения микроциркуляции могут быть вызваны патологией со стороны системы крови, без поражения кровеносных сосудов. Истинная полицитемия, гемоглобинопатии или протеинопатии могут повышать вязкость крови, что приводит к сопротивлению кровотоку и агрегации форменных элементов, является причиной церебральной ишемии. В редких случаях возможно развитие микроэмболии. Важными дополнительными факторами могут быть нарушения обмена веществ, прежде всего, сахарный диабет и нарушение венозного оттока.
Нарушения ауторегуляции мозгового кровообращения являются как причиной, так и следствием поражения микрососудов, принимая участие в порочном круге патологических изменений.
Лейкоареоз — нейровизуализационный термин (снижение рентгеновской плотности на КТ головного мозга, повышение интенсивности сигнала по данным МРТ в Т2/FLAIR режимах), описывающий неспецифические изменения подкоркового белого вещества головного мозга. Выявляются двусторонние очаговые, иногда сливные изменения. В основе лейкоареоза лежит поражение мелких артерий и артериол вследствие липогиалиноза (также обозначается как артериосклероз) и микроатероматоза [11].
Факторами риска развития лейкоареоза являются возраст, повышенное артериальное давление и сахарный диабет [18]. Повышение внутрижелудочкового давления рассматривается в качестве дополнительного механизма развития лейкоареоза, оно приводит к нарушению микроциркуляции в прилегающих к желудочкам участках головного мозга. У пациентов с нормотензивной гидроцефалией отмечаются распространённые изменения подкоркового белого вещества [21].
Доказана связь распространенности диффузных изменений белого вещества головного мозга с выраженностью депрессии и когнитивных нарушений [9,43].
В препаратах головного мозга лейкоареоз часто сочетается с расширением периваскулярных (Вирхова-Робина) пространств — криблюрами (‘etát criblé’). Этот феномен связывают с повторными эпизодами ишемии и плазматического пропитывания участков ткани, окружающих микрососуды.
Липогиалиноз — дистрофический процесс, поражающий пенетрирующие артерии и артериолы диаметром до 200 мкм. Протекает под действием повышения артериального давления, гипергликемии, а также вследствие возрастных изменений. Повышение тканево-сосудистой проницаемости в субэндотелиальном пространстве сосуда приводит к поступлению туда белков плазмы и адсорбции их на изменённых волокнистых структурах соединительной ткани с последующей преципитацией и образованием белка гиалина. В последующем, гиалин оттесняет и разрушает эластичную мембрану, средняя оболочка истончается, и перфорирующая артерия приобретает вид стекловидной трубочки. Просвет артерии резко сужается, возможно развитие окклюзии.
При развитии липогиалиноза фоне сахарного диабета субэндотелиально часто откладывается не только гиалин, но и липиды. Сосудистая стенка инфильтрируется макрофагами с включениям фагоцитированных липидов — пенистыми клетками. В изменённых тканях происходит отложение фибриноида (сложного вещества, состоящего из белков и полисахаридов, распадающихся коллагеновых волокон, межклеточного вещества и плазмы крови). В неблагоприятных условиях происходит гибель окружающих тканей — фибриноидный некроз. Этот патологических процесс выявляется в артериолах и капиллярах головного мозга, сетчатки и почек часто сочетается с гиалинозом.
Этот патологический процесс, видимо является реактивным феноменом. Он не рассматривается, как ведущая причина гипертонического внутричерепного кровоизлияния, так как в препаратах головного мозга в случаях острого внутричерепного кровоизлияния не обнаруживается на отдалении от гематомы. В лабораторных исследованиях выраженные изменения по типу фибриноидного некроза выявлялись вокруг стереотаксически введенных тромбов в опытах у грызунов, что могло указывать на его реактивное происхождение.
Вследствие нарушения работы ассоциации эндотелиоцит-глиальная клетка (астроцит)-нейрон (»нейроваскулярное звено«) страдают механизмы ауторегуляции мозгового кровотока на уровне капилляров и микроартериол. Это приводит к сужению диапазона допустимых показателей перфузии. Из-за того, что мелкие сосуды утрачивают способность расширяться, становится невозможным перераспределение кровотока в пользу активно работающих отделов мозга, а это в свою очередь приводит к их функциональной инактивации, а затем – и к необратимому повреждению. Преимущественное поражение белого вещества в перивентрикулярном и глубинных отделах при церебральной гипоперфузии объясняется особым характером их кровоснабжения сосудами терминального типа, не имеющими коллатералей.
Клетки нервной ткани различаются по чувствительности к ишемии. При нарушении кровотока, некротические изменения развиваются сначала в нейронах, затем олигодендроцитах, миелинизированных аксонах, астроцитах и наконец в эндотелиальных клетках [38]. После гибели наиболее чувствительных типов клеток — нейронов и олигодендроцитов, относительно резистентные к ишемии астроциты, выполняющие в головном мозге опорную функцию, замещают дефект за счёт увеличения в объёме своих отростков. Формируется глиальный рубец (»неполный» инфаркт») [33]. При тотальной гибели всех элементов участка мозговой ткани формируется участок некроза (лакуна), на периферии регенерация глиальных клеток формирует его «оболочку».
В патологоанатомических исследованиях отмечена связь липогиалиноза мелких артерий с лакунарными инфарктами головного мозга. Указывается на более высокую распространённость расширенных периваскулярных пространств у пациентов с сосудистой деменцией, чем у пациентов с болезнью Альцгеймера [30]. У здоровых пожилых пациентов с выявленными расширенными периваскулярными пространствами отмечались худшие результаты тестирования когнитивных функций.
Микроатероматоз — атеросклеротическое поражение артериол, приводит к развитию более крупных лакунарных инфарктов. В зависимости от локализации, инфаркты могут проявляться клиникой инсульта, но чаще (примерно в 80 % случаев) протекают субклинически (»немые» инфаркты)[40]. У части пациентов основные патологические процессы вызываются церебральной амилоидной ангиопатией (ЦАА) — отложением амилоидных пептидов (прежде всего Аβ — амилоида) в мышечной оболочке и адвентиции микрососудов и сосудов среднего калибра, значительно реже в стенках капилляров и вен.
Частота выявления амилоидоза церебральных артерий на аутопсии с возрастом увеличивается: на основании серии из 784 аутопсийных материалов, признаки умеренной и тяжёлой ЦАА встречались с частотой 2.3% в возрасте от 65 до 74 лет, 8.0% в возрасте от 75 до 84 лет, и 12.1% в возрасте старше 85 лет [14].
Значимых половых различий во встречаемости амилоидоза не выявлено. Несмотря на то, что вопрос связи ЦАА с артериальной гипертензией продолжает обсуждаться, очевидно, что в большом количестве случаев у пациентов при жизни отмечалось нормальное артериальное давление[3].
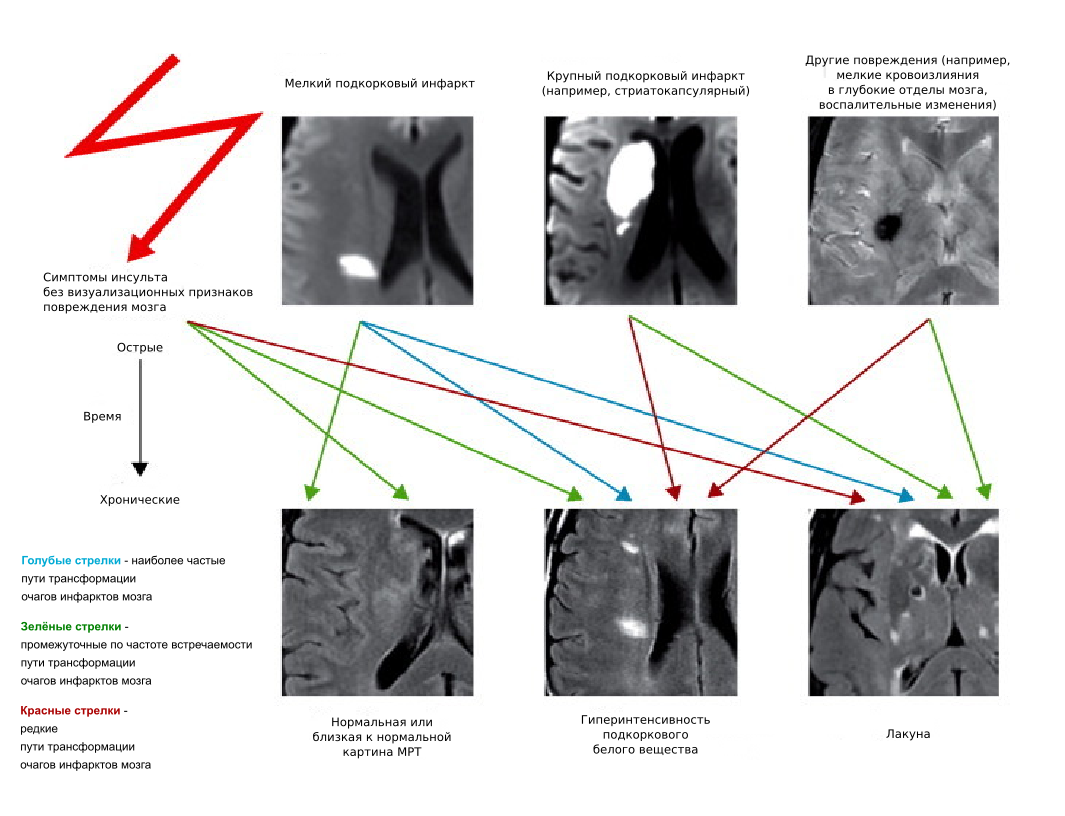
Рисунок 1. Пути трансформации мелких сосудистых очагов и сходство МРТ картины отдалённых последствий поражения мозга различной природы
Предполагается, что амилоидные пептиды, блокируют отток по переваскулярным пространствам, выполняющим в головном мозге дренажную функцию. Повышение ломкости стенки сосудов при отложении амилоида значительно увеличивает риск внутримозговых кровоизлияний. Они, как правило, имеют небольшие размеры и располагаются кнаружи от внутренней капсулы, в белом веществе больших полушарий, для сравнения, гипертонические кровоизлияния поражают преимущественно область подкорковых ядер. В связи с таким расположением микрокровоизлияний при ЦАА, подкорковые структуры остаются относительно интактными, поэтому, экстрапирамидные симптомы не характерны для клиники этого состояния. По данным Фрамингемского исследования установлена связь деменции и внутримозговых микрокровоизлияний, которая не зависела от выраженности других сердечно-сосудистых факторов риска. Наличие ЦАА предполагается у пациентов старше 55–60 лет с множественными лобарными кровоизлияниями без другой явной причины.
Бостонские критерии для кровоизлияний, связанных с церебральной амилоидной ангиопатией [19]
* приём варфарина с превышением целевого значения МНО (> 3,0), перенесённые инсульты и черепно-мозговые травмы, опухоли головного мозга, сосудистые аномалии и васкулиты, патология системы крови, коагулопатии [41].
У пациентов с подозрением на церебральную амилоидную ангиопатию, развитие острых и транзиторных неврологических нарушений может быть связано с геморрагическими осложнениями, что стоит принимать во внимание при планировании их обследования.
У пациентов с выраженным лейкоареозом и множественными лакунарными инфарктами в отсутствии факторов риска сосудистых заболеваний стоит предположить наличие церебральной аутосомно-доминантной артериопатии с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL) — наследственного заболевания, вызванного мутацией гена Notch 3 на 19-й хромосоме. У трети пациентов, страдающих этим заболеванием, отмечается мигрень с аурой, которая рассматривается как раннее проявление заболевания. Приблизительно у 75% лиц, носителей мутации, в конечном счёте развивается деменция[27].
Таким образом, хронические сосудистые поражения головного мозга определяются большим количеством факторов риска, как генетических, так и средовых. Профиль факторов риска развития дисциркуляторной энцефалопатии и инсульта не тождественны. Поражение артерий мозга может быть и изолированным — встречается у пациентов без поражения прецеребральных артерий и артериальной гипертензии.
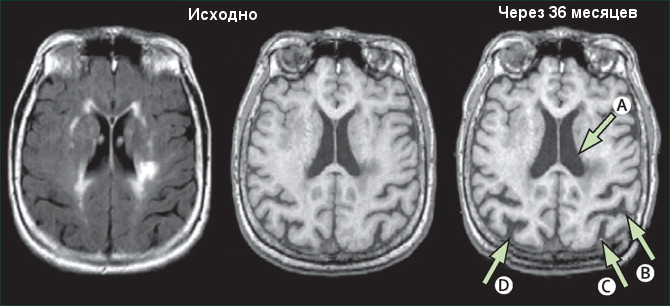
Рисунок 2. Динамика атрофических изменений вещества головного мозга
В патогенезе развития основных симптомов дисциркуляторной энцефалопатии (когнитивных нарушений, нарушений ходьбы, пирамидных и мозжечковых знаков, псевдобульбарного синдрома) лежит разобщение корковых и подкорковых структур вследствие поражения подкоркового белого вещества больших полушарий. Нарушается работа корково-подкорковых кругов, обеспечивающих последовательную избирательную активизацию отдельных участков коры головного мозга при выполнении сложных многоэтапных действий, поддерживающих общий уровень активности коры, несущих информацию для коррекции действий на стадии афферентного синтеза и исполнения (функции I [энергетического] и III [программирование, регуляция и контроль] блоков по А. Р. Лурия).
Клинико-нейровизуализационные соответствия
Термин «энцефалопатия» предполагает наличие не только субъективных жалоб, но и объективных признаков органического поражения мозга, выявляемых при неврологическом или нейропсихологическом исследовании [2]. Вместе с тем, обнаружение подобных признаков, даже вкупе с сосудистыми факторами риска, клиническими или параклиническими признаками цереброваскулярной патологии является необходимым, но недостаточным признаком ДЭП. Важнейшим принципом диагностики ДЭП должна стать констатация причинно-следственной связи между имеющимися у больного клиническими проявлениями и цереброваскулярным заболеванием.
Подобный принцип впервые был заложен в критерии клинической диагностики сосудистой деменции NINDS-AIREN. Представляется, что только следование этому принципу позволит избежать гипердиагностики ДЭП и отделить случаи ДЭП от нейродегенеративных заболеваний, широко представленных у лиц пожилого возраста (в первую очередь от болезни Альцгеймера или болезни Паркинсона, набор симптомов которых на начальных стадиях может соответствовать последствиям хронического сосудистого поражения головного мозга).
Доказательством причинно-следственной связи могут служить:
КТ или МРТ головного мозга при ДЭП могут выявить: двустороннее более или менее симметричное диффузное поражение белого вещества (лейкоареоз) в перивентрикулярной зоне, зрительной лучистости, семиовальном центре; множественные лакунарные очаги (размером 3–15 мм) в базальных ганглиях, таламусе, мосте, мозжечке, внутренней капсуле, белом веществе лобных долей; более крупные корковые и подкорковые инфаркты, отражающие патологию крупных артерий. Церебральная атрофия, выявляемая при КТ или МРТ у больных ДЭП, обычно сопровождает лейкоареоз, лакунарые или территориальные инфаркты [2]. Как правило, расширение желудочковой системы при ДЭП более выражено, чем расширение корковых борозд, и может отражать не только убыль мозгового вещества в глубинных отделах мозга, но и, возможно, снижение резистентности перивентрикулярных тканей к ликвородинамическим воздействиям [2].
В ряде исследований выявлена связь между тяжестью и/или локализацией нейровизуализационных изменений и выраженностью когнитивных и двигательных нарушений [18]. Так, показано, что умеренное когнитивное расстройство возникает, когда распространенность лейкоареоза превышает как минимум 10% белого вещества полушарий, а деменция – если распространенность лейкоареоза превысит 1/4 объема белого вещества полушарий. При наличии лакун выраженность когнитивных нарушений зависит не столько от числа лакунарных очагов, сколько от их локализации (глубинные отделы лобных долей, головка хвостатого ядра и переднее бедро внутренней капсулы, таламус). Выраженность когнитивных нарушений увеличивается при двустороннем поражении указанных структур и сочетании лакунарных очагов с лейкоареозом. Более того, должно быть соответствие между нейровизуализационными изменениями и профилем когнитивных нарушений. Например, в отсутствие соответствующих корковых очагов на КТ и МРТ у пациентов не должны выявляться признаки очагового поражения корковых функций: афазии, апраксии и агнозии. Отмечена также связь между распространенностью лейкоареоза, особенно в передних отделах мозга, локализацией лакунарных очагов в чечевицеобразном ядре и выраженностью нарушений ходьбы и равновесия.
Выраженность когнитивных и двигательных нарушений при ДЭП коррелирует и со степенью расширения боковых желудочков и особенно их передних рогов. С другой стороны, отсутствие сосудистых изменений на МРТ при клинической картине I-III стадий ДЭП и КТ при клинической картине II – III стадий ДЭП может заставлять усомниться в диагнозе. Данные КТ и МРТ имеют значение не только в диагностике ДЭП, но и могут помочь отслеживать динамику заболевания, быть маркером эффективности мер по коррекции факторов риска сердечно-сосудистых осложнений [2]. Отдельные нейровизуализационные феномены считаются нормальным проявлением старения: [12,42]