Тепловые машины второе начало термодинамики
Второй Закон Термодинамики. Тепловой Двигатель
Второй Закон Термодинамики. Тепловой Двигатель
Чуть раньше У. Томсона формулировку второго закона в 1850 г. дал немецкий физик Р. Клаузиус (1822-1888): «Теплота не переходит самопроизвольно от холодного тела к более горячему». Эта формулировка подчеркивает односторонность реальных процессов.
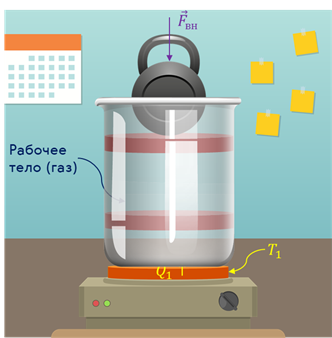
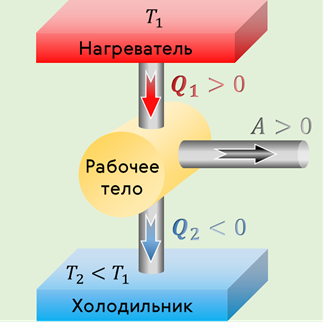
Общая блок-схема теплового двигателя представлена на рис. 32. Чаще всего рабочими телами, совершающими работу в тепловых двигателях, являются газ или пар.
Охладителем у большинства тепловых двигателей является окружающая среда (атмосфера).
Тепло, полученное от нагревателя, рабочее тело не может полностью превратить в механическую энергию путем совершения работы. Если бы Q 1 = А`, то тогда температура рабочего тела упала до О К, а это, как говорилось выше, невозможно. Если бы температура рабочего тела оказалась ниже температуры окружающей среды, то давление газа (пара) было бы меньше атмосферного и двигатель не смог бы совершать работу.
Максимальный КПД имеет тепловой двигатель, работающий по циклу Карно, состоящему из двух изотерм и двух адиабат.
Тепловые Двигатели и Охрана Природы
Влияние тепловых двигателей на окружающую среду заключается в следующем:
Второе начало термодинамики. Принцип работы тепловой машины. Цикл Карно. КПД теплового двигателя



Второе начало термодинамики (ВНТ)
Выражая всеобщий закон сохранения и превращения энергии, первое начало термодинамики (ПНТ) не позволяет определить направление протекания процессов
ВНТ справедливо только по отношению к термодинамическим системам. Существует несколько эквивалентных формулировок ВНТ:
1. Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему (формулировка Клаузиуса).
2. Невозможен процесс, единственным результатом которого является совершение работы за счет охлаждения одного тела (формулировка Томсон).
3. Энтропия изолированной системы не может убывать при любых происходящих в ней процессах, т.е. dS³0, где знак равенства относится к обратимым процессам, а знак больше – к необратимым процессам.(Формулировка Клаузиуса)
Формула Больцмана (31) S=klnW позволяет дать статистическое истолкование третьей формулировки ВНТ: Термодинамическая вероятность W состояния изолированной системы при всех происходящих в ней процессах не может убывать.
Оно выражает необходимые закономерности хаотического движения большого числа частиц, входящих в состав изолированной системы.
Цикл Карно изображен, где изотермическое расширение и сжатие заданы соответственно кривыми 1-2 и 3-4, адиабатическое расширение и сжатие – кривыми 2-3 и 4-1.
 | Согласно (23) КПД цикла Карно h=А/Q=( Q1-Q2)/ Q1= 1- Q2/Q1, где Q1— количество теплоты, полученное газом от нагревателя, температура которого Т1, Q2— количетво теплоты, отданное газом холодильнику, температура которого Т2. Карно показал, что для такого цикла h=(Q1-Q2)/Q1=(Т1-Т2)/Т1=1-Т2/Т1, (24) т.е. КПД определяется только температурами нагревателя и холодильника. Карно предположил, что этот результат справедлив для любых термодинамических систем. |
Принцип работы тепловой машины.
Тепловой машиной называется циклическое устройство, превращающее теплоту, выделенную при сжигании топлива, в работу.
Элементы тепловой машины:
КПД-Это работы машины к затраченной энергии.
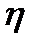
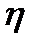
Рабочее вещество идеальной тепловой машины совершает цикл Карно.
Вывод фор-ы Карно: 
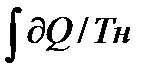
Qн= 
-Qх= 


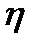
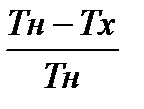
14. Энтропия. Статистический смысл второго закона термодинамики.
Пришла пора разобраться со вторым фундаментальным постулатом термодинамики, который именуется второе начало термодинамики. Второе начало не является доказуемым в рамках классической термодинамики. Его формулировки – результат обобщения опытов, наблюдений и экспериментов. Попытаемся рассказать о нем кратко и понятно.
В прошлой статье по термодинамике мы говорили о термодинамических системах, состоящих из большого числа частиц. Для описания подобных систем используются так называемые функции состояния.
Термодинамическая функция состояния (или термодинамический потенциал) – это функция, зависящая от нескольких независимых параметров, определяющих состояние системы. Чтобы было понятнее, приведем пример. Одна из функций состояния системы – это ее внутренняя энергия. Она не зависит от того, как именно система оказалось в данном состоянии
Энтропия
Еще одно понятие, с которым нужно познакомиться – это энтропия. Для понимания второго начала термодинамики энтропия очень важна. А еще это красивое слово, которое многих ставит в ступор и которым можно блеснуть в компании.
В самом общем случае, энтропия – мера хаотичности некоторой системы
В термодинамике, энтропия – это функция состояния термодинамической системы, которая определяет меру необратимого рассеивания энергии. Что это значит? Это значит, что какая-то часть внутренней энергии системы не может перейти в совершаемую системой механическую работу. Например, процесс преобразования теплоты в механическую работу всегда сопровождается потерями, в результате которых теплота трансформируется в другие виды энергии.
Энтропия при необратимых термодинамических процессах увеличивается, а при обратимых – остается постоянной. Математическая запись энтропии (S):
Здесь дельта Q – количество теплоты, подведенное или отведенное от системы, T – температура системы, dS – изменение энтропии.
Существует несколько различных формулировок второго начала термодинамики, и вот одна из них:
Энтропия замкнутой системы возрастает при любых необратимых процессах в этой системе
Так как нас интересует именно понимание сути вещей, приведем еще одно самое простое определение:
Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему
К слову, данная формулировка второго начала термодинамики принадлежит Рудольфу Клаузиусу, который и ввел в обиход понятие энтропии.

И снова вечный двигатель
После разочарования с идеей вечного двигателя первого рода люди и не думали сдаваться. Через какое-то время был придуман вечный двигатель второго рода, работа которого основывалась на передаче тепла и не перечила закону сохранения энергии. Такой двигатель преобразует все тепло, полученное от окружающих тел, в работу. Например, в качестве его реализации предполагалось путем охлаждения океана получить огромное количество теплоты. Но к счастью до охлаждения океана и заморозки рыб дело не дошло, т.к. данная идея противоречит второму началу динамики. КПД любой машины не может быть равен единице, также как тепло не может быть преобразовано в работу полностью. Так что сколько ни старайтесь, а вечный двигатель второго рода создать невозможно, так же как и вечный двигатель первого рода.
После введения Рудольфом Клаузиусом понятия энтропии в 1865 году возникло множество споров, домыслов и теорий, связанных с этим понятием. Одна из них – гипотеза о тепловой смерти Вселенной, сформулированная самим Клаузиусом на основе второго начала термодинамики.

Данная теория, сформулированная Клаузиусом, гласит, что Вселенная, как любая замкнутая система, стремится к состоянию термодинамического равновесия, характеризующемуся максимальной энтропией и полным отсутствием макроскопических процессов, что в свою очередь обессмысливает привычное нам понятие времени. По Клаузиусу: «Энергия мира остается постоянной. Энтропия мира стремиться к максимуму». Это означает, что когда Вселенная придет в состояние термодинамического равновесия, все процессы прекратятся и мир погрузиться в состояние «тепловой смерти». Температура в любой точке Вселенной будет одной и той же, более не будет каких-либо причин, способных вызвать возникновение каких бы то ни было процессов.
Концепция тепловой смерти вселенной еще в недалеком прошлом была довольно широко распространена и являлась предметом активных дискуссий. Так, в книге Джинса «Universe around us» (1932г.) можно найти следующие строки касательно тепловой смерти Вселенной: «Вселенная не может существовать вечно; рано или поздно должно наступить время, когда ее последний эрг энергии достигнет наивысшей степени на лестнице падающей полезности, и в этот момент активная жизнь Вселенной должна будет прекратиться».

При выводе своей теории Клаузиус прибегал в своих рассуждениях к следующим экстраполяциям (приближениям):
Интересный факт : рассуждения о тепловой смерти позволили церкви заявить, что с научной точки зрения (в том числе и благодаря теории Клаузиуса) можно найти предпосылки, указывающие на существование бога. Так, в 1952 году на заседании «папской академии наук» папа Пий 12-й в своей речи сказал: «Закон энтропии, открытый Рудольфом Клаузиусом, дал нам уверенность, что спонтанные природные процессы всегда связаны с некоторой потерей свободной, могущей быть использованной энергии, откуда следует, что в замкнутой материальной системе в конце концов эти процессы в макроскопическом масштабе когда-то прекратятся. Эта печальная необходимость. красноречиво свидетельствует о существовании Необходимого Существа».
Опровержение теории тепловой смерти Вселенной
Как уже отмечалось выше Клаузиусом, при выводе его теории применялись определенные экстраполяции. Сегодня несмотря на некоторые сложности можно с уверенностью сказать, что подобные выводы являются антинаучными. Дело в том, что существуют определенные границы применимости второго начала термодинамики: нижняя и верхняя. Так, второе начало термодинамики не может быть применено для описания микросистем, размеры которых сравнимы с размерами молекул, и для макросистем, состоящих из бесконечного числа частиц, т.е. для Вселенной в целом.

Собственно первым ученым, установившим статистическую природу второго начала термодинамики и противопоставившим теории тепловой смерти Вселенной так называемую флуктуационную гипотезу, был выдающийся физик-материалист Больцман. Имеет место формула Больцмана, позволяющая дать статистическое истолкование второму началу термодинамики
Здесь S – энтропия системы, k – постоянная Больцмана, P – термодинамическая вероятность состояния, определяющая число микросостояний системы, соответствующих данному макросостоянию. Согласно формуле Больцмана,

Современный подход безусловно отвергает теорию тепловой смерти Вселенной. Учитывая огромный возраст Вселенной и тот факт, что она не находится в состояние тепловой смерти, можно сделать вывод о том, что во Вселенной протекают процессы, препятствующие росту энтропии, т.е. процессы с отрицательной энтропией. Однако выводам Больцмана о том, что во Вселенной преобладает состояние термодинамического равновесия, все более противоречит растущий экспериментальный материал астрономии. Материя обладает никогда не утрачиваемой способностью к концентрации энергии и превращения одних форм движения в другие. Так, например, процесс образования из рассеянной материи звезд подчиняется определенным закономерностям и не может быть сведен исключительно к случайным флуктуациям распределения энергии во Вселенной.
Дорогие друзья! Сегодня мы по возможности выяснили, какой смысл имеет понятие энтропии для второго начала термодинамики, узнали, что вечный двигатель второго рода невозможен, а также порадовались, что тепловой смерти Вселенной все-таки не случится. Мы как всегда надеемся на то, что вам понравилась наша статья, в которой мы старались рассказать о термодинамике просто, понятно и интересно. Желаем успехов в учебе и напоминаем – подсказать, помочь, проконсультировать и взять часть нагрузки на себя всегда готовы наши специалисты. Учитесь и живите в свое удовольствие!
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Тепловые двигатели. Второй закон термодинамики
Урок 39. Физика 10 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Тепловые двигатели. Второй закон термодинамики»
Первый закон термодинамики является частным случаем всеобщего закона сохранения энергии, в котором утверждается, что количество энергии при любых её превращениях остаётся неизменным. Между тем многие процессы, вполне допустимые с точки зрения закона сохранения энергии, в действительности же никогда не протекают. Например, первый закон термодинамики допускает самопроизвольный переход энергии как от более нагретого тела к менее нагретому, так и наоборот. Важно только то, чтобы уменьшение внутренней энергии одного тела было равно увеличению внутренней энергии другого тела. Но наш опыт подсказывает, что самопроизвольного перехода энергии от менее нагретого к более нагретому телу в природе не существует. Например, трудно себе представить, чтобы кубик льда, брошенный в сосуд с водой, охлаждался бы ещё больше. Наоборот, всегда некоторое количество теплоты будет самопроизвольно переходит от тёплой воды к холодному кубику льда, пока в системе «лёд—вода» не установится тепловое равновесие.
Таким образом, первый закон термодинамики не позволяет нам установить, в каком направлении может происходить термодинамический процесс. Направленность реальных тепловых процессов определяется вторым законом (или вторым началом) термодинамики. Идея, лежащая в основе этого закона, была заложена ещё Сади Карно в 1824 году. В своей работе он писал, что «при отсутствии разности температур теплота не может быть преобразована в работу».
Однако само название «второе начало термодинамики» и исторически первая её формулировка датируются 1850 годом и принадлежат немецкому учёному Рудольфу Клаузиусу: невозможно перевести тепло от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах.
Этот научный факт и определяет единственно возможное направление самопроизвольного протекания тепловых процессов — они идут в направлении к состоянию теплового равновесия.
Кто-то из вас может возразить, что, например, в холодильниках процесс теплопередачи идёт от более холодного тела к менее холодному. И действительно, у охлаждаемого продукта уменьшается его температура, а убыль внутренней энергии в виде количества теплоты передаётся в окружающую среду. Но ведь этот процесс протекает не сам по себе, а происходит за счёт работы двигателя компрессора холодильника. То есть эта передача энергии связана с другими изменениями в окружающих телах.
Из второго закона термодинамики вытекает невозможность создания вечного двигателя второго рода, то есть двигателя, который совершал бы работу за счёт охлаждения какого-либо одного тела.
Важность второго начала и в том, что из него можно вывести заключение о необратимости не только процесса теплопередачи, но и других процессов в природе.
Давайте проведём виртуальный опыт. Предположим, что у нас есть абсолютно упругий шар, который падает с некоторой высоты в абсолютном вакууме на абсолютно упругую плиту. Не трудно доказать, что после отражения от плиты шар вернётся в исходную точку, пройдя в обратном направлении все те промежуточные состояния, которые он проходил при падении. И в конечном итоге система вернётся в своё исходное состояние. Такой процесс в физике принято называть обратимым.
Но в действительности в природе нет строго консервативных систем. Во всех реальных системах всегда действуют силы трения. То есть реальные процессы, происходящие в природе, являются необратимыми.
Необратимыми называются такие процессы, которые могут самопроизвольно протекать лишь в одном определённом направлении; в обратном направлении они могут протекать только при внешнем воздействии.
Все реальные тепловые процессы являются необратимыми. Например, мы знаем, что при диффузии выравнивание концентрации происходит самопроизвольно. Однако обратный процесс, то есть разделение смеси газов на составляющие её компоненты, никогда не произойдёт.
Второе начало термодинамики определяет направление процессов в изолированной системе, однако этот закон носит статистический (то есть вероятностный) характер. Поясним. Итак, нам уже известно, что любое макросостояние системы, характеризующееся некоторыми макропараметрами, определяется его микросостояниями. Например, давление газа и его температура определяются числом молекул, их скоростью, распределением молекул по объёму и так далее. И если изолированную систему предоставить самой себе, то, как мы знаем, со временем она придёт в равновесное состояние. Процесс перехода системы из неравновесного состояния в равновесное — необратимый процесс.
Но равновесное состояние соответствует хаотичному движению молекул, то есть система, с точки зрения микросостояний, приходит к полному хаосу, который предполагает непрерывное перемещение молекул газа по всему объёму, обмен скоростями и тому подобное. В то же время макропараметры газа не меняются.
Движение молекул — это механическое движение, которое является обратимым. В то же время все необратимые процессы, такие, как теплообмен, происходят вследствие механического движения атомов и молекул, так как столкновения молекул обеспечивают передачу энергии. То есть получается, что необратимые процессы являются следствием обратимого механического движения.
Для соединения этих двух неоспоримых фактов, Людвиг Больцман использовал понятие вероятности. Так, состояние газа, при котором молекулы движутся хаотично, является наиболее вероятным, наиболее вероятным является и равномерное распределение молекул по объёму сосуда, например, вашего класса. Но возможно и такое, что из-за случайных перемещений, все молекулы в какой-то момент времени займут одну часть класса, а мы — другую. Что произойдёт? Правильно, мы задохнёмся.
Но какова вероятность того, что такой процесс произойдёт на самом деле? Наверное, такая же, как и вероятность того, что 30 000 тысяч обезьян стуча по клавиатуре наберут без ошибок текст «Войны и мира» Льва Николаевича Толстого.
Следовательно, мы можем смело сказать, что вероятность обратных процессов перехода от равновесных состояний к неравновесным для макроскопических систем чрезвычайно низкая. Однако для малых объёмов, содержащих небольшое количество молекул, вероятность отклонения от равновесия становится достаточно заметной. Такие случайные отклонения системы от равновесия называются флуктуациями.
Именно флуктуациями плотности газа в земной атмосфере в областях порядка длины волны объясняется голубой цвет нашего неба. Именно флуктуациями давления в малых объёмах можно объяснить броуновское движение.
Таким образом, второй закон термодинамики выполняется только для макросистем.
В начале урока мы с вами отмечали, что идея, лежащая в основе второго начала термодинамики, была заложена ещё Сади Карно в его исследовании «Размышления о движущей силе огня и о машинах, способных развивать эту силу», посвящённом паровым машинам.
С тех пор как человечество познало закономерности тепловых явлений, учёные стремились найти способы использования тепловой энергии, и, в частности, способы преобразования её в механическую.
Устройства, которые совершают механическую работу за счёт внутренней энергии топлива, называются тепловыми двигателями.
Интересно, но первое известное устройство, приводимое в движение паром, было описано ещё в первом столетии Героном Александрийским. Пар, выходящий по касательной из дюз, закреплённых на шаре, заставлял последний вращаться.
Однако долгое время устройства, приводимы в движение паром, не применялись для решения полезных задач. Лишь в конце XVII — начале XVIII веков исследованием паровых машин учёные заинтересовались всерьёз.
Простейший тепловой двигатель представляет собой цилиндрический сосуд, в котором находится газ под поршнем. Поместим на поршень тело некоторой массы и будем нагревать газ в цилиндре. По мере роста давления газа, его объём увеличивается и поршень приходит в движение, поднимая тело на некоторую высоту. Сила давления газа совершает работу.
Но, работа эта одноразовая и такие устройства малопригодны. Поэтому первый принцип действия тепловых двигателей — это цикличность (непрерывность) их работы. Тело, совершающее работу, — рабочее тело, после получения количества теплоты от нагревателя, находящегося при температуре «Тэ один» (Т1), должно в конечном счёте вернуться в исходное состояние, чтобы снова начать такой же процесс.
Для возвращения поршня в исходное положение газ необходимо сжать до первоначального объёма. При этом внешняя сила совершает работу сжатия. Но если сжатие будет происходить при той же температуре, что и расширение газа, то полная работа газа за один цикл (расширение — сжатие) окажется равной нулю. Отсюда вытекает второй принцип действия тепловых двигателей — сжатие газа должно происходить при более низкой температуре, чем его расширение.
Из рисунка видим, что в этом случае полная работа газа за цикл положительная и численно равна площади закрашенной фигуры:
Значит, перед сжатием рабочее тело необходимо охладить. Это осуществляется путём передачи количества теплоты третьему телу — холодильнику. Из сказанного следует, что для работы циклического теплового двигателя кроме нагревателя и рабочего тела необходимо наличие холодильника.
Таким образом, любой тепловой двигатель состоит из трёх основных элементов: нагревателя, рабочего тела (как правило, газ) и холодильника (атмосфера или вода при температуре окружающей среды).
Энергия, выделяемая при сгорании топлива в нагревателе, передаётся рабочему телу (газу) путём теплопередачи. При расширении газа часть его внутренней энергии идёт на совершение работы. Некоторое количество теплоты неизбежно передаётся холодильнику.
Эффективнее всего охладить рабочее тело перед сжатием можно путём адиабатного расширения газа, при котором его температура понизится до температуры холодильника. Далее при изотермическом сжатии рабочее тело передаёт холодильнику некоторое количество теплоты. Завершать цикл теплового двигателя эффективнее всего адиабатным сжатием газа до первоначальной температуры. Впервые этот цикл был предложен французским инженером Сади́ Карно́, поэтому его ещё называют циклом Карно.
При такой цикличности тепловой двигатель обладает максимально возможным коэффициентом полезного действия.