трепанация мозга что это
ТРЕПАНАЦИЯ ЧЕРЕПА
ТРЕПАНАЦИЯ ЧЕРЕПА (франц. trepanation, от греч. trypanon бурав, трепан) — хирургическая операция, заключающаяся во вскрытии полости черепа с целью снижения внутричерепного давления или обеспечения доступа к внутричерепным образованиям.
Имеются археологические данные, свидетельствующие о том, что Т. ч. производили еще во времена неолита и бронзового века. Техникой этой операции владели лекари в Киевской Руси (10—11 вв.). В России Т. ч. была уже достаточно хорошо известна в 17 и 18 вв.
Существует два способа Т. ч.— резекционный и костно-пластический. До конца 19 в. производили только резекционную Т. ч., для выполнения к-рой пользовались различными долотами и специальными инструментами — трепаном и трефином (см. Нейрохирургический инструментарий). В результате резекционной Т. ч. остается дефект костей стенки свода черепа. Костно-пластическая Т. ч. состоит в создании трепанационного окна путем выпиливания костного лоскута, к-рым после выполнения необходимых манипуляций на внутричерепных структурах закрывают операционный дефект черепа.
Резекционная трепанация черепа получила также название декомпрессивной, поскольку она направлена на снижение давления в полости черепа, т. е. на создание наружной декомпрессии (в отличие от внутренней декомпрессии, когда для достижения такой же цели производят резекцию патологически измененных участков головного мозга).
Показанием к декомпрессивной Т. ч. является прогрессирующий отек и набухание головного мозга (см.) после острой черепно-мозговой травмы (см.), подозрение на внутричерепную гематому, нек-рые случаи глубинных неудалимых опухолей полушарий головного мозга с инфильтративным ростом.
Типичную декомпрессивную Т. ч. производят в височной области.
В наст, время ее применяют редко, гл. обр. как неотложную операцию при быстро прогрессирующем ухудшении общего состояния больного с черепно-мозговой травмой и невозможности в связи с этим уточнить локализацию патол. процесса. При подозрении на внутричерепную гематому невыясненной локализации накладывают пробные фрезевые отверстия (трефинация черепа) в височных областях. К трефинации черепа в соответствующих типичных точках прибегают также при необходимости пункции боковых желудочков головного мозга.
Техника декомпрессивной Т. ч., разработанной X. Кушингом, состоит в следующем. В положении больного на боку, противоположном стороне операции, после обработки операционного поля намечают линию разреза, вдоль к-рой производят послойную инфильтрационную анестезию 0,25% р-ром новокаина. Разрез начинают от средины верхнего края скуловой дуги (не ниже, во избежание повреждения ветвей лицевого нерва) и заканчивают в области теменного бугра (рис. 1). Кожу и апоневроз отпрепаровывают в обе стороны. Рассекают фасцию височной мышцы, затем по ходу волокон раздвигают височную мышцу и рассекают надкостницу, к-рую распатором отслаивают в стороны, обнажая чешую височной кости. Края раны разводят крючками пли ранорасширителем. Операция может быть выполнена также с помощью дугообразного разреза мягких тканей. В центре освободившегося участка кости трепаном накладываютфрезевое отверстие (рис. 2, а) и расширяют его путем резекции кости костными щипцами, образуя трепанационное окно диам. 6—7 см (рис. 2, б). Скусывание кости в базальном направлении необходимо производить осторожно во избежание повреждения средней менингеальной артерии, к-рая может находиться в костном канале. В случае повреждения артерии кровотечение останавливают путем диатермокоагуляции или промазывания края кости мед. воском. После визуального и пальпаторного определения степени напряжения твердой оболочки головного мозга ее крестообразно вскрывают. При значительном напряжении оболочки для снижения внутричерепного давления предварительно вводят дегидратационные средства (маннитол, салуретики). Операцию заканчивают послойным наложением шелковых швов на височную мышцу, ее фасцию, апоневроз и кожу.
Резекционную Т. ч. в наст, время также применяют для обеспечения доступов к различныхм отделам задней черепной ямки, причем в зависимости от локализации и объема патол. очага (опухоли, абсцессы и др.) пользуются различными кожными разрезами (рис. 3). Важным элементом Т. ч. при срединных доступах к задней черепной ямке является предложенная X. Кушингом резекция края большого (затылочного) отверстия и задней дуги атланта, к-рая направлена на предотвращение сдавления продолговатого мозга в послеоперационном периоде.
После декомпрессивной Т. ч. в связи с нарушением герметичности полости черепа, суточными колебаниями внутричерепного давления и перепадами атмосферного давления могут отмечаться головные болит церебрастенические явления, признаки раздражения оболочек мозга и прилежащих к зоне трепанации церебральных структур, что обозначают как синдром трепанированных. При незначительной его выраженности применяют симптоматическую терапию. В случае выраженных явлений рекомендуется операция закрытия дефекта черепа (см. Краниопластика).
Костно-пластическая трепанация черепа с выкраиванием единого кожно-надкостнично-костного лоскута была разработана в эксперименте Вулфом (J. R. Wolfe) в 1863 г. и впервые осуществлена в клинике Вагнером (W. Wagner) в 1(889 г. Она получила название метода Вагнера — Вулфа (рис. 4, а). Недостатком этого метода является возможность нарушения кровоснабжения кожно-апоневротического лоскута в области его узкой ножки. В 1930 г. Оливекруна (H. A. Olivecrona) предложил выкраивать вначале кожно-апоневротический лоскут с широким основанием, а затем — мышечно-надкостнично-костный, что позволяет при необходимости произвести более обширную трепанацию и облегчает технику ее выполнения (рис. 4, б).
Костно-пластическую Т. ч. почти всегда Производят под эндотрахеальным наркозом (см. Ингаляционный наркоз). Форма кожного разреза зависит от вида хирургического доступа к различным участкам мозга и другим внутричерепным структурам. Наиболее часто применяют дугообразные (рис. 5) и линейные разрезы (рис. 6), реже — фигурные (S-образные, Т-образные и др.). Дугообразный разрез должен располагаться так, чтобы ножка кожного лоскута была широкой и направленной в сторону главных питающих сосудов данной области. Следует избегать повреждения таких сосудов, т. к. это может привести к некрозу части лоскута.
Для вскрытия передней черепной ямки и для доступа к лобным долям и области турецкого седла производят дугообразный одно- или двусторонний разрез в лобной области (рис. 5, а.). Для доступа к теменной доле разрез начинают кпереди от ушной раковины, ведут до сагиттального (стреловидного) шва, огибая теменной бугор, и заканчивают позади уха (рис. 5, б). Для подхода к височной доле подковообразный разрез проводят от середины верхнего края скуловой дуги, вверх и кзади к теменному бугру и заканчивают у сосцевидного отростка (рис. 5, в). Для подхода к затылочной доле разрез начинают у верхнего края ушной раковины, продолжают кверху и кзади по направлению к средней линии и заканчивают у наружного затылочного выступа (рис. 5, г).
Э. И. Злотник предложил применять линейные разрезы кожи при любой локализации трепанационного окна. При этом кожный разрез по длине должен примерно вдвое превосходить вертикальный размер костного лоскута. Преимущество таких разрезов заключается в меньшей травматичности, кровоточивости, лучшем заживлении раны и уменьшении частоты осложнений (нагноения, гематомы, ликвореи).
Типичную костно-пластическую трепанацию выполняют следующим образом. После подготовки операционного поля и нанесения линии кожного разреза 10% р-ром нитрата серебра или метиленовым синим кожу с апоневрозом рассекают по намеченной линии частями, разрезая каждый последующий участок только после остановки кровотечения на предыдущем. Во избежание излишней кровопотери кожу в момент рассечения сильно прижимают к кости концами пальцев, слегка оттягивая ее в обе стороны от линии разреза. Кожно-апоневротический лоскут с помощью скальпеля или тупым путем отделяют от подлежащих тканей так, чтобы подапоневротическая клетчатка и надкостница оставались на кости. Отделенный лоскут отворачивают и прикрывают салфетками. Затем, отступая от краев кожного разреза на 1 — 2 см, дугообразным разрезом рассекают надкостницу. Нижние концы разреза продолжают на височную мышцу. Отслоив надкостницу распатором в обе стороны от разреза, трепаном просверливают в кости 5— 6 фрезевых отверстий по линии разреза надкостницы. Кость между ними пропиливают проволочной пилой после предварительного проведения под кость между соседними отверстиями проводника Оливекруны (рис. 4, б). Пропиливать кость необходимо наклонно, с тем чтобы костный лоскут в последующем плотно лежал на краю отверстия, не проваливаясь в него. Кость у основания костного лоскута частично резецируют щипцами Дальгрена, после чего лоскут приподнимают элеваторами и надламывают у основания. Твердую мозговую оболочку вскрывают подковообразным или крестообразным разрезом. После завершения внутричерепной части операции твердую мозговую оболочку зашивают шелковыми швами, костный лоскут укладывают на место и фиксируют швами. Затем послойно ушивают узловатыми швами надкостницу, височную мышцу, апоневроз и кожу. В заднем углу раны на 1 — 2 сут. оставляют резиновый дренаж и накладывают провизорный шов, к-рый затягивают а завязывают после удаления дренажа.
Библиогр.: 3лотник Э. И. О применении линейных разрезов кожи при трепанации черепа, Вопр. нейрохир., № 4, с. 34, 1969; Многотомное руководство по хирургии, под ред., Б. В. Петровского, т., 3, кн. 2, с. 528, М., 1968; Угрюмое В. М., Васкин И. С. и Абраков Л. В. Оперативная нейрохирургия, с. 65, Л., 1959; Cushing Н, Subtemporal decompressive operations for the intracranial complications associated with bursting fractures of the skull, Ann.. Surg., v. 47, p. 641, 1908; О 1 i v e с r o-n a H. Die chirurgische Behandlung der Gehirntumoren, B., 1927; Vara Lopez R. La craniectomla a trav£s de los siglos, Valladolid, 1949; Wagner W* Die temporare Resektion der Schadeldaches an Stelle der Trepanation, Zbl. Chir., Bd 16, S. 833, 1889.
Что такое патологоанатомическое вскрытие?
У патологоанатомического вскрытия существуют синонимы – «некропсия», «аутопсия», «секция» и другие. Также вскрытие разделяют на патологоанатомическое исследование, необходимое для подтверждения ранее сделанных врачами выводов относительно причин смерти, и судебно-медицинскую экспертизу. Первую проводят в общем случае и по ряду причин от неё можно отказаться. Например, если скончавшемуся был поставлен диагноз СПИД или одно из онкологических заболеваний. Конфессиональная принадлежность как причина рассматривается при наличии заполненной за последние полгода амбулаторной карты.
Для чего нужно вскрытие?
Некропсию делают для установления точных причин смерти. Во избежание ошибок патологоанатом делает множественный забор проб и детально изучает, в каком состоянии находились органы умершего во время оперативного вмешательства. Спешка в этом деле не приветствуется, ибо только тщательность исследований даёт гарантию верного результата. В среднем на одного умершего сотрудник морга уделяет 1-3 часа. Далее анализы попадают в лабораторию и лишь после получения всех результатов выставляется окончательный диагноз.
Данные о случившихся смертях составляют сухую статистику. Но кроме цифр эксперты смогут изучить и другие побочные факторы. Так, кончина во время экспериментального лечения и дальнейшая секция поможет врачам определиться, что пошло не так во время назначенных медицинских процедур, каков отклик у больных на то или иное лекарство.
Патологоанатомическое исследование и судебно-медицинская экспертиза
Два понятия, обозначающих по сути вскрытие, отличаются своей направленностью и средствами обеспечения.
Важно! Если в ходе стандартной секции у патологоанатома возникнут подозрения на неестественность летального исхода или первичный диагноз не найдёт подтверждения, то тело отправляют на дообследование в Бюро судебно-медицинской экспертизы.
Основные этапы патологоанатомического вскрытия
Точное следование регламенту проведения вскрытия и внимательность – залог установления действительных причин смерти. Перечислим этапы, что составляют основу некропсии:
Осмотр телесных покровов
Вскрытие и исследование брюшной полости
Традиционно аутопсия проводится путём Y-образного разреза брюшной полости. Очень важно не коснуться при секции внутренних органов – ведь это может повлиять на истинность конечных результатов. В первую очередь обращают внимание на внутренние органы находящиеся под подозрением. При летальном исходе во время лечения проверяют, какой была реакция печени на вводимые медикаменты.
Укладывание внутренних органов обратно в брюшину
В российских клиниках принято укладывать на место извлечённые внутренние органы из брюшины. Такая же практика внедрена и в странах Евросоюза. А вот на американском континенте внутренности уничтожаются, а брюшина наполняется вспомогательными материалами. В обоих случаях патологоанатомы стараются аккуратно зашить тело усопшего, дабы во время похорон не были видны следы от разрезов.
Лабораторные анализы биоматериалов
Исследованием биоматериалов занимается группа лабораторных экспертов. Иногда анализы проводятся и самими патологоанатомами. Множественность лабораторных исследований не позволяет проводить их все по отношению к каждому трупу. И хотя требуемый биоматериал собирается в полном объёме, это не означает, что он весь используется. Если очевидность причин смерти доказана, например, от пулевого ранения, то гистологический анализ на наличие опухолей не проводится.
Составление отчёта
В завершении ответственный сотрудник морга составляет отчёт, в котором указываются проведённые при вскрытии действия, взятые пробы, результаты анализов и экспертное заключение. Своей подписью исполнитель удостоверяет достоверность изложенных в документе данных.
Реконструкция тела и бальзамирование
Как уже было упомянуто ранее, при зашивании разрезов после аутопсии сотрудники стремятся максимально воссоздать прежний облик почившего. Аккуратные швы, сокрытие их с помощью похоронного грима и прочих манипуляций позволяют провести прощание с усопшим, подвергшимся вскрытию, при открытом гробе. При необходимости используют инъекции и примочки с бальзамирующим раствором для приостанавливания патогенных процессов, что проходят в мёртвом теле.
Хирургическое лечение церебральных аневризм в остром периоде кровоизлияния

Фото справа налево: В. Доленс, А. Королев (зав. нхо КОКБ), Ю. Хернисниеми, А. Воробьев
Нетравматические внутричерепные кровоизлияния при разрывах аневризм относятся к одним из наиболее тяжелых форм нарушений мозгового кровообращения.
В России ежегодно регистрируется около 18000 субарахноидальных кровоизлияний (САК), т.е. 13 на 100000 населения в год.
Что такое аневризма и у кого она чаще встречается.
Наиболее часто САК развивается у лиц среднего и пожилого возраста. У больных в возрасте от 40 до 59 лет его частота достигает 50%.
Аневризма представляет собой выпячивание стенки артерии, обычно в области бифуркации сосуда или в месте отхождения от нее крупных ветвей. Характерным для аневризмы является отсутствие трехслойной сосудистой стенки — отсутствие мышечного слоя и эластической мембраны. Стенка аневризмы состоит из соединительной ткани, прорастающей наружную и внутреннюю оболочки. Купол представлен одним тонким внутренним слоем, поэтому кровотечение возникает именно отсюда.
По конфигурации они бывают мешотчатыми, вёретенообразными и фузиформными а также однокамерными и многокамерными. По величине аневризмы делят на милираные (до 3 мм), обычные (от 4 до 15 мм), большие (от 15 до 25 мм), гигантские (более 25 мм). Аневризмы обычно бывают одиночными, но могут быть и множественными (в 15% случаев), располагаясь на различных артериях. В подавляющем числе наблюдений (90-91%) аневризмы располагаются в переднем отделе
артериального круга большого мозга (виллизиева круга) и толь¬ко 9-10% аневризм локализуются в ВББ.
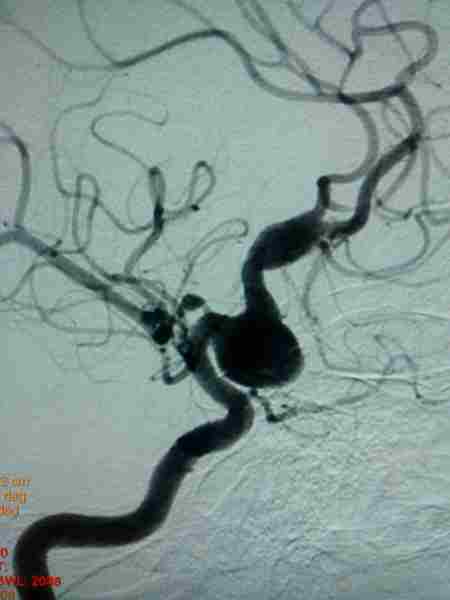
Пример множественных аневризм. Мешотчатая и фузиформная (веретенообразная) аневризмы правой передней мозговой артерии (ПМА).
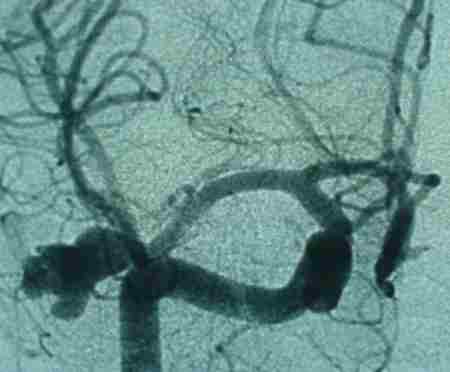
Пример многокамерной аневризмы развилки правой СМА.
При САК кровь поступает под паутинную оболочку и распространяется по базальным цистернам большого мозга. Кровь попадает также в цистерны задней черепной ямки (препонтинную, большую затылочную, мостомозжечкового угла) и далее поступает в позвоночный канал. Источник и интенсивность кровоизлияния определяют характер распространения крови по субарахноидальным пространствам — оно может быть локальным, а может заполнять все субарахноидальные пространства головного мозга с образованием сгустков крови в цистернах. При разрушении мозговой ткани в области кровоизлияния появляются участки паренхиматозного кровоизлияния в виде пропитывания мозгового вещества кровью или формирования гематомы в веществе мозга (субарахноидально-паренхиматозное кровоизлияние).

Разрыв аневризмы ПСА с массивным базальным и паренхиматозным (и немного вентрикулярным) кровоизлиянием.
При значительном поступлении крови в субарахноидальное пространство может возникнуть рефлюкс крови в желудоч¬ковую систему через вывороты IV желудочка (отверстия Мажанди и Люшка) и далее — через водопровод мозга в III и бо¬ковые желудочки. Возможно и прямое проникновение крови в желудочки мозга через поврежденную конечную пластину, что чаще бывает при разрывах аневризмы передней соединительной артерии (субарахноидально-вентрикулярное кровоизлияние). При значительном паренхиматозном кровоизлиянии на фоне САК возможен прорыв гематомы в желудочки мозга (субарахно- идально-паренхиматозно-вентрикулярное кровоизлияние).
Клиника разрыва аневризм мозга.
Клиническая картина САК при разрыве аневризмы развивается остро, иногда на фоне или после физического и эмоционального напряжения. Возникает сильная головная боль. Чаще пациенты описывают ее как головную боль «жгучего», «распирающего» характера, «как будто в голове разлился кипяток». На фоне головной боли развивается кратковременное или длительное угнетение сознания от умеренного оглушения до комы. В остром периоде кровоизлияния нередко возникают психомоторное возбуждение, гипертермия, тахикардия, повышение артериального давления. Неврологическая картина характеризуется развитием менингеального синдрома (ригидность мышц затылка, положительный симптом Кернига, светобоязнь, повышенная чувствительность к шуму и др.). Подобная типичная клиническая картина САК отмечается у 72% пациентов. Однако почти у каждого третьего больного с САК наблюдается иная клиника. Выделяют следующие атипичные варианты САК, для которых характерным является один из ведущих синдромов:
— мигренеподобный;
— ложновоспалительный;
— ложногипертонический;
— ложнорадикулярный;
— ложнопсихотический;
— ложнотоксический.
Неврологическая симптоматика которая развивается при разрывах аневризм той или иной локализации, бывает обусловлена не только эффектом самого САК или паренхиматозного кровоизлияния, но и ишемическими изменениями в мозговой ткани вследствие сосудистого спазма, и тогда клиническая картина заболевания определяется бассейном спазмированных артерий, степенью сужения артерий и особенностями коллатерального кровообращения. Кроме того, при оценке клинических проявлений необходимо учитывать и сроки заболевания, каждый этап которого характеризуется определенной частотой возникновения и формой течения осложнений (повторные кровотечения из аневризмы, внутримозговая гематома, кровоизлияние в желудочки, гидроцефалия, спазм артерий и ишемия мозга, электролитные и эндокринные нарушения, кардиоваскулярные и легочные осложнения и др.).
При всем многробразии клинической картины в практической неврологии и нейрохирургии используют классификации тяжести состояния. К настоящему времени известно более 50 классификаций, которые применяют для оценки тяжести состояния при САК. Наиболее распространенной из них является классификация, предложенная
W. Hunt и R. Hess
I. Бессимптомное течение или слабая головная боль и легкая ригидность мышц затылка.
II. Умеренная или сильная головная боль, ригидность мышц затылка, парез черепно-мозговых нервов.
III. Оглушение, сонливость, спутанность. Умеренный неврологический дефицит.
IV. Сопор, умеренный или выраженный гемипарез, ранняя децеребрационная ригидность.
V. Глубокая кома, децеребрационная ригидность, внешний вид умирающего.
Диагностика субарахноидальных кровоизлияний.
Верификацию кровоизлияния традиционно выполняют путем поясничной пункции.
Компьютерная томография (КТ) головного мозга.
Является ведущим методом в диагностике САК, особенно в первые часы и сутки кровоизлияния. С помощью КТ определяют не только интенсивность базального кровоизлияния и его распространенность по цистернам, но и наличие и объем паренхиматозного и вентрикулярного кровоизлияний, выраженность гидроцефалии, наличие и распространенность очагов ишемии мозга, выраженность и характер дислокационного синдрома.
Кроме того, с помощью КТ иногда удается диагностировать и истинную причину кровоизлияния. Выявляемость САК в первые 12 часов после кровоизлияния достигает 95,2%, в течение 48 часов 80-87%; на 3-и-5-е сутки — 75% и на 6-21-е сутки — всего 29%. Степень выявляемости сгустков крови при САК зависит не только от интенсивности самого кровоизлияния, но и от соотношения сгустков крови и плоскости срезов на КТ. Оптимальным для диагностики САК считается условие, когда плоскость сгустков перпендикулярна плоскости срезов на КТ и толщина сгустков превышает ширину среза КТ. Поэтому САК чаще обнаруживают при сгустках крови толщиной более 1,5 мм.
Наиболее распространенной КТ-классификацией кровоизлияния является классификация, предложенная С.М Fisher et al. в 1980 г.
Данные КТ четко — коррелируют с тяжестью состояния и прогнозом заболевания.
Чем выраженнее кровоизлияние по КТ, тем более вероятно развитие церебрального ангиоспазма и соответственно фатальных ишемических осложнений.
Диагностика источника кровотечения.
Непосредственная визуализация аневризмы возможна тремя методами диагностики: дигитальной субтракционной ангиографией (ДСА), магнитно-резонансной ангиографией (МРА), компьютернотомографической ангиографией (КТА).
Диагностику церебральных аневризм (ЦА) следует начинать с неинвазивных методов.
Компьютерно-томографическая ангиография.
Современная трехмерная КТА с ЗD-реконструкцией (KT-3D-A) обладает чувствительностью в пределах от 87,9 до 97% и специфичностью от 95 до 100%.
При КТА можно получать трехмерное изображение и определять пространственную конфигурацию аневризмы, взаиморасположение с близлежащими структурами.
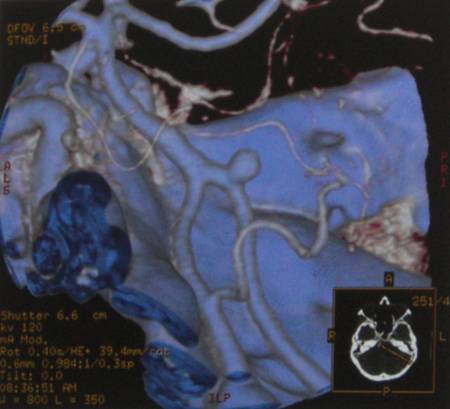
КТА. Аневризма правой позвоночной артерии.
Магнитно-резонансная ангиография.
МРА обеспечивает верификацию внутричерепных аневризм с чувствительностью в пределах от 74 до 100% и специфичностью от 74 до 100%. Чувствительность МРА в обнаружении аневризм диаметром более 3 мм составляет 86%, что сравнимо с результатами ДСА. Отмечено снижение чувствительности МРА при диаметре аневризмы менее 3-5 мм.
Имеется ряд параметров, которые влияют на способность МРА обнаруживать аневризмы: размер ЦА, скорость и направление кровотока в аневризме относительно магнитного поля, тромбоз и кальциноз, — поэтому МРА предпочтительно выполнять в первые 3 суток после кровоизлияния. В сроки от 3 суток до 3 недель после кровоизлияния ее точность снижается из-за биотрансформации молекулы гемоглобина.
Как неинвазивный метод МРА широко применяют в качестве скринингового исследования у пациентов с высоким риском наличия ЦА.
Дигитальпая субтракционная ангиография.
Селективную ДСА необходимо выполнять в следующих случаях: нет возможности проведения КТА или МРА; если эти исследования не выявили источник кровоизлияния или полученные данные недостаточны для проведения хирургического вмешательства. Исследование должно быть выполнено в следующем объеме: оба каротидных бассейна и обе позвоночные артерии. ДСА осуществляют в прямой, боковой, косой, а при необходимости в других атипичных проекциях.
Помимо выявления источника кровоизлияния, необходимо оценить степень выраженности и распространенность сосудистого спазма, особенности кровообращения.
При отсутствии визуализации аневризмы при ДСА у пациентов с типичной клиникой аневризматического САК, при ангиографических признаках сосудистого спазма целесообразно через 3-4 недели после кровоизлияния выполнить повторное ангиографическое исследование, которое позволяет выявить ранее не контрастированные аневризмы приблизительно еще у 3% больных.
Диагностика ангиоспазма.
Сосудистый спазм развивается исключительно при разрывах аневризм и практически не наблюдается при разрывах артериовенозных мальформаций и САК иной этиологии.
Под сосудистым спазмом следует понимать изменения всех слоев артериальной стенки, приводящие к сужению просвета артерии. Они возникают в ответ на кровоизлияние в церебральные цистерны.
Морфологические, изменения в сосудистой стенке следующие: отек и десквамация эндотелия, сокращение гладкомышечных клеток с их последующим некрозом и заместительным склерозом, разрушение эластических волокон наружной и внутренней эластических мембран, коллагеновых волокон адвентиции. Подобные морфологические изменения приводят к сужению просвета артерий, изменению упругоэластических свойств артерии, пристеночному тромбообразованию и иногда полному тромбозу артерий мозга (в 20% случаев). Из вышеописанных морфологических изменений следует, что, во-первых, термин «сосудистый спазм» весьма условен, более уместен термин «констриктивная ангиопатия», во-вторых, более понятным становится, почему терапия артериального спазма спазмолитическими препаратами является неэффективной.
Обычно ангиоспазм при САК развивается с 3-4-х суток от начала заболевания, его пик отмечается на 7-14-е сутки и в последующие дни наблюдается регресс.
Важную роль в оценке выраженности ангиоспазма и характера развивающейся у пациента ишемии мозга играют траскраниальная допплерография — ТКДГ, ЭЭГ и регистрация акустических стволовых вызванных потенциалов. ТКДГ является наиболее чувствительным методом диагностики спазма. При увеличении линейной скорости кровотока до 120 см/с сужение просвета определяется на ангиограммах, а при повышении линейной скорости кровотока более 200 см/с у больных обнаруживаются неврологические расстройства, обусловленные ишемией мозга.
Хирургическое лечение больных с разрывом аневризмы.
Основной целью операции у больных с аневризмами являются выключение аневризмы из кровотока для предотвращения повторных кровотечений и устранение сгустков крови из базальных цистерн для предотвращения сосудистого спазма и ишемии мозга. Учитывая, что и ишемические осложнения, и повторное кровоизлияние возникают через несколько дней после разрыва аневризмы, необходимо стремиться произвести операцию в течение первых 3 суток заболевания. В случаях поздней госпитализации больных с САК и запоздалой диагностики аневризмы, когда развиваются сосудистый спазм и ишемия мозга, операцию приходится откладывать на несколько недель до регресса ишемических осложнений.
В первые 2 недели после разрыва аневризмы повторные кровотечения происходят у 15-20% больных. В первые 6 месяцев после разрыва аневризмы они развиваются у 50% пациентов с летальностью до 60%. В последующем риск повторного кровотечения составляет 3% в год со смертностью 2% в год, что склоняет многих нейрохирургов к тактике ранних оперативных вмешательств.
Показания к проведению открытых хирургических вмешательств.
1) больные с I-II степенью тяжести САК по Hunt-Hess;
2) больные с III степенью тяжести САК по Hunt-Hess при легком или умеренном ангиоспазме (скорость кровотока в сегменте M1 менее 200 см/с);
3) больные с III-IV степенью тяжести САК по Hunt-Hess, ес¬ли тяжесть состояния обусловлена внутримозговой гематомой с развитием дислокационного синдрома.
Показаниями к отсроченному хирургическому лечению являются:
1) III-IV степень тяжести САК по Hunt-Hess при наличии умеренного или выраженного ангиоспазма (скорость кровотока в сегменте M1 менее 200 см/с), III-IV тип изменений ЭЭГ;
2) анатомически сложные аневризмы (гигантские аневриз¬мы, аневризмы базилярной артерии);
3) V степень тяжести САК по Hunt-Hess без внутримозговой гематомы.
Эндоваскулярные методы лечения аневризм.
Абсолютные показания:
1) невозможность клипирования аневризмы в ходе открытой операции.
Приоритетные показания:
1) труднодоступность аневризмы для прямого хирургического вмешательства (аневризмы кавернозного и параклиноидного отделов ВСА, вертебрально-базилярного бассейна);
2) больные старшей возрастной группы (старше 75 лет);
3) тяжелое состояние больных (III-IV степень по Hunt-Hess);
4) фузиформные и расслаивающие аневризмы.
Операции по поводу разрыва аневризм производят под общим обезболиванием, обязательно с использованием операционного микроскопа и микрохирургической техники.
Хирург работает с микроскопом (Хельсинки, Финляндия, проф. Ниемели М.).
Общий вид нейрохирургической операционной (Хельсинки, Финляндия).
Операция складывается из нескольких этапов: трепанации черепа в лобно- височной области, вскрытия твердой мозговой оболочки, paссeчения арахноидальной оболочки на основании мозга и аспирации СМЖ, выделения магистральных сосудов головного мозга, выделения несущей аневризму артерии, самой аневризмы и выключения ее из кровотока путем клипирования.
Факторами риска в хирургии аневризм в остром периоде кровоизлияния являются:
— тяжелое состояние больного (IV-V степень по Hunt-Hess);
— наличие распространенного спазма и ишемии мозга;
— внутримозговая гематома объемом более 30 мл;
— прорыв крови в желудочки мозга и окклюзионная гидроцефалия;
— смещение срединных структур мозга более 5 мм.
Лечение в послеоперационном периоде.
До настоящего времени каких-либо эффективных методов медикаментозной терапии сосудистого спазма не существует. Поэтому при разрыве аневризмы для профилактики ишемии мозга или ее лечения проводят терапию, направленную на нормализацию перфузии мозга. С этой целью широко используют так называемую ЗН-терапию (hypertensia, hypervolemia, hemodilucia). До настоящего времени не установлено, какой из этих компонентов наиболее важен. Артериальное давление удерживают на уровне 15-20% выше обычного для данного больного давления, используя симпатомиметики. Гиперволемия достигается внутривенным введением альбумина и плазмы, гемодилюция — физиологического раствора. Гематокритное число не должно превышать 38-40. Подобная терапия позволяет значительно снизить риск развития ишемии мозга (до 15%) или уменьшить ее выраженность. Однако подобная терапия не позволяет предотвратить развития повторных кровотечений из аневризмы. Кроме того, при ЗН-терапии увеличивается риск развития сердечно-легочной недостаточности, почечной недостаточности, нарушений водно-электролитного баланса, коагулопатий.
Для профилактики ишемии и в ее лечении необходимо использовать антагонист кальция — нимодипин. Являясь блокатором кальциевых каналов, нимодипин препятствует поступлению ионов кальция через поврежденную мембрану в клетку и предотвращает ее повреждение. Первоначально препарат вводят внутривенно, через инфузомат, доводя скорость инфузии до 5 мл/час, под контролем артериального давления, затем назначают перорально. Иcпoльзовaниe препарата позволяет уменьшить число неврологических расстройств, обусловленных спазмом, на 12%. Необходимо помнить, что при внутривенном введении нимодипина может развиться артериальная гипотония, поэтому параллельно необходимо вводить и симпатомиметики. поддерживая нормальную перфузию мозга.
При написании статьи использованы материалы методических рекомендаций (№ 37) ДЗ Москва 2008.
Учреждение-разработчик: Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского.
Составители: Академик РАМН проф. В.В. Крылов, канд. мед. наук А.Э. Талыпов.
Автор статьи: врач-нейрохирург Воробьев Антон Викторович Рамка вокруг текста






