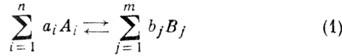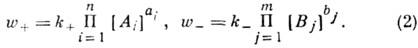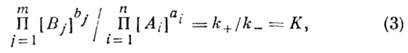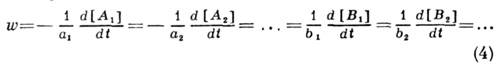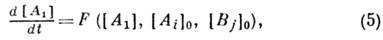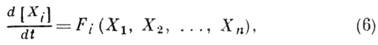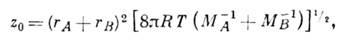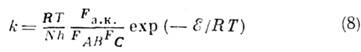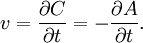учение о скоростях и механизмах химических реакций называется химической
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Механизм химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакций. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Реакции могут быть гомогенными и гетерогенными.Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе).Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (например, в твердой и жидкой или газовой и жидкой и т.д.).Гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами. Гетерогенные – происходят на границе раздела фаз. Примером гетерогенной реакции может служить реакции между веществом в газовой фазе и поверхностью жидкого или твердого тела.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций)
Скорость химической реакции обычно характеризует изменение концентрации одного из реагирующих веществ в единицу времени.
При этом безразлично, о каком из участвующих в реакциивеществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время — в секундах (с), поэтому размерность скорости реакции равна [моль/л • с].
Рассмотрим реакцию взаимодействия водорода с парами хлора:
Обозначим концентрацию паров хлора в начале некоторого отрезка времени t1черезС1, а при t2 –С2. Так, хлор в процессе реакции расходуется, следовательно, С1>С2. Скорость реакции Vможет быть найдена из равенства
По мере расходования исходных веществ,скорость реакции уменьшается (рис. 1).
Рисунок 1- Изменение концентрации реагирующего вещества во времени
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т.е. мгновенную скорость, которая выражается производной от концентрации во времени:
Мгновенная (истинная) скорость– это скорость реакции в конкретный момент времени.
где: t – это время от начала химической реакции до момента появления видимых изменений (изменение окраски раствора, появление газа, осадка).
Основным законом химической кинетики является закон действующих масс, который гласит, что скорость реакции прямо пропорциональна произведению концентраций реагентов в степени, являющейся порядком реакции по данному реагенту, т. е.
где k – константа скорости реакции, зависящая только от температуры; m –число реагентов; ni – порядок реакции по i-тому реагенту.
Константа скорости реакции и ее порядок являются эмпирическими величинами и расчету практически не поддаются.
Скорость реакции зависит от природы реагирующих веществ, их концентрации и внешних условий (например, температуры, давления, катализаторов).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Кинетика химическая
Полезное
Смотреть что такое «Кинетика химическая» в других словарях:
КИНЕТИКА ХИМИЧЕСКАЯ — раздел физической химии, учение о скоростях и механизмах химических реакций. Кинетика химическая научная основа создания новых и совершенствования существующих процессов химической технологии. Методы кинетики химической используются в биологии и… … Большой Энциклопедический словарь
КИНЕТИКА ХИМИЧЕСКАЯ — область физ. химии, в к рой изучают механизмы и скорости хим. реакций. К. х. включает три осн. задачи: изучение закономерностей протекания хим. реакций во времени и зависимость их скоростей от концентраций реагентов, темп ры и др. факторов;… … Физическая энциклопедия
КИНЕТИКА ХИМИЧЕСКАЯ — (от греч. kinesis движение), отдел теоретической химии, посвященный изучению законов хим. реакций. Можно наметить несколько типов хим. взаимодействий и прежде всего отличать реакции, протекающие в гомогенной (однородной) среде, от реакций,… … Большая медицинская энциклопедия
Кинетика химическая — – раздел физической химии, изучающей скорость и механизмы химических реакций, закономерности изменения во времени концентраций исходных, промежуточных компонентов и конечных продуктов реакций, описываемых кинетическими кривыми. [Ушеров… … Энциклопедия терминов, определений и пояснений строительных материалов
кинетика химическая — раздел физической химии; учение о скоростях и механизмах химических реакций. Химическая кинетика научная основа создания новых и совершенствования существующих процессов химической технологии. Методы химической кинетики используются в биологии и … Энциклопедический словарь
Кинетика химическая — Химическая кинетика или кинетика химических реакций раздел химии, изучающий механизмы протекания химических реакций, порядок химической реакции, а также закономерности протекания химических реакций во времени. Содержание 1 Скорость химической… … Википедия
КИНЕТИКА ХИМИЧЕСКАЯ — (от греч. kinetikos движущий), раздел физ. химии, изучающий хим. р цию как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления. К. х. устанавливает временные закономерности протекания хим. р ций,… … Химическая энциклопедия
КИНЕТИКА ХИМИЧЕСКАЯ — учение о скоростях и механизмах (совокупности и последовательности стадий) хим. реакции; раздел физической химии. Скорость хим. реакций в замкнутых системах определяется по изменению концентрации исходных, промежуточных или конечных в в (молекул … Большой энциклопедический политехнический словарь
КИНЕТИКА ХИМИЧЕСКАЯ — раздел физ. химии; учение о скоростях и механизмах хим. реакций. К. х. науч. основа создания новых и совершенствования существующих процессов хим. технологии. Методы К. х. используются в биологии и др. областях естествознания. См. также… … Естествознание. Энциклопедический словарь
Химическая кинетика — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
КИНЕТИКА ХИМИЧЕСКАЯ
Полезное
Смотреть что такое «КИНЕТИКА ХИМИЧЕСКАЯ» в других словарях:
КИНЕТИКА ХИМИЧЕСКАЯ — раздел физической химии, учение о скоростях и механизмах химических реакций. Кинетика химическая научная основа создания новых и совершенствования существующих процессов химической технологии. Методы кинетики химической используются в биологии и… … Большой Энциклопедический словарь
КИНЕТИКА ХИМИЧЕСКАЯ — область физ. химии, в к рой изучают механизмы и скорости хим. реакций. К. х. включает три осн. задачи: изучение закономерностей протекания хим. реакций во времени и зависимость их скоростей от концентраций реагентов, темп ры и др. факторов;… … Физическая энциклопедия
КИНЕТИКА ХИМИЧЕСКАЯ — (от греч. kinesis движение), отдел теоретической химии, посвященный изучению законов хим. реакций. Можно наметить несколько типов хим. взаимодействий и прежде всего отличать реакции, протекающие в гомогенной (однородной) среде, от реакций,… … Большая медицинская энциклопедия
Кинетика химическая — – раздел физической химии, изучающей скорость и механизмы химических реакций, закономерности изменения во времени концентраций исходных, промежуточных компонентов и конечных продуктов реакций, описываемых кинетическими кривыми. [Ушеров… … Энциклопедия терминов, определений и пояснений строительных материалов
кинетика химическая — раздел физической химии; учение о скоростях и механизмах химических реакций. Химическая кинетика научная основа создания новых и совершенствования существующих процессов химической технологии. Методы химической кинетики используются в биологии и … Энциклопедический словарь
Кинетика химическая — кинетика химических реакций, учение о химических процессах о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической… … Большая советская энциклопедия
Кинетика химическая — Химическая кинетика или кинетика химических реакций раздел химии, изучающий механизмы протекания химических реакций, порядок химической реакции, а также закономерности протекания химических реакций во времени. Содержание 1 Скорость химической… … Википедия
КИНЕТИКА ХИМИЧЕСКАЯ — учение о скоростях и механизмах (совокупности и последовательности стадий) хим. реакции; раздел физической химии. Скорость хим. реакций в замкнутых системах определяется по изменению концентрации исходных, промежуточных или конечных в в (молекул … Большой энциклопедический политехнический словарь
КИНЕТИКА ХИМИЧЕСКАЯ — раздел физ. химии; учение о скоростях и механизмах хим. реакций. К. х. науч. основа создания новых и совершенствования существующих процессов хим. технологии. Методы К. х. используются в биологии и др. областях естествознания. См. также… … Естествознание. Энциклопедический словарь
Химическая кинетика — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
КИНЕТИКА ХИМИЧЕСКАЯ
— область физ. химии, в к-рой изучают механизмы и скорости хим. реакций. К. х. включает три осн. задачи: изучение закономерностей протекания хим. реакций во времени и зависимость их скоростей от концентраций реагентов, темп-ры и др. факторов; теоретич. определение констант скоростей хим. реакций на основе молекулярного строения реагентов; исследование хим. реакций в условиях движения вещества, диффузии реагентов, наличия теплопередачи и т. д. (хим. макрокинетика).
Скорость хим. реакции зависит от темп-ры и давления, а при заданных внеш. условиях является ф-цией концентраций реагирующих веществ. В идеальных газовых смесях и идеальных (разбавленных) растворах скорость 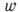
Коэф. k + и k_ наз. константами скоростей хим. реакций.
При равенстве скоростей прямой и обратной реакций наступает хим. равновесие, при к-ром
При обычных условиях вероятность одноврем. встре-чи более чем трёх частиц крайне мала, поэтому наблюдаются лишь элементарные акты, включающие в себя распад отд. молекулы или реакции между двумя или тремя частицами. Они наз. соответственно мономолекулярными, бимолекулярными и тримолекулярными реакциями. Сумма стехиометрич. коэффициентов исходных веществ или число молекул, участвующих в элементарном акте, наз. порядком реакции, к-рый для простых реакций не превышает трёх. Порядок реакции по данному веществу равен его стехиометрич. коэффициенту.
Зависимость концентраций реагентов и продуктов простой реакции от времени получается интегрированием кинетич. ур-ния. Скорость реакции по определению равна
Для сложных, многостадийных реакций закон действующих масс выполняется лишь для отд. стадий, но не для стехиометрич. ур-ния реакции. Исследование кинетики таких реакций проводится на основе системы кинетич. ур-ний:
В связи с огромным многообразием сложных хим. реакций полная их классификация вряд ли возможна. Реакции типа 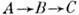
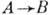
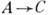
В процессе развития цепной реакции может происходить гибель атомов и радикалов на стенках реакционного сосуда или в объёме реагирующей среды. Конкуренция гибели и размножения их в разветвлённых цепных реакциях приводит к своеобразным предельным явлениям (см. Взрыв).
Константы скоростей химической реакции. В задачу К. х. входит теоретич. определенно констант скоростей элементарных стадий. Они зависят от темп-ры Т и типа реагирующих молекул. Температурная зависимость скорости реакции определяется законом Арре-ниуса:
Кинетич. теория газов позволяет дать оценку пред-экспонентального множителя z для би- и тримолеку-лярных реакций в газовой фазе. Скорость бимолекулярной реакции А+В пропорц. кол-ву двойных соударений z 0 [A][B], причём фактор двойных столкновений
Лит.: Франк-Каменецкий Д.
Кинетика химическая
Содержание
Скорость химической реакции
Порядок химической реакции
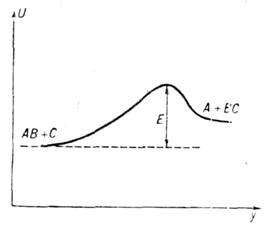
Переходное состояние
Катализ
Видные деятели химии о катализе
И. Берцелиус (1837): «Известные вещества оказывают при соприкосновении с другими веществами такое влияние на последние, что возникает химическое действие,- одни вещества разрушаются, другие образуются вновь без того, чтобы тело, присутствие которого вызывает эти превращения, принимало в них какое-либо участие. Мы называем причину, вызывающую эти явления, каталитической силой».
М. Фарадей (1840). «Каталитические явления можно объяснить известными свойствами материи, не снабжая ее при этом никакой новой силой».
П. Рашиг (1906): «Катализ представляет вызываемое внешними причинами изменение строения молекулы, имеющее следствием изменение химических свойств».
Э. Абель (1913): «Я пришел к выводу, что катализ осуществляется в результате реакции, а не простого присутствия вещества».
Л. Гурвич (1916): «Каталитически действующие тела, притягивая к себе движущиеся молекулы гораздо сильнее, чем тела, лишенные каталитического действия, тем самым увеличивают силу удара, попадающих на их поверхность молекул».
Если не принимать во внимание неудачную попытку Берцелиуса связать наблюдаемые явления с действием скрытой «каталитической силы», то, как можно заметить из приведенных выступлений, дискуссия шла в основном вокруг физических и химических аспектов катализа. Длительное время особенно популярной была энергетическая теория катализа, связывающая процесс возбуждения молекул с резонансной миграцией энергии. Катализатор вступает во взаимодействие с реагирующими молекулами, образуя неустойчивые промежуточные соединения, которые распадаются с выделением продукта реакции и химически неизменного катализатора. Современные наши знания лучше всего отражены в высказывании Борескова. Здесь, однако, возникает вопрос, а не может ли катализатор, поскольку он сам химически участвует в реакции, создать новое равновесное состояние? Если бы это было так, то идея о химическом участии катализатора немедленно вступала бы в противоречие с законом сохранения энергии. Чтобы избежать этого, ученые были вынуждены принять, а затем и экспериментально доказать, что катализатор ускоряет реакцию не только в прямом, но и в обратном направлениях. Те же соединения, которые изменяют и скорость и равновесие реакции, в строгом смысле этого слова не являются катализаторами. Нам остается добавить, что обычно в присутствии катализатора имеет место ускорение химических реакций, и это явление называют «положительным» катализом в отличие от «отрицательного», при котором введение катализатора в реакционную систему вызывает снижение скорости. Строго говоря, катализ всегда повышает скорость реакции, но иногда ускорение одной из стадий (например, появление нового пути обрыва цепей) приводит к наблюдаемому торможению химической реакции.
Мы будем рассматривать только положительный катализ, который принято подразделять на следующие типы:
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. «Цепными реакциями, как известно, называются такие химические и физические процессы, в которых образование в веществе или в смеси веществ некоторых активных частиц (активных центров) приводит к тому, что каждая из активных частиц вызывает целый ряд (цепь) последовательных превращений вещества» (Эмануэль, 1957).
До сих пор мы рассматривали лишь неглубокие стадии процессов окисления; на более глубоких стадиях например в случае окисления углеводородов, образуются кислоты, спирты, кетоны, альдегиды, которые также могут реагировать с катализатором и служить дополнительным источником свободных радикалов в реакции, т. е. в этом случае будет налицо дополнительное вырожденное разветвление цепей.
Гетерогенный катализ
По каталитической активности в реакции разложения многих гидроперекисей соединения металлов располагаются следующим ря-
Катализ в биохимии
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это все же очень часто не может помочь нам ответить на два главных вопроса: 1) почему ферменты так избирательны и ускоряют химические превращения молекул только вполне определеyyой структуры (которая нам тоже известна); 2) каким образом фермент снижает энергетический барьер, т. е. выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре.