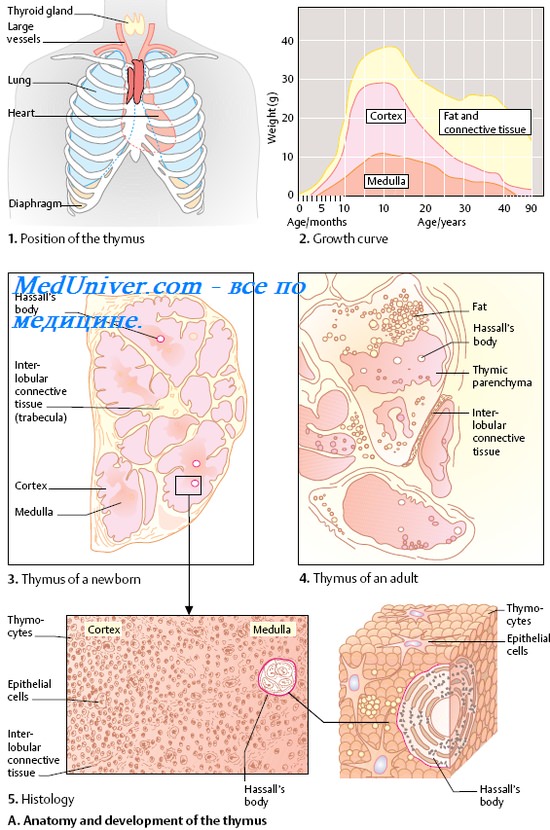
учение об иммунологической толерантности сформулировали
Современные представления о механизмах центральной и периферической толерантности
В обзоре представлены механизмы центральной и периферической толерантности. Описаны механизмы негативной селекции, клональной делеции аутореактивных Т-лимфоцитов с помощью рецепторного редактирования; рассмотрена роль ингибиторных рецепторов и Fas-киллинга в механизмах периферической толерантности, а также описаны дефекты белка FoxP3, контролирующего программирование функциональных свойств Трег. лимфоцитов.
Д ля индукции адаптивного иммунного ответа против антигена его молекула должна быть распознана лимфоцитами как чужеродная. Противоположностью этой способности распознавать и элиминировать «чужое» является специфическая неотвечаемость к «своим» антигенам, называемая иммунологической толерантностью. В последнее десятилетие исследователями достигнут существенный прогресс в изучении механизмов толерантности, а также в установлении причин, приводящих к ее срыву и возникновению аутоиммунных заболеваний, от которых страдает около 3% населения развитых стран [12].
Существует два основных пути формирования естественной толерантности. Первый обеспечивается программой развития лимфоцитов, в ходе реализации которой аутореактивные клоны лимфоцитов элиминируются. Механизмы, обеспечивающие реализацию этой программы, ответственны за формирование центральной толерантности, которая называется так потому, что она формируется в центральных органах адаптивной иммунной системы – тимусе и костном мозге, где происходит развитие Т- и В-лимфоцитов.
Второй путь осуществляется с помощью механизмов, которые работают в периферических лимфоидных органах и предотвращают или ограничивают активацию аутореактивных лимфоцитов, которые не были элиминированы механизмами центральной толерантности. Эти механизмы обеспечивают формирование периферической толерантности.
Механизмы центральной иммунологической толерантности
Центральная иммунологическая толерантность является ведущим механизмом естественной толерантности. Принято разделять центральную Т-клеточную толерантность и центральную В-клеточную толерантность.
Ведущим механизмом центральной Т-клеточной толерантности является процесс негативной селекции. Развитие тимоцитов проходит через ряд стадий, в процессе которых незрелые клетки сначала подвергаются положительной селекции в коре тимуса, в результате которой выживают лишь те тимоциты, антигенраспознающие Т-клеточные рецепторы которых (ТКР) комплементарны белкам МНС собственного организма. На следующем этапе дифференцировки происходит негативная селекция. Клоны Т-лимфоцитов, прошедшие положительную селекцию и рестриктированные по белкам МНС, которые имеют ТКР, высокоаффинные к комплексам «собственный пептид-белок МНС» на поверхности дендритных клеток (ДК) и клеток эпителия тимуса, погибают в результате апоптоза (негативная селекция) или на них индуцируется экспрессия белка FoхP3 – регулятора транскрипции, и они дифференцируются в регуляторные Т-лимфоциты. Эти клетки выходят на периферию, где играют важную роль в механизмах периферической толерантности, оказывая супрессорное действие на аутореактивные клоны Т-лимфоцитов той же специфичности. Считается, что высокий уровень аффинности ТКР к собственным антигенам способствует преобладанию негативной селекции над развитием Трег. лимфоцитов [11,18,19,20].
Долгое время считалось, что центральная Т-клеточная толерантность ограничена только теми собственными белками, которые экспрессированы в тимусе, и поэтому исключается ее формирование по многим белкам, которые экспрессируются только в специализированных периферических тканях. Недавно установлено, однако, что негативная селекция приводит к формированию центральной Т-клеточной толерантности не только к тем собственным белкам организма, которые экспрессируются на поверхности тимусных ДК и медуллярных эпителиальных клеток, но и к многим органоспецифическим белкам, которые хотя и содержатся только в определенных тканях, однако тоже экспрессируются на АПК тимуса. Показано, что для экспрессии антигенов многих эндокринных тканей требуется наличие регулятора транскрипции – ядерного белка Aire (аутоиммунный регулятор) [1,5]. Редкий генетический дефект этого белка вызывает у человека аутоиммунное заболевание, известное как «аутоиммунная полиэндокринопатия – кандидозы – эктодермальная дистрофия» (APECED), которое называется также «Аутоиммунный полиэндокринный синдром I типа». Было установлено, что это заболевание обусловлено единичным аутосомным мутантным локусом и наследуется по рецессивному типу. Показано, что виновный ген APECED кодирует белок Aire. Этот белок экспрессируется в первую очередь в тимусе, поджелудочной железе и надпочечниках. Он регулирует представление аутоантигенов периферических тканей на ДК и медуллярных эпителиальных клетках тимуса. Недавно были созданы мыши, дефицитные по Aire, у них развивались мультиорганные аутоиммунные заболевания [1,5,12,17]. Конкретные детали механизма регуляции белком Aire экспрессии собственных антигенных пептидов в тимусе пока мало понятны, и в настоящее время этот механизм интенсивно изучается.
Клональная делеция аутореактивных Т-лимфоцитов осуществляется также с помощью другого механизма – рецепторного редактирования. В его основе лежит реарранжировка фрагментов, образующих функциональные гены, кодирующие вариабельные домены ТКР, высокоаффинные к собственным пептидам организма. Она происходит в незрелых Т-лимфоцитах мезенхимы тимуса при распознавании этих пептидов на поверхности АПК. Если образующийся в результате генетической реарранжировки (рецепторного редактирования) ТКР утрачивает специфичность к собственному пептиду, то такой клон Т-лимфоцитов выживает. Если аффинность ТКР вследствие рецепторного редактирования существенно не изменяется, клетка вступает в апоптоз и погибает. Рецепторное редактирование нечасто происходит в тимусе, и преобладающим механизмом центральной Т-клеточной толерантности все же является негативная селекция [9,11,16].
Центральная В-клеточная толерантность также формируется за счет клональной делеции аутореактивных клонов незрелых В-лимфоцитов в костном мозге. Главным механизмом в данном случае является рецепторное редактирование, а роль негативной селекции, в отличие от центральной Т-клеточной толерантности, второстепенна.
Рецепторное редактирование аутореактивных В-клеток – это процесс, при котором незрелые В-лимфоциты, экспрессирующие антигенраспознающие рецепторы (ВКР), высокоаффинные к собственным антигенам организма, контактируя с этими антигенами (если они присутствуют в костном мозге), получают от ВКР сильный сигнал и прекращают дифференцировку, оставаясь в костном мозге. Под действием ряда стимулов в клетке начинается реарранжировка генов, кодирующих синтез вариабельных доменов молекулы иммуноглобулина, в первую очередь вариабельных доменов легкой цепи (VL-доменов). Это приводит к изменению специфичности антигенсвязывающего центра иммуноглобулина, что снижает аффинность ВКР к данному антигену ниже критического порогового уровня, ведущего к возможности возникновения аутоиммунного процесса. Однако если в течение 1-2 дней этого не произойдет, то В-лимфоцит вступает в апоптоз и погибает. Процесс рецепторного редактирования, таким образом, по своему механизму является скорее молекулярной селекцией, чем клеточной [9,10,11,14,16]. Так как в данном случае происходит изменение специфичности уже имеющегося у В-лимфоцита функционального ВКР, процесс и получил название рецепторного редактирования (receptor edition). Показано также, что частично формирование центральной толерантности продолжается в селезенке, и в этом случае рецепторное редактирование не имеет места, а В-клеточная толерантность незрелых транзиторных В-клеток формируется с помощью механизма негативной селекции. Для формирования центральной В-клеточной толерантности необходимо, чтобы собственные антигены были доступны для взаимодействия с аутореактивными В-лимфоцитами в костном мозге либо в селезенке. Поэтому считается, что собственные антигены, которые сильно рестриктированы по тканям, не могут эффективно индуцировать центральную В-клеточную толерантность. Для предотвращения продукции антител, направленных против таких антигенов, важны механизмы периферической В-клеточной толерантности [5,16].
Механизмы периферической толерантности
В многочисленных экспериментах на мышах было показано, что центральная толерантность не является идеальным процессом и не обеспечивает полной элиминации всех аутореактивных лимфоцитов из-за того, что, во-первых, не все собственные антигены экспрессируются в центральных органах адаптивной иммунной системы и, во-вторых, существует пороговый уровень аффинности к собственным антигенам, при превышении которого запускаются процессы клональной делеции. Это позволяет некоторым клонам с более низкой аффинностью к аутоантигенам избежать апоптоза и выжить. Процесс, называемый периферической толерантностью, инактивирует эти клетки на периферии, что приводит к их гибели или неспособности отвечать на собственные антигены [9,12,15].
Периферическую толерантность также иногда подразделяют на Т-клеточную и В-клеточную. Ряд механизмов периферической толерантности является общим для Т- и В-лимфоцитов, однако некоторые из них присущи только одному из этих типов клеток. Механизмы периферической толерантности можно подразделить на две категории: механизмы, обусловленные отсутствием костимулирующих сигналов и приводящие к анергии (неотвечаемости на антигенные стимулы) аутореактивных В- и Т-лимфоцитов; и супрессорный механизм подавления аутоиммунного ответа, осуществляемый регуляторными Т-лимфоцитами [5].
Отсутствие костимулирующих сигналов
В основе механизмов, относящихся к первой категории, лежит принцип, что одной антигенной стимуляции через ТКР или ВКР зрелых Т- и В-лимфоцитов недостаточно для индукции адаптивного иммунного ответа. Лимфоциты должны получить дополнительные, костимулирующие сигналы, обеспечиваемые АПК, принадлежащими к системе врожденного иммунитета. Для аутореактивных лимфоцитов такая активация в отсутствие костимуляции обычно бывает абортивной, и лимфоциты либо погибают вследствие апоптоза, либо переходят в состояние анергии [5,12].
В-лимфоциты становятся анергичными когда они контактируют с антигеном, не получая костимулирующего сигнала от Т-хелперов. Клональная анергия В-клеток, возникает, когда зрелые В-лимфоциты распознают растворимый антиген с помощью ВКР в фолликулах периферических лимфоидных органов и, активированные этим распознаванием, мигрируют к границе фолликула и Т-клеточной зоны, куда также могут мигрировать Т-хелперы после их первоначальной активации антигенпредставляющими ДК. Т-хелперы с помощью цитокинов и костимулирующих молекул (взаимодействие CD40/CD40L) обеспечивают В-лимфоцитам необходимый костимулирующий сигнал. В отсутствие этого сигнала активированные В-лимфоциты входят в состояние анергии, из которого их активация становится весьма затруднительной. Анергичные В-лимфоциты достаточно быстро вступают в апоптоз и погибают. Таким образом предотвращается синтез антител против собственных антигенов [9,10,12].
Клональная анергия Т-лимфоцитов также возникает, когда активированная через ТКР клетка не получает необходимого костимулирующего сигнала (он обеспечивается взаимодействием белка CD28 на поверхности аутореактивного Т-лимфоцита с костимулирующей молекулой В7 на АПК). Для находящихся на периферии аутореактивных лимфоцитов собственные антигены организма практически всегда доступны благодаря рециркуляции. Контакт с ними может вызвать активацию этих клеток. Однако если в месте локализации этих антигенов нет инфекции или деструкции тканей, то распознавшие антиген Т-лимфоциты не получают достаточного костимулирующего сигнала, так как контактируют с ДК, созревшими в отсутствие инфекции или воспаления. Такие ДК представляют на своей поверхности аутоантиген в комплексе с белками МНС, но с низким уровнем экспрессии В7 и без секреции цитокинов, поддерживающих развитие активированных Т-лимфоцитов. В результате такие ДК индуцируют абортивную активацию аутореактивных Т-лимфоцитов, в процессе которой кратковременная пролиферация клона сменяется снижением его численности за счет апоптоза. Небольшая часть аутореактивных Т-клеток переходит в состояние анергии и становится рефрактерной к последующей активации. Такова судьба большинства аутореактивных Т-лимфоцитов.
Однако существует вероятность, что некоторые из них могут попасть в лимфоузел, дренирующий участок, где уже имеются инфекция или воспаление. В этом лимфоузле находятся ДК, созревшие в условиях контакта с патогенами (и поэтому экспрессирующие большее количество костимулирующих молекул В7-1 или В7-2), которые мигрировали в лимфоузел. На поверхности этих ДК содержатся комплексы пептидов с белками МНС, в состав которых входят антигенные пептиды как из инфекционного агента, так и из собственных молекул клеточных фрагментов, также находящихся в очаге инфекции. Наивные рециркулирующие аутореактивные Т-лимфоциты, распознавшие эти собственные пептиды, представленные ДК в ассоциации с индуцированными инфекцией костимуляторами В7, активируются, пролиферируют, дифференцируются в эффекторные клетки и начинают атаку против собственных нормальных антигенов организма. Подавить такой процесс могут полноценно функционирующие Трег лимфоциты, роль которых в механизмах периферической толерантности будет рассмотрена ниже [2,3].
Роль Fas-киллинга в механизмах толерантности
Из уже изложенного видно, что гибель аутореактивных анергичных лимфоцитов в результате апоптоза играет важную роль в сохранении периферической толерантности. Экспрессия белка Fas на В-лимфоцитах индуцирует их апоптоз, так как Fas представляет собой рецептор для белков семейства TNF, содержащий домен смерти. По сравнению с нормальными В-лимфоцитами анергичные клетки более чувствительны к Fas-киллингу, потому что у них передача сигнала через ВКР сильно ослаблена (а сильный сигнал через ВКР может предотвратить Fas-индуцированный апоптоз В-лимфоцитов, взаимодействующих с Т-хелперами). [3,9,17].
Важную роль Fas-киллинга в механизмах периферической толерантности доказывает факт развития системных аутоиммунных заболеваний у мышей с природными мутациями в Fas-рецепторе или в Fas-лиганде. Активированные через ТКР аутореактивные Т-лимфоциты экспрессируют повышенные уровни Fas и FasL. И у В-, и у Т-лимфоцитов взаимодействие Fas-FasL индуцирует быстрый апоптоз с последующей гибелью клеток, так как анергичные В- и Т-клетки со слабым сигналом от ВКР/ТКР весьма чувствительны к Fas-киллингу. У мышей, несущих инактивирующие мутации в генах Fas и FasL, не работает механизм Fas-киллинга, и у них в раннем возрасте развиваются аутоиммунные заболевания. Аналогичное заболевание встречается и у людей, это – аутоиммунный лимфопролиферативный синдром. У больных обнаружена мутация гена Fas. Подобно мышам с аналогичным генетическим дефектом, у них тяжелый аутоиммунный процесс поражает многие органы, наблюдается интенсивная пролиферация В-лимфоцитов в периферических лимфоидных органах (лимофаденопатия), идет интенсивный синтез аутоантител, включая антитела к антигенам ядер. Это заболевание получило название «Аутоиммунный лимфопролиферативный синдром» [5,9,12,17].
Понимание того, что сигнал от взаимодействия CD28/В7 обеспечивает необходимый костимулирующий сигнал для активации Т-лимфоцитов, привело к детальному изучению механизмов костимуляции и к открытию существования ингибиторных рецепторовна Т-клетках, таких как CTLA-4 и РD-1, которые, как выяснилось, также участвуют в механизмах периферической Т-клеточной толерантности.
Роль ингибиторных рецепторов в периферической толерантности
CTLA-4, подобно CD28, связывается с В7, но вместо активационного сигнала передает Т-лимфоциту ингибирующий сигнал, который подавляет его активацию. Экспрессия CTLA-4 индуцируется позже, чем экспрессия CD28 (взаимодействие которого с CD28 индуцирует Т-клеточный ответ). Это обеспечивает торможение и завершение иммунного ответа. Роль молекулы CTLA-4 была выяснена, когда были получены мыши, лишенные гена, кодирующего этот рецептор. У таких мышей развивалась массивная пролиферация Т-лимфоцитов и возникали, аутоиммунные заболевания, что доказывало важную роль этой молекулы в сохранении периферической толерантности [9,12,17].
Экспрессия ингибиторного рецептора РD-1 (Programmed death-1 – Рецептор программируемой смерти — 1) индуцируется на поверхности Т-лимфоцитов при их дифференцировке в эффекторные клетки. Один из лигандов этого рецептора (PD-1L) экспрессируется на стромальных клетках во многих тканях. Контакт указанных рецепторов на активированных Т-лимфоцитах с соответствующими лигандами подавляет активацию этих клеток и индуцирует их апоптоз. Точная природа этого механизма пока недостаточно изучена, но в экспериментах с мышами с мутантной формой PD-1 было показано, что у этих животных повышается частота аутоиммунных заболеваний [5,12].
Супрессорный механизм периферической толерантности
Ключевым механизмом периферической толерантности является супрессорная толерантность, осуществляемая регуляторными CD4 + Т-лимфоцитами. Эти клетки имеют фенотип CD4 + 25 + FoxP3 + и обладают супрессорной активностью по отношению к эффекторным Т-лимфоцитам той же специфичности (Тх1, CD8 + цитотоксическим лимфоцитам), а также по отношению к ДК, которые осуществляют представление антигенов и активацию Т-клеток, распознающих этот антиген. Одной из важнейших функций Трег. лимфоцитов является участие в формировании периферической толерантности путем супрессии работы аутореактивных клонов Т-лимфоцитов. Важными маркерами и эффекторными молекулами Трег. лимфоцитов являются белок CD25 (представляющий собой α-цепь рецептора для ИЛ-2), а также фактор транскрипции FoxP3, регулирующий транскрипцию генов, ответственных за дифференцировку Т-лимфоцитов и синтез ими цитокинов [15,18]. Существует как минимум два механизма супрессии, осуществляемой Трег. лимфоцитами: прямой, при непосредственном контакте между этими клетками и эффекторными Т-лимфоцитами той же специфичности; и дистанционный, который осуществляется на расстоянии с помощью цитокинов (ИЛ-10, TGF-β, ИЛ-35 и др.). При прямом механизме супрессии Трег. лимфоциты, взаимодействуя с эффекторными Т-лимфоцитами, выделяют гранзим В, вызывающий апоптоз этих клеток [2,4,8,13].
Установлено, что дефекты белка FoxP3, контролирующего программирование функциональных свойств Трег. лимфоцитов, приводит к возникновению (как у человека, так и у мышей) тяжелого аутоиммунного заболевания, характеризующегося воспалительным поражением многих органов. У человека FoxP3 кодируется генами, локализованными в Х-хромосоме, и генетический дефект этого белка вызывает заболевание, которое называется «Иммунодисрегуляция, полиэндокринопатия, энтеропатия, Х-связанный синдром» — IPEX. У мышей дефицит FoxP3 вызывает очень похожее тяжелое аутоиммунное заболевание, которое может быть излечено простым переносом нормального функционального FoxP3 гена в часть CD4 + Т-клеток. Это доказывает, что именно отсутствие Трег. лимфоцитов является причиной такой тяжелой утраты толерантности [9,12,17].
Считается, что активированные аутореактивные Т-лимфоциты становятся резистентными к действию Трег. лимфоцитов после получения сигнала от ДК, которые были активированы через Толл-подобные рецепторы (TLR) и начали продукцию провоспалительных цитокинов, в первую очередь ИЛ-6, а также с помощью мембраносвязанного члена семейства TNF называемого CITR-лиганд (его экспрессия индуцируется на ДК, в результате стимуляции через TLR). То есть, супрессорная функция Трег. лимфоцитов блокируется в результате распознавания инфекции ДК. С одной стороны, такая активация ДК способствует индукции адаптивного иммунного ответа специфичными к патогену клонами Т-лимфоцитов, но с другой – она индуцирует срыв толерантности к антигенам тканей, находящихся в очаге инфекции, так как ослабляется деятельность Трег. лимфоцитов, подавляющих активацию аутореактивных Т-лимфоцитов той же специфичности [3,5,17].
Детальное изучение механизмов периферической толерантности, обеспечиваемой Трег. лимфоцитами, может иметь клиническое применение, так как способы повышения супрессорной активности этих клеток могут быть использованы для лечения аутоиммунных и аллергических заболеваний.
Литература
Төзімділіктің орталық және шеткері механизмдеріне кәзіргі көзкарас
С.В. Кожанова, Б.Б. Бижигитова, Г.Т. Балпанова
Шолуда төзімділіктің орталық және шеткері механизмдері берілген. Теріс сұрыпталу, аутореактивті Т-лимфоциттердің рецепторлық іріктелу механизмі көмегімен клонды делециясы қарастырылған. Шеткері төзімділік механизмдерінде тежегіш рецепторлар мен Fas-киллингтің қызметі көрсетілген. Сонымен қатар, Треттегіш лимфоциттердің функционалдық қасиеттерінің бағдарлауын бақылайтын FoxP3 нәруызының жетіспеушілігі бейнеленген.
The modern view on mechanisms of central and peripheral tolerance
Kozhanova S.V., Bizhigitova B.B., Balpanova G.T.
The mechanisms of central and peripheral tolerance are presented in this review. The role of negative selection, autoreactive T-lymphocytes of klonal deletion by receptor editing, inhibitory receptors and Fas-killing in the mechanisms of peripheral tolerance are examined too. The defects in protein FoxP3, controlling programming of the functional properties of Tregulatory lymphocytes are described.
С.В. Кожанова, Б.Б. Бижигитова, Г.Т. Балпанова
Казахский Национальный медицинский университет имени С.Д. Асфендиярова
Учение об иммунологической толерантности сформулировали
Естественная толерантность иммунитета развивается по отношению к аутоантигенам. Состояние естественной толерантности развивается до рождения. Поскольку в это время лимфоциты функционально незрелы, то для развития толерантности необходимо длительное присутствие Аг в организме. Природа этих Аг может быть различной, ими могут быть даже микробные продукты. Попав в организм в период иммунной некомпетентности, они впоследствии воспринимаются как собственные Аг. Этим объясняется трудность развития естественной толерантности во взрослом состоянии.
Искусственная толерантность иммунной системы
Искусственная толерантность может индуцироваться различными веществами, попавшими в организм в начальном периоде постнатального развитии. Такие вещества называют толерогенами. Толерогенами могут быть практически любые Аг, но толерантность легче развивается при попадании в организм растворимых и низкомолекулярных Аг. Высокоиммуногенные Аг реже вызывают состояние толерантности, по сравнению с малоиммуногенными. Чем больше генетических различий между реципиентом и толерогеном, тем труднее формируется толерантность.
Иммунный паралич
Иммунный паралич — близкое к толерантности состояние, развивающееся после введения очень больших доз Аг. При этом повторное введение Аг в возрастающих количествах через короткие промежутки более эффективно, чем однократная иммунизация. В этом имеется определённая аналогия с десенсибилизацией организма по A.M. Безрёдке. При этом дозы Аг могут быть более низкими (так называемая толерантность низкой дозы), чем однократное введение больших количеств Аг.
Расщеплённая толерантность иммунитета
При введении гаптенов может развиваться расщеплённая толерантность: AT при сохранении клеточных реакций иммунитета не образуются или наоборот, имеются AT при отсутствии клеточных реакций.
Нарушения толерантности иммунной системы. Аутоимунные заболевания
Если естественная толерантность сохраняется годами, то искусственная — не более нескольких месяцев. Толерантность может развиваться при некоторых заболеваниях, но значительно чаще она нарушается по отношению к собственным Аг, результате чего развиваются аутоиммунные заболевания. Это состояние впервые наблюдал П. Эрлих и назвал его horror autotoxicus (дословно «самоотравляющий ужас»). Действительно, в большинстве случаев аутоиммунный процесс вызывает гораздо больше повреждений, чем провоцирующее его заболевание (например, ревматоидный артрит или гломерулонефрит после стрептококковой инфекции).
МЕХАНИЗМЫ НАРУШЕНИЯ ИММУНОЛОГИЧЕСКОЙ ТОЛЕРАНТНОСТИ
Аннотация
Аутоиммунные болезни относятся к заболеваниям с неясной этиологией. Спектр аутоиммунных заболеваний широк, к наиболее известным из них относятся диабет 1 типа, ревматоидный артрит, системная красная волчанка, рассеянный склероз, болезнь Крона, витилиго и др. Ключевую роль в развитии аутоиммунных реакций играют нарушения иммунологического гомеостаза. Несмотря на многочисленные исследования, точные механизмы развития аутоиммунитета все еще остаются малоизученными. В обзоре представлен анализ данных литературы о механизмах
нарушения иммунологической толерантности. Дано описание наиболее обсуждаемых теорий развития патологических аутоиммунных процессов: теория наследственной предрасположенности, теория нарушения иммунологической регуляции с участием регуляторных Т-клеток, теория сетевой регуляции, инфекционная те-
ория развития аутоиммунных заболеваний (молекулярная мимикрия, поликлональная активация лимфоцитов). Теория наследственной предрасположенности отражает важнейшую роль наследственных факторов в развитии аутоиммунитета,
в частности, представлены сведения о связи аутоиммунных расстройств с главным комплексом гистосовместимости человека. Также в работе приведены данные,
свидетельствующие о том, что развитие аутоиммунных процессов в организме может быть связано с изменениями в содержании и функционировании регуляторных
Т-лимфоцитов. Эти клетки принимают непосредственное участие в механизмах клеточного иммунного ответа при аутоиммунных заболеваниях и могут служить
объяснением нарушения иммунологической толерантности, впоследствии приводящей к развитию и прогрессированию иммунопатологии. В описании теории сетевой регуляции раскрывается идея идиотип-антиидиотипических взаимодействий, которые могут быть механизмом контроля аутоиммунных реакций в норме или приводить к активации аутореактивных клонов. Инфекционная теория развития аутоиммунных патологий, которая представлена в обзоре, основывается на результатах многочисленных исследований и указывает на то, что вирусы могут провоцировать сбои иммунитета и приводить к аутоиммунизации.
Ключевые слова
Полный текст:
Литература
Зайчик А. Ш., Полетаев А. Б., Чурилов Л. П. Распознавание «своего» и взаимодействие со «своим» как основная форма активности адаптивной иммунной системы // Вестн. С.-Петерб. ун-та. Сер. 11. Медицина. 2013. № 1. С. 6–27.
Рыжков П. А., Рыжкова Н. С., Коновалова Р. В. Генетика сахарного диабета 1 типа // «Живые и биокосные системы». 2013. № 4; URL: http://www.jbks.ru/archive/issue-4/article-14
Храмова Т.В., Бедулева Л.В., Толстолуцкая Т.О., и др. Продукция аутоантител к CD4 у негуманизированных крыс в ответ на иммунизацию GP120 белком ВИЧ // Современная медицина: актуальные вопросы. 2014. № 35-36. С. 71-76.
Alcina A., Fedetz M., Ndagire D. et al. IL2RA/CD25 gene polymorphisms: uneven association with multiple sclerosis and type 1 diabetes // PLoS One. 2009. Vol. 4, N 1. P.e4137. doi: 10.1371/journal.pone.0004137.
Alonso N., Martinez-ArconadaM. J., Granada M. L. et al. Regulatory T cells in type 1 diabetic patients with autoimmune chronic atrophic gastritis // Endocrine. 2009. Vol. 35, N 3. P. 420–428. doi: 10.1007/s12020-009-9166-2.
Alvarez-Quiroga C., Abud-Mendoza C., Donuz-Padilla L. et al. CTLA-4-Ig therapy diminishes the frequency but enhances the function of Treg cells in patients with rheumatoid arthritis // J. Clin. Immunool. 2011. Vol. 31, N 4. P. 588–595. doi: 10.1007/s10875-011-9527-5.
Antiga E., Quaglino P., Bellandi S. et al. Regulatory T cells in the skin lesions and blood of patients with systemic sclerosis and morphoea // Br J Dermatol. 2010. Vol. 162, N 5. P. 1056–1063. doi: 10.1111/j.1365-2133.2010.09633.x.
Antony J.M., Deslauriers A. M., Bhat R. K., Ellestad K. K., Power C. Human endogenous retroviruses and multiple sclerosis: innocent bystandersor disease determinants? // Biochim Biophys Acta.. 2011. Vol. 1812, N 2. P. 162–176. doi: 10.1016/j.bbadis.2010.07.016.
Arkema E. V., Karlson E. W., Costenbader K. H. A prospective study of periodontal disease and risk of rheumatoid arthritis // J Rheumatol. 2010. Vol. 37, N 9. P. 1800- 1804. doi: 10.3899/jrheum.091398.
Bailey-Bucktrout S. L., Bluestone J. A. Regulatory T cells: stability revisited // Trends Immunol. 2011. Vol. 32, N 7. P. 301-306. doi: 10.1016/j.it.2011.04.002.
Barrett J. C., Clayton D. G., Concannon P. et al. Genome-wide association study and meta-analysis find that over 40 loci affect risk of type 1 diabetes // Nat Genet. 2009. Vol.41, N 6. P.703-707. doi: 10.1038/ng.381.
Bartold P. M., Marino V., Cantley M., Haynes D. R. Effect of Porphyromonas gingivalis-induced inflammation on the development of rheumatoid arthritis // J Clin Periodontol. 2010. Vol.37, N 5. P. 405-411. doi: 10.1111/j.1600-051X.2010.01552.x.
Beduleva L., Menshikov I. Role of idiotype–anti-idiotype interactions in the induction of collagen-induced arthritis in rats // Immunobiology. 2010. Vol. 215, N 12. P. 963–970. doi: 10.1016/j.imbio.2009.12.001.
Bettini M., Vignali D. A. Regulatory T cells and inhibitory cytokines in autoimmunity // Curr. Opin. Immunol. 2009. Vol. 21, N 6. P. 612–618. doi: 10.1016/j.coi.2009.09.011.
Bouzid D., Amouri A., Fourati H. et al. Polymorphisms in the IL2RA and IL2RB genes in inflammatory bowel disease risk // Genet Test Mol Biomarkers. 2013. Vol. 17, N 11. P. 833-839. doi: 10.1089/gtmb.2013.0291.
Bovenschen H. J. van de Kerkhof P. C., van Erp P. E. et al. Foxp3+ regulatory T cells of psoriasis patients easily differentiate into IL-17A-producing cells and are found in lesional skin // J Invest Dermatol. 2011. Vol. 131, N 9. P. 1853-1860. doi: 10.1038/jid.2011.139.
Brok H. P., Boven L., van Meurs M. et al. The human CMV-UL86 peptide 981-1003 shares a crossreactive T-cell epitope with the encephalitogenic MOG peptide 34-56, but lacks the capacity to induce EAE in rhesus monkeys // J Neuroimmunol. 2007. Vol. 182, N 1-2. P. 135-152.
Buckner J. H. Mechanisms of impared regulation by CD4+CD25+ FoxP3+ regulatory T cells in human aytoummune diseases // Nat Rev Immunol. 2010. Vol. 10, N 12. P. 849-859. doi: 10.1038/nri2889.
Cantley M. D., Haynes D. R., Marino V., Bartold P. M. Pre-existing periodontitis exacerbates experimental arthritis in a mouse model // J Clin Periodontol. 2011. Vol. 38, N 6. P. 532-541. doi: 10.1111/j.1600-051X.2011.01714.x.
Chang H. H., Tai T. S., Lu B. et al. PTPN 22.6, a dominant negative isoform of PTPN22 and potential biomarkers of rheumatoid arthritis // PLoS One. 2012. Vol. 7, N 3. P. e33067. doi: 10.1371/journal.pone.0033067.
Cheng W., Ma Y., Gong F., et al. Cross-reactivity of autoreactive T cells with MBP and viral antigens in patients with MS // Front Biosci (Landmark Ed). 2012. Vol. 17. P. 1648-1658.
Chiu Y. C., Lin C. Y., Chen C. P. et al. Peptidoglycan enhances IL-6 production in human synovial fibroblasts via TLR2 receptor, focal adhesion kinase, Akt, and AP-1- dependent pathway // J Immunol. 2009. Vol. 183, N 4. P. 2785-2792. doi: 10.4049/jimmunol.0802826.
Chowdhary V. R., Tilahun A. Y., Clark C. R. et al. Chronic Exposure to Staphylococcal Superantigen Elicits a Systemic Inflammatory Disease Mimicking Lupus // J Immunol. 2012. Vol. 189, N 4. P. 2054–2062. doi: 10.4049/jimmunol.1201097.
Davidson T. S., DiPaolo R. J., Andersson J., Shevach E. M. Cutting Edge: IL-2 is essential for TGF-beta-mediated induction of Foxp3+ T regulatory cells // J Immunol. 2007. Vol. 178, N 7. P. 4022-4026.
de Smit M., Westra J., Vissink A. et al. Periodontitis in established rheumatoid arthritis patients: a cross-sectional clinical, microbiological and serological study // Arthritis Res Ther. 2012. Vol. 14, N 5. R222. doi: 10.1186/ar4061.
do Olival G. S., Faria T. S., Nali L. H. et al. Genomic analysis of ERVWE2 locus in patients with multiple sclerosis: absence of genetic association but potential role of human endogenous retrovirus type W elements in molecular mimicry with myelin antigen // Front Microbiol. 2013. 4:172. doi: 10.3389/fmicb.2013.00172.
Dominguez-Villar M., Baecher-Allan C. M., Hafler D. A. Identification of T helper type 1-like, Foxp3+ regulatory T cells in human autoimmune disease // Nat Med. 2011. Vol.17, N 6. P. 673-675. doi: 10.1038/nm.2389.
Draborg A. H., Jørgensen J. M., Müller H. et al. Epstein-Barr virus early antigen diffuse (EBV-EA/D)-directed immunoglobulin A antibodies in systemic lupus erythematosus patients // Scand J Rheumatol. 2012. Vol. 41, N 4. P. 280–289. doi: 10.3109/03009742.2012.665944.
Dreyfus D. H., Nagasawa M., Kelleher C. A., Gelfand E. W. Stable expression of Epstein-Barr virus BZLF-1-encoded ZEBRA protein activates p53-dependent transcription in human Jurkat T-lymphoblastoid cells // Blood. 2000. Vol. 96, N 2. P. 625–634.
Dreyfus D. H., Nagasawa M., Pratt J. C. et al. Inactivation of NF-kappaB by EBV BZLF-1-encoded ZEBRA protein in human T-cells // J Immunol. 1999. Vol. 163, N 11. P. 6261–6268.
Ei Wafai R. J., Chmaisse H. N., Makki R. F., Fakhoury H. Association of HLA class II alleles and CTLA-4 polymorphism with type 1 diabetes // Saudi. J. Kidney Dis. Transpl. 2011.Vol. 22, N 2. P. 273-281.
Erre G. L., Mameli G., Cossu D. et al. Increased Epstein-Barr Virus DNA load and antibodies against EBNA1 and EA in Sardinian patients with rheumatoid arthritis // Viral Immunol. 2015. P. 1-6. doi: 10.1089/vim.2015.0035.
Esen B.A., Yilmaz, G., Uzun S. et al. Serologic response to Epstein-Barr virus antigens in patients with systemic lupus erythematosus: a controlled study // Rheumatol Int. 2012. Vol. 32, N 1. P. 79–83. doi: 10.1007/s00296-010-1573-4.
Flores-Borja F., Jury E. C., Mauri C., Ehrenstein M. R. Defects in CTLA-4 are associated with abnormal regulatory T cell function in rheumatoid arthritis // Proc. Natl. Acad. Sci USA. 2008. Vol. 105, N 49. P.19396-19401. doi: 10.1073/pnas.0806855105.
Fraser J. D., Proft T. The bacterial superantigen and superantigen-like proteins // Immunol. Rev. 2008. Vol. 225. P. 226–243. doi: 10.1111/j.1600-065X.2008.00681.x.
Fritzching B., Haas J., König F. et al. Intracerebral human regulatory T cells: analysis of CD4+CD25+FOXP3+ T cells in brain lesions and cerebrospinal fluid of multiple sclerosis patients // PLoS ONE. 2011. Vol. 6, N 3. e17988. doi:10.1371/journal.pone.0017988.
Frulloni L., Lunardi C., Simone R. Identification of a novel antibody associated with autoimmune pancreatitis // N Engl J Med. 2009. Vol.361, N 22. P. 2135-2142. doi: 10.1056/NEJMoa0903068.
Fujinami R. S., Oldstone M. B. Amino acid homology between the encephalitogenic site of myelin basic protein and virus: mechanism for autoimmunity // Science. 1985. Vol. 230. P. 1043-1045.
Furukawa H., Oka S., Shimada K. et al. Association of Human Leukocyte Antigen with Interstitial Lung Disease in Rheumatoid Arthritis: A Protective Role for Shared Epitope // PLoS ONE. 2012. Vol. 7, N 5. P. e33133. doi: 10.1371/journal.pone.0033133.
Garg G., Tyler J. R., Yang J. H. et al. Type 1 diabetes-associated IL2RA variation lowers IL-2 signaling and contributes to diminished CD4+CD25+ regulatory T cell function // J. Immunol. 2012. Vol. 188, N 9. P. 4644-4653. doi: 10.4049/jimmunol.1100272.
Goodman W. A., Levine A. D., Massari J. V. et al. IL-6 signaling in psoriasis prevents immune suppression by regulatory T cells // J. Immunol. 2009. Vol. 183, N 5. Р. 3170–3176. doi: 10.4049/jimmunol.0803721.
Guarneri F, Guarneri C, Benvenga S. Helicobacter pylori and autoimmune pancreatitis: role of carbonic anhydrase via molecular mimicry? // J Cell Mol Med. 2005. Vol. 9, N 3. P. 741-744.
Habibagahi M, Habibagahi Z, Jaberipour M, Aghdashi A. Quantification of regulatory T cells in peripheral blood of patients with systemic lupus erythematosus // Rheumatol Int. 2011. Vol. 31, N 9. P. 1219-1225. doi: 10.1007/s00296-010-1427-0.
Halenius A., Hengel H. Human cytomegalovirus and autoimmune disease // Biomed Res Int. 2014. P.1-15. doi: 10.1155/2014/472978.
Han G. M., O’Neil-Andersen N. J., Zurier R. B., Lawrence D. A. CD4+CD25high T cell numbers are enriched in the peripheral blood of patients with rheumatoid arthritis // Cell Immunol. 2008. Vol. 253, N 1-2. P. 92–101. doi: 10.1016/j.cellimm.2008.05.007.
Hasham A., Tomer Y. Genetic and epigenetic mechanisms in thyroid autoimmunity // Immunol Res. 2012. Vol. 4, N 1-3. P. 204-213. doi: 10.1007/s12026-012-8302-x.
Hiemstra H. S., Schloot N. C., van Veelen P. A. et al. Cytomegalovirus in autoimmunity: T cell crossreactivity to viral antigen and autoantigen glutamic acid decarboxylase // Proc Natl Acad Sci USA. 2001. Vol. 98, N 7. P. 3988-3991.
Hirano T. Interleukin 6 in autoimmune and inflammatory diseases: a personal memoir // Proc Jpn Acad Ser B Phys Biol Sci. 2010. Vol. 86, N 7. P. 717-730.
Honeyman M. C., Stone N. L., Falk B. A., et al. Evidence for molecular mimicry between human T cell epitopes in rotavirus and pancreatic islet autoantigens // J Immunol. 2010. Vol. 184, N 4. P. 2204-2210. doi: 10.4049/jimmunol.0900709.
Islander U., Andersson A., Lindberg E. et al. Superantigenic Staphylococcus aureus stimulates production of interleukin-17 from memory but not naive T cells // Infect Immun. 2010. Vol. 78, N 1. P. 381–386. doi: 10.1128/IAI.00724-09.
Jacobsen J. T., Lunde E, Sundvold-Gjerstad V. et al. The cellular mechanism by which complementary Id+ and anti-Id antibodies communicate: T cells integrated into idiotypic regulation // Immunol Cell Biol. 2010. Vol. 88, N 5. P. 515–522. doi: 10.1038/icb.2009.118.
Jailwala P., Waukau J., Glisic S. et al. Apoptosis of CD4+ CD25(high) T cells in type 1 diabetes may be partially mediated by IL-2 deprivation // PLoS ONE. 2009. Vol. 4, N 8. e6527. doi: 10.1371/journal.pone.0006527.
James J.A., Harley J. B. Linear epitope mapping of an Sm B/B’ polypeptide // J. Immunol. 1992. Vol. 148, N 7. P. 2074–2079.
James, E. A., Moustakas A. K., Bui J. et al. HLA–DR1001 presents «altered-self» peptides derived from joint associated proteins by accepting citrulline in three of its binding pockets // Arthritis Rheum. 2010. Vol. 62, N 10. P.2909-2918. doi: 10.1002/art.27594.
Jerne N. K. Idiotypic Networks and Other Preconceived Ideas // Immunol Rev. 1984. N. 79. P. 5-24.
Johnson K., Wong R., Barriga K. J. et al. rs11203203 is associated with type 1 diabetes risk in population pre-screened for high-risk HLA-DR,DQ genotypes // Pediatric Diabetes. 2012. Vol. 13, N 8. P. 611–615. doi: 10.1111/j.1399-5448.2012.00888.x.
Kawashighri S. Y., Kawakami A., Okada A, et al. CD4+CD25highCD127low/-Treg cell frequency from peripheral blood correlates with disease activity in patients with rheumatoid arthritis // J Rheumatol. 2011. Vol. 38, N 12. P. 2517–2521. doi: http://dx.doi.org/10.3899/jrheum.110283.
Kim J. R., Chae J. N., Kim S. H., Ha J. S. Subpopulations of regulatory T cells in rheumatoid arthritis, systemic lupus erythematosus, and Behcet’s disease // J Korean Med Sci. 2012. Vol. 27, N 9. P. 1009-1013. doi: 10.3346/jkms.2012.27.9.1009.
Kinloch A. J., Alzabin S., Brintnell W. et al. Immunization with Porphyromonas gingivalis enolase induces autoimmunity to mammalian α-enolase and arthritis in DR4-IE-transgenic mice // Arthritis Rheum. 2011. Vol. 63, N 12. P. 3818- 3823. doi: 10.1002/art.30639.
Klatt T., Ouyang Q., Flad T. et al. Expansion of peripheral CD8+ CD28- T cells in response to Epstein-Barr virus in patients with rheumatoid arthritis // J Rheumatol. 2005. Vol. 32, N 2. P. 239-251.
Knevel R., de Rooy D. P., Zhernakova A. et al. Association of variants in IL2RA with progression of joint destruction in rheumatoid arthritis // Arthritis Rheum. 2013. Vol. 65, N 7. P. 1684-1693. doi: 10.1002/art.37938.
Komatsu N., Mariotti-Ferrandiz M. E., Wang Y. et al. Heterogeneity of natural Foxp3+ T cells: a committed regulatory T-cell lineage and an uncommitted minor population retaining plasticity // Proc Natl Acad Sci USA. 2009. Vol. 106, N 6. P. 1903-1908. doi: 10.1073/pnas.0811556106.
Komatsu N., Okamoto K., Sawa S. et al. Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis // Nat Med. 2014. Vol. 20, N 1. P. 62-68. doi: 10.1038/nm.3432.
Krzysztalowska-Wawrzyniak M., Ostanek M., Clark J. et al. The distribution of human endogenous retrovirus K-113 in health and autoimmune diseases in Poland // Rheumatology (Oxford). 2011. Vol. 50, N 7. P. 1310-1314. doi: 10.1093/rheumatology/ker022.
Lang H. L., Jacobsen H., Ikemizu S., et al. A functional and structural basis for TCR cross-reactivity in multiple sclerosis // Nat Immunol 2002. Vol. 3, N 10. P. 940-943.
Larsson H. E., Jönsson I., Lernmark A. et al. Decline in titers of anti-idiotypic antibodies specific to autoantibodies to GAD65 (GAD65Ab) precedes development of GAD65Ab and type 1 diabetes // PLOS ONE. 2013. Vol. 8, N 6. P. e65173. doi: 10.1371/journal.pone.0065173.
Lee Y. H., Bae S. C., Choi S. J. et al. The association between the PTPN22 C1858T polymorphism and rheumatoid arthritis: a meta-analysis update // Mol. Biol. Rep. 2012. Vol. 39, N 4. P. 3453-3460. doi: 10.1007/s11033-011-1117-3.
Lee Y. H., Kim J. H., Seo Y. H. et al. CTLA-4 polymorphisms and susceptibility to inflammatory bowel disease: a meta-analysis // Hum Immunol. 2014. Vol. 75, N 5. P. 414–421. doi: 10.1016/j.humimm.2014.02.020.
Lee Y.H., Choi S.J., Ji J.D., Song G.G. The association between the PTPN22 C1858T polymorphism and systemic sclerosis: a meta-analysis // Mol. Biol. Rep. 2012. Vol. 39, N 3. P. 3103-3108. doi: 10.1007/s11033-011-1074-х.
Levin L. I., Munger K. L., O’Reilly E. J. et al. Primary infection with the Epstein-Barr virus and risk of multiple sclerosis // Ann Neurol. 2010. Vol. 67, N 6. P. 824–830. doi: 10.1002/ana.21978.
Li N., Ma T., Han J. et al. Increased apoptosis induction in CD4+CD25+ Foxp3+ T cells contributes to enhanced disease activity in patients with rheumatoid arthritis through IL-10 regulation // Eur Rev Med Pharmacol Sci. 2014. Vol. 18, N 1. P. 78–85.
Li S., Yu Y., Yue Y. et al. Microbial Infection and Rheumatoid Arthritis // J Clin Cell Immunol. 2013. Vol. 4, N 6. P.174.
Liang B., Gardner D., Griswold D.E. et al. Anti-interleukin-6 monoclonal antibody inhibits autoimmune responses in a murine model of systemic lupus erythematosus // Immunology. 2006. Vol. 119, N 3. P. 296–305.
Liberal R., Grant C. R., Mieli-Vergani G., Vergani D. Autoimmune hepatitis: A comprehensive review // J Autoimmun. 2013. Vol. 4. P. 126-139. doi: 10.1016/j.jaut.2012.11.002.
Lin S. C., Chen K. H., Lin C. H. et al. The quantitative analysis of peripheral blood FOXP3-expressing T cells in systemic lupus erythematosus and rheumatoid arthritis patients // Eur J Clin Invest. 2007. Vol. 37, N 12. P. 987-996.
Lindsey J. W., Hatfield L. M., Crawford M. P., Patel S. Quantitative PCR for Epstein-Barr virus DNA and RNA in multiple sclerosis // Mult. Scler. 2009. Vol. 15, N 2. P. 153–158. doi: 10.1177/1352458508097920.
Long S. A., Cerosaletti K., Bollyky P. L. et al. Defects in IL-2R signaling contribute to diminished maintenance of FOXP3 expression in CD4+CD25+ regulatory T-cells of type 1 diabetic subjects // Diabetes. 2010. Vol. 59, N 2. P. 407–415. doi: 10.2337/db09-0694.
Lucas R. M., Ponsonby A. L., Dear K. et al. Current and past Epstein-Barr virus infection in risk of initial CNS demyelination // Neurology. 2011. Vol. 77, N 4. P. 371–379. doi: 10.1212/WNL.0b013e318227062a.
Lundberg K., Kinloch A., Fisher B. A., et al. Antibodies to citrullinated alpha-enolase peptide 1 are specific for rheumatoid arthritis and cross-react with bacterial enolase // Arthritis Rheum. 2008. Vol. 58, N 10. P. 3009-3019. doi: 10.1002/art.23936.
Lünemann J. D., Jelcić I., Roberts S., et al. EBNA1-specific T cells from patients with multiple sclerosis cross react with myelin antigens and co-produce IFN-gamma and IL-2 // J Exp Med.. 2008. Vol. 205, N 8. P. 1763–1773. doi: 10.1084/jem.20072397.
Maier L. M., Lowe C. E., Cooper J. et al. IL2RA genetic heterogeneity in multiple sclerosis and type 1 diabetes susceptibility and soluble interleukin-2 receptor production // PLoS Genet. 2009. Vol. 5, N 1. P. e1000322. doi: 10.1371/journal.pgen.1000322.
Malek T. R., Castro I. Interleukin-2 receptor signaling: at the interface between tolerance and immunity // Immunity. 2010. Vol. 33, N 2. P. 153-165. doi: 10.1016/j.immuni.2010.08.004.
Martinez-Forero I., Garcia-Munoz R., Martinez-Pasamar S. et al. IL-10 suppressor activity and ex vivo Tr1-cell function are impaired in multiple sclerosis // Eur J Immunol. 2008. Vol. 38, N 2. P. 576–586. doi: 10.1002/eji.200737271.
Martinez-Martinez R. E., Abud-Mendoza C., Patiño-Marin N. et al. Detection of periodontal bacterial DNA in serum and synovial fluid in refractory rheumatoid arthritis patients // J Clin Periodontol. 2009. Vol. 36, N 12. P. 1004-1010. doi: 10.1111/j.1600-051X.2009.01496.x.
Marwaha A. K., Crome S. Q., Panagiotopoulos C. et al. Cutting edge: increased IL-17-secreting T cells in children with new-onset type 1 diabetes // J Immunol. 2010. Vol. 185, N 7. P. 3814–3818. doi: 10.4049/jimmunol.1001860.
McClain M. T., Heinlen L. D., Dennis G. J. et al. Early events in lupus humoral autoimmunity suggest initiation through molecular mimicry // Nat Med. 2005. Vol. 11, N 1. P. 85–89.
Menconi F., Osman R., Monti M. C. et al. Shared molecular amino acid signature in the HLA-DR peptide binding pocket predisposes to both autoimmune diabetes and thyroiditis // Proc Natl Acad Sci USA. 2010. Vol. 107, N 39. P.16899–16903. doi: 10.1073/pnas.1009511107.
Mikulkova Z., Praksova P., Stourac P. et al. Imbalance in T-cell and cytokine profiles in patients with relapsing-remitting multiple sclerosis // J Neurol Sci. 2011. Vol. 300, N 1-2. P. 135–141. doi: 10.1016/j.jns.2010.08.053.
Mikuls T. R., Thiele G. M., Deane K. D. et al. Porphyromonas gingivalis and disease-related autoantibodies in individuals at increased risk of rheumatoid arthritis // Arthritis Rheum. 2012. Vol. 64, N 11. P. 3522-3530. doi: 10.1002/art.34595.
Miyara M., Amoura Z., Parizot C. et al. Global natural regulatory T cell depletion in active systemic lupus erythematosus // J. Immunol. 2005. Vol. 175, N 12. P. 8392–8400.
Mohammad A. A., Rahbar A., Lui W. O. et al. Detection of circulating hcmv-miR-UL112-3p in patients with glioblastoma, rheumatoid arthritis, diabetes mellitus and healthy controls // PLoS One. 2014. Vol. 9, N 12. P.e113740. doi: 10.1371/journal.pone.0113740.
Mohammad A. A., Rahbar A., Lui W. O. et al. Detection of circulating hcmv-miR-UL112-3p in patients with glioblastoma, rheumatoid arthritis, diabetes mellitus and healthy controls // PLoS One. 2014. Vol. 9, N 12. e113740. doi: 10.1371/journal.pone.0113740.
Moradi B., Schnatzer P., Hagmann S., et al. CD4+CD25+/highCD127low/- regulatory T cell are enriched in rheumatoid arthritis and osteoarthritis joints – analysis of frequency and phenotype in synovial membrane, synovial fluid and peripheral blood // Arthritis Res Ther. 2014. Vol. 16, N 2. R97. doi: 10.1186/ar4545.
Moser K. L., Kelly J. A., Lessard C. J., Harley J. B. Recent insights into the genetic basis of systemic lupus erythematosus // Genes Immun. 2009. Vol. 10, N 5. P. 373–379. doi: 10.1038/gene.2009.39.
Nie H., Zheng Y., Li R. et al. Phosphorylation of FOXP3 controls regulatory T cell function and is inhibited by TNF-alpha in rheumatoid arthritis // Nat Med. 2013. Vol. 19, N 3. P. 322–328. doi: 10.1038/nm.3085.
Niu Q., Cai B., Huang Z. C. et al. Disturbed Th17/Treg balance in patients with rheumatoid arthritis // Rheumatol Int. 2012. Vol. 32, N 9. P. 2731-2736. doi: 10.1007/s00296-011-1984-x.
O’Gorman W. E., Dooms H., Thorne S. H. et al. The initial phase of an immune response functions to activate regulatory T cells // J. Immunol. 2009. Vol. 183, N 1. P. 332-339. doi: 10.4049/jimmunol.0900691.
Ohl, K., Tenbrock K. Inflammatory cytokines in systemic lupus erythematosus // J. Biomed. Biotechnol. 2011. doi: 10.1155/2011/432595.
Ollier W. Rheumatoid arthritis and Epstein-Barr virus: a case of living with the enemy? // Ann Rheum Dis. 2000. Vol. 59, N 7. P. 497-499.
O’Shea J. J., Paul W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells // Science. 2010. Vol. 327, N 5969. P. 1098-1102. doi: 10.1126/science.1178334.
Ouyang P., Rakus K., van Beurden S. J. et al. IL-10 encoded by viruses: a remarkable example of independent acquisition of a cellular gene by viruses and its subsequent evolution in the viral genome // J Gen Virol. 2014. Vol. 95 N Pt 2. P. 245-262. doi: 10.1099/vir.0.058966-0.
Pakpoor J., Disanto G., Gerber J. E. et al. The risk of developing multiple sclerosis in individuals seronegative for Epstein-Barr virus: a meta-analysis // Mult. Scler. 2013. Vol. 19, N 2. P. 162-166. doi: 10.1177/1352458512449682.
Perron H., Germi R., Bernard C. et al. Human endogenous retrovirus type W envelope expression in blood and brain cells provides new insights into multiple sclerosis disease // Mult. Scler. 2012. Vol. 18, N 12. P. 1721–1736. doi: 10.1177/1352458512441381.
Pieper J., Herrath J., Raghavan S. et al. CTLA4-Ig (abatacept) therapy modulates T cell effector functions in autoantibody-positive rheumatoid arthritis patients // BMC Immunol. 2013. 14:34. doi: 10.1186/1471-2172-14-34.
Pierer M., Rothe K., Quandt D. et al. Association of anticytomegalovirus seropositivity with more severe joint destruction and more frequent joint surgery in rheumatoid arthritis // Arthritis Rheum. 2012. Vol. 64, N 6. P.1740-1749. doi: 10.1002/art.34346.
Pischon N., Pischon T., Kröger J. et al. Association among rheumatoid arthritis, oral hygiene, and periodontitis // J Periodontol. 2008. Vol. 79, N 6. P. 979–986. doi: 10.1902/jop.2008.070501.
Prado C., de Paz B., López P. et al. Relationship between FOXP3 positive populations and cytokine production in systemic lupus erythematosus // Cytokine. 2013. Vol. 61, N 1. 90–96. doi: 10.1016/j.cyto.2012.08.033.
Radstake T. R., van Bon L., Broen J. et al. Increased frequency and compromised function of T regulatory cells in systemic sclerosis (SSc) is related to a diminished CD69 and TGFbeta expression // PLoS One. 2009. Vol. 4, N 6. e5981. doi: 10.1371/journal.pone.0005981.
Reynier F., Verjat T., Turrel F. et al. Increase in human endogenous retrovirus HERV-K (HML-2) viral load in active rheumatoid arthritis // Scand J Immunol. 2009. Vol. 70, N 3. P. 295-299. doi: 10.1111/j.1365-3083.2009.02271.x.
Röhner E., Detert J., Kolar P. et al. Induced apoptosis of chondrocytes by Porphyromonas gingivalis as a possible pathway for cartilage loss in rheumatoid arthritis // Calcif Tissue Int. 2010. Vol. 87, N 4. P. 333-340. doi: 10.1007/s00223-010-9389-5.
Rolland A., Jouvin-Marche E., Saresella M. et al. Correlation between disease severity and in vitro cytokine production mediated by MSRV (multiple sclerosis associated retroviral element) envelope protein in patients with multiple sclerosis // J Neuroimmunol. 2005. Vol. 160, N 1-2. P. 195-203.
Rolland A., Jouvin-Marche E., Viret C. et al. The envelope protein of a human endogenous retrovirus-W family activates innate immunity through CD14/TLR4 and promotes Th1-like responses // J Immunol. 2006. Vol. 176, N 12. P. 7636-7644.
Routsias J. G., Kyriakidis N. C., Friedman D. M. et al. Association of the idiotype: antiidiotype antibody ratio with the efficacy of intravenous immunoglobulin treatment for the prevention of recurrent autoimmune-associated congenital heart block // Arthritis Rheum. 2011. Vol. 63, N 9. P. 2783–2789. doi: 10.1002/art.30464.
Russell S. E., Moore A. C., Fallon P. G., Walsh P. T.. Soluble IL-2Rα (sCD25) exacerbates autoimmunity and enhances the development of Th17 responses in mice// PLoS One. 2012. Vol. 7, N 10. e47748. doi: 10.1371/journal.pone.0047748.
Ryba-Stanislawowska M, Skrzypkowska M, Mysliwiec M, Mysliwska J. Loss of the balance between CD4(+)Foxp3(+) regulatory T cells and CD4(+)IL17A(+) Th17 cells in patients with type 1 diabetes // Hum Immunol. 2013. Vol. 74, N 6. P.701–707. doi: 10.1016/j.humimm.2013.01.024.
Sabbatini A., Bombardieri S., Migliorini P. Autoantibodies from patients with systemic lupus erythematosus bind a shared sequence of SmD and Epstein-Barr virus-encoded nuclear antigen EBNA I // Eur J Immunol. 1993. Vol. 23, N 5. P. 1146–1152.
Sakaguchi S., Miyara M., Costantino C. M., Hafler D. A. FOXP3+ regulatory T cells in the human immune system //Nat. Rev. Immunol. 2010. Vol. 10, N 7. P. 490–500. doi: 10.1038/nri2785.
Salinas-Carmona M. C., de la Cruz-Galicia G., Pérez-Rivera I. et al. Spontaneous arthritis in MRL/lpr mice is aggravated by Staphylococcus aureus and ameliorated by Nippostrongylus brasiliensis infections // Autoimmunity. 2009. Vol. 42, N 1. P. 25-32. doi: 10.1080/08916930802228290.
Saresella M., Marventano I., Longhi R. et al. CD4+CD25+FoxP3+PD1-regulatory T-cells in acute and stable relapsing remitting multiple sclerosis and their modulation by therapy. FASEB J. 2008. Vol. 22, N 10. P. 3500–3508. doi: 10.1096/fj.08-110650.
Schneider A., Rieck M., Sanda S. et al. The effector T cells of diabetic subjects are resistant to regulation via CD4+FOXP3+ regulatory T cells // J. Immunol. 2008. Vol. 181, N 10. Р. 7350–7355.
Schulte B. M., Bakkers J., Lanke K. H. et al. Detection of enterovirus RNA in peripheral blood mononuclear cells of type 1 diabetic patients beyond the stage of acute infection // Viral Immunol. 2010. Vol. 23, N 1. P. 99-104. doi: 10.1089/vim.2009.0072.
Sempere-Ortells J. M., Perez-Garcia V., Marin-Alberca G. et al. Quantification and phenotype of regulatory T cells in rheumatoid arthritis according to Disease Activity Score-28 // Autoimmunity. 2009. Vol. 42, N 8. P. 636-645. doi: 10.3109/08916930903061491.
Shapira Y., Agmon-Levin N., Shoenfeld Y. Geoepidemiology of autoimmune rheumatic diseases // Nat. Rev. Rheumatol. 2010. Vol. 6, N 8. Р. 468–476. doi: 10.1038/nrrheum.2010.86.
Shimane K., Kochi Y., Suzuki A. et al. An association analysis of HLA-DRB1 with systemic lupus erythematosus and rheumatoid arthritis in a Japanese population: effects of *09:01 allele on disease phenotypes // Rheumatology. 2013. Vol. 52, N 7. P. 1172-1182. doi:10.1093/rheumatology/kes427.
Snijders A., Elferink D. G., Geluk A. et al. An HLA-DRB1-derived peptide associated with protection against rheumatoid arthritis is naturally processed by human APCs // J Immunol. 2001. Vol. 166, N 8. P. 4987-4993.
Sojka D. K., Huang Y. H., Fowell D. J. Mechanisms of regulatory T-cell suppression – a diverse arsenal for a moving target // Immunology. 2008. Vol. 124, N 1. P. 13-22. doi: 10.1111/j.1365-2567.2008.02813.x.
Song G. G., Bae S. C., Kim J. H., Lee Y. H. The PTPN22 C1858T polymorphism and rheumatoid arthritis: a meta-analysis // Rheumatol. Int. 2013. Vol. 33, N 8. P. 1991-1999. doi: 10.1007/s00296-013-2679-2.
Song G. G., Kim J. H., Lee Y. H. The CTLA-4 +49 A/G, CT60 A/G and PTPN22 1858 C/T polymorphisms and susceptibility to vitiligo: a meta-analysis //Mol. Biol. Rep. 2013. Vol. 40, N 4. P. 2985-2993. doi: 10.1007/s11033-012-2370-9.
Stahl E. A., Raychaudhuri S., Remmers E. F. et al. Consortium et al Genome-wide association study meta-analysis identifies seven new rheumatoid arthritis risk loci // Nat Genet. 2010. Vol. 42, N 6. P. 508-514. doi: 10.1038/ng.582.
Suen J. L., Li H. T., Jong Y. J. et al. Altered homeostasis of CD4+FoxP3+ regulatory T-cell subpopulations in systemic lupus erythematosus // Immunology. 2009. Vol. 127, N 2. P. 196-205. doi: 10.1111/j.1365-2567.2008.02937.x.
Sur G., Sporis D., Kudor-Szabadi L., Samasca G. Super-antigens and human pathology: always an interesting topic // J Bioequiv Availab. 2013. Vol. 5, N 3. P. 125-128. doi:10.4172/jbb.1000146.
Tejada-Simon M. V., Zang Y.C., Hong J. et al. Cross-reactivity with myelin basic protein and human herpesvirus-6 in multiple sclerosis // Ann Neurol. 2003. Vol. 53, N 2. P. 189-197.
Uner A., Gavalchin J. Idiotypes // Encyclopedia of life sciences. 2006. P. 1-5. doi: 10.1002/9780470015902.a0000912.
Venken K., Hellings N., Thewissen M. et al. Compromised CD4+CD25(high) regulatory T-cell function in patients with relapsing remitting multiple sclerosis is correlated with a reduced frequency of FOXP3-positive cells and reduced FOXP3 expression at the single cell level // Immunology. 2008. Vol. 123, N 1. P. 79–89.
Vrabelova, Z., Hrotekova Z., Hladikova Z. et al. CD127- and FoxP3+ expression on CD25+CD4+ T regulatory cells upon specific diabetogeneic stimulation in high-risk relatives of type 1 diabetes mellitus patients // Scand J Immunol. 2008. Vol. 67, N 4. P. 404-410. doi: 10.1111/j.1365-3083.2008.02074.x.
Wang L. M., Zhang D. M., Xu Y. M., Sun S. L. Interleukin 2 Receptor α Gene Polymorphism and Risk of Multiple Sclerosis: a meta-analysis // J Int Med Res. 2011. Vol. 39, N 5. P. 1625-1635.
Wang T., Sun X., Zhao J. et al. Regulatory T cells in rheumatoid arthritis showed increased plasticity toward Th17 but retained suppressive function in peripheral blood // Ann Rheum Dis. 2015. Vol. 74, N 6. P. 1293-1301. doi: 10.1136/annrheumdis-2013-204228.
Wehrens E. J., Mijnheer G., Duurland C. L. et al. Functional human regulatory T cells fail to control autoimmune inflammation due to PKB/c-akt hyperactivation in effector cells // Blood. 2011. Vol. 118, N 13. P. 3538-3548. doi: 10.1182/blood-2010-12-328187.
Wing K., Sakaguchi S. Regulatory T cells exert checks and balances on self tolerance and autoimmunity // Nat. Immunol. 2010. Vol. 11, N 1. P. 7–13.
Yomogida K., Chou Y. K., Chu C. Q. Superantigens induce IL-17 production from polarized Th1 clones // Cytokine. 2013. Vol. 63, N 1. P. 6–9. doi: 10.1016/j.cyto.2013.04.015.
Zanelli E., Gonzalez-Gay M. A., David C.S. Could HLA-DRB1 be the protective locus in rheumatoid arthritis // Immunol.Today. 1995. Vol. 16, N 6. P. 274–278.
Zanone M. M., Favaro E., Quadri R. et al. Association of cytomegalovirus infections with recurrence of humoral and cellular autoimmunity to islet autoantigens and of type 1 diabetes in a pancreas transplanted patient // Transpl Int.. 2010. Vol. 23, N 3. P. 333–337. doi: 10.1111/j.1432-2277.2009.00994.x.
Zhou L., Chong M. M, Littman D. R. Plasticity of CD4+ T cell lineage differentiation // Immunity. 2009. Vol. 30, N 5. P. 646-655. doi: 10.1016/j.immuni.2009.05.001.
REFERENCES in ENGLISH
Zajchik A. Sh., Poletaev A. B., Churilov L. P. Raspoznavanie «svoego» i vzaimodejstvie so «svoim» kak osnovnaja forma aktivnosti adaptivnoj immunnoj sistemy // Vestn. S.-Peterb. un-ta. Ser. 11. Medicina. 2013. № 1. S. 6–27.
Ryzhkov P. A., Ryzhkova N. S., Konovalova R. V. Genetika saharnogo diabeta 1 tipa // «Zhivye i biokosnye sistemy». 2013. № 4; URL: http://www.jbks.ru/archive/issue-4/article-14
Hramova T.V., Beduleva L.V., Tolstoluckaja T.O., i dr. Produkcija autoantitel k CD4 u negumanizirovannyh krys v otvet na immunizaciju GP120 belkom VICh // Sovremennaja medicina: aktual’nye voprosy. 2014. № 35-36. S. 71-76.
Alcina A., Fedetz M., Ndagire D. et al. IL2RA/CD25 gene polymorphisms: uneven association with multiple sclerosis and type 1 diabetes // PLoS One. 2009. Vol. 4, N 1. P.e4137. doi: 10.1371/journal.pone.0004137.
Alonso N., Martinez-ArconadaM. J., Granada M. L. et al. Regulatory T cells in type 1 diabetic patients with autoimmune chronic atrophic gastritis // Endocrine. 2009. Vol. 35, N 3. P. 420–428. doi: 10.1007/s12020-009-9166-2.
Alvarez-Quiroga C., Abud-Mendoza C., Donuz-Padilla L. et al. CTLA-4-Ig therapy diminishes the frequency but enhances the function of Treg cells in patients with rheumatoid arthritis // J. Clin. Immunool. 2011. Vol. 31, N 4. P. 588–595. doi: 10.1007/s10875-011-9527-5.
Antiga E., Quaglino P., Bellandi S. et al. Regulatory T cells in the skin lesions and blood of patients with systemic sclerosis and morphoea // Br J Dermatol. 2010. Vol. 162, N 5. P. 1056–1063. doi: 10.1111/j.1365-2133.2010.09633.x.
Antony J.M., Deslauriers A. M., Bhat R. K., Ellestad K. K., Power C. Human endogenous retroviruses and multiple sclerosis: innocent bystandersor disease determinants? // Biochim Biophys Acta.. 2011. Vol. 1812, N 2. P. 162–176. doi: 10.1016/j.bbadis.2010.07.016.
Arkema E. V., Karlson E. W., Costenbader K. H. A prospective study of periodontal disease and risk of rheumatoid arthritis // J Rheumatol. 2010. Vol. 37, N 9. P. 1800- 1804. doi: 10.3899/jrheum.091398.
Bailey-Bucktrout S. L., Bluestone J. A. Regulatory T cells: stability revisited // Trends Immunol. 2011. Vol. 32, N 7. P. 301-306. doi: 10.1016/j.it.2011.04.002.
Barrett J. C., Clayton D. G., Concannon P. et al. Genome-wide association study and meta-analysis find that over 40 loci affect risk of type 1 diabetes // Nat Genet. 2009. Vol.41, N 6. P.703-707. doi: 10.1038/ng.381.
Bartold P. M., Marino V., Cantley M., Haynes D. R. Effect of Porphyromonas gingivalis-induced inflammation on the development of rheumatoid arthritis // J Clin Periodontol. 2010. Vol.37, N 5. P. 405-411. doi: 10.1111/j.1600-051X.2010.01552.x.
Beduleva L., Menshikov I. Role of idiotype–anti-idiotype interactions in the induction of collagen-induced arthritis in rats // Immunobiology. 2010. Vol. 215, N 12. P. 963–970. doi: 10.1016/j.imbio.2009.12.001.
Bettini M., Vignali D. A. Regulatory T cells and inhibitory cytokines in autoimmunity // Curr. Opin. Immunol. 2009. Vol. 21, N 6. P. 612–618. doi: 10.1016/j.coi.2009.09.011.
Bouzid D., Amouri A., Fourati H. et al. Polymorphisms in the IL2RA and IL2RB genes in inflammatory bowel disease risk // Genet Test Mol Biomarkers. 2013. Vol. 17, N 11. P. 833-839. doi: 10.1089/gtmb.2013.0291.
Bovenschen H. J. van de Kerkhof P. C., van Erp P. E. et al. Foxp3+ regulatory T cells of psoriasis patients easily differentiate into IL-17A-producing cells and are found in lesional skin // J Invest Dermatol. 2011. Vol. 131, N 9. P. 1853-1860. doi: 10.1038/jid.2011.139.
Brok H. P., Boven L., van Meurs M. et al. The human CMV-UL86 peptide 981-1003 shares a crossreactive T-cell epitope with the encephalitogenic MOG peptide 34-56, but lacks the capacity to induce EAE in rhesus monkeys // J Neuroimmunol. 2007. Vol. 182, N 1-2. P. 135-152.
Buckner J. H. Mechanisms of impared regulation by CD4+CD25+ FoxP3+ regulatory T cells in human aytoummune diseases // Nat Rev Immunol. 2010. Vol. 10, N 12. P. 849-859. doi: 10.1038/nri2889.
Cantley M. D., Haynes D. R., Marino V., Bartold P. M. Pre-existing periodontitis exacerbates experimental arthritis in a mouse model // J Clin Periodontol. 2011. Vol. 38, N 6. P. 532-541. doi: 10.1111/j.1600-051X.2011.01714.x.
Chang H. H., Tai T. S., Lu B. et al. PTPN 22.6, a dominant negative isoform of PTPN22 and potential biomarkers of rheumatoid arthritis // PLoS One. 2012. Vol. 7, N 3. P. e33067. doi: 10.1371/journal.pone.0033067.
Cheng W., Ma Y., Gong F., et al. Cross-reactivity of autoreactive T cells with MBP and viral antigens in patients with MS // Front Biosci (Landmark Ed). 2012. Vol. 17. P. 1648-1658.
Chiu Y. C., Lin C. Y., Chen C. P. et al. Peptidoglycan enhances IL-6 production in human synovial fibroblasts via TLR2 receptor, focal adhesion kinase, Akt, and AP-1- dependent pathway // J Immunol. 2009. Vol. 183, N 4. P. 2785-2792. doi: 10.4049/jimmunol.0802826.
Chowdhary V. R., Tilahun A. Y., Clark C. R. et al. Chronic Exposure to Staphylococcal Superantigen Elicits a Systemic Inflammatory Disease Mimicking Lupus // J Immunol. 2012. Vol. 189, N 4. P. 2054–2062. doi: 10.4049/jimmunol.1201097.
Davidson T. S., DiPaolo R. J., Andersson J., Shevach E. M. Cutting Edge: IL-2 is essential for TGF-beta-mediated induction of Foxp3+ T regulatory cells // J Immunol. 2007. Vol. 178, N 7. P. 4022-4026.
de Smit M., Westra J., Vissink A. et al. Periodontitis in established rheumatoid arthritis patients: a cross-sectional clinical, microbiological and serological study // Arthritis Res Ther. 2012. Vol. 14, N 5. R222. doi: 10.1186/ar4061.
do Olival G. S., Faria T. S., Nali L. H. et al. Genomic analysis of ERVWE2 locus in patients with multiple sclerosis: absence of genetic association but potential role of human endogenous retrovirus type W elements in molecular mimicry with myelin antigen // Front Microbiol. 2013. 4:172. doi: 10.3389/fmicb.2013.00172.
Dominguez-Villar M., Baecher-Allan C. M., Hafler D. A. Identification of T helper type 1-like, Foxp3+ regulatory T cells in human autoimmune disease // Nat Med. 2011. Vol.17, N 6. P. 673-675. doi: 10.1038/nm.2389.
Draborg A. H., Jørgensen J. M., Müller H. et al. Epstein-Barr virus early antigen diffuse (EBV-EA/D)-directed immunoglobulin A antibodies in systemic lupus erythematosus patients // Scand J Rheumatol. 2012. Vol. 41, N 4. P. 280–289. doi: 10.3109/03009742.2012.665944.
Dreyfus D. H., Nagasawa M., Kelleher C. A., Gelfand E. W. Stable expression of Epstein-Barr virus BZLF-1-encoded ZEBRA protein activates p53-dependent transcription in human Jurkat T-lymphoblastoid cells // Blood. 2000. Vol. 96, N 2. P. 625–634.
Dreyfus D. H., Nagasawa M., Pratt J. C. et al. Inactivation of NF-kappaB by EBV BZLF-1-encoded ZEBRA protein in human T-cells // J Immunol. 1999. Vol. 163, N 11. P. 6261–6268.
Ei Wafai R. J., Chmaisse H. N., Makki R. F., Fakhoury H. Association of HLA class II alleles and CTLA-4 polymorphism with type 1 diabetes // Saudi. J. Kidney Dis. Transpl. 2011.Vol. 22, N 2. P. 273-281.
Erre G. L., Mameli G., Cossu D. et al. Increased Epstein-Barr Virus DNA load and antibodies against EBNA1 and EA in Sardinian patients with rheumatoid arthritis // Viral Immunol. 2015. P. 1-6. doi: 10.1089/vim.2015.0035.
Esen B.A., Yilmaz, G., Uzun S. et al. Serologic response to Epstein-Barr virus antigens in patients with systemic lupus erythematosus: a controlled study // Rheumatol Int. 2012. Vol. 32, N 1. P. 79–83. doi: 10.1007/s00296-010-1573-4.
Flores-Borja F., Jury E. C., Mauri C., Ehrenstein M. R. Defects in CTLA-4 are associated with abnormal regulatory T cell function in rheumatoid arthritis // Proc. Natl. Acad. Sci USA. 2008. Vol. 105, N 49. P.19396-19401. doi: 10.1073/pnas.0806855105.
Fraser J. D., Proft T. The bacterial superantigen and superantigen-like proteins // Immunol. Rev. 2008. Vol. 225. P. 226–243. doi: 10.1111/j.1600-065X.2008.00681.x.
Fritzching B., Haas J., König F. et al. Intracerebral human regulatory T cells: analysis of CD4+CD25+FOXP3+ T cells in brain lesions and cerebrospinal fluid of multiple sclerosis patients // PLoS ONE. 2011. Vol. 6, N 3. e17988. doi:10.1371/journal.pone.0017988.
Frulloni L., Lunardi C., Simone R. Identification of a novel antibody associated with autoimmune pancreatitis // N Engl J Med. 2009. Vol.361, N 22. P. 2135-2142. doi: 10.1056/NEJMoa0903068.
Fujinami R. S., Oldstone M. B. Amino acid homology between the encephalitogenic site of myelin basic protein and virus: mechanism for autoimmunity // Science. 1985. Vol. 230. P. 1043-1045.
Furukawa H., Oka S., Shimada K. et al. Association of Human Leukocyte Antigen with Interstitial Lung Disease in Rheumatoid Arthritis: A Protective Role for Shared Epitope // PLoS ONE. 2012. Vol. 7, N 5. P. e33133. doi: 10.1371/journal.pone.0033133.
Garg G., Tyler J. R., Yang J. H. et al. Type 1 diabetes-associated IL2RA variation lowers IL-2 signaling and contributes to diminished CD4+CD25+ regulatory T cell function // J. Immunol. 2012. Vol. 188, N 9. P. 4644-4653. doi: 10.4049/jimmunol.1100272.
Goodman W. A., Levine A. D., Massari J. V. et al. IL-6 signaling in psoriasis prevents immune suppression by regulatory T cells // J. Immunol. 2009. Vol. 183, N 5. Р. 3170–3176. doi: 10.4049/jimmunol.0803721.
Guarneri F, Guarneri C, Benvenga S. Helicobacter pylori and autoimmune pancreatitis: role of carbonic anhydrase via molecular mimicry? // J Cell Mol Med. 2005. Vol. 9, N 3. P. 741-744.
Habibagahi M, Habibagahi Z, Jaberipour M, Aghdashi A. Quantification of regulatory T cells in peripheral blood of patients with systemic lupus erythematosus // Rheumatol Int. 2011. Vol. 31, N 9. P. 1219-1225. doi: 10.1007/s00296-010-1427-0.
Halenius A., Hengel H. Human cytomegalovirus and autoimmune disease // Biomed Res Int. 2014. P.1-15. doi: 10.1155/2014/472978.
Han G. M., O’Neil-Andersen N. J., Zurier R. B., Lawrence D. A. CD4+CD25high T cell numbers are enriched in the peripheral blood of patients with rheumatoid arthritis // Cell Immunol. 2008. Vol. 253, N 1-2. P. 92–101. doi: 10.1016/j.cellimm.2008.05.007.
Hasham A., Tomer Y. Genetic and epigenetic mechanisms in thyroid autoimmunity // Immunol Res. 2012. Vol. 4, N 1-3. P. 204-213. doi: 10.1007/s12026-012-8302-x.
Hiemstra H. S., Schloot N. C., van Veelen P. A. et al. Cytomegalovirus in autoimmunity: T cell crossreactivity to viral antigen and autoantigen glutamic acid decarboxylase // Proc Natl Acad Sci USA. 2001. Vol. 98, N 7. P. 3988-3991.
Hirano T. Interleukin 6 in autoimmune and inflammatory diseases: a personal memoir // Proc Jpn Acad Ser B Phys Biol Sci. 2010. Vol. 86, N 7. P. 717-730.
Honeyman M. C., Stone N. L., Falk B. A., et al. Evidence for molecular mimicry between human T cell epitopes in rotavirus and pancreatic islet autoantigens // J Immunol. 2010. Vol. 184, N 4. P. 2204-2210. doi: 10.4049/jimmunol.0900709.
Islander U., Andersson A., Lindberg E. et al. Superantigenic Staphylococcus aureus stimulates production of interleukin-17 from memory but not naive T cells // Infect Immun. 2010. Vol. 78, N 1. P. 381–386. doi: 10.1128/IAI.00724-09.
Jacobsen J. T., Lunde E, Sundvold-Gjerstad V. et al. The cellular mechanism by which complementary Id+ and anti-Id antibodies communicate: T cells integrated into idiotypic regulation // Immunol Cell Biol. 2010. Vol. 88, N 5. P. 515–522. doi: 10.1038/icb.2009.118.
Jailwala P., Waukau J., Glisic S. et al. Apoptosis of CD4+ CD25(high) T cells in type 1 diabetes may be partially mediated by IL-2 deprivation // PLoS ONE. 2009. Vol. 4, N 8. e6527. doi: 10.1371/journal.pone.0006527.
James J.A., Harley J. B. Linear epitope mapping of an Sm B/B’ polypeptide // J. Immunol. 1992. Vol. 148, N 7. P. 2074–2079.
James, E. A., Moustakas A. K., Bui J. et al. HLA–DR1001 presents «altered-self» peptides derived from joint associated proteins by accepting citrulline in three of its binding pockets // Arthritis Rheum. 2010. Vol. 62, N 10. P.2909-2918. doi: 10.1002/art.27594.
Jerne N. K. Idiotypic Networks and Other Preconceived Ideas // Immunol Rev. 1984. N. 79. P. 5-24.
Johnson K., Wong R., Barriga K. J. et al. rs11203203 is associated with type 1 diabetes risk in population pre-screened for high-risk HLA-DR,DQ genotypes // Pediatric Diabetes. 2012. Vol. 13, N 8. P. 611–615. doi: 10.1111/j.1399-5448.2012.00888.x.
Kawashighri S. Y., Kawakami A., Okada A, et al. CD4+CD25highCD127low/-Treg cell frequency from peripheral blood correlates with disease activity in patients with rheumatoid arthritis // J Rheumatol. 2011. Vol. 38, N 12. P. 2517–2521. doi: http://dx.doi.org/10.3899/jrheum.110283.
Kim J. R., Chae J. N., Kim S. H., Ha J. S. Subpopulations of regulatory T cells in rheumatoid arthritis, systemic lupus erythematosus, and Behcet’s disease // J Korean Med Sci. 2012. Vol. 27, N 9. P. 1009-1013. doi: 10.3346/jkms.2012.27.9.1009.
Kinloch A. J., Alzabin S., Brintnell W. et al. Immunization with Porphyromonas gingivalis enolase induces autoimmunity to mammalian α-enolase and arthritis in DR4-IE-transgenic mice // Arthritis Rheum. 2011. Vol. 63, N 12. P. 3818- 3823. doi: 10.1002/art.30639.
Klatt T., Ouyang Q., Flad T. et al. Expansion of peripheral CD8+ CD28- T cells in response to Epstein-Barr virus in patients with rheumatoid arthritis // J Rheumatol. 2005. Vol. 32, N 2. P. 239-251.
Knevel R., de Rooy D. P., Zhernakova A. et al. Association of variants in IL2RA with progression of joint destruction in rheumatoid arthritis // Arthritis Rheum. 2013. Vol. 65, N 7. P. 1684-1693. doi: 10.1002/art.37938.
Komatsu N., Mariotti-Ferrandiz M. E., Wang Y. et al. Heterogeneity of natural Foxp3+ T cells: a committed regulatory T-cell lineage and an uncommitted minor population retaining plasticity // Proc Natl Acad Sci USA. 2009. Vol. 106, N 6. P. 1903-1908. doi: 10.1073/pnas.0811556106.
Komatsu N., Okamoto K., Sawa S. et al. Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis // Nat Med. 2014. Vol. 20, N 1. P. 62-68. doi: 10.1038/nm.3432.
Krzysztalowska-Wawrzyniak M., Ostanek M., Clark J. et al. The distribution of human endogenous retrovirus K-113 in health and autoimmune diseases in Poland // Rheumatology (Oxford). 2011. Vol. 50, N 7. P. 1310-1314. doi: 10.1093/rheumatology/ker022.
Lang H. L., Jacobsen H., Ikemizu S., et al. A functional and structural basis for TCR cross-reactivity in multiple sclerosis // Nat Immunol 2002. Vol. 3, N 10. P. 940-943.
Larsson H. E., Jönsson I., Lernmark A. et al. Decline in titers of anti-idiotypic antibodies specific to autoantibodies to GAD65 (GAD65Ab) precedes development of GAD65Ab and type 1 diabetes // PLOS ONE. 2013. Vol. 8, N 6. P. e65173. doi: 10.1371/journal.pone.0065173.
Lee Y. H., Bae S. C., Choi S. J. et al. The association between the PTPN22 C1858T polymorphism and rheumatoid arthritis: a meta-analysis update // Mol. Biol. Rep. 2012. Vol. 39, N 4. P. 3453-3460. doi: 10.1007/s11033-011-1117-3.
Lee Y. H., Kim J. H., Seo Y. H. et al. CTLA-4 polymorphisms and susceptibility to inflammatory bowel disease: a meta-analysis // Hum Immunol. 2014. Vol. 75, N 5. P. 414–421. doi: 10.1016/j.humimm.2014.02.020.
Lee Y.H., Choi S.J., Ji J.D., Song G.G. The association between the PTPN22 C1858T polymorphism and systemic sclerosis: a meta-analysis // Mol. Biol. Rep. 2012. Vol. 39, N 3. P. 3103-3108. doi: 10.1007/s11033-011-1074-х.
Levin L. I., Munger K. L., O’Reilly E. J. et al. Primary infection with the Epstein-Barr virus and risk of multiple sclerosis // Ann Neurol. 2010. Vol. 67, N 6. P. 824–830. doi: 10.1002/ana.21978.
Li N., Ma T., Han J. et al. Increased apoptosis induction in CD4+CD25+ Foxp3+ T cells contributes to enhanced disease activity in patients with rheumatoid arthritis through IL-10 regulation // Eur Rev Med Pharmacol Sci. 2014. Vol. 18, N 1. P. 78–85.
Li S., Yu Y., Yue Y. et al. Microbial Infection and Rheumatoid Arthritis // J Clin Cell Immunol. 2013. Vol. 4, N 6. P.174.
Liang B., Gardner D., Griswold D.E. et al. Anti-interleukin-6 monoclonal antibody inhibits autoimmune responses in a murine model of systemic lupus erythematosus // Immunology. 2006. Vol. 119, N 3. P. 296–305.
Liberal R., Grant C. R., Mieli-Vergani G., Vergani D. Autoimmune hepatitis: A comprehensive review // J Autoimmun. 2013. Vol. 4. P. 126-139. doi: 10.1016/j.jaut.2012.11.002.
Lin S. C., Chen K. H., Lin C. H. et al. The quantitative analysis of peripheral blood FOXP3-expressing T cells in systemic lupus erythematosus and rheumatoid arthritis patients // Eur J Clin Invest. 2007. Vol. 37, N 12. P. 987-996.
Lindsey J. W., Hatfield L. M., Crawford M. P., Patel S. Quantitative PCR for Epstein-Barr virus DNA and RNA in multiple sclerosis // Mult. Scler. 2009. Vol. 15, N 2. P. 153–158. doi: 10.1177/1352458508097920.
Long S. A., Cerosaletti K., Bollyky P. L. et al. Defects in IL-2R signaling contribute to diminished maintenance of FOXP3 expression in CD4+CD25+ regulatory T-cells of type 1 diabetic subjects // Diabetes. 2010. Vol. 59, N 2. P. 407–415. doi: 10.2337/db09-0694.
Lucas R. M., Ponsonby A. L., Dear K. et al. Current and past Epstein-Barr virus infection in risk of initial CNS demyelination // Neurology. 2011. Vol. 77, N 4. P. 371–379. doi: 10.1212/WNL.0b013e318227062a.
Lundberg K., Kinloch A., Fisher B. A., et al. Antibodies to citrullinated alpha-enolase peptide 1 are specific for rheumatoid arthritis and cross-react with bacterial enolase // Arthritis Rheum. 2008. Vol. 58, N 10. P. 3009-3019. doi: 10.1002/art.23936.
Lünemann J. D., Jelcić I., Roberts S., et al. EBNA1-specific T cells from patients with multiple sclerosis cross react with myelin antigens and co-produce IFN-gamma and IL-2 // J Exp Med.. 2008. Vol. 205, N 8. P. 1763–1773. doi: 10.1084/jem.20072397.
Maier L. M., Lowe C. E., Cooper J. et al. IL2RA genetic heterogeneity in multiple sclerosis and type 1 diabetes susceptibility and soluble interleukin-2 receptor production // PLoS Genet. 2009. Vol. 5, N 1. P. e1000322. doi: 10.1371/journal.pgen.1000322.
Malek T. R., Castro I. Interleukin-2 receptor signaling: at the interface between tolerance and immunity // Immunity. 2010. Vol. 33, N 2. P. 153-165. doi: 10.1016/j.immuni.2010.08.004.
Martinez-Forero I., Garcia-Munoz R., Martinez-Pasamar S. et al. IL-10 suppressor activity and ex vivo Tr1-cell function are impaired in multiple sclerosis // Eur J Immunol. 2008. Vol. 38, N 2. P. 576–586. doi: 10.1002/eji.200737271.
Martinez-Martinez R. E., Abud-Mendoza C., Patiño-Marin N. et al. Detection of periodontal bacterial DNA in serum and synovial fluid in refractory rheumatoid arthritis patients // J Clin Periodontol. 2009. Vol. 36, N 12. P. 1004-1010. doi: 10.1111/j.1600-051X.2009.01496.x.
Ссылки
© Труды КарНЦ РАН, 2014-2019