в гипоталамо гипофизарной системе частью головного мозга является
Заболевания гипоталамо-гипофизарной системы
Особенностью эндокринной системы является множество функциональных связей между эндокринными органами. Ярким примером служит гипоталамо-гипофизарная система.
Гипоталамус и его гормоны:
Заболевания гипоталамуса:
Заболевания гипоталамуса встречаются крайне редко. Чаще всего это нарушения полового развития (ускоренное или замедленное половое развитие) и несахарный диабет – заболевание, симптомами которого является жажда и обильное частое мочеиспускание. Патология гипоталамуса может быть заподозрена на основании характерных симптомов и подтверждена гормональным, а при необходимости и генетическим обследованием.
Гипофиз:
Гормоны гипофиза:
В гипофизе вырабатываются следующие гормоны:
Заболевания гипофиза:
В конечном итоге это может приводить к гипофункции, гиперфункции гипофиза, а иногда к масс-эффекту.
Масс-эффект:
Масс-эффект крупной опухоли гипофиза обуславливает нарушение зрения (вследствие сдавления перекреста зрительных нервов) и головные боли. При подозрении на нарушение полей зрения из-за опухоли гипофиза может потребоваться консультация офтальмолога. Для диагностики наличия образования используется МРТ хиазмально-селлярной области с контрастированием.
Гиперфункция гипофиза:
Гипофункция гипофиза:
При гипофункции гипофиза развивается гипогонадизм (снижение половой функции), вторичная надпочечниковая недостаточность (снижение артериального давления, похудание, снижение уровня глюкозы), вторичный гипотиреоз – снижение функции щитовидной железы (ломкость волос и ногтей, сонливость, отеки). У детей также может наблюдаться задержка роста и полового развития.
Диагностика и лечение:
Заболевание гипофиза может быть заподозрено на приеме эндокринолога при подробном расспросе и осмотре пациента, после чего, при необходимости, назначаются гормональные и инструментальные обследования. Зачастую первичная диагностика заболеваний гипофиза проводится по уровню гормона на периферическом уровне (например, при подозрении на болезнь Иценко-Кушинга исключается избыток кортизола, гормона надпочечников). Стоит отметить, что при исследовании уровня многих гормонов (пролактина, кортизола, АКТГ и т.д) нужно соблюдать определенные правила, так как значения этих гормонов значимо изменяются в зависимости от времени суток, менструального цикла и других условий. При дальнейшей диагностике могут потребоваться функциональные пробы (например, проба с дексаметазоном при диагностике Болезни Иценко-Кушинга).
Диагностика и лечение заболеваний гипофиза
Гипофизом называют маленькую железу, расположенную в нижней части головного мозга, в костном кармане (так называемом турецком седле). Это центральный орган эндокринной системы. В нем синтезируются гормоны, влияющие на метаболизм, рост и репродуктивную функцию. Гипофиз тесно связан с другой областью мозга — гипоталамусом, с которым образует гипоталамо-гипофизарную систему, регулирующую большинство функций организма.
Основные причины патологий гипофиза
Причины снижения синтеза гормонов гипофиза:
Основной причиной усиленного синтеза является аденома гипофиза. Клетки этой доброкачественной опухоли продуцируют в избытке определенные гормоны. При этом опухоль сдавливает гипофиз, что может приводить к снижению синтеза других гормонов.
Наиболее распространенные заболевания гипофиза
Чаще всего нарушение работы гипофиза связано с доброкачественными опухолями – аденомами. Такие опухоли могут быть гормонально активными и продуцировать определенные гормоны, либо гормонально неактивными и ничего не продуцировать. Клинически данная патология проявляется по-разному в зависимости от того, какие именно гормоны продуцирует опухоль или вообще ничего не продуцирует, а также в зависимости от размера опухоли. Опухоль может усиливать выработку одних гормонов гипофиза и подавлять синтез других, что приводит к гормональному сбою в организме. В ряде случаев патологический процесс протекает бессимптомно, поэтому новообразование в гипофизе обнаруживается случайно при выполнении МРТ или КТ головного мозга.
Это заболевание развивается, когда у детей и подростков синтезируется слишком много соматотропина. В этом возрасте зона роста на концах костей еще не закрыта, поэтому они начинают усиленно расти в длину. У человека с гигантизмом высокий рост (от 195 сантиметров и выше), длина конечностей увеличена. Вслед за костной тканью начинают расти и мышцы. Для их нормальной работы требуется усиление кровоснабжения, сердце не справляется с возросшими нагрузками, в результате у человека развиваются сердечно-сосудистые заболевания. Кроме этого, при гигантизме часто наблюдается недоразвитие половых органов.
Заболевание обычно возникает у людей в возрасте 30–50 лет и связано с повышенным синтезом соматотропного гормона. В этом возрасте такое повышение уже не влияет на рост костей в длину, так как зона роста закрыта. Поэтому костная ткань начинает разрастаться в ширину, что приводит к деформации и утолщению частей тела, в особенности конечностей. Черты лица становятся грубыми, челюсть массивной. Темнеет и грубеет кожа, могут увеличиться размеры языка, голос становится хриплым, зрение снижается. В результате увеличения размеров сердца развивается сердечная недостаточность. Патологические изменения развиваются медленно, поэтому в течение долгого времени остаются незаметными.
Возникает при нехватке соматотропного гормона в детском возрасте. У женщин, страдающих нанизмом, рост не превышает 120 сантиметров, у мужчин — 130 сантиметров.
Болезнь Иценко — Кушинга
Это целый комплекс симптомов, вызванных избыточным синтезом адренокортикотропного гормона (АКТГ) гипофизом, который в свою очередь стимулирует усиленную выработку глюкокортикоидных гормонов надпочечниками. Основные признаки данного патологического состояния: ожирение верхней части тела (конечности при этом остаются тонкими), отечное «лунообразное» лицо, тонкая кожа, снижение мышечной массы, склонность к синякам, растяжки на коже. Постепенно развиваются сопутствующие заболевания: остеопороз, артериальная гипертензия, нарушение толерантности к глюкозе и сахарный диабет.
Это резкое снижение функции аденогипофиза у женщин после родов, которое возникает в результате некроза гипофиза. Отмирание тканей происходит из-за сложных родов с сильными кровотечениями, в результате чего резко падает артериальное давление и снижается объем циркулирующей крови. Лактация при синдроме Шихана не наступает, у женщины развивается кахексия, возможно выпадение волос в подмышечной области и на лобке, а также возможно развитие острой надпочечниковой недостаточности, проявляющейся резким снижением артериального давления, тошнотой, рвотой, слабостью, учащенным сердцебиением. Без своевременного оказания помощи это состояние может закончиться летальным исходом.
Заболевание, которое развивается вследствие недостаточной секреции антидиуретического гормона (вазопрессина) задней долей гипофиза. Причиной данного заболевания могут быть опухоли гипофиза и гипоталамуса, нарушение кровоснабжения в гипоталамо-гипофизарной области, черепно-мозговая травма.
Проявляется данное заболевание жаждой, учащенным мочеиспусканием и электролитными расстройствами.
Если опухоль гормонально неактивная, но при этом достаточно крупная (более 1-2 см), то на первый план могут выходить следующие симптомы: головные боли, жажда, полное или частичное выпадение полей зрения.
Диагностика патологий гипофиза включает следующие этапы:
При необходимости врач может назначить дополнительные исследования.
Методы лечения
Терапия патологий гипофиза может быть консервативной либо оперативной. При пониженном синтезе гормонов гипофиза показана заместительная гормональная терапия, которая, как правило, является пожизненной. При избыточном синтезе пациенту может быть предложено оперативное лечение, либо назначают препараты, подавляющие активность или выработку целевого гормона.
При аденоме и других новообразованиях обычно показано оперативное лечение. Кроме этого, для купирования симптомов заболевания и подавления роста новообразования по показаниям применяют лучевую терапию. При некоторых видах гормонозависимых аденом, а также при наличии противопоказаний к оперативному лечению применяют лекарственную терапию, что помогает подавить гормональную гиперсекрецию, а в некоторых случаях приводит к уменьшению опухоли в размерах. Гормонально неактивные опухоли малых размеров без симптомов сдавления зрительных нервов требуют динамического наблюдения без применения оперативного лечения.
Нарушения в работе гипофиза представляют серьезную опасность для здоровья человека и могут привести к развитию целого ряда тяжелых заболеваний. Своевременная диагностика и правильное лечение — вот залог долголетия и крепкого здоровья.
В гипоталамо гипофизарной системе частью головного мозга является
Гипофиз — это небольшая шаровидной или овальной формы железа внутренней секреции, расположена в турецком седле и находится непосредственно под головным мозгом. Гипофиз связан с диэнцефальной областью посредством гипофизарной ножки, проходящей через отверстие в складке твердой мозговой оболочки, которая закрывает вход в полость турецкого седла. Далее твердая мозговая оболочка опускается в турецкое седло, сливаясь там с надкостницей и гипофизарной капсулой.
Мягкая и паутинная оболочки головного мозга доходят только до диафрагмы турецкого седла и не имеют дальнейшего продолжения в его ямке. У человека длина гипофиза составляет 10 мм, ширина 12,5 мм, высота 5—6 мм, вес колеблется от 0,55 до 0,65 г. Во время беременности гипофиз значительно увеличивается в размере и после родов полного возврата к исходному весу не происходит. Размер гипофиза нередко значительно увеличивается при недостаточности периферических желез внутренней секреции: щитовидной железы, яичек, яичников и др.
У людей в возрасте до 40 лет вес гипофиза увеличивается, а после 40 лет уменьшается.
Гипофиз разделяют на адсногипофиз и нейрогипофиз.
Аденогипофиз включает в себя туберальную часть, дистальную и промежуточную части. К нейрогипофизу относят инфундибулярный отросток, воронку и срединное возвышение (согласно терминологии Международной комиссии по анатомической номенклатуре).
Гистологически аденогипофиз представлен хромофобными, эозинофильными и базофильными клетками, которые при сложных методах окраски подразделяются на более тонкие структуры. С последними связывают секрецию тех или иных тройных гормонов. В то же время существует мнение, что в зависимости от функционального состояния аденогипофиза одни и те же клетки могут продуцировать различные тройные гормоны.
Хромофобные клетки не дифференцированы. Они являются материалом для других, диференцированных, гормональноактивных клеток.
Эозинофильные клетки составляют примерно 30— 35% железистых клеток аденогипофиза. Круглые ядра этих клеток занимают в основном центральное положение. В цитоплазме хорошо выражены митохондрии и сетчатый аппарат Гольджи.
В периферических отделах передней доли гипофиза преобладают базофильные клетки, а в центральных — эозинофильные.
Соотношение клеток различного типа в передней доле гипофиза может зависеть от пола, возраста и функционального состояния железы. У мужчин и женщин преобладают эозинофильпые и базофильные клетки и в меньшем числе у них находят хромофобные и амбофильные клетки.
Средняя доля гипофиза состоит из мелких фолликулов, заполненных коллоидом, и отдельных мелких кист (остатки полости гипофизарного кармана). Нейрогипофиз представлен нервными клетками, сосудами, нейроглиальными и эпендимальными волокнами, клетками-питуицитами и тельцами Герринга. Аденогипофиз секретирует тропные гормоны: АКТГ, СТГ (гормон роста), ФСГ, ЛГ, ЛТГ (пролактим) и ТТГ. В промежуточной его доле образуется, по мнению многих авторов, мела-ноформный гормон (интермедии) —МСГ.
Из передней доли гипофиза также получены жиромобилизующий фактор, влияющий на жировой обмен, экзофтальмический и эритропоэтический факторы.
Все тропные гормоны аденогипофиза оказывают эффект через периферические эндокринные железы, кроме гормона роста (СТГ), оказывающего влияние непосредственно на обмен тканей и клеток организма.
Гормон роста обладает анаболическим действием в отношении белкового обмена, стимулирует рост эпифизарных хрящей, оказывает диабетогенный эффект, а также влияет на жировой и кальциево-фосфорпый обмен. Он обладает выраженной видовой специфичностью. В последнее время доказано, что инскреция гормона роста стимулируется витамином B12, особенно в комбинации с фолиевой кислотой.
Заболевания гипоталамо-гипофизарной системы
Широта методов диагностики, тщательно подобранное лечение. Запишитесь на прием в клинику.
Скидка 500 ₽!
При записи на лечение к специалистам Группы клиник Диадент в «горящие» окна текущего дня (не распространяется на консультации). Список «горящих» окон уточняйте у администраторов.
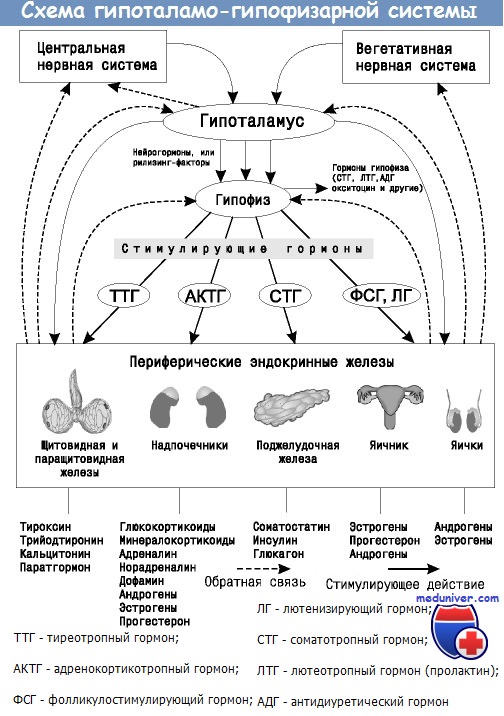
Гипоталамо-гипофизарной системой называют комплекс структур, состоящий из двух отделов и их соединения. Компонентами данной системы являются гипофиз, гипоталамус и ножка.
Гипофиз представляет собой располагающийся в области турецкого седла нижний мозговой придаток, являющийся центральным органов эндокринной системы человеческого организма.
Гипоталамус, расположенный выше гипофиза и ниже таламуса, представляет собой часть отдела промежуточного мозга, несущую ответственность за работу вегетативной функции. Ножка, или подъём, представляет собой зону, соединяющую гипоталамус с гипофизом.
Гипоталамо-гипофизарная система связывает нервную и эндокринную системы организма между собой, осуществляя регулировку синтеза гормонов, без которых невозможна корректная работа многих органов. Каждый из отделов, входящих в комплекс системы, вырабатывает особый тип гормонов, которые оказывают непосредственное влияние на деятельность органов и систем.
За что отвечают гормоны гипофиза и гипоталамуса?
Гормоны гипофиза и гипоталамуса тесно взаимодействуют между собой. Именно от их взаимодействия зависят такие функции нашего организма, как:
Гормоны гипоталамо-гипофизарной системы
Основная функция гипофиза – выработка гормонов, участвующих в регуляции деятельности периферических эндокринных желез. Эти гормоны несут ответственность за репродуктивные функции, рост тканей, обменные процессы в организме, обеспечивают нормальное функционирование щитовидной железы.
Гипоталамус вырабатывает рилизинг-гормоны, либерины и статины, осуществляющие поддержку работы надпочечников, щитовидной и поджелудочной желез и половой системы, а также участвующих в процессах регуляции температуры тела и поддержке нормальной работы внутренних органов.
Любые нарушения в работе гипоталамо-гипофизарной системы могут обернуться крайне негативными последствиями, вплоть до летального исхода. К сожалению, довольно часто патологии этой системы развиваются скрыто, проявляясь лишь в виде сопутствующих заболеваний, который, на первый взгляд, не имеют отношения к работе эндокринной и нервной систем.
Узнайте стоимость лечения на бесплатной консультации по телефону +7 (812) 40-000-60
Мы предлагаем Вам множество способов оплаты услуг клиники для физических и юридических лиц: наличным и безналичным расчётом, картой или с помощью сертификата.
Записывайтесь на прием, и он пройдет в точно назначенное время.
В Диадент разработана совершенная система безопасности, которая сводит риск заболеваний (защита от ВИЧ, гепатита и других болезней) к нулю.
Диагностика и лечение заболеваний гипоталамо-гипофизарной системы
Комплексное обследование может включать в себя:
Только получив точные данные о состоянии всей системы в целом и каждого из её компонентов в отдельности, врач-эндокринолог может безошибочно поставить диагноз и назначить соответствующее лечение, которое позволит нормализовать работу гипофиза, гипоталамуса и всего организма.
Для оценки функционирования системы, производится анализ крови на комплекс гормонов, участвующих в функциональной связи её элементов. При подозрении на развитие гормонально-неактивных аденом применяется анализ сыворотки крови на концентрацию хромогранинов.
Лечение заболеваний гипоталамо-гипофизарной системы строго индивидуально, напрямую зависит от поставленного диагноза и сопутствующих факторов, таких, как степень и тяжесть заболевания, наличие аллергических реакций, непереносимость определённых медикаментов, пол и возраст пациента и т.д.
При этом важно помнить, что чем раньше начато лечение, тем более низкой будет вероятность развития серьёзных осложнений, зачастую представляющих серьёзную угрозу для жизни пациента.
Узнайте стоимость лечения на бесплатной консультации по телефону +7 (812) 40-000-60
Для оценки функционирования системы, производится анализ крови на комплекс гормонов, участвующих в функциональной связи её элементов. При подозрении на развитие гормонально-неактивных аденом применяется анализ сыворотки крови на концентрацию хромогранинов.
Лечение заболеваний гипоталамо-гипофизарной системы строго индивидуально, напрямую зависит от поставленного диагноза и сопутствующих факторов, таких, как степень и тяжесть заболевания, наличие аллергических реакций, непереносимость определённых медикаментов, пол и возраст пациента и т.д. При этом важно помнить, что чем раньше начато лечение, тем более низкой будет вероятность развития серьёзных осложнений, зачастую представляющих серьёзную угрозу для жизни пациента.
В гипоталамо гипофизарной системе частью головного мозга является
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
Организация и функционирование нейроэндокринной системы
Журнал: Проблемы эндокринологии. 2013;59(1): 62-69
Бабичев В. Н. Организация и функционирование нейроэндокринной системы. Проблемы эндокринологии. 2013;59(1):62-69.
Babichev V N. Organization and functioning of the neuroendocrine system. Problemy Endokrinologii. 2013;59(1):62-69.
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
Достижения нейроэндокринологии в последние годы дали возможность сформулировать цельное представление о системном подходе к лечению эндокринных заболеваний. В обзоре приведены экспериментальные и клинические доказательства присутствия в гипоталамусе специфических рецепторов к гормонам периферических эндокринных желез и тропным гипофизарным гормонам. Продукция гипоталамусом специфических веществ (рилизинг-гормонов) обеспечивает связь нервных и эндокринных структур. Прямые и обратные связи в организме способствуют устойчивой работе всех систем организма.
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
Эндокринная система вместе с нервной составляет единое целое. Объединяющим и координирующим центром нейроэндокринной системы является область промежуточного мозга — гипоталамус, который не только проводит нервные импульсы, но и секретирует различные физиологические вещества [1].
Гипоталамус расположен на основании мозга и ограничен спереди перекрестом зрительных нервов, сзади — маммилярными телами, по бокам — расходящимися трактами зрительных нервов. Сверху в гипоталамическую область внедряется третий желудочек мозга, превращая гипоталамус в парный орган с симметричным расположением клеточных образований. В основании гипоталамуса располагается срединное возвышение, переходящее в ножку гипофиза.
Эндокринные функции гипоталамуса осуществляют преимущественно его передняя и медиальная части. Нервные клетки гипоталамуса группируются в многочисленные ядра, часть которых обладает секреторными свойствами. Крупноклеточные ядра переднего гипоталамуса (супраоптические и паравентрикулярные) связаны нервными волокнами с задней долей гипофиза. Многочисленные ядра медиобазального и части заднего гипоталамуса, часть паравентрикулярных, вентромедиальные и аркуатные — продуцируют нейросекрет в систему воротных вен гипофиза. Многочисленные комиссуральные пути гипоталамуса обеспечивают взаимодействие между нейроэндокринными ядрами. Нервные клетки паравентрикулярных и аркуатных ядер имеют многочисленные контакты с вышележащими структурами ЦНС.
Роль гипоталамуса в регуляции эндокринных функций была выяснена в 1955 г. Гиллемин впервые показал, что гипоталамический экстракт при введении его животным стимулирует секрецию гипофизом АКТГ. В 60-х годах XX века интенсивно исследовали влияние экстрактов гипоталамуса и срединного возвышения на секрецию гипофизом гормона роста (соматотропин, СТГ) и тиреотропного гормона (тиреотропин, ТТГ). Благодаря достижениям аналитической химии пептидов, разработке радиоиммунологических методов определения гормонов, развитию техники культивирования клеток сделан революционный скачок в исследованиях гипоталамической регуляции функций эндокринной системы.
Наличие в гипоталамусе специфических рецепторов к периферическим гормонам эндокринных желез и тропным гипофизарным гормонам определяет его особое положение в системах обратной связи. В гипоталамусе происходит переключение информации с нервно-медиаторного на нейрогормональный путь, которой составляют либерины и статины: кортиколиберин (АКТГ-рилизинг гормон, КРГ), люлиберин (гонадолиберин, ЛГ/ФСГ-рилизинг-гормон, ГнРГ), тиролиберин (ТРГ), соматолиберин (РГГР), соматостатин, меланолиберин, а также дофамин (ДА) и энкефалины, оказывающие влияние на функции гипофиза.
Гипоталамус является высшим вегетативным центром, осуществляющим сложную интеграцию и различных внутренних систем. В организме нет ни одной функции, к регуляции которой гипоталамус не имел бы отношения: он играет существенную роль в поддержании оптимального уровня обмена веществ (белкового, углеводного, жирового, водного и минерального) и энергии, в регуляции температурного баланса организма, деятельности пищеварительной, сердечно-сосудистой, выделительной, дыхательной и эндокринной систем.
Нейроэндокринологи имеют полное право рассматривать гипоталамус как главный нейроэндокринный орган, который осуществляет взаимосвязь между ЦНС и железами внутренней секреции. Он является интегрирующим звеном, пультом управления, на котором замыкаются все пути между ЦНС и эндокринной системой. Естественно, возникает вопрос, каким образом маленькая структура промежуточного мозга справляется со столь многочисленными функциями.
Для эндокринологов, в первую очередь, важен вопрос о регуляции гормональной системы.
Связь между гипофизом, который является основным продуцентом всех тропных гормонов (АКТГ, ТТГ, ЛГ, ФСГ, СТГ, пролактин) и гипоталамусом осуществляется через портальную систему сосудов, а также через гипоталамо-гипофизарный тракт — самый короткий, но хорошо очерченный пучок аксонов нейронов гипоталамуса. Волокна их берут начало в супраоптическом и паравентрикулярных ядрах и проходят через гипофизарную ножку к нейрогипофизу.
Биохимиками было показано существование в гипоталамусе специфических веществ, которые синтезируются нервными клетками и освобождаются в капилляры портальной системы, достигая передней доли гипофиза. На сегодняшний день выделено и охарактеризовано более 10 гипоталамических нейрогормонов, каждый из которых обладает специфическим влиянием (стимуляцией или торможением) секреции того или иного тропного гормона гипофиза. Такие соединения получили название ингибирующих и рилизинг-гормонов (либерины и статины), обладающие высокой специфичностью действия и чрезвычайно высокой биологической активностью. Установлена и подтверждена химическим синтезом их структура.
Основной точкой приложения гипоталамических рилизинг-гормонов являются клетки гипофиза, и некоторое время считалось, что каждый гормон стимулирует один тип клеток аденогипофиза, который в свою очередь синтезирует лишь один тропный гормон.
В дальнейшем было показано, что в ряде случаев гипоталамические гормоны стимулируют секрецию нескольких гипофизарных гормонов. Например, ТРГ усиливает выделение и ТТГ, и ПРЛ. ГнРГ способствует секреции ЛГ и ФСГ; соматостатин угнетает секрецию и гормона роста, и ТТГ. Каждый клеточный элемент аденогипофиза подвергается действию многих регуляторных факторов, и клетки в аденогипофизе не строго специализированы: в одной клетке могут синтезироваться несколько гормонов, например ЛГ и ФСГ, АКТГ и β-липотропин, СТГ и ПРЛ, но не ТТГ или ЛГ. Бифункциональность некоторых гормонов объясняется по-разному. Способность ГнРГ вызывать секрецию как ЛГ, так и ФСГ, причем несовпадающую по времени, определяется разной чувствительностью гонадотрофов, секретирующих ЛГ или ФСГ, а также длительностью воздействия с учетом влияния половых стероидов на гипофизарные клетки в разные стадии полового цикла. Большие концентрации эстрогенов в плазме, предшествующие овуляторному выбросу ЛГ, увеличивают чувствительность гипофиза к ГнРГ, а минимальные количества эстрогенов и прогестерона, секретируемого после овуляции, напротив, снижают эту чувствительность. Секреция ФСГ более чувствительна к ингибирующему эффекту эстрогенов. Нельзя исключить наличие в аденогипофизе и двух видов рецепторов. Одни из них характеризуются высоким сродством к ГнРГ и низкой связывающей способностью; за их счет осуществляется быстрая секреция ЛГ; вторые — более низким сродством к ГнРГ, но большей силой связывания, что и определяет более медленное освобождение ФСГ. Возможно существование двух различных нейрогормонов — ЛГ-РГ и ФСГ-РГ.
Анатомия и физиология гипофиза
Гипофиз расположен в турецком седле в основании черепа. Сверху он отделен от мозга выростом твердой мозговой оболочки. Гипофиз состоит из трех долей: передней, задней и средней (промежуточной). Последняя, как правило, анатомически не обособлена и вместе с передней входит в состав аденогипофиза, который составляет около 80% массы железы; задняя доля — нейрогипофиз — анатомически и функционально объединена со срединным возвышением, являющимся частью гипоталамуса. Аденогипофиз образуется из задней стенки ротовой полости зародыша (карман Ратке), задняя доля — из дивертикула дна третьего желудочка мозга.
Структурно-функциональная связь гипофиза с гипоталамусом осуществляется нервным и гуморальным путем. Нервные волокна из крупноклеточных гипофизотропных ядер гипоталамуса (паравентрикулярного и супраоптического) через срединное возвышение и ножку гипофиза достигают задней его доли. По аксонам этих клеточных ядер в заднюю долю гипофиза поступают окситоцин и вазопрессин. На стенках капилляров срединного возвышения оканчиваются терминали пептидергических волокон. Аксоны гипоталамических нейронов, идущие к аденогипофизу, прерываются на уровне срединного возвышения, где и происходит секреция гипоталамических статинов и либеринов.
Нейрогормоны попадают в переднюю долю гипофиза с кровотоком по системе воротных вен гипофиза. Стенки каппиляров, образуемых ветвями верхних гипофизарных артерий в срединном возвышении, проницаемы для рилизинг-гормонов. Концентрация последних в крови воротных вен гипофиза во много раз выше, чем в периферической крови.
Кровоток через переднюю долю гипофиза значительнее, чем через любой другой орган, что, наряду с высоким содержанием нейрогормонов в крови сосудов гипофиза, создает оптимальные условия для регуляции функций аденогипофиза и зависимых от него эндокринных желез. Задняя доля гипофиза снабжается кровью нижних гипофизарных артерий.
Являясь анатомически целостным органом, гипофиз образован двумя онтогенетически разными образованиями: передним (железистым) и задним (нервным). Клетки аденогипофиза разделяются по своей гистологической окраске на базофилы, ацидофилы (эозинофилы), хромофобы. Однако выявление специализированных клеток—лактотрофов, тиреотрофов, соматотрофов, кортикотрофов, гонадотрофов, продуцирующих соответствующие гормоны, осуществляется иммуноцитохимическим методом, выявляющим специализацию клеток с помощью высокоспецифических антител к конкретному гормону. Большую часть популяции аденогипофизоцитов составляют лактотрофы и соматотрофы. Обнаруживаются и камбиальные элементы, способные при необходимости дифференцироваться в те или иные специализированные клетки.
Гипофиз как центральный орган эндокринной системы получает афферентную и эфферентную информацию. Из срединного возвышения по сосудам портальной системы в аденогипофиз поступает кровь, содержащая гипоталамические нейрогормоны. К гипофизу поступает также большое количество гормонов периферических эндокринных желез и биологически активных метаболитов. Переработка этой информации позволяет гипофизу осуществлять тонкую интегральную функцию и посылать периферическим эндокринным железам адекватные, строго дозированные регуляторные сигналы путем выделения в кровь тропных гормонов. Периферические эндокринные железы, реагируя на тропные гормоны гипофиза, секретируют в кровь собственные гормоны, регулирующие биохимические процессы в тканях-мишенях. Циркулирующие в крови гормоны и биологически активные метаболиты контактируют со всеми структурами нейроэндокринной системы: ЦНС, гипоталамусом, гипофизом, другими железами внутренней секреции, клетками АПУД-системы (которые присутствуют в различных органах и тканях и продуцируют полипептидные гормоны за счет поглощения и декарбоксилирования предшественников аминов).
Вопрос и о локализации биосинтеза гипоталамических гормонов окончательно не решен. Имеются данные об их образовании в нервных окончаниях — синаптосомах, так как именно в них обнаруживается скопление этих гормонов и биогенных аминов. В настоящее время биогенным аминам отводится главная роль в регуляции секреции и синтеза гипоталамических гормонов. В гипоталамусе присутствуют специфические рецепторы гормонов и периферических аминорецепторов.
Воспринимая регуляторные сигналы сверху, железа ускоряет или тормозит выделение собственного гормона и, более того, она получает информацию о результатах действия ее гормонов на периферии. Механизм такой организации эндокринной железы, называемой в литературе принципом обратной связи (положительной и отрицательной), был впервые сформулирован М.М. Завадовским (1935). Он обеспечивает надежность работы нейроэндокринной системы в организме. Классическим примером может служить функционирование щитовидной железы, когда ТТГ стимулирует секрецию тиреоидных гормонов, которые в свою очередь, достигнув высоких концентраций в крови, тормозят секрецию гипофизом ТТГ. Обратная связь реализуется на четырех уровнях (ЦНС, гипоталамус, гипофиз, сама железа), и в ней различают длинные, короткие и ультракороткие звенья. Эндокринные регуляторы — гормоны дистантного действия — достигают своих целевых объектов с кровотоком.
Концентрация и ритм секреции гормонов определяют направленность действия и точку приложения в организме. Так, эстрогены, стимулируя секрецию пролактина гипофизом, увеличивают выделение ДА гипоталамусом, что приводит к торможению лактотропной функции гипофиза. На телах нейронов, синтезирующих ДА, обнаружены рецепторы эстрадиола. В этом процессе участвуют и метаболические регуляторы, такие как глюкоза [10].
В одной и той же железе имеется возможность обмена химической информацией между клетками, в которой принимают участие и гормоны. Показано, в частности, наличие рецепторов инсулина на альфа-клетках, секретирующих глюкогон (паракринная регуляция). Биологически активные вещества, в том числе гормоны, могут выделяться и связываться рецепторами той же клетки (аутокринная регуляция).
Чувствительность тканей к конкретному гормону определяется количеством специфических рецепторов, связывающих этот гормон. Высокие концентрации гормона, связывая большую часть рецепторов, снижают их биосинтез и уровень активных форм рецепторов, что предохраняет клетки-мишени от чрезмерного гормонального воздействия. Возможна и ситуация, когда гормон увеличивает концентрации собственных рецепторов.
Гормон может влиять не только на свои рецепторы, но и на рецепторы других гормонов. Так, ПРЛ стимулирует образование рецепторов ЛГ и ФСГ в гонадах, тиреоидные гормоны влияют на уровень эстрогенных и катехоламиновых рецепторов и т.д. Обратная связь реализуется довольно быстро, что обеспечивает постоянный относительный гомеостаз в организме; замедление или ускорение этого процесса свидетельствует о развитии патологического процесса.
Нарушения гормональной рецепции ведут к развитию патологического процесса (например, инсулинорезистентность при ожирении и сахарном диабете 2-го типа).
В срединном возвышении обнаружены многочисленные синаптические и аксональные контакты нейронов, вырабатывающих нейропептиды, а также анастомозы между капиллярами сосудов, идущими к аденогипофизу и нейрогипофизу, что и обеспечивает тесное взаимодействие различных эндокринных подсистем (гипоталамус—гипофиз—кора надпочечников, гипоталамус—гипофиз—щитовидная железа, гипоталамус—гипофиз—гонады и др.).
Главным достижением нейроэндокринологии последних лет является доказательство причастности нейромедиаторов к нейроэндокринной интеграции действия нейросекреторных нейронов, регулирующих секрецию тропных гормонов гипофиза. К ним относятся норадреналин (НА), адреналин (А), ДА, серотонин, гистамин, гамма-аминомасляная кислота (ГАМК), ацетилхолин, соматостатин, ТРГ, КРГ, соматолиберин и многие другие соединения. Все эти вещества несут нейрогенную информацию, необходимую для нормального функционирования нейросекреторных нейронов, регулирующих секрецию тропных гормонов гипофиза. Прежде всего это люлиберинпродуцирующие нейроны, регулирующие выделение ЛГ и ФСГ, нейроны, секретирующие пролактинингибирующий гормон, ТРГ, вазоактивный интестинальный полипептид, а также ДА. Полное понимание нейроэндокринного контроля требует точного знания топографии нейросекреторных и обычных проводниковых нейронов. Необходимо определить главные проекции нейронов и идентифицировать нейромедиаторы, содержащиеся в них. Обнаружены синапсы между норадренергическими нейронами и ГАМК-содержащими нейронами в этой области. Следует отметить также возможность несинаптического взаимодействия катехолсодержащих нейронов в ЦНС.
Дофаминергические нейроны, иннервирующие гипоталамус, имеют клеточные тела в трех областях мозга: во-первых, это тубероинфундибулярные нейроны, которые составляют 3—5% клеточных тел нейронов аркуатной области и обозначаются как А12. Терминали этих нейронов обнаружены в срединном возвышении в тесном контакте с первичными капиллярами гипофизарного портального сплетения. Эти нейроны выделяют большое количество ДА в портальную кровь и играют ведущую роль в регуляции секреции ПРЛ, а также ГнРГ. Две другие группы дофаминергических нейронов расположены в каудальном таламусе, заднем гипоталамусе и перивентрикулярных ядрах. Диффузное распределение дофаминергических нейронов в гипоталамусе затрудняет изучение их роли в регуляции секреции гонадотропинов и других тропных гормонов.
Изложение контрольных функций адренергических нейронов в секреции гонадотропинов целесообразно начать с их роли в регуляции пульсирующего выделения ЛГ, которая определяется квантовым выделением ГнРГ. Большинство исследователей, занимающихся этой проблемой, приходят к выводу, что норадренергические нейроны в физиологических условиях включаются в этот процесс, хотя на отдельных нейронах обнаружены адренергические рецепторы, активация которых вызывает торможение пульсирующего выделения ЛГ. Направленность действия ДА-нейронов зависит, скорее всего, от уровня половых гормонов.
При изучении роли биогенных аминов в регуляции овуляторного выброса гонадотропинов особое внимание обращается на значение половых гормонов в активации или торможении катехолсодержащих нейронов в системе обратной связи. На модели овариэктомированных крыс с имплантацией эстрадиола показано, что выброс ЛГ каждые 24 ч сопровождается увеличением скорости обмена НА в преоптической и аркуатной областях и супрахиазматических ядрах, а также срединном возвышении. Аналогичные данные получены и в опытах на интактных животных, у которых отмечено увеличение скорости обмена НА в преоптической области во 2-й половине проэструса, т.е. во время овуляторного выброса ЛГ, тогда как в другие стадии цикла подобных изменений в обмене НА в этой области не зарегистрировано. О негативном действии эстрадиола на обмен НА свидетельствуют эксперименты на овариэктомированных животных, у которых скорость обмена НА в преоптической области увеличивалась через 3 сут, а введение эстрадиола приводило к снижению скорости его обмена в этой области и срединном возвышении уже через 3 ч. Действие эстрогенов на обмен НА может осуществляться как непосредственно на уровне норадренергических нейронов, содержащих эстрогенные рецепторы, так и через опиоидные или ГАМК-содержащие интернейроны, которые также содержат рецепторы стероидных гормонов. Скорость обмена адреналина в некоторых областях гипоталамуса также увеличивается одновременно с овуляторным выбросом ЛГ. Это касается, главным образом, медиобазального гипоталамуса и преоптической области. Возникает вопрос о степени сродства адренергических рецепторов нейронов к половым гормонам в ходе менструального цикла.
Влияние половых гормонов на активность дофаминергических нейронов проявляется менее отчетливо. Дело в том, что изменение состояния тубероинфундибулярных дофамин-содержащих нейронов теснее связано с секрецией ПРЛ. Введение эстрогенов повышает уровень ПРЛ, который в свою очередь усиливает обмен ДА в этих нейронах. Показано также наличие рецепторов к эстрадиолу в дофаминергических клеточных телах нейронов аркуатного ядра и повышение скорости обмена ДА в этом ядре и срединном возвышении во второй половине стадии проэструса. В преоптической области изменения дофаминергической активности в это время не наблюдается. Овариэктомия незначительно влияет на обмен ДА в некоторых областях гипоталамуса, тогда как введение эстрадиола вызывает снижение обмена ДА в преоптической области и срединном возвышении и увеличение в медиобазальном гипоталамусе.
Имеется ряд сообщений о влиянии катехоламинергических агентов на овуляторный выброс ЛГ в проэструсе и вызванный эстрогенами выброс ЛГ. Начало этим исследованиям было положено в 1950 г. Сойером, который показал, что α-адренергические антагонисты блокируют овуляцию у крыс. В дальнейшем были исследованы более специфические фармакологические агенты, такие как α-метил-р-тирозин и диэтилдитиокарбомат, блокирующие синтез НА и А соответственно. Они тормозили овуляторный выброс ЛГ. Блокада α-адренергических рецепторов также прерывает овуляцию, причем наиболее эффективным является препарат празозин, избирательно блокирующий подтип α1-рецепторов, тогда как блокада другого подтипа рецепторов (α2) пипероксаном неэффективна.
Приведенные данные позволяют утверждать, что норадренергические и адренергические нейроны включаются в стимуляцию овуляторного выброса ЛГ, и действие их опосредуется через α1-адренергические рецепторы, локализованные в основном в медиобазальной преоптической области гипоталамуса. Роль дофаминсодержащих нейронов в регуляции овуляторного выброса ЛГ спорна: введение относительно специфического антагониста ДА пимозина в утренние часы проэструса снижало выброс ЛГ у крыс во второй половине дня. Этот же препарат, введенный женщинам за 2 ч до ожидаемого выброса ЛГ в середине менструального цикла, снижает величину выброса. В другом случае внутрижелудочковое введение ДА в проэструсе у крыс способствует увеличению уровня ЛГ в крови. Исследования in vitro также дают спорные результаты. Так, перфузия ДА фрагментов медиобазального гипоталамуса самцов крыс увеличивает выделение ГнРГ, которое блокируется введением антагониста α-адренергических рецепторов (фентоламина), но не антагониста ДА (пимозина). ДА обладает способностью ускорять выделение НА из терминалей срединного возвышения, но не влияет на обратный захват и обмен НА. Противоречивые данные затрудняют интерпретацию роли и значения ДА в решении системы ГнРГ—ЛГ.
Серотонинергическая система ЦНС представляет собой популяцию нейронов ствола мозга, которые берут начало в ядрах шва среднего мозга. Аркуатные ядра получают плотную серотонинергическую иннервацию, тесно контактирующую с дофаминергическими клеточными телами аркуатного ядра и медиальной зоны инсепта. Описаны контакты между нейрональными элементами, содержащими ГнРГ и серотонин, в преоптической области, концевой пластинке и срединном возвышении. Серотонин обнаружен в нервных окончаниях, локализованных вокруг больших кровеносных сосудов аденогипофиза, а также в секреторных гранулах гонадотрофов. Причастность серотонина к регуляции гонадотропной функции гипофиза доказана многочисленными исследованиями. Он может как стимулировать, так и тормозить эту функцию в зависимости от гормонального фона. Действие серотонина на секрецию ЛГ и овуляцию опосредовано регуляцией секреции ГнРГ нейросекреторными нейронами. Серотонинергическая система является одной из многих нейросекреторных систем, тесно связанных с гонадотропинрегулирующей системой преоптикопереднего и медиобазального отделов гипоталамуса и срединного возвышения. Половые гормоны модулируют активность этой нейротрансмиттерной системы. Анализ роли нейромедиаторов адренергического ряда в регуляции гонадотропной функции гипофиза позволяет утверждать, что НА следует рассматривать в качестве ведущего агента в регуляции секреции ЛГ, основной точкой приложения которого является преоптическая область. ДА реализует свой эффект через аркуатную область гипоталамуса, а серотонин играет роль синхронизирующего агента.
Новый класс соединений, выделяемых в группу пептидных нейромедиаторов, вносит свой вклад в наши представления об участии нервной системы в регуляции эндокринных функций гипофиза. Обнаружение регуляторных пептидов, общих как для нервной, так и для эндокринной систем, вызвало революцию в наших представлениях. Возникло новое направление исследований — психонейроэндокринология.
Практически каждый из перечисленных выше нейропептидов причастен к регуляции секреции гонадотропинов, ПРА, АКТГ, ТТГ. Большинство из них обнаружено в медиобазальном гипоталамусе. Нейропептиды, выделяясь в гипофизарную портальную систему, действуют на несколько типов аденогипофизарных клеток и, кроме того, взаимодействуют с многими нейромедиаторами непептидной природы, поступающими в медиобазальный гипоталамус из других структур, что в свою очередь обеспечивает их прямое или опосредованное действие на гормональный контроль.
Гипоталамические нейроны, продуцирующие нейропептиды, составляют общую систему. Большинство их клеточных тел локализовано в паравентрикулярных ядрах, медиальной перивентрикулярной области и аркуатных ядрах. Незначительная часть таких нейронов обнаружена в преоптической области и супрахиазматических ядрах. Бóльшая часть всех этих нейронов заканчивается в области срединного возвышения. Аксональные коллатерали иннервируют ряд гипоталамических и экстрагипоталамических структур. Нервные клетки паравентрикулярных и аркуатных ядер в свою очередь имеют многочисленные контакты с большим числом других структур ЦНС, что и определяет их стратегическую позицию в координации гормональной регуляции, а также ряда поведенческих реакций. Особенно это касается полового поведения, требующего синхронизации поведенческих компонентов с процессами менструального цикла. Окончания нейронов, синтезирующих нейропептиды, тесно контактируют не только с перикарионами, вырабатывающими нейротрансмиттеры, но и с нейронами, синтезирующими нейропептиды. Например, ГнРГ-продуцирующие нейроны и их волокна могут оканчиваться на аналогичных клеточных телах; имеют место также аксо-аксональные контакты.
Учитывая большое число нейропептидов, принимающих участие в регуляции репродуктивной системы, целесообразно сгруппировать их по месту синтеза. Такими группами могут быть: 1) нейропептиды, продуцируемые нейронами, локализованными, главным образом, в преоптической области (соматостатин, ГнРГ, тахикинины, нейротензин, предсердный натрийуретический гормон); 2) нейропептиды, продуцируемые нейронами аркуатной области (панкреатический нейропептид, пептид YY, нейропептид Y); 3) нейропептиды, синтезирующиеся в перикарионах паравентрикулярных или супраоптических ядер (ТРГ, КРГ, холецистокинин, вазопрессин, окситоцин, ангиотензин, брадикинин, бомбезин); 4) гастроинтестинальные пептиды (ВИП, гастроинтестинальный пептид); 5) семейство опиоидных пептидов.
Механизм действия этих нейропептидов как на гипоталамическом, так и на гипофизарном уровне можно проследить на примере модуляции секреции гонадотропинов, ПРЛ, окситоцина, т.е. тех гормонов, которые имеют отношение к репродуктивной функции. Например, соматостатин, который обнаружен во многих структурах ЦНС и главным действием которого является угнетение продукции гормона роста и частично ТТГ и ПРЛ, способен изменять активность нейромедиаторных систем мозга, вызывая блокаду секреции ГнРГ.
Группа классических пептидов (тахикинины А и Б, субстанция Р) стимулирует выделение ПРЛ и тормозит выделение гормона роста. Пептид нейротензин широко распространен в ЦНС и проявляет свой эффект за счет стимуляции секреции инсулина, ингибиции секреции глюкагона и модуляции гастроинтестинальной перистальтики. Внутрижелудочковое введение нейротензина снижает уровень ЛГ в крови, что делает возможным его участие в контроле гонадотропной функции гипофиза. Предсердный натрийуретический гормон угнетает выделение вазопрессина и может стимулировать выделение ЛГ и пролонгировать действие ГнРГ. Семейство панкреатических пептидов также причастно к функционированию репродуктивной системы, они чаще всего блокируют секрецию ЛГ и снижают частоту пульсации ГнРГ в срединном возвышении.
Пептиды, синтезирующиеся в паравентрикулярных и супрахиазматических ядрах, основными из которых являются вазопрессин и окситоцин, наиболее активно влияют на репродуктивную систему. Основная гормональная функция вазопрессина на уровне аденогипофиза — стимуляция выделения АКТГ за счет усиления действия КРГ. Имеются данные о тормозном влиянии вазопрессина на секрецию ПРЛ за счет повышения обмена ДА в тубероинфундибулярных нейронах. Стимулирующий эффект вазопрессина на выделение ПРЛ может опосредоваться опиатными нейронами. ТРГ, синтезирующийся в паравентрикулярных ядрах, помимо своего прямого действия на секрецию ТТГ, способен стимулировать выделение ПРЛ и гормона роста, и его эффект усиливается под влиянием эстрогенов. ТРГ также оказывает влияние на обмен нейромедиаторов в мозге. Из группы гастроинтестинальных пептидов следует выделить вазоактивный интестинальный полипептид (ВИП), основное нейроэндокринное действие которого сводится к стимуляции выделения ПРЛ, а также гормона роста и ТТГ. Этот эффект является эстрогензависимым.
Особое внимание в регуляции гонадотропной функции гипофиза в последние годы уделяется опиоидным пептидам. Главным действием опиоидов является их способность повышать выделение ПРЛ и гормона роста и блокировать секрецию ЛГ, ФСГ и ТТГ. Они специфически ингибируют овуляторный выброс ЛГ и ФСГ. Опиаты способны регулировать амплитуду и частоту пульсации ЛГ за счет модуляции гипоталамического пейсмекера, контролирующего периодичность активации ГнРГ-продуцирующих нейронов. Влияние опиатов на секрецию ЛГ опосредовано повышением секреции ПРЛ. Опиаты блокируют тоническую секрецию ГнРГ на фоне высокого уровня ПРЛ. Регуляция процессов биосинтеза и секреции ПРЛ, как и ЛГ, опиоидными пептидами осуществляется через специфические рецепторы.
Приведенные выше данные о влиянии различных нейромедиаторов адренергической природы и нейропептидов ставят вопрос о том, каким образом разные вещества с различными механизмами действия координируют работу репродуктивной системы. В ряде случаев отмечен синергизм их действия как на гипоталамическом, так и на гипофизарном уровне, в других — антагонизм их влияния. Можно отметить параллелизм в действии различных медиаторов, вырабатываемых в одних и тех же структурах. В настоящее время наблюдается быстрый прогресс в изучении химии и нейроанатомии нейросекреторных нейронов, участвующих в регуляции репродуктивной функции.
В настоящее время цельное представление о функционировании гипоталамо-гипофизарной системы распалось на отдельные направления исследований с использованием новых специфических методических приемов. Интенсивно используются достижения смежных дисциплин, таких как иммунология. Показана тесная взаимосвязь нейроэндокринной и иммунной систем в различные периоды жизни и при различных физиологических состояниях. Например, с возрастом снижается реакция иммунной системы и параллельно снижается активность гормона роста. При беременности снижается секреция пролактина и окситоцина и повышается секреция половых гормонов — эстрогенов, прогестерона. Доказана взаимосвязь нервной, иммунной и эндокринной систем регуляции секреции инсулина. Разработка фундаментальных аспектов нейроэндокринологии открывает широкие перспективы лечения нарушений репродуктивной системы, заболеваний щитовидной железы или надпочечников гормональными средствами или препаратами, обладающими нейрогенными свойствами. Такими препаратами могут быть производные нейромедиаторов адренергической, холинергической природы, а также нейропептиды.
Начиная с конца 50-х годов прошлого столетия внимание исследователей всего мира все больше стало привлекать изучение воздействия гормональных факторов на функцию головного мозга. В результате многочисленных исследований родилась новая наука — психонейроэндокринология. Ее задачами является изучение вопросов, связанных с влиянием гормонов на высшие функции мозга, — от молекулярного уровня до различных сторон психической деятельности.
Проблема воздействия гормональных факторов на высшие интегративные функции мозга чрезвычайно сложна как по существу, так и в силу отсутствия объективной модели, отражающей зависимость между уровнем гормонов в организме и его влиянием на когнитивные функции.
Показано, что гормоны, взаимодействуя с нейромедиаторами, образуют на уровне ЦНС единую координирующую нейрогуморальную систему, контролирующую интегративную деятельность головного мозга. Нарушение биосинтеза или обмена нейромедиаторов, нарушения их взаимодействия с соответствующими рецепторами могут играть патогенетическую роль в развитии ряда нервно-психических состояний. Сложились устойчивые представления о том, что функция гормонов в ЦНС связана с контролем экспресии гормонзависимых генов и регуляции таких процессов, как развитие и старение мозга, регенерация, адаптация, память.
Различают геномный и негеномный механизм действия гормонов. Полипептидные гормоны действуют на специфические рецепторные зоны мембраны клетки. Связывание лиганда поверхностными рецепторами клетки индуцирует внутриклеточный сигнал (цАМФ и/или кальций) и приводит к быстрому результату (активации остеокластов, секреции кортизола и т.п.). Трансдукция сигнала полипептидных гормонов может вовлекать фосфатидилиновый путь или фосфорилирование рецепторов.
Стероидные и тиреоидные гормоны проявляют свое действие главным образом через специфические внутричерепные связывающие белки, которые взаимодействуют с элементами генов клеток-мишеней, что сопровождается изменением транскрипции специфических генов.
Гипофиз — главный регулятор функционирования эндокринных желез
В аденогипофизе секретируются следующие гормоны: ТТГ, АКТГ, ЛГ и ФСГ, которые оказывают стимулирующее влияние соответственно на клетки щитовидной железы, коры надпочечников и половые железы. Попадая в кровь, гормоны периферических желез активизируют деятельность всех органов и тканей организма, в том числе и аденогипофиза. Осуществляя обратную связь, они блокируют избыточное поступление тропных гормонов гипофиза. Наступает равновесие между мутацией гормонов гипофиза и потребностью организма в гормонах периферических желез. Несколько иной результат наблюдается в отношении ПРА и гормона роста, не имеющих специализированного целевого органа, секреция которого оказывала бы тормозной эффект на выделение этих гормонов. Помимо блокирующего эффекта гормонов периферических желез на синтез и секрецию тропных гормонов гипофиза, аналогичным эффектом обладают также ингибиторные факторы гипоталамического происхождения.
Синдромы эндокринной недостаточности, обусловленные полным или частичным выпадением функций передней и задней долей гипофиза, обозначаются как гипопитуаризм. Гипофункция гипофиза может быть следствием поражения самого гипофиза или гипоталамуса. Результат один — сниженная секреция гипофизарных гормонов с последующим дефицитом гормонов периферических желез.
Уровень гормона роста в крови в норме очень низок, но увеличивается при физической нагрузке, во время сна и при стрессе. Наиболее надежные стимулирующие тесты для данного гормона — индуцированная инсулином гипогликемия, инфузия аргинина или введение L-допа. Эти тесты сопровождаются увеличением секреции гипоталамического соматолиберина.
Секреция пролактина у здоровых людей обычно низкая в течение дня, увеличивается во сне, при стрессе и родах. В клинике используют провоцирующий тест с внутривенным введением ТРГ