выращивание нейронов головного мозга
Нейрогенез гиппокампа как мишень для лечения психических расстройств
2%) и шизофренией (1,1%).
Многие работы в области нейрогенеза у человека сосредоточены на судорожной активности и эпилепсии, которая, как известно, значительно увеличивает нейрогенез как у грызунов, так и у людей.
Несколько аспектов нейрогенеза остаются для нас неуловимыми. В частности, стволовые клетки гиппокампа трудно исследовать частично, потому что они делятся редко, а предполагаемые стволовые клетки экспрессируют маркеры незрелых астроцитов и поддерживают уникальную морфологию с сомой неправильной формы и сложным рядом процессов во внутреннем молекулярном слое. Кроме того, остается неясным, в какой момент клетки-предшественники «обречены» стать нейронами. В условиях культивирования происходящие из гиппокампа предшественники могут дифференцироваться в три отличительные линии, включая нейроны, астроциты и олигодендроциты. Однако, в нормальных условиях in vivo подавляющее большинство (70–90%) выживших взрослых клеток становятся нейронами. Кроме того, поведенческое и функциональное значение нейрогенеза у взрослых остается недостаточно понятным, хотя недавние исследования подчеркивают, что новые гранулярные нейроны могут играть роль в дискретных задачах памяти гиппокампа и в аспектах регуляции настроения.
Многие препятствия стоят на пути полного использования нейрогенеза гиппокампа для лечения психических заболеваний и других нарушений головного мозга. Одним из наиболее очевидных пробелов в знаниях является отсутствие понимания различий между нейрогенезом грызунов и человека. Более конкретно, почти ничего не известно о нейрогенезе человека, за исключением того, что он сохраняется во взрослой жизни. Требуется больше информации о степени нейрогенеза, функции генерируемых взрослыми нейронов, расположении и функции взрослой стволовой клетки и даже о том, повторяются ли стадии нейрогенеза, которые так хорошо охарактеризованы у грызунов, у человека. Нам также необходимо лучше понять, как новые нейроны интегрируются в гиппокампальную схему.
Широко используемые подходы для подавления нейрогенеза гиппокампа, такие как облучение черепа, оказываются очень полезными для выявления новых ролей нейрогенеза у взрослых при психических расстройствах, таких как зависимость. Возможно, использование таких подходов более широко и строго позволит нам узнать больше о том, как мы можем стимулировать миграцию генерируемых SGZ нейронов в близлежащие регионы, как это было показано в других областях мозга. Это потенциально позволило бы направленную миграцию генерируемых взрослыми нейронов к месту патологии при каждом заболевании головного мозга, что значительно повысило бы полезность этого подхода для трансляционного использования.
Выращивание нейронов головного мозга
Н а протяжении всей своей 100-летней истории нейрон аука придерживалась догмы: мозг взрослого человека не подвержен изменениям. Считалось, что человек может терять нервные клетки, но не обретать новые. Действительно, если бы мозг был способен к структурным изменениям, как бы сохранялась память?
Кожа, печень, сердце, почки, легкие и кровь могут образовывать новые клетки для замены поврежденных. Вплоть до недавнего времени специалисты считали, что такая способность к регенерации не распространяется на центральную нервную систему, состоящую из головного и спинного мозга.
Однако за последние пять лет нейробиологи открыли, что мозг все же меняется в течение жизни: происходит образование новых клеток, позволяющих справиться с возникающими трудностями. Такая пластичность помогает мозгу восстанавливаться после травмы или заболевания, увеличивая свои потенциал ьные возможности.
Нейробиологи на протяжении десятков лет ищут способы улучшить состояние мозга. Стратегия лечения основывалась на восполнении недостатка нейромедиаторов — химических веществ, передающих сообщения нервным клеткам ( нейрон ам). При болезни Паркинсона, например, мозг больного теряет способность вырабатывать нейромедиатор дофамин, поскольку производящие его клетки гибнут. Химический «родственник» дофамина, L-Допа, может временно облегчить состояние больного, но не излечить его. Для замены нейрон ов, погибающих при таких неврологических заболеваниях, как болезни Гентингтона и Паркинсона, и при травмах спинного мозга, нейробиологи пытаются имплантировать стволовые клетки, полученные из эмбрионов. В последнее время исследователи заинтересовались нейрон ами, полученными из эмбриональных стволовых клеток человека, которые при определенных условиях можно заставить образовывать в чашках Петри любые типы клеток человеческого организма.
Несмотря на то что у стволовых клеток много преимуществ, очевидно, следует развивать способности взрослой нервной системы к самовосстановлению. Для этого необходимо ввести вещества, стимулирующие мозг к образованию собственных клеток и восстановлению поврежденных нервных цепей.
Новорожденные нервные клетки
В 1960 — 70-х гг. исследователи пришли к выводу, что центральная нервная система млекопитающих способна к регенерации. Первые эксперименты показали, что основные ветви нейрон ов взрослого головного и спинного мозга — аксон ы могут восстанавливаться после повреждения. Вскоре было обнаружено рождение новых нейрон ов в мозге взрослых птиц, обезьян и людей, т.е. нейрогенез.
Возникает вопрос: если центральная нервная система может образовывать новые нейрон ы, способна ли она восстанавливаться в случае болезни или травмы? Для того чтобы ответить на него, необходимо понять, как происходит нейрогенез во взрослом мозге и каким образом можно его стимулировать.
Рождение новых клеток происходит постепенно. Так называемые мультипотентные стволовые клетки в мозге периодически начинают делиться, давая начало другим стволовым клеткам, которые могут вырасти в нейрон ы или опорные клетки, называемые глией. Но для созревания новорожденные клетки должны избегать влияния мультипотентных стволовых клеток, что удается лишь половине из них — остальные гибнут. Такое расточительство напоминает процесс, происходящий в организме до рождения и в раннем детстве, когда возникает больше нервных клеток, чем необходимо для образования мозга. Выживают только те из них, которые формируют действующие связи с другими.
Станет ли уцелевшая молодая клетка нейрон ом или глиальной клеткой, зависит от того, в каком участке мозга она окажется и какие процессы будут происходить в этот период. Новому нейрон у требуется более месяца, чтобы начать полноценно функционировать. посылать и принимать информацию. Таким образом. нейрогенез представляет собой не одномоментное событие. а процесс. который регулируется веществами. называемыми факторами роста. Например, фактор, названный «звуковой еж» (sonic hedgehog), обнаруженный впервые у насекомых, регулирует способность незрелых нейрон ов к пролиферации. Фактор notch и класс молекул. названных морфогенетическими протеинами кости, видимо, определяют, станет ли новая клетка глиальной или нервной. Как только это произойдет. другие факторы роста. такие как мозговой нейротрофический фактор (BDNF). нейротрофины и инсулинподобный фактор роста (IGF), начинают поддерживать жизнедеятельность клетки, стимулируя ее созревание.
Место действия
Новые нейрон ы возникают во взрослом мозге млекопитающих не случайно и. по всей видимости. образуются только в заполненных жидкостью пустотах в переднем мозге — в желудочках, а также в гиппокампе — структуре, спрятанной глубоко в мозге. имеющей форму морского конька. Нейробиологи доказали, что клетки, которым суждено стать нейрон ами. перемещаются из желудочков в обонятельные луковицы. которые получают информацию от клеток, расположенных в слизистой носа и чувствительных к запаху. Никто точно не знает, почему обонятельной луковице требуется столько новых нейрон ов. Легче предположить, зачем они нужны гиппокампу: поскольку эта структура важна для запоминания новой информации, дополнительные нейрон ы, вероятно. способствуют упрочению связей между нервными клетками, повышая способность мозга обрабатывать и хранить сведения.
Процессы нейрогенеза также обнаружены за пределами гиппокампа и обонятельной луковицы, например, в префронтальной коре — обители интеллекта и логики. а также в других областях взрослого головного и спинного мозга. Последнее время появляются все новые подробности о молекулярных механизмах, управляющих нейрогенезом, и о химических стимулах, регулирующих его. и мы вправе надеяться. что со временем можно будет искусственно стимулировать нейрогенез в любой части мозга. Зная, как факторы роста и локальное микроокружение управляют нейрогенезом, исследователи рассчитывают создать методы лечения, позволяющие восстановить больной или поврежденный мозг.
С помощью стимулирования нейрогенеза можно улучшить состояние пациента при некоторых неврологических заболеваниях. Например. причина инсульта — закупорка сосудов головного мозга, в результате чего из-за недостатка кислорода гибнут нейрон ы. После инсульта в гиппокампе начинает развиваться нейрогенез, стремящийся «вылечить» поврежденную ткань мозга с помощью новых нейрон ов. Большинство новорожденных клеток гибнет, однако некоторые успешно мигрируют к поврежденному участку и превращаются в полноценные нейрон ы. Несмотря на то что для компенсации повреждений при тяжелом инсульте этого недостаточно. нейрогенез может помочь мозгу после микроинсультов,которые часто проходят незамеченными. Сейчас нейробиологи пытаются применять васкуло-эпидермальный фактор роста (VEGF) и фактор роста фибробластов (FGF) для усиления естественного восстановления.
Оба вещества представляют собой крупные молекулы, которые с трудом преодолевают гематоэнцефалический барьер, т.е. сеть тесно переплетенных клеток, выстилающих кровеносные сосуды мозга. В 1999 г. биотехнологическая компания Wyeth-Ayerst Laboratories and Scios из Калифорнии приостановила клинические испытания FGF применяемого для лечения инсульта. поскольку его молекулы не попадали в мозг. Некоторые исследователи пытались решить эту задачу, соединяя молекулу FGF с другой, которая вводила клетку в заблуждение и заставляла ее захватывать весь комплекс молекул и переносить его в ткань мозга. Другие ученые методами генной инженерии создавали клетки, вырабатывающие FGF. и трансплантировали их в мозг. Пока подобные эксперименты проводились лишь на животных.
Стимулирование нейрогенеза может оказаться действенным при лечении депрессии. главной причиной которой (помимо генетической предрасположенности) считается хронический стресс. ограничивающий, как известно. количество нейрон ов в гиппокампе. Многие из выпускаемых лекарственных средств. показанных при депрессии. в том числе прозак. усиливают нейрогенез у животных. Интересно, что для снятия депрессивного синдрома с помощью этого препарата требуется один месяц — столько же. сколько и для осуществления нейрогенеза. Возможно. депрессия отчасти вызвана замедлением данного процесса в гиппокампе. Последние клинические исследования с применением методов визуализации нервной системы подтвердили. что у пациентов с хронической депрессией гиппокамп меньше, чем у здоровых людей. Длительное применение антидепрессантов. похоже. подстегивает нейрогенез: у грызунов. которым давали эти препараты на протяжении нескольких месяцев. в гиппокампе возникали новые нейрон ы.
Как мозг создает новые нейрон ы
Нейрональные стволовые клетки дают начало новым клеткам мозга. Они периодически делятся в двух основных областях: в желудочках (фиолетовый цвет), которые заполнены спинномозговой жидкостью, питающей центральную нервную систему, и в гиппокампе (голубой цвет) — структуре, необходимой для обучения и памяти. При пролиферации стволовых клеток (внизу) образуются новые ствоповые клетки и клетки-предшественники, которые могут превратиться либо в нейрон ы, либо в поддерживающие клетки, называемые глиальными (астроциты и дендроциты). Однако дифференцировка новорожденных нервных клеток может произойти только после того, как они уйдут прочь от своих предков (красные стрелки), что удается в среднем лишь половине из них, а остальные гибнут. Во взрослом мозге новые нейрон ы были обнаружены в гиппокампе и обонятельных луковицах, необходимых для восприятия запахов. Ученые надеются заставить взрослый мозг восстанавливаться, вызывая деление и развитие нейрон альных стволовых клеток или клеток-предшественников там и тогда, где и когда это необходимо.
Как мозг создает новые нейрон ы
Потенциальным средством для восстановления поврежденного мозга исследователи считают два типа стволовых клеток. Во-первых, нейрон альные стволовые клетки взрослого мозга: редкие первичные клетки, сохранившиеся от ранних стадий эмбрионального развития, обнаруженные как минимум в двух областях мозга. Они могут делиться на протяжении всей жизни, давая начало новым нейрон ам и поддерживающим клеткам, называемым глией. Ко второму типу относятся человеческие эмбриональные стволовые клетки, выделенные из зародышей на очень ранней стадии развития, когда весь эмбрион состоит примерно из ста клеток. Такие эмбриональные стволовые клетки могут давать начало любым клеткам организма.
В большинстве исследований производится наблюдение за ростом нейрон альных стволовых клеток в культур альных чашках. Они могут там делиться, их можно генетически пометить и затем трансплантировать назад в нервную систему взрослого индивидуума. В экспериментах, которые пока проводились только на животных, клетки хорошо приживаются и могут дифференцироваться в зрелые нейрон ы в двух областях мозга, где образование новых нейрон ов происходит и в норме, — в гиппокампе и в обонятельных луковицах. Однако в других областях нейрон альные стволовые клетки, взятые из взрослого мозга, не торопятся становиться нейрон ами, хотя могут стать глией.
Устанавливая важные связи
Поскольку проходит около месяца с момента деления нейрон альной стволовой клетки до тех пор, пока ее потомок не включится в функциональные цепи мозга, роль этих новых нейрон ов в поведении, вероятно, определяется не столько родословной клетки, сколько тем, как новые и уже существующие клетки соединяются друг с другом (образуя синапс ы) и с существующими нейрон ами, формируя нервные цепи. В процессе синаптогенеза так называемые шипики на боковых отростках, или дендрит ах, одного нейрон а соединяются с основной ветвью, или аксон ом, другого нейрон а.
Как показывают недавние исследования, дендрит ные шипики (внизу) могут менять свою форму в течение нескольких минут. Это свидетельствует о том, что синаптогенез может лежать в основе обучения и памяти. Одноцветные микро-фотографии мозга живой мыши (красная, желтая, зеленая и голубая) были сделаны с интервалом в одни сутки. Многоцветное изображение (крайнее справа) представляет собой те же фотографии, наложенные друг на друга. Участки, не претерпевшие изменений, выглядят практически белыми.
Микрофотографии мозга живой мыши
Помоги мозгу
Еще одно заболевание, провоцирующее нейрогенез, — болезнь Альцгеймера. Как показали недавние исследования, в органах мыши. которой были введены гены человека, пораженные болезнью Альцгеймера. обнаружены различные отклонения нейрогенеза от нормы. В результате такого вмешательства у животного в избытке вырабатывается мутантная форма предшественника человеческого амилоидного пептида, и уровень нейрон ов в гиппокампе падает. А гиппокамп мышей с мутантным геном человека. кодирующим белок пресенилин. обладал малым количеством делящихся клеток и. соответственно. меньшим числом выживших нейрон ов. Введение FGF непосредственно в мозг животных ослабляло тенденцию; следовательно. факторы роста могут стать хорошим средством лечения этого разрушительного заболевания.
Следующий этап исследований — факторы роста, управляющие различными стадиями нейрогенеза (т.е. рождением новых клеток, миграцией и созреванием молодых клеток), а также факторы, тормозящие каждый этап. Для лечения таких заболеваний, как депрессия, при которой снижается количество делящихся клеток, необходимо найти фармакологические вещества или другие методы воздействия. усиливающие пролиферацию клеток. При эпилепсии, видимо. новые клетки рождаются. но затем мигрируют в ложном направлении, и нужно понять. как направить «заблудшие» нейрон ы по правильному пути. При злокачественной глиоме мозга глиальные клетки пролиферируют и образуют смертельно опасные разрастающиеся опухоли. Хотя причины возникновения глиомы еще не ясны. некоторые полагают. что она возникает в результате неконтролируемого разрастания стволовых клеток мозга. Лечить глиому можно с помощью природных соединений. регулирующих деление таких стволовых клеток.
Для лечения инсульта важно выяснить. какие факторы роста обеспечивают выживание нейрон ов и стимулируют превращение незрелых клеток в здоровые нейрон ы. При таких заболеваниях. как болезнь Гентингтона. амиотрофический боковой склероз (АЛС) и болезнь Паркинсона (когда гибнут совершенно конкретные типы клеток, что ведет к развитию специфических когнитивных или моторных симптомов). данный процесс происходит наиболее часто, поскольку клетки. с которыми связаны эти болезни, располагаются в ограниченных областях.
Возникает вопрос: как управлять процессом нейрогенеза при том или ином типе воздействия, чтобы контролировать количество нейрон ов, поскольку их избыток также представляет опасность? Например, при некоторых формах эпилепсии нейрон альные стволовые клетки продолжают делиться даже после того, как новые нейрон ы уже утрачивают способность устанавливать полезные связи. Нейробиологи предполагают, что «неправильные» клетки остаются недозрелыми и оказываются в ненужном месте. формируя т.н. фикальные корковые дисплазии (ФКД), генерирующие эпилептиформные разряды и вызывая эпилептические припадки. Не исключено, что введение факторов роста при инсульте. болезни Паркинсона и других заболеваниях может заставить нейрон альные стволовые клетки делиться чересчур быстро и привести к сходным симптомам. Поэтому исследователи должны сначала изучить применение факторов роста для индукции рождения, миграции и созревания нейрон ов.
При лечении травм спинного мозга, АЛС или рассеянного склероза необходимо заставить стволовые клетки производить олигодендроциты, одну из разновидностей глиальных клеток. Они необходимы для коммуникации нейрон ов друг с другом. поскольку изолируют длинные аксон ы, проходящие от одного нейрон а к другому. предотвращая рассеяние проходящего по аксон у электрического сигнала. Известно, что стволовые клетки в спинном мозге обладают способностью время от времени производить олигодендроциты. Исследователи применили факторы роста для стимулирования данного процесса у животных с травмой спинного мозга и получили положительные результаты.
Зарядка для мозга
Одна из важных особенностей нейрогенеза в гиппокампе состоит в том, что персональный опыт индивидуума может влиять на скорость деления клеток, количество выживших молодых нейрон ов и их способность встраиваться в нервную сеть. Например. когда взрослых мышей переселяют из обычных и тесных клеток в более удобные и просторные. у них происходит значительное усиление нейрогенеза. Исследователи обнаружили, что тренировки мышей в колесе для бега достаточно для того, чтобы удвоить количество делящихся клеток в гиппокампе, что ведет к резкому увеличению числа новых нейрон ов. Интересно, что регулярная физическая нагрузка может снять депрессию у людей. Возможно. это происходит благодаря активации нейрогенеза.
Если ученые научатся управлять нейрогенезом, то наши представления о заболеваниях и травмах мозга кардинально изменятся. Для лечения можно будет использовать вещества, избирательно стимулирующие определенные этапы нейрогенеза. Фармакологическое воздействие будет сочетаться с физиотерапией, усиливающей нейрогенез и стимулирующей определенные области мозга к встраиванию в них новых клеток. Учет взаимосвязей между нейрогенезом и умственной и физической нагрузками позволит снизить риск возникновения неврологических заболеваний и усилить природные репаративные процессы в мозге.
Путем стимуляции роста нейрон ов в мозге здоровые люди получат возможность улучшить состояние своего организма. Однако вряд ли им понравятся инъекции факторов роста, с трудом проникающих сквозь гематоэнцефалический барьер после введения в кровоток. Поэтому специалисты ищут препараты. которые можно было бы выпускать в виде таблеток. Подобное лекарство позволит стимулировать работу генов, кодирующих факторы роста, непосредственно в мозге человека.
Улучшить деятельность мозга возможно также путем генной терапии и трансплантации клеток: искусственно выращенные клетки, производящие конкретные факторы роста. можно имплантировать в определенные области мозга человека. Также предлагается вводить в организм человека гены, кодирующие производство различных факторов роста, и вирусы. способные доставить эти гены до нужных клеток мозга.
Пока не ясно. какой из методов окажется наиболее перспективным. Исследования, проведенные на животных, показывают. что применение факторов роста может нарушить нормальное функционирование мозга. Процессы роста могут вызвать образование опухолей, а трансплантированные клетки — выйти из под контроля и спровоцировать развитие рака. Такой риск может быть оправдан только при тяжелых формах болезни Гентингтона. Альцгеймера или Паркинсона.
Оптимальный способ стимулирования деятельности мозга — интенсивная интеллектуальная деятельность в сочетании со здоровым образом жизни: физическая нагрузка. хорошее питание и полноценный отдых. Экспериментально подтверждается и то. что на связи в мозге влияет окружающая среда. Возможно. когда-нибудь в жилых домах и офисах люди будут создавать и поддерживать специально обогащенную среду для улучшения функционирования мозга.
Если науке удастся понять механизмы самовосстановления нервной системы, то в скором будущем исследователи овладеют методами. позволяющими использовать собственные ресурсы мозга для его восстановления и совершенствования.
Источник: Мозг, восстанови себя
Дата создания: 04.11.2014
Последнее редактирование: 04.11.2014
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
Картина художника и дипломированного нейрофизиолога Грега Данна, изображающая одну из главных зон взрослого нейрогенеза — гиппокамп.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Выражение «нервные клетки не восстанавливаются» является одним из лидеров среди расхожих в быту утверждений о человеческом мозге. При этом уже 20 лет как доказана его ложность, а количество рассматривающих это самое восстановление статей до сих пор увеличивается чуть ли не по экспоненте. Уже установлены зоны, где оно проходит, его функциональное значение, а также огромное количество влияющих на него факторов. А сколько еще предстоит открыть.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Пошатнуть стереотип оказалось непросто.
Еще в начале прошлого века потеря нейронов в результате травмы или старения считалась фатальной — ведь даже лучшие умы настаивали на невозможности новообразования нейронов (или нейрогенез) у взрослых особей высших позвоночных. Впервые это постулировал гениальный С. Рамон-и-Кахаль [1], у которого на тот момент просто не могло быть инструментов исследования мозга, способных фиксировать малоинтенсивные постнатальные процессы. Авторитет Рамон-и-Кахаля был огромен, к тому же было известно, что с возрастом масса мозга снижается. О наличии малого пула стволовых клеток поводов задуматься не было, а отсутствие знаний о пластичности мозга не позволяло решить проблему интеграции новых нейронов в сложнейшую систему старых.
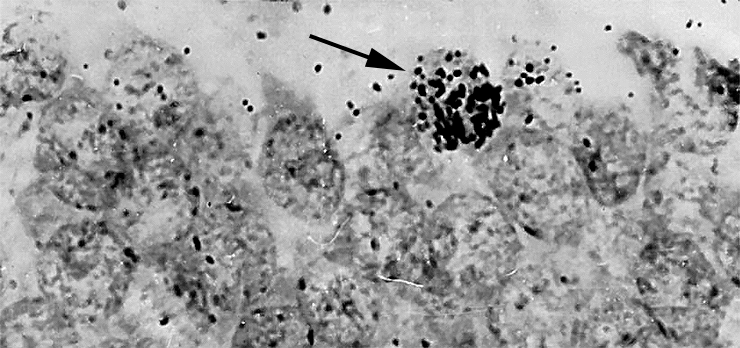
В результате убежденность в невозможности образования нервных клеток во взрослом состоянии была настолько твердой, что стала причиной ряда драматических историй в науке. Одним из первых, кто говорил о существовании взрослого нейрогенеза, был Джозеф Альтман. Используя новый для того времени метод авторадиографии с меченым тимидином (рис. 1), он и его сотрудники выпустили в 60-х целый ряд работ, утверждавших протекание нейрогенеза в зубчатой фасции гиппокампа, обонятельных луковицах и коре головного мозга у взрослых крыс, морских свинок, а также в новой коре у кошек [2].
Рисунок 1. Первые признаки взрослого нейрогенеза. Животным вводили 3 Н-тимидин — радиоактивный аналог обычного нуклеотида тимидина, — который тоже встраивается в ДНК делящейся клетки, но который потом можно регистрировать методом авторадиографии.
Альтман также предположил, что «взрослорождённые» нейроны имеют ключевое значение в процессах обучения и формирования памяти. Несмотря на то, что работы были выпущены в ведущих научных журналах, ученое сообщество проигнорировало их выводы, противоречившие установившемуся стереотипу. В результате Альтман прекратил работы по этому направлению. В начале 80-х его утверждения дополнились ультраструктурными доказательствами того, что возникающие в мозге взрослых крыс клетки похожи на нейроны. Кроме того, процессы деления были зафиксированы уже в мозге взрослых приматов — макак. Эти результаты получил Майкл Каплан, известный биолог и врач, позднее работавший в Университете Джонса Хопкинса и Национальном институте по проблемам старения (США). В ответ на его статьи некоторые именитые ученые говорили, что подобные результаты, полученные на крысах, не могут быть показательными, так как крысы не прекращают расти в течение жизни, следовательно, не могут когда-либо считаться «взрослыми». А обнаруженные деления в мозге макак сочли недостаточными для доказательства существования у них значительного нейрогенеза. Такие реакции не вдохновляли Каплана на продолжение исследований этой проблемы, и он занялся реабилитационной медициной [3].
. и всё же это удалось!
Одним из поворотных моментов в изучении нейрогенеза стала серия статей Фернандо Ноттебома, вышедшая в 80-х и 90-х годах. Сейчас Ноттебом — глава отдела экологии и этологии Рокфеллеровского университета, а тогда он занимался мозгом птиц, в частности — вокальным центром канареек. В ходе его работы выяснилось, что в отделах их мозга, гомологичных коре и гиппокампу приматов, помимо гибели происходит образование огромного количества новых клеток! При этом многие новые клетки являются нейронами и образуют синапсы, а активность всего этого процесса коррелирует со сложностью окружающей птицу среды. Несмотря на то, что многими эти результаты списывались на некую специфику птиц, они сильно сдвинули общественное мнение [3].
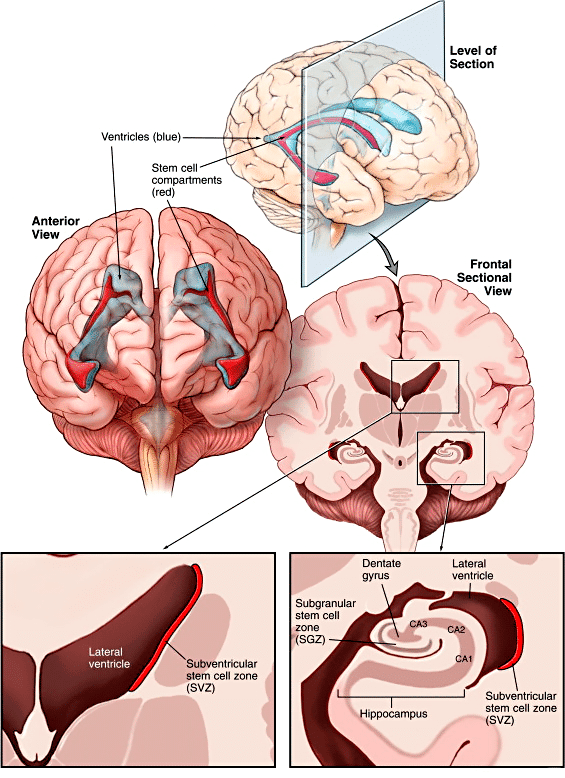
Исследование нейрогенеза продолжилось с новыми силами после введения в научную практику синтетических аналогов тимидина. Такие аналоги куда легче потом обнаружить в тканях, чем радиоактивные, которые использовал Альтман. Кроме того, были открыты маркеры клеток разных типов: нейронов различной степени зрелости, клеток глии, а также любых клеток, находящихся в фазе митоза, то есть делящихся. Это позволило еще увереннее говорить об активном нейрогенезе в зубчатой фасции гиппокампа и в стенках желудочков мозга с проекциями в обонятельные луковицы (рис. 2) [4]. Последние работы демонстрируют нейрогенез и в ряде других структур мозга: в хвостатом ядре, фронтальной коре, первичной и вторичной моторной и соматосенсорной коре (рис. 3) [5], [6]. Но недостаточно высокая активность процесса всё же не позволяет называть эти зоны нейрогенными, в отличие от двух вышеназванных.
Рисунок 2. Зоны мозга, в которых происходит нейрогенез: субвентрикулярная зона мозга (SVZ) в боковых стенках первых двух желудочков и субгранулярная зона зубчатой фасции гиппокампа (SGZ). У грызунов образующиеся в SVZ клетки потом мигрируют по ростральному миграционному тракту в обонятельные луковицы.
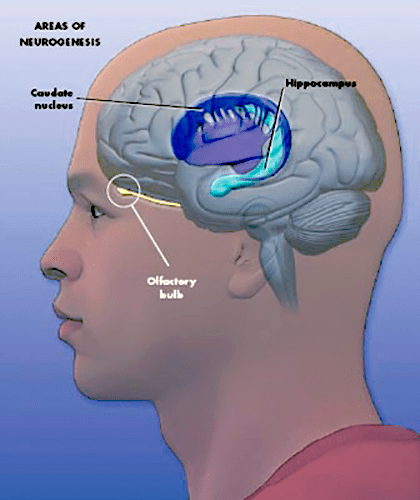
Рисунок 3. Зоны мозга человека, в которых происходит нейрогенез. У приматов клетки, образующиеся в субвентрикулярной области, мигрируют еще и в полосатое тело, которое представляет собой анатомическую структуру мозга, отвечающую за мышечный тонус, формирование условных рефлексов, а также регулирующую некоторые поведенческие реакции.
Нейрогенез в желудочках мозга значительно усиливается при каком-либо обонятельном опыте, а также при беременности у грызунов, так как узнавание детенышей у них сильно связано с обонянием [7], [8]. Результаты работ по исследованию нейрогенеза в этой зоне у человека пока не приводят к окончательным выводам: часть из них свидетельствует о его протекании у человека, другая ставит под сомнение миграцию нейронов в обонятельные луковицы. Недавно было показано, что у приматов новообразованные нейроны из субвентрикулярной зоны могут мигрировать в полосатое тело (или стриатум), отвечающее за сложные двигательные реакции и формирование условных рефлексов [9]. С повреждениями стриатума связан синдром Туретта, а также более серьезные проблемы, такие как болезни Паркинсона и Хантингтона. Поэтому в будущем можно рассчитывать на появление ряда работ по связанному с этой областью нейрогенезу.
Нейрогенез оказался важным инструментом в нашем организме.
Пожалуй, для человека самой важной нейрогенной зоной всё же можно назвать зубчатую фасцию гиппокампа. Гиппокамповая формация является частью лимбической системы и участвует в исполнении таких функций мозга, как интеграция и распределение по мозгу сенсорной информации, ответ на новизну, регуляция настроения и активности организма. Будучи частью круга Пейпеца, гиппокамп удерживает информацию при бодрствовании и участвует в ее переводе в кору больших полушарий во время сна, то есть из кратковременной памяти в долговременную. Нейрогенез вовлечен в осуществление некоторых из этих функций, выполнение которых становится возможным благодаря специфическим характеристикам образующихся клеток — в частности, молодые гранулярные клетки зубчатой фасции имеют более низкий порог долговременной потенциации, чем старшие [10]. Считается, что подобная пластичность играет роль в процессах обучения и памяти [11].
Скорость образования новых нейронов гиппокампа для взрослой крысы оценивается в 9000 клеток в сутки, однако большинство новообразованных клеток погибает между первой и второй неделями после своего рождения, из-за чего число окончательно интегрировавшихся в гиппокамп новых нейронов в месяц равно примерно 25000, что составляет около 3,3% их популяции [12]. Скорость нейрогенеза у человека оценивается в 700 нейронов ежедневно, а в год обновляется около 1,75% всего гиппокампа или же 0,004% нейронов его зубчатой фасции [13]. Половая специфика в этих показателях отсутствует, а с возрастом активность процесса снижается, при этом «качество» предшественников остается прежним, так как in vitro они культивируются так же хорошо, как и в молодом возрасте. Это позволяет предположить, что с возрастом происходит удлинение продолжительности клеточного цикла предшественников нервных клеток in vivo [14].
Стадии нейрогенеза в зубчатой фасции подробно описаны по морфологии клеток и набору специфических клеточных маркеров (рис. 4) [15].
Рисунок 4. Схема дифференцировки нервных стволовых клеток зубчатой фасции со специфическими маркерами разных стадий. Покоящиеся нервные предшественники (quiescent neural progenitors, в ранней классификации называемые радиальной глией) после активации цитокинами, ростовыми или иными факторами начинают делиться асимметричным митозом с образованием в базальной части делящегося нервного предшественника (amplifying neural progenitor, в ранней классификации — нерадиальный предшественник). Он, в свою очередь дважды поделившись, выходит из клеточного цикла и становится постмитотическим нейробластом (neuroblast 1, ранее — промежуточный прогенитор). Именно на этой стадии погибает большинство клеток. Оставшиеся превращаются в нейробласты второго порядка (neuroblasts 2, ранее — нейробласты) и затем в незрелые нейроны, мигрирующие в гранулярный слой, где завершается их созревание. Полное превращение нервной (нейральной) стволовой клетки в функциональный нейрон занимает около месяца.
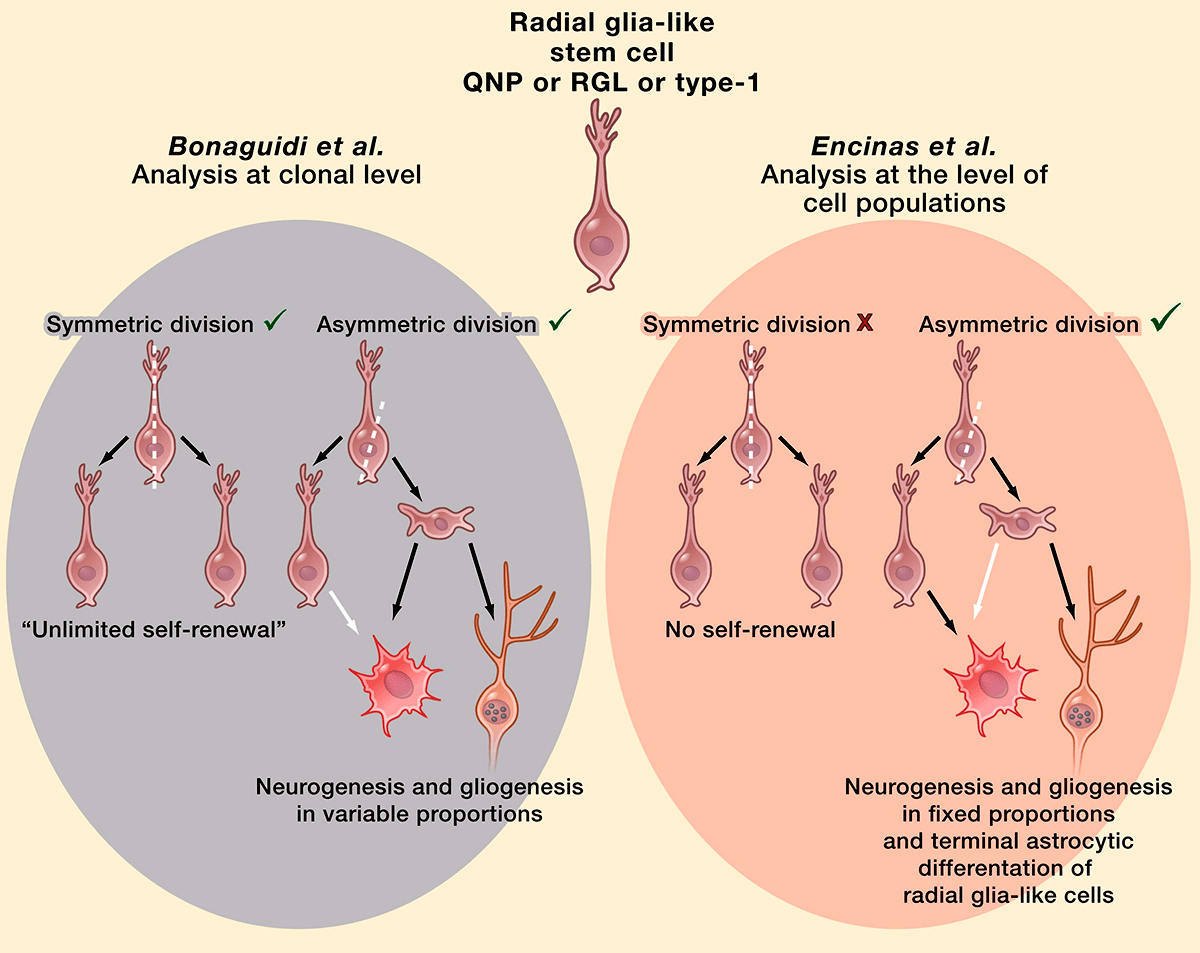
В настоящее время ведутся споры относительно судьбы QNP (quiescent neural progenitors, покоящихся нервных предшественников) после деления. Согласно «оптимистической» модели, стволовые клетки мозга — по аналогии с гемопоэтическими стволовыми клетками — являются самовозобновляемыми: в результате асимметричного деления они дают клетку, дифференцирующуюся потом в нейрон, а затем возвращаются в покоящееся состояние и могут быть заново активированы. В противоположность этому, согласно «пессимистической» модели, стволовые клетки зубчатой фасции не способны к самовоспроизведению, и их активация в конечном итоге приводит к превращению в астроциты. Предполагают, что сами стволовые клетки используются только единожды в течение взрослой жизни, выходя из этого пула после серии быстрых делений, в результате которых образуются прогениторы. Это объясняет и связывает между собой снижение темпов нейрогенеза и рост количества астроцитов в течение жизни (рис. 5) [16].
Рисунок 5. «Оптимистическая» (слева) и «пессимистическая» (справа) модели деления стволовых клеток.
В то же время вторая модель не исключает возможности нахождения в зубчатой фасции или малых популяций самовоспроизводящихся стволовых клеток, или клеток с удлиненными G2/M-фазами, или же каких-то специфических клеток, не экспрессирующих нестин. В последнем случае их просто не удалось бы обнаружить при использованном дизайне эксперимента.
. на работу которого многое может повлиять
Уровень новообразования нервных клеток — в частности, в зубчатой фасции — может меняться под воздействием множества факторов. Если принять во внимание «пессимистическую» модель и роль нейрогенеза в осуществлении некоторых функций гиппокампа, а также патогенез ряда нейродегенеративных заболеваний, станет очевидной важность определения мишеней для этих факторов — влияют ли они на молчащие стволовые клетки, расходуя их пул, или же способствуют выживаемости их потомков, или увеличивают количество их делений. Все влияния на нейрогенез в конечном итоге можно подразделить по результату их действия на положительные и отрицательные. К первым относятся как банальные (содержание в обогащенной среде, физическая нагрузка, прием антидепрессантов или мелатонина, социальные взаимодействия), так и специфические — вроде одноночной бессонницы или приема каннабиноидов. Ко вторым — радиация, стресс, хроническое недосыпание, злоупотребление опиатами, алкоголем и множество прочих общенегативных для мозга вещей.
Хотя в целом результат воздействия многих перечисленных факторов можно предугадать, механизм их воздействия, а также влияние их комбинаций требуют изучения — как для выстраивания правильной общей профилактики, так и для лечения конкретных заболеваний. Среди так называемых позитивных факторов особенно эффективным является обогащенная среда, включающая в себя физические упражнения. По различным данным, нахождение в течение небольшого количества времени (примерно от недели до месяца) в такой среде стабильно и значимо повышает уровень нейрогенеза, причем увеличение может быть даже пятикратным — в зависимости от возраста, состояния здоровья и других параметров [17]. Несмотря на активное изучение эффектов обогащенной среды на нейрогенез, на современном этапе исследований остается открытым вопрос о том, какие именно из ее компонентов (физическая или исследовательская активность) оказывают влияние на процесс формирования новых нейронов в мозге, а также на какие этапы нейрогенеза эти эффекты распространяются. Разрешение этих вопросов важно для поиска новых терапевтических и нейропротекторных воздействий и для нахождения эффективных путей регуляции нейрогенеза во взрослом мозге. Именно поэтому интерес к этой теме лишь усиливается, и количество статей по ней будет расти еще долгое время.