5 альфа редуктаза у мужчин что это
Риск эректильной дисфункции на фоне приема ингибиторов 5-α редуктазы
Ингибиторы 5-α редуктазы финастерид (5 мг) и дутастерид (0.5 мг) изначально использовались для лечения доброкачественной гиперплазии предстательной железы, вторым показанием для применения финастерида в дозе 1 мг служит алопеция.
Необходимо отметить, что сама по себе гиперплазия предстательной железы является независимым фактором развития эректильной дисфункции, однако получены данные о том. что ингибиторы 5-α редуктазы могут иметь схожий побочный эффект. Объяснением этому факту может служит лекарственно индуцированный дефицит андрогенов и снижение уровня 5-α дигидротестостерона.
Целью настоящего исследования было определить риск эректильной дисфункции у мужчин, получающих ингибиторы 5-α редуктазы по поводу доброкачественной гиперплазии предстательной железы и алопеции.
В анализ были включены когортные исследования, проводимые в Великобритании. Риски оценивались в популяции мужчин 40 лет и старше, не имеющих факторов риска эректильной дисфункции или других типов сексуальной дисфункции, и получающих ингибиторы 5-α редуктазы и/илиα-блокатор по поводу гиперплазии предстательной железы, а также пациенты в возрасте 18-59 с алопецией, которым назначался финастерид.
Конечной точкой исследования было выбрано развитие эректильной дисфункции.
В исследование были включены 71 849 пациентов с доброкачественной гиперплазией предстательной железы. Анализ не показал увеличения риска развития эректильной дисфункции на фоне применения монотерапии ингибиторами 5-α редуктазы (относительный риск 0.92, 95% CI, 0.85-0.99; отношение шансов 0.94, 95% CI, 0.85-1.03) и комбинации ингибитор 5-α редуктазы + α-блокатор (относительный риск 1.09, 0.99-1.21; отношение шансов 0.92, 0.80-1.06), по сравнению с монотерапией α-блокатором, вне зависимости от числа назначений и длительности приема.
Обращало на себя внимание повышение риска эректильной дисфункции на фоне длительности существования самой гиперплазии предстательной железы вне зависимости от используемой медикаментозной терапии.
При анализе пациентов с алопецией (n=12 346) риск эректильной дисфункции не увеличивался на фоне приема 1 мг финастерида по сравнению с теми, кто препарат не получал (относительный риск 1.03, 0.73-1.44; отношение шансов 0.95, 0.64-1.41).
Ингибиторы 5-α-редуктазы, как показывают результаты исследования, не повышают статистически значимо риск эректильной дисфункции. При этом риск эректильной дисфункции увеличивается с продолжительностью существования доброкачественной гиперплазии предстательной железы.
Источник: Katrina Wilcox Hagberg, Hozefa A Divan, Rebecca Persson, J Curtis Nickel, Susan S Jick. Risk of erectile dysfunction associated with use of 5-α reductase inhibitors for benign prostatic hyperplasia or alopecia: population based studies using the Clinical Practice Research Datalink. BMJ 2016;354:i4823
Доброкачественная гиперплазия предстательной железы
Доброкачественная гиперплазия предстательной железы (ДГПЖ) — одно из наиболее распространенных заболеваний, к 80 годам оно проявляется у 80-90% мужчин. Этиология ДГПЖ изучена недостаточно.
Клинически выявляются различные симптомы, связанные с нарушением пассажа мочи по нижним мочевым путям. Причинами нарушения мочеиспускания при ДГПЖ являются инфравезикальная обструкция и ослабление функции детрузора. В основе обструкции лежит увеличение простаты в размерах с постепенным сужением просвета мочеиспускательного канала (механический компонент) и повышение тонуса гладкомышечных волокон предстательной железы и задней уретры (динамический компонент).
Следует помнить, что многие из симптомов нарушения мочеиспускания не являются строго специфичными для ДГПЖ и могут встречаться при раке простаты или простатите, поэтому большое значение имеет правильная методика обследования и постановка диагноза.
“Золотым стандартом” лечения ДГПЖ во всем мире является трансуретральная резекция предстательной железы. Тем не менее медикаментозная терапия расстройств мочеиспускания, обусловленных ДГПЖ, в последние годы находит все более широкое применение. С одной стороны, это связано с разработкой новых лекарственных препаратов, а с другой — с расширением показаний к медикаментозной терапии и возможностью наблюдения за больными.
Поскольку на данный момент отмечается многообразие доступных способов консервативного лечения, актуален вопрос формулировки показаний и выбор препарата. Медикаментозную терапию следует назначать больным с начальными проявлениями нарушения мочеиспускания без вовлечения в процесс верхних мочевых путей и осложнений, пациентам с относительными и абсолютными противопоказаниями к оперативному лечению, а также отказавшимся от такового или откладывающим его по разным причинам.
В настоящее время несколько десятков препаратов применяются для медикаментозной терапии ДГПЖ. По происхождению и механизму действия они могут быть разделены на несколько групп.
Основные группы препаратов для консервативной терапии ДГПЖ
Альфа-адреноблокаторы являются самыми многочисленными и популярными препаратами для лечения ДГПЖ во всех странах мира, что обусловлено их высокой эффективностью и быстротой появления клинического эффекта.
Доказано, что в области тела мочевого пузыря локализуются преимущественно холинергические и бета-адренергические нервные рецепторы, в то время как в простатическом отделе уретры, в задней уретре и в предстательной железе — в основном альфа-адренергические рецепторы. Такое распределение нервных окончаний играет важную роль в координационной деятельности мускулатуры мочевого пузыря и предстательной железы.
Исследования последних лет дают основания полагать, что при ДГПЖ возрастает активность симпатических нервных волокон, что вызывает повышение тонуса гладкомышечных структур основания мочевого пузыря, задней уретры и предстательной железы. Процесс гиперплазии идет преимущественно за счет стромального компонента предстательной железы, который содержит до 60% гладкомышечных волокон, являющихся “мишенью” альфа1-адреноблокаторов. В основе механизма их действия лежит расслабление гладкой мускулатуры шейки мочевого пузыря и задней уретры.
Помимо устранения динамического компонента инфравезикальной обструкции, снижение активности симпатической нервной системы улучшает кровоснабжение органов малого таза и, в частности, мочевого пузыря, что уменьшает выраженность гипоксии, способствует улучшению биоэнергетики и сократительной способности детрузора.
На объем простаты и уровень ПСА сыворотки крови препараты этой фармакологической группы не влияют.
При сравнительном анализе результатов лечения разными альфа-адреноблокаторами доказано, что эффективность лечения ими сопоставима и достигает 60-70%, а различия касаются в основном параметров фармакокинетики (табл. 2).
В России одним из наиболее популярных лекарственных средств этой группы является альфузозин. Отсутствие необходимости титровать дозу выгодно отличает его от большинства альфа1-адреноблокаторов. Препарат назначают по 5 мг 2 раза в день после еды. На нашей кафедре доказана эффективность “дробной схемы” приема альфузозина по 5 мг 2 раза в сутки через день. Эта схема представляется очень перспективной, поскольку позволяет добиться столь же высоких результатов, как и стандартная, при большей экономичности.
В последнее время широкое распространение получила новая лекарственная форма с замедленным высвобождением, содержащая 10 мг альфузозина и рассчитанная на однократный прием в течение дня.
У большей части больных применение альфа1-адреноблокаторов сопровождается уменьшением степени выраженности расстройств мочеиспускания (IPSS) в среднем на 40% (в отдельных случаях до 75%) и улучшением качества жизни (QOL) вдвое. На фоне лечения отмечается улучшение уродинамических показателей: увеличение максимальной скорости мочеиспускания в среднем на 1,5—3,5 мл/с, или на 30—47%, уменьшение максимального давления детрузора и давления открытия, а также снижение количества остаточной мочи в среднем на 50%. Все это свидетельствует об объективном уменьшении инфравезикальной обструкции и ирритативной симптоматики при лечении альфа1-адрено-блокаторами.
Вышеуказанные положительные изменения появляются обычно на 2-4-й неделе приема и сохраняются на всем протяжении лечения. Если терапевтический эффект не наблюдается в первые 3 месяца терапии альфа1-адреноблокаторами (примерно 13—30% случаев), дальнейшее использование этих препаратов не показано.
Наиболее частые побочные эффекты при лечении альфа-адреноблокаторами — снижение артериального давления и, как следствие этого, головокружение, ортостатическая гипотензия и головная боль, возникающие у 4—10% больных.
Вышеперечисленные побочные эффекты наименее выражены у тамсулозина, относящегося к подгруппе альфа1а-адреноблокаторов. Альфа1а-адренорецепторы находятся исключительно в предстательной железе и составляют 70% от общего количества адренорецепторов простаты. В связи с высокой селективностью у тамсулозина практически отсутствует вазодилатирующий эффект, вследствие чего на фоне приема препарата не происходит понижения АД, а его эффективность сопоставима с таковой при назначении других альфа1-адреноблокаторов.
У больных ДГПЖ с сопутствующей артериальной гипертензией (что наблюдается в половине случаев) альфа1-адреноблокаторы приводят к существенному снижению артериального давления; при исходно нормальных его значениях гипотензивный эффект практически отсутствует.
Ингибиторы 5-альфа-редуктазы
Для медикаментозного лечения ДГПЖ часто используют и блокаторы 5-альфа-редуктазы, обладающие периферическим антиандрогенным эффектом. В настоящее время доказана роль гипоталамо-гипофизарно-гонадной системы в механизмах, обеспечивающих рост предстательной железы.
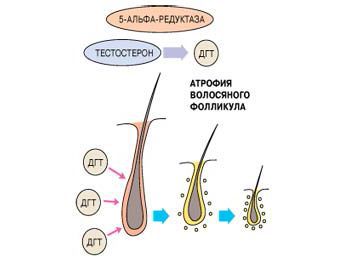
Внутриклеточный фермент 5-альфа-редуктаза превращает в предстательной железе тестостерон в активную форму — дигидротестостерон (ДГТ). Блокада фермента приостанавливает этот процесс, и тестостерон метаболизируется не в ДГТ, а в эстрадиол или андростендион, в результате предстательная железа перестает увеличиваться, а в 30—40% случаев может даже уменьшаться.
Ингибиторы 5-альфа-редуктазы по происхождению делятся на две группы: синтетические (финастерид) и растительного происхождения (препараты Serenoa repens).
В настоящее время наибольший экспериментальный и клинический опыт применения синтетических ингибиторов 5-альфа-редуктазы связан с финастеридом. Он относится к 4-азастероидам и является мощным конкурентным ингибитором фермента 5-альфа-редуктазы. Важно отметить, что препарат не связывается с андрогенными рецепторами и не дает побочных эффектов, характерных для “классических” гормональных средств.
Оптимальная доза финастерида составляет 5 мг/сут. Результаты исследований свидетельствуют, что у пациентов, получавших его в указанной дозе, уже через месяц отмечается снижение уровня ДГТ на 70—75%. При этом уменьшение объема предстательной железы через 3 месяца составило 18%, а через 6 месяцев — 27%.
Клинически значимое улучшение симптоматики и уменьшение объема предстательной железы отмечается примерно у 55—65% больных, причем у большинства из них не ранее чем через 6—12 месяцев после начала лечения финастеридом. Согласно данным, полученным в 2001 г., длительное применение препарата статистически достоверно уменьшает риск возникновения острой задержки мочеиспускания и снижает вероятность хирургического вмешательства.
К особенностям финастерида следует отнести свойство снижать уровень ПСА сыворотки крови на 50% после 6 месяцев лечения, что следует учитывать при проведении дифференциальной диагностики с раком простаты.
К наиболее значимым побочным эффектам препарата относятся: импотенция — 3,7, снижение либидо — 3,3, уменьшение объема эякулята — 2,8%. По нашим наблюдениям, через 4 года постоянного приема финастерида жалобы на половые расстройства стали более редкими, и вышеуказанные осложнения составляли 2,1; 1,5 и 0,3% соответственно.
Блокаторы 5-альфа-редуктазы растительного происхождения в основном представлены экстрактом американской вееролистной пальмы Serenoa repens. Результаты исследований свидетельствуют, что эти препараты обладают антиандрогенным, антипролиферативным и противовоспалительным эффектом на уровне предстательной железы.
Другие препараты растительного происхождения
С давних времен для лечения расстройств мочеиспускания у больных ДГПЖ применялись экстракты растений. Эти лекарственные средства улучшают субъективную оценку пациентами качества мочеиспускания и умеренно воздействуют на объективные параметры, вызывая при этом максимально низкий уровень осложнений и побочных эффектов. Их эффективность определяется содержанием фитостеролов, фармакологический механизм действия которых до конца не изучен.
Для приготовления фитотерапевтических препаратов наиболее часто используют Serenoa repens (пермиксон, простагут, серпенс), Pygeum africanus (таденан, трианол), Cucurbita pepo (номон, простамед).
Необходимо отметить, что при продолжительном применении их терапевтический эффект заметно снижается.
Прочие лекарственные средства
Применение этих препаратов не имеет четкого научного обоснования и в основном базируется на малочисленных эмпирических данных. Поэтому эти лекарственные средства (полиеновые антибиотики, аминокислотные комплексы и экстракты половых органов крупного рогатого скота) не включены в список лекарств, рекомендованных для лечения ДГПЖ.
Выбор препаратов
С целью правильного выбора препарата для медикаментозной терапии ДГПЖ мы предлагаем разделять пациентов на 4 категории и в зависимости от этого назначать им лекарство.
Категории больных ДГПЖ:
При соблюдении указанных принципов медикаментозная терапия ДГПЖ является высокоэффективной и способна значительно улучшить качество жизни больного.
Что такое андрогенная алопеция (облысение у мужчин)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гнездиловой М. В., врача-косметолога со стажем в 8 лет.
Определение болезни. Причины заболевания
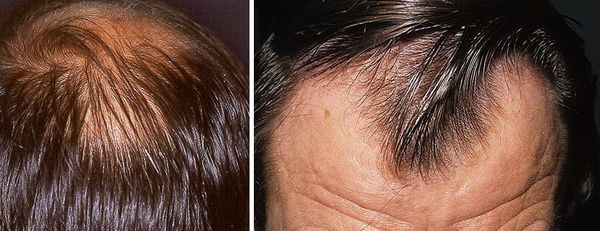
Андрогенетическая алопеция (АГА) — это выпадение волос в результате повышенной чувствительности волосяных фолликулов к андрогенам. У мужчин наблюдается двустороннее поредение лобно-височных областей с поражением фронтальной линии роста волос и поражение макушки. Код АГА в международной классификации болезней (МКБ-10) — L64.
Андрогенетическая алопеция может начаться в любом возрасте после периода полового созревания, но обычно наиболее выражена в 40-50 лет.
Присущая каждому фолликулу чувствительность к андрогенам и, следовательно, возраст начала, скорость развития, общая тяжесть и тип потери волос предопределены генетически. Тип наследования, вероятно, полигенный, т. е. зависящий от нескольких генов.
Симптомы андрогенной алопеции
Патогенез андрогенной алопеции
Механизм развития андрогенетической алопеции:
Роль перифолликулярного воспаления
Помимо андрогензависимых изменений, среди причин возникновения андрогенной алопеции выделяют влияние фолликулярного микровоспаления с разрастанием соединительной ткани (фиброза). Воспаление могут провоцировать бактерии, токсины и окислительный стресс.
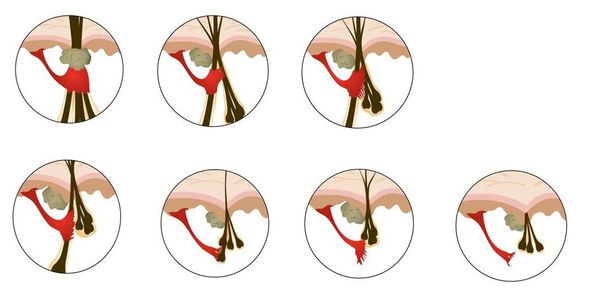
Патофизиологические изменения в цикле роста волос
Кроме миниатюризации волосяных фолликулов, при андрогенетической алопеции меняется динамика волосяного цикла.
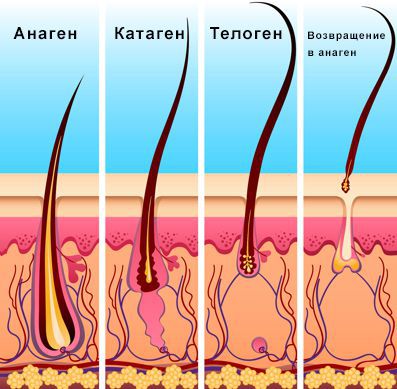
Нормальный жизненный цикл волоса:
При андрогенетической алопеции фаза анагена постоянно укорачивается, поэтому длина волос уменьшается до тех пор, пока они не станут настолько короткими, что их уже не видно у фолликулярных отверстий. Фаза телогена остаётся такой же или удлиняется, что приводит к повышенному выпадению волос и увеличению количества пустых фолликулов на голове.
Изменения в фолликулярных единицах
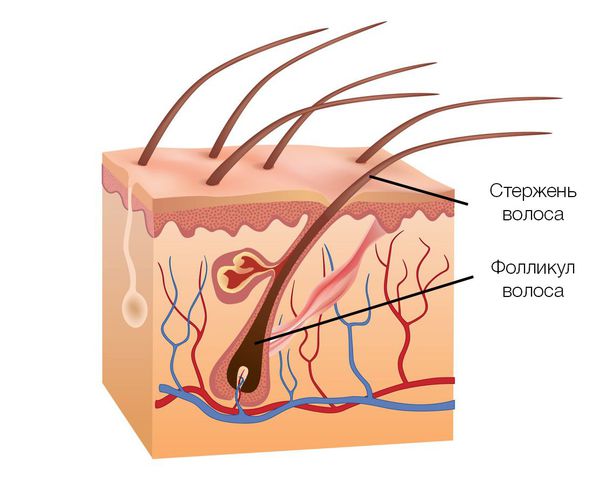
Фолликулярная единица — совокупность волосяных фолликулов (корней волос с окружающими их тканями).
Вначале миниатюризация затрагивает несколько волос, но не все волосы в пределах одной фолликулярной единицы, поэтому в поражённых участках головы наблюдается не полное отсутствие волос, а их уменьшение в каждой фолликулярной единице.
Важную роль играет также связь между волосами в каждой фолликулярной единице и мышцей, поднимающей волосы.
У большинства млекопитающих чётко прослеживается иерархия волос в пределах фолликулярной единицы:
Классификация и стадии развития андрогенной алопеции
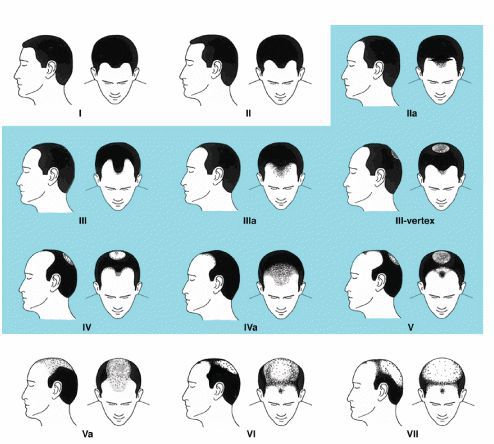
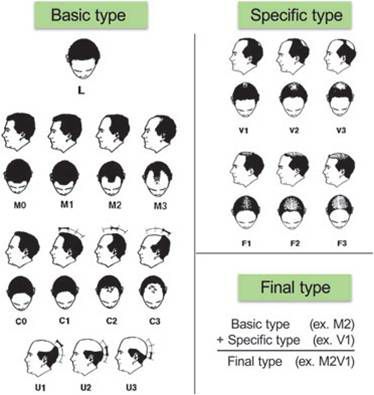
Степень выраженности облысения определяется по шкале Норвуда — Гамильтона.
Шкала Норвуда — Гамильтона:
Осложнения андрогенной алопеции
Андрогенная алопеция может снижать качество жизни — большинство пациентов напуганы своим состоянием, временно дезориентированы, проявляют чрезмерную эмоциональность или испытывают комплексы при общении с людьми.
Диагностика андрогенной алопеции
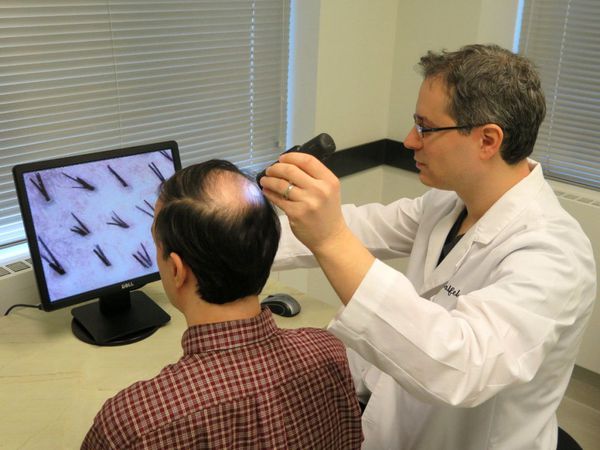
Для диагностики андрогенной алопеции применяют методы обзорных фотографий, трихоскопии и фототрихограммы.
Метод обзорных фотографий (макросъёмка)
С помощью макросъёмки можно объективно оценить состояние волос и кожи головы пациента. Метод используется при проведении клинических исследований, а также при длительном лечении. Фотосъёмка проводится с применением стереотаксических устройств позиционирования.
Трихоскопия
Трихоскопию волос и скальпа проводят с помощью ручного дерматоскопа или светового видеомикроскопа (или видеокамеры). С помощью трихоскопии оценивают:
Дерматоскопические признаки андрогенетической алопеции (АГА):
Разность диаметров волосяного стержня более чем у 20 % волос — важный признак андрогенетической алопеции.
Феномен пустующих фолликулов — на коже волосистой части головы появляются жёлтые точки, которые соответствуют пустующим фолликулам. Цвет точек связан с тем, что расширенные фолликулярные устья заполнены себумом — кожным салом, который вырабатывают сальные железы.
Пигментация — неспецифический признак андрогенетической алопеции, который часто встречается. Это сетчатая, ячеистая пигментация поверхностного слоя кожи, хорошо заметная при 40–50-кратном увеличении. Пигментация вызвана повышенным воздействием солнечных лучей на кожу головы, недостаточно покрытую волосами.
Перипилярные знаки (перифолликулярная пигментация), также называемые перипилярными кольцами, выглядят как тёмный ореол размером около 1 мм вокруг фолликулярного устья, из которого выходит волос.
Фототрихограмма
Метод, помимо вышеперечисленных параметров, позволяет оценить соотношение волос в анагеновой и телогеновой фазах, а также процент веллусных и терминальных волос в разных фазах.
Для проведения фототрихограммы врач выбирает участок, расположенный в стандартной точке в лобно-теменной зоне.
На первом этапе фототрихограммы триммером сбривают волосы на участках размером 10х10 мм. Затем в зоне фототрихограммы ставится татуажная метка для проведения повторных исследований в той же области. Через 2-3 дня среди подбритых волос можно будет обнаружить отросшие анагеновые и оставшиеся прежней длины телогеновые волосы.
Диагноз андрогенетической алопеции ставится, если:
Для исключения исправимых причин алопеции могут назначаться лабораторные исследования:
Также важна история приёма лекарственных препаратов.
Лечение андрогенной алопеции
1. Специфические препараты:
Чтобы поддерживать рост волос, препарат принимают ежедневно в течение длительного времени.
Побочные эффекты: импотенция, потеря либидо, уменьшение количества спермы (у 2-3 % пациентов).
«Дутастерид» («Аводарт») блокирует 5-альфа-редуктазу 1, 2 типов, из-за чего снижается синтез ДГТ в коже и предстательной железе. Период полураспада у «Дутастерида» длиннее, поэтому его воздействие на половую функцию потенциально тяжелее и длительнее, чем у «Финастерида».
Кроме ингибиторов 5-альфа-редуктазы для лечения андрогенной алопеции используют блокаторы рецепторов к андрогенам («Флутамид»). Препарат влияет на либидо и размер молочных желёз: наблюдается гинекомастия (увеличение грудных желез), сперматогенез и снижение потенции, поэтому наряду с антиандрогенами рекомендуется применять стимуляторы потенции.
2. Неспецифические препараты: (наружные, введение методом электропорации, мезотерапия).
Миноксидил («Регейн») — чувствительный к аденозинтрифосфату (АТФ) активатор калиевых каналов, который стимулирует выработку VEGF (фактор роста эндотелия сосудов) в клетках дермального сосочка.
Ранние стадии облысения лечатся лучше, чем длительно существующая гладкая лысина. Лечение миноксидилом даёт первые результаты через 4 месяца и стабильный рост волос через 12 месяцев. Рост волос сохраняется всё время, пока пациент применяет миноксидил. При отмене препарата облысение начинается снова. Лекарство стимулирует волосяные фолликулы, увеличивает кровоток, продлевает активную стадию роста волоса. Также препарат приводит к сокращению числа телогеновых фолликулов и увеличению размера волосяного фолликула.
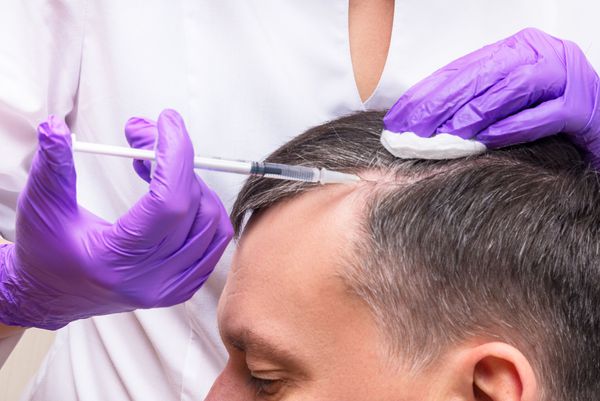
Инъекционные методы в лечении андрогенной алопеции
Используются техники поверхностного и глубокого наппажа, точечные инъекции или микропапулы, фракционная мезотерапия и фармакопунктура.
Техника наппажа, или внутрикожно-поверхностная мезотерапия, выполняется серией мелких и частых инъекций с минимальным объёмом вещества.
Микропапулы — техника более глубокого проникновения препарата, чем при наппаже. Активный коктейль вводится на глубину 1.5-2 мм, расстояние между проколами составляет около 10 мм.
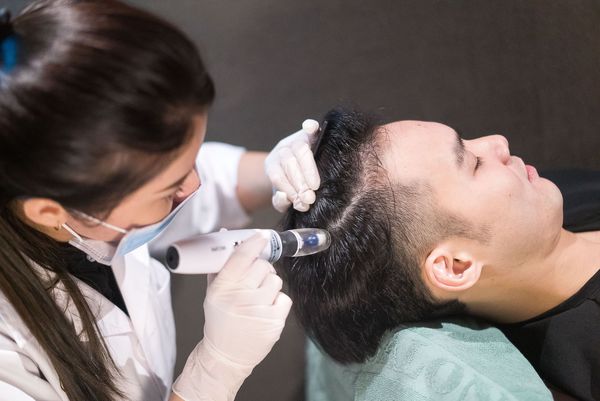
Микропунктурное воздействие с помощью скальп-роллера. Скальп-роллер — это барабан, на поверхности которого размещено около 200 микроигл длиной 0,5 —1,0 мм. При прокатывании ролика по коже происходит её перфорация с образованием множества микроканалов, через которые нанесённые вещества проникают в глубокие слои кожи. Микротравмы служат пусковым моментом для развития местной воспалительной реакции, сопровождающейся выделением множества биологически активных соединений. Эти соединения стимулируют восстановительные процессы, выработку коллагена и эластина.
Фракционная мезотерапия предполагает одновременное выполнение множественных микроинъекций с помощью специального аппарата. При проведении процедуры в зоне облысения происходит мощная стимуляция роста волос за счёт усиления васкуляризации (образования новых кровеносных сосудов), повышения обменных процессов и активности деления клеток дермальных сосочков и образования матричных кератиноцитов волосяных фолликулов.
Перспективные инъекционные ингредиенты и терапевтические композиции для лечения алопеции:
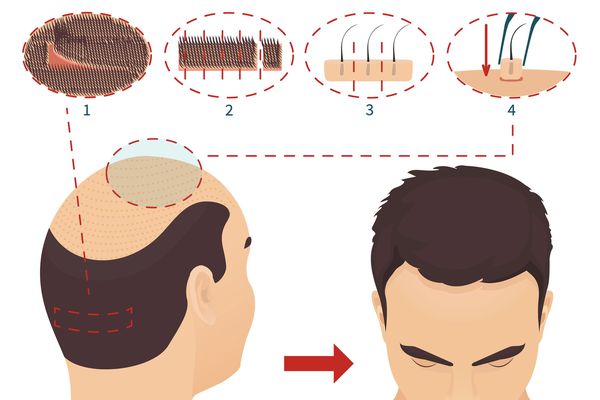
Хирургическое восстановление волосяного покрова
Хирургический метод состоит в перераспределение терминальных волос с целью закрыть какую-либо часть редеющего участка волосистой части головы. Количество волосяных фолликулов при этом остаётся неизменным. У мужчин трансплантаты из затылочной части головы пересаживают на редеющие участки при помощи специальных инструментов-панчей. Стандартной техникой считается пересадка фолликулярных юнитов, содержащих от 1 до 4 волос:
Оба метода имеют свои показания и могут комбинироваться. Опытные хирургические бригады могут значительно улучшить состояние волосистой кожи головы за 1 – 2 операционные сессии.
Повысить приживляемость волосяных фолликулов можно с помощью плазмотерапии — инъекций обогащённой тромбоцитами собственной плазмы пациента (PRP). Тромбоциты выделяют множество факторов роста, обладающих стимулирующим воздействием, в том числе и на клетки волосяных фолликулов.
Ожидания пациента должны быть реалистичными — трансплантация волос не прекращает облысение, волосам в зоне трансплантации нужна регулярная поддержка. Кроме того, пациент должен знать, что на донорском и реципиентном участках волосы могут временно выпадать — это реакция на хирургическое вмешательство. Пересаженные волосы начинают расти, как правило, через 3-4 месяца.
Осложнения после пересадки волос крайне редки. К ним можно отнести:
Прогноз. Профилактика
Современные сферы исследований и будущие методы лечебного воздействия — стволовые клетки фолликулярного происхождения и технологии культивирования тканей волосяного фолликула.