5 системные принципы работы мозга
Пять принципов, которые определяют работу нашего мозга
Независимый обозреватель, экс-редактор Rusbase
Андрей Курпатов, руководитель Лаборатории нейронаук и поведения человека в Сбербанке, на форуме AI Journey рассказал о пяти принципах работы человеческого мозга и объяснил, почему мы совершаем ошибку, когда собираемся его досконально воспроизводить.
Все хотят, чтобы самый мощный компьютер был адекватен человеческому мозгу. Я много мозгов подержал в руках и, должен сказать, видел некоторые суперкомпьютеры. Когда их сравниваешь, есть подозрение, что люди как-то неправильно об этом думают.
Мы должны понимать, что, когда создавался мозг, не было единого плана. Это происходило достаточно спонтанно, эволюция много экспериментировала. Поэтому в наших мозгах есть куча рудиментов, атавизмов, изменение функций разных отделов и так далее.
Задачи нашего мозга определены эволюционно, и они тоже очень ограничены. То есть если вам кажется, что ваш мозг был сотворен для создания искусственного интеллекта, то это не так, его основная задача — чтобы мы жили и передали свои гены дальше.
Поэтому, когда мы собираемся воспроизводить мозг, возможно, мы совершаем ошибку. И нужно думать не о том, чтобы воспроизвести мозг досконально, а о том, чтобы адаптировать принципы естественного интеллекта для цифровой среды.
Я расскажу про пять основных принципов, которые определяют работу нашего мозга на всех уровнях организации.
Но прежде надо узнать про нас несколько неприятных вещей.
Что мы такое
То, что мы думаем о самих себе и то, что на самом деле представляет собой наш мозг, — это две совершенно разные вещи. Правда состоит в том, что наше сознание не является специфической сущностью, — это артефакт, точно такой же, как и ощущение красного.
Принцип генерации сложности
Наши мозги — сложнейший инструмент по созданию картинок, звуков и прочих образов из очень ограниченного количества раздражителей.
Поступающая к нам информация — это данные с ограниченного количества механорецепторов, хеморецепторов и рецепторов электромагнитных волн. Как из этого можно создавать такой красочный образ мира, это вопрос, о котором я хочу сейчас сказать пару слов.
Возможно, вы знаете о таком явлении, как синестетики. Когда мы рождаемся, клетки связаны хаотично. И потом, по мере взросления, одни клетки отмирают, другие — становятся более выраженными.
Если при рождении ваша слуховая кора связана со зрительной зоной, то эти связи должны распасться. Но у некоторых людей они не распадаются. В этом случае звуки будут обрабатываться вашим мозгом как цвета. То есть, вопрос состоит только в том, в какую часть мозга будет приведен соответствующий сигнал.
Если посмотреть на общую схему, то она выглядит следующим образом — мы представляем собой некое рецепторное поле, на которое подается аналоговый сигнал. Мы ограничены теми сигналами, которые можем воспринять. Это, по сути, моделирование реальности мозгом.
В свое время эта гениальная идея была сформулирована Людвигом Витгенштейном, когда он наткнулся на статью в газете, где описывалось судебное заседание, связанное с первой дорожной аварией, которая случилась в Вене.
Судья пытался разрешить конфликт, но не мог представить, что случилось, потому что не понимал, что такое автомобили и как они могут врезаться друг в друга. Чтобы он сообразил, нужно было сделать модельки этих машин, улицы и показать, как произошла авария.
Витгенштейн говорит, что отсюда должна следовать сущность истины — мы все время моделируем реальность и имеем дело с моделью, а не с реальностью как таковой.
Принцип отношений
Вот ваш череп, а в нем — животное со спинным мозгом и 12 хвостиками, которые он вытащил наружу, чтобы собирать информацию. Вопрос — если он получает данные, как он может понять, с чем имеет дело?
Вы сидите там, в темноте, и оттуда видите мир, который полон стольких красок, чувств, звуков. Решается это за счет принципа, который был в свое время сформулирован представителями гештальт-психологии, — на самом деле мы ничего не воспринимаем, мы воспринимаем что-то относительно чего-то.
Вот классический пример с курицей и квадратами. Курицу в первой фазе эксперимента учат тыкать на черный квадрат, — тогда она получает зерна. Если она тыкнет на серый, то награды не будет. Вопрос: на что будет тыкать эта курица во второй части эксперимента, где один квадрат будет темно-серый, а второй — светло-серый?
Если правы бихевиористы (а они правы), мы воспринимаем просто фактические раздражители. Значит, она будет тыкать на темно-серый, потому что воспринимает не серый цвет, а контраст.
Мораль сей басни такова: мы с вами не воспринимаем никаких фактов, а только отношения между ними.
Кроме того, память, которая, как нам кажется, железобетонная, кристаллическая, на самом деле, таковой не является. Если мы посчитаем, на что рассчитаны наши мозги, то окажется, что места хватит всего на три года видеопамяти. Вы, наверное, живете чуть дольше.
Надо понимать, как работает память. Если я попрошу вас вспомнить последнее съеденное яблоко, вы не вспомните то самое. У вас есть кортикальные колонки, отвечающие за зеленое, красное, желтое, сладкое, кислое и так далее. Из этих элементов вы и соберете яблоко, которое, как вам кажется, вы ели в прошлый раз. На самом деле это не так — мы не храним информацию обо всех яблоках, которые съели.
Как во всей этой неразберихе мозг умудряется разбираться в своих моделях и действовать целенаправленно? Это решается за счет третьего принципа.
Принцип аппроксимации
Мы не создаем модели реальности просто, чтобы их создать. Мы это делаем зачем-то. Это, конечно, эволюционно продиктовано, поэтому даже шестимесячные дети могут справиться с такой задачей.
Представьте, что я показываю шестимесячному ребенку мультик, в котором есть три действующих персонажа — красный кружок, желтый треугольник и синий квадрат. Кружок пытается забраться на гору, желтый треугольник ему помогает, а синий квадрат мешает.
После этого я предлагаю ребенку выбрать игрушку — синий квадрат или желтый треугольник. Ребенок выбирает желтый треугольник — потому что уже в шесть месяцев он понимает, что ему нужен тот, кто будет оказывать помощь. Это фундаментальный принцип, когда мы пытаемся найти в окружающей реальности нечто, исходя из нашей потребности.
У нас есть куча слов, которые определяются друг через друга. И это определение друг через друга позволяет нам концептуализировать пространство, которое мы имеем.
Они могут быть не связаны с реальностью. Чтобы это дело аппроксимировать, мы создаем нарративы. Все, что мы рассказываем друг другу, — это бесконечное количество историй.
Принцип преобразования
Если посмотреть на наш мозг, его можно разделить разными способами.
Мы можем разделять мозг на множество отдельных систем, но он при этом работает как единая система. Есть параллельно идущие процессы генерации и локальности. Сейчас ведется много исследований, которые показывают, что наш мозг работает именно таким способом.
Принцип «тяжести»
Этот принцип отвечает за принимаемые мозгом решения. Я говорил, что наше сознание иллюзорно и свободы воли нет. Ученые способны предсказывать решения, которые вы примете сознательно, за восемь секунд до того, как вы это сделаете. Что же происходит?
На этот вопрос ответил Алексей Алексеевич Ухтомский, который изучал оборонительную реакцию. Собака, закрепленная в экспериментальном станке, держала лапы на металлической пластине, на которую подавался электрический ток. Собака вскидывала лапы, и Алексей Алексеевич считал, когда нервная система перестанет так резко реагировать.
В какой-то момент собака перестала откидывать лапы. Он подумал, что прибор сломался, но дело оказалось в другом — в этот момент верх над оборонительной реакцией взяла реакция дефекации. В один момент может быть одна доминанта одного поведения — нельзя делать одновременно и то, и другое. Формируется специфическая тяжесть, которая определяет, что станет нашей доминантой.
А что происходит, когда речь идет о более сложных вещах, чем оборонительная реакция? За это отвечают лобные доли, задача которых — предложить разные варианты развития будущего. И то будущее, которое в большей степени отвечает вашим потребностям и вашим ожиданиям от действительности, создает тяжесть соответствующей доминанты.
Вывод
Так, существуют пять принципов, которые работают в мозге на всех уровнях организации — от клеточного до системного. За каждым из них стоит достаточно простая математика. Может быть, не самая простая, но если мы сможем интегрировать в компьютер каждый из этих принципов, мы получим совершенно новое существо.
Оно будет обладать интеллектом, потому что будет построено на принципах работы нашего мозга. Но сможет делать значительно больше, нежели мы, ограниченные потребностями, способами восприятия, модальностями, интенсивностью.
Так что нам есть чему поучиться у мозга. Только надо это делать, не пытаясь воспроизвести его механически, а стремясь понять, какие принципы определяют его работу.
В целях сохранения благозвучности некоторые цитаты приведены не дословно.
Фото в тексте и на обложке: Софья Федосеева
Нейроны и нейромедиаторы
Химические цепочки
Все чувства и эмоции, которые испытывают люди, возникают путем химических изменений в головном мозге. Прилив радости, который человек ощущает после получения положительной оценки, выигрыша в лотерею или при встрече с любимым, происходит вследствие сложных химических процессов в головном мозге. Мы можем испытывать огромное количество эмоций, например таких, как печаль, горе, тревога, страх, изумление, отвращение, экстаз, умиление. Если мозг дает телу команду на осуществление какого-либо действия, например, сесть, повернуться или бежать, это также обусловлено химическими процессами. «Химический язык» нашей нервной системы состоит из отдельных «слов», роль которых исполняют нейромедиаторы (их еще называют нейротрансмиттерами).
Любой нейрон может получать большое количество химических сообщений, как положительных, так и отрицательных («работай» или «стоп»), от других нейронов, которые его окружают. Эти сообщения могут конкурировать или «сотрудничать», между собой, заставляя нейрон отвечать специфическим образом. Поскольку все эти события происходят в течение очень короткого времени (считаные доли секунды), очевидно, что медиатор должен быть удален из синаптического пространства очень быстро, чтобы те же самые рецепторы могли работать снова и снова. И это удаление может происходить тремя способами. Молекулы нейромедиатора могут быть захвачены назад в то нервное окончание, из которого они были выделены, и этот процесс получил название «обратный захват» («reuptake»); нейромедиатор может быть разрушен специфическими ферментами, находящимися в готовности недалеко от рецепторов на поверхности нейрона; или активное вещество может просто рассеяться в окружающую область мозга, и быть разрушено там.
Изменение нейротрансмиссии с помощью лекарств
Рассмотрим, что происходит при изменении уровней нейромедиаторов мозга на примере трех из них (серотонин, дофамин и гамма-аминомасляная кислота (ГАМК).
Серотонин
Многие исследования показывают, что низкий уровень серотонина в головном мозге приводит к депрессии, импульсивным и агрессивным формам поведения, насилию, и даже самоубийствам. Лекарственные вещества под названием антидепрессанты создают блок на пути обратного захвата серотонина, тем самым несколько увеличивая время его нахождения в пространстве синапса. Как итог, в целом увеличивается количество серотонина, участвующего в передаче сигналов с нейрона на нейрон, и депрессия со временем проходит.
В последние годы ведутся бурные дискуссии вокруг психического расстройства, носящего название «синдром дефицита внимания с 
Наркотическое вещество, известное как «экстази» или МДМА, также изменяет уровень серотонина в мозге, но намного более радикально. Он заставляет выделяющие серотонин нейроны выплескивать все содержимое сразу, затапливая этим химикатом весь мозг, что, конечно, вызывает ощущение чрезвычайного счастья и гиперактивность (чрезмерную двигательную активность). Однако, за это приходится расплачиваться позже. После того как экстази израсходовал весь мозговой запас серотонина, включаются компенсаторные механизмы, быстро разрушающие избыток нейромедиатора в мозге. После того, как спустя несколько часов действие наркотика заканчивается, человек, вероятно, будет чувствовать себя подавленным. Этот период «депрессии» продлится до тех пор, пока мозг не сможет восполнить запасы и обеспечить нормальный уровень медиатора. Повторное использование на этом фоне экстази может привести к глубокой депрессии или другим проблемам, которые будут тянуться в течение долгого времени.
Дофамин
Ученые обнаружили, что люди с расстройством психики, известным как шизофрения, фактически чрезмерно чувствительны к дофамину в мозге. Как следствие, при лечении шизофрении используются лекарства, которые блокируют дофаминовые в головном мозге, таким образом, ограничивая воздействие этого нейромедиатора.
С другой стороны, вещества, известные как амфетамины, увеличивают уровень дофамина, заставляя нейроны его высвобождать, и препятствуя его обратному захвату. В некоторых странах врачи используют разумные дозы этих препаратов при лечении некоторых заболеваний, например, синдрома гиперактивности с дефицитом внимания. Тем не менее, иногда люди абсолютно необдуманно неправильно используют эти вещества, пытаясь обеспечить себе повышенный уровень бодрствования и способность решать любые задачи.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота, или ГАМК, является главным медиатором, чья роль заключается в передаче нейронам команды «стоп». Исследователи полагают, что определенные типы эпилепсии, которые характеризуются повторными припадками, затрагивающими сознание человека и его двигательную сферу, могут являться результатом снижения содержания ГАМК в головном мозге. Передающая система мозга, не имея адекватного «тормоза», входит в состояние перегрузки, когда десятки тысяч нейронов начинают сильно и одновременно посылать свои сигналы, что приводит к эпилептическому приступу. Ученые полагают, что за разрушение слишком большого количества ГАМК могут быть ответственны мозговые ферменты, в связи с чем появились лекарства, которые помогают остановить этот процесс. Время показало их эффективность в лечении не только эпилепсии, но и некоторых других нарушений работы мозга.
Гормоны
Химическое взаимодействие
Как системная биология раскрывает тайны мозга
Как системная биология раскрывает тайны мозга
Работа мозга — одна из самых интригующих тайн жизни. Рисунок в полном размере.
Автор
Редакторы
Эта статья завершает цикл «Пятерка по системной биологии». В ней мы расскажем, в каком состоянии сейчас находятся науки о мозге, какие у них приоритеты и перспективы, а также опишем посвященные мозгу научные работы, выполненные в рамках стипендиальной программы по системной биологии ФМИ.
Пятерка по системной биологии
Победителями Стипендиальной программы по системной, клеточной и молекулярной биологии, организованной российскими аффилированными лицами компании «Филип Моррис Интернэшнл» (ФМИ) на базе Центра наук о жизни Сколковского института науки и технологий, ежегодно становятся пять молодых ученых до 35 лет. Знания по своим темам у стипендиатов, без сомнения, также заслуживают «пятерки» — поэтому спецпроект и получил такое название.
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Как изучают мозг, почему это так сложно и зачем вообще это делать
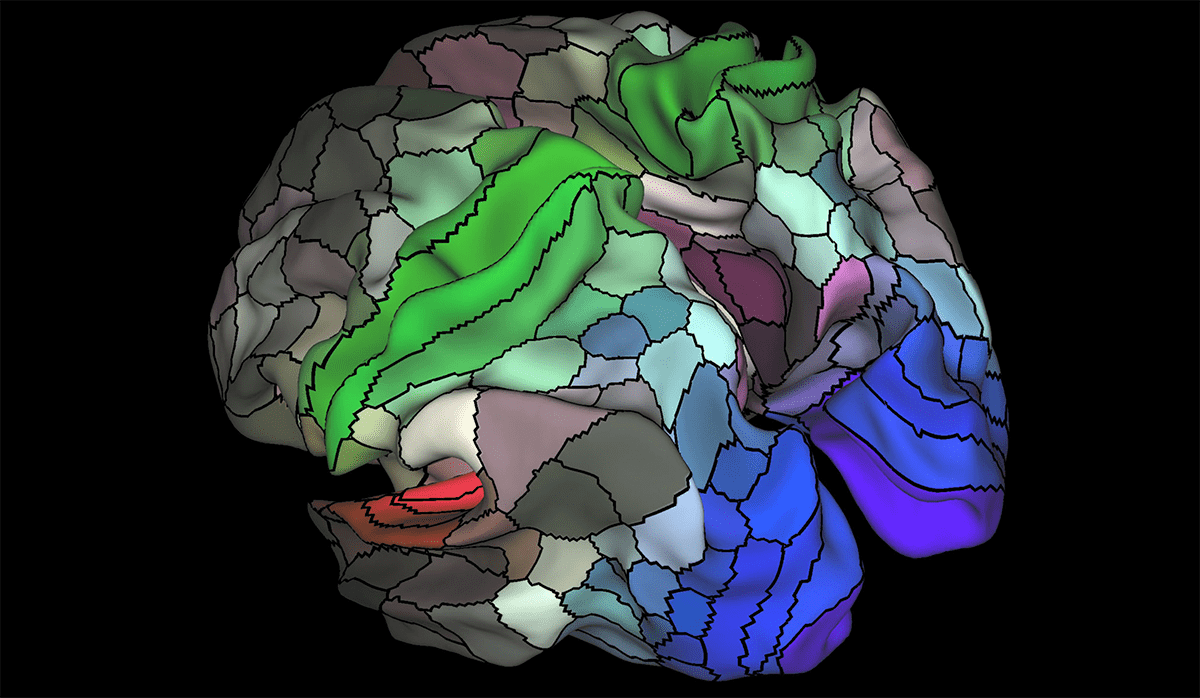
Исследовать головной мозг очень тяжело, ведь этот орган невероятно сложен. Кора головного мозга делится на 180 участков [1] (рис. 1), которые состоят из нейронов с аналогичной структурой, функциями и связями, а всего человеческий мозг содержит около 84,6 миллиардов глиальных клеток, 86 миллиардов нейронов [2] и примерно 10 15 синапсов, соединяющих нейроны друг с другом [3]. Это настолько умопомрачительно сложная сеть, что полное описание структуры всех связей в мозге человека — коннектóм — до сих пор недоступно. Еще бы: ведь даже небольшой набор данных (микроконнектом) с полным разрешением занимает 12 терабайт [4]!
Рисунок 1. Карта коры головного мозга, полученная при помощи фМРТ: цветом выделены 180 участков с различными функциями
Однако изучать мозг критически важно, причем не только потому, что это интереснейший биологический объект. У фундаментальных исследований мозга есть важное практическое значение. Только досконально разобравшись, как работает мозг, мы научимся лечить заболевания головного мозга человека. Например, изучение нейронных основ амблиопии [5] — расстройства зрения у детей, при котором в мозг поступают искаженные сигналы, из-за чего зрительная кора головного мозга неправильно воспринимает сигналы от глаз, — уже помогло разобраться с происхождением болезни и выявить ранние чувствительные периоды, в течение которых ребенку проще всего помочь.
Сегодня в мире действует несколько международных проектов, посвященных фундаментальным исследованиям мозга. Например, в 2013 году сотрудники Национальных институтов здравоохранения (NIH) США запустили инициативу BRAIN, нацеленную на всестороннее изучение мозга на нескольких уровнях. При Институте нейровизуализации и информатики им. Марка и Мэри Стивенс (USC) действует Human Connectome Project, задача которого — построить карту нейронных сетей в человеческом мозге (то есть коннектом), которая выявит анатомические и функциональные связи в здоровом мозге человека и предоставит совокупность данных, необходимых для исследования причин заболеваний мозга. Например, дислексии, расстройств аутистического спектра, болезни Альцгеймера и шизофрении.
И это далеко не всё. Например, специалисты из Института исследования мозга Аллена под руководством Аллана Джонса составили транскриптомный атлас человеческого мозга. Он уже позволил расширить наши знания о функциях отдельных зон мозга, лучше понять причины заболеваний центральной нервной системы, а в будущем поможет разобраться с функциями малоизученных генов мозга, экспрессия которых была обнаружена при составлении атласа. Подробнее прочитать об этом можно в статье «Allen Brain Atlas: транскриптом мозга» [6].
В Европе действует проект Human Brain Project (HBP), включающий 121 научный институт из 20 стран. Его ключевая задача — моделирование головного мозга человека. HBP вырос из предыдущего крупного исследования — Blue Brain Project, — авторам которого удалось смоделировать нейронную колонку коры больших полушарий мозга крысы. Прочитать об этом подробнее можно в статьях «Blue Brain Project: как все связано?» [7] и «Blue brain project: связи и хаос» [8].
Аналогичные проекты существуют и в Азии. В Японии с 1997 года работает RIKEN Brain Science Institute (BSI), организованный по четырем основным направлениям исследований: разум и интеллект, функции нейронных цепей, механизмы заболеваний и развитие передовых технологий. А в 2010 году китайское Министерство науки и технологий (MOST) профинансировало проект Brainnetome — один из 50 крупных китайских проектов, сотрудники которого совместно с учеными из США занимаются визуализацией и вычислительным анализом того, как функционируют нормальные и поврежденные нейронные сети.
В нашей стране глобального проекта по исследованию мозга пока нет, а в уже существующих международных проектах Россия не участвует. В 2019 году президент Российской академии наук Александр Сергеев призвал запустить общенациональный проект по исследованию мозга, но он пока не стартовал. Тем не менее в нашей стране много научных центров, сотрудники которых очень активно занимаются исследованиями мозга — в том числе с международным сотрудничеством.
Профессор Филипп Хайтович об основных направлениях исследования мозга
Филипп Хайтович, Ph.D., профессор Центра нейробиологии и восстановления мозга при Сколтехе, Иллинойсский Университет в Чикаго.
Существует два основных направления в исследованиях мозга. Первое — это изучение анатомической структуры мозга на гистологическом, клеточном и молекулярном уровнях. А второе — это изучение активности мозга. Это когда ученые пытаются связать проявления нашей мозговой деятельности — например, если мы слушаем музыку или о чем-нибудь думаем, — со всеми процессами и активностями, которые происходят в нашем мозге в это время. Оба направления дополняют друг друга: помогают связать структуру, то есть строение мозга, с функцией — то есть с тем, как именно он работает.
Если речь идет об изучении мозговой ткани, в большинстве случаев исследовать приходится мертвый или умирающий мозг, потому что иначе получить материал невозможно. Методы из этой группы обладают очень высоким разрешением, но не позволяют прослеживать функциональные изменения мозга. К ним относятся, например, нейромикроскопия и аффинное окрашивание нейронов.
«Сегодня существует много методов расшифровки состава ткани, отдельных клеток, активности генов, липидного состава мембран, метаболического состава с помощью масс-спектрометрии, с помощью биохимии, расшифровки последовательностей РНК и ДНК, — рассказывает профессор Филипп Хайтович. — Мы наконец-то получили возможность узнать, какие клетки есть в нашем мозге. Казалось бы, мы изучаем это уже много лет. Однако до сих пор не можем сказать, сколько типов нейронов и сколько типов глиальных клеток находится в тех или иных регионах мозга».
Благодаря методам молекулярной биологии мы понемногу начинаем получать ответы на эти вопросы. Например, о том, что о работе мозга смогли выяснить специалисты из исследовательской группы профессора Филиппа Хайтовича, можно прочитать в статье «Как биологи работают с большими массивами данных» [9]. Однако исследователей, которые пытаются раскрыть тайны мозга на молекулярном уровне, гораздо больше: многие из них работают в крупных проектах, посвященных мозгу, или в уже упоминавшемся Институте исследования мозга Аллена.
Но, к сожалению, у методов молекулярной биологии тоже есть ограничения — например, они не дают никакой информации о том, как эти клетки взаимодействуют друг другом, с клетками других типов и с остальными структурами в ходе работы мозга. И здесь на помощь приходят методики, позволяющие изучать работу живого мозга.
С этой целью в нейробиологии применяют оптогенетику [10], которая позволяет управлять модифицированными нейронами лабораторных животных при помощи света, позитронно-эмиссионную томографию (ПЭТ) и ряд других методик. Почитать о них можно в статье «12 методов в картинках: нейробиология» [11], а во врезке ниже мы расскажем о четырех самых популярных методиках, которые принесли человечеству множество ярких открытий.
Четыре самые популярные методики изучения работы мозга
Возможно, ситуация изменится, если Илону Маску удастся завершить проект Neuralink [14]. В ходе этого проекта планируется разработать высокоточного нейрохирургического робота, способного вводить в мозг электроды микронного размера (на обезьянах это, кажется, уже удалось). Возможно, когда-нибудь это позволит исследовать мозг здоровых добровольцев с высоким пространственным и временным разрешением.
Еще мы можем изучать работу мозга, используя модельные организмы — от грызунов до приматов. Однако нужно иметь в виду, что мозг этих живых существ ощутимо отличается от нашего и по числу анатомических областей в коре головного мозга, и по количеству связей между ними. Так что переносить на людей данные, полученные на животных, нужно с большой осторожностью. Почему так, можно узнать из статьи «Что особенного в мозге человека?» [15].
Грызуны и обезьяны: самые популярные модельные организмы для исследований мозга
Генетически модифицированные мыши и крысы, в определенные нейроны которых ввели светочувствительный белок опсин, — излюбленные модели для онтогенетических исследований мозга. О том, как создают трансгенных мышей и каким образом в их мозг вводят электроды (для этого применяется метод под названием «стереотаксис»), можно прочитать в статье «Модельные организмы: грызуны» [16].
Однако самые лучшие модельные организмы для изучения мозга — это, конечно, приматы, ведь по своему строению и функциям обезьяний мозг куда ближе к человеческому, чем мышиный. А поскольку крохотных, меньше килограмма весом, игрунок легко содержать в неволе, это делает их (наряду с макаками резус) незаменимыми проводниками в мир разума представителей нашего вида. Прочитать о том, как наши ближайшие родственники помогают нам изучать человеческие болезни, можно в материале «Модельные организмы: приматы» [17].
Узнать больше об органоидах можно из статьи «Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом» [19]. А о том, какие проблемы возникают при изучении человеческого мозга и как ученые пытаются их решать, рассказано в статье «Что нам стоит мозг построить?» [20].
В трех предыдущих статьях спецпроекта мы рассказывали о работах стипендиатов, посвященных системной, молекулярной и клеточной биологии [21]; системной иммунологии [22]; и системной биологии хроматина [23]. В этой статье речь пойдет о двух интересных работах, поддержанных стипендиальной программой по системной биологии ФМИ на базе Сколтеха. Обе работы касаются актуальных тем, интересующих научное сообщество по всему миру: эволюции и генетики мозга.
Чем мозг человека с РАС отличается от мозга здорового человека на молекулярном уровне
Стипендиат 2016 года: Екатерина Храмеева, к.б.н, старший преподаватель Центра наук о жизни Сколтеха.
Название проекта: «Молекулярные маркеры нормального и аномального развития, старения и продолжительности жизни в мозге человека».
Расстройство аутистического спектра, или РАС, — это нарушение развития человека, которое может вызывать серьезные социальные, коммуникативные и поведенческие проблемы. Причем симптомы могут быть как легкими, так и довольно тяжелыми, сильно затрудняющими нормальную жизнь.
«Механизм возникновения РАС до сих пор неизвестен. Значит, такие исследования, как наше, очень важны, — рассказывает Екатерина Храмеева. — Они помогают собрать информацию о том, что же именно меняется в работе мозга и приводит к РАС».
Исследования РАС смогут облегчить жизнь людям с этим состоянием. Кроме того, работа поможет разобраться с уникальным механизмом нарушения эволюционно нового, специфичного для человека социального поведения, которое не встречается у обезьян. Но чтобы понять, чем «обычный» мозг отличается от мозга человека с РАС, необходимо изучать молекулярные маркеры, отличающие один объект от другого.
«Молекулярные маркеры — это любые отличия на молекулярном уровне между патологией и нормой, — рассказывает Екатерина Храмеева. — Чаще всего под “молекулярными маркерами” подразумевают молекулы, количество которых сильно изменяется при РАС. Это могут быть метаболиты — небольшие молекулы вроде глюкозы или аминокислот, образующиеся в процессе обмена веществ; гены, экспрессия которых сильно меняется при нарушениях в работе мозга; и генотипы — тогда речь идет о различиях на уровне ДНК между здоровыми и людьми, у которых есть нарушения в работе мозга».
По данным предыдущих исследований было известно, что в сыворотке крови людей с РАС повышалась концентрация глутамата [24] и продуктов гликолиза — лактата и пирувата. Напротив, понижалась концентрация карнитина [25] — переносчика жирных кислот из цитозоля в митохондрии — и глутатиона [26] — ключевого нейтрализатора активных форм кислорода. Несмотря на то, что существующие исследования охватывали различные аспекты изменения концентрации метаболитов при РАС, они не смогли полностью оценить метаболические различия, происходящие в мозге.
Чтобы разобраться с механизмом развития этого расстройства, нужно собрать воедино все данные по генотипам, генам и метаболитам и интегрировать их. Иными словами, нужно найти «поломку» на уровне ДНК, в результате которой уменьшается экспрессия определенного гена. Это очень непростая задача: в теории, из-за снижения экспрессии должно снижаться количество белка, так что эти белки синтезируют меньше метаболитов. Однако на практике связать гены и метаболиты не так просто: далеко не все поломки на уровне ДНК приводят к изменениям экспрессии, а информация о связи генов с метаболитами довольно скудная.
«Мы изучили 32 образца мозговой ткани пациентов с РАС, 40 образцов здоровых людей из группы контроля и еще по 40 от шимпанзе и макак. Каждая группа охватывала широкий возрастной диапазон: 2–60 лет для лиц с РАС и 0–61 год для контрольной группы. При помощи метода жидкостной хроматографии [27] и масс-спектрометрии (LC-MS) в положительном и отрицательном режимах ионизации нам удалось измерить в префронтальной коре 1366 метаболитов. Это далеко не все метаболиты, которые есть в мозге, зато наш экспериментальный метод позволял детектировать их с высокой точностью», — рассказывает Екатерина Храмеева.
РАС влияет на когнитивные способности, особенно ярко выраженные у людей. Измерения метаболома мозга у шимпанзе и макак позволили определить 170 из 1366 метаболитов как специфичные для человека: их уровни в человеческом мозге были значительно повышены или понижены по сравнению с приматами.
«Гены, отвечающие за синтез этих метаболитов, преимущественно находились в 27 путях. И оказалось, что эти 27 путей неслучайно перекрываются с путями, затронутыми изменениями в метаболизме у пациентов с РАС, — рассказывает Екатерина Храмеева — Так, пути метаболизма пирувата, пуринов и пиримидинов содержали большое количество изменений, специфичных для человека, и одновременно характерных для пациентов с РАС. Это наблюдение позволяет предположить, что при РАС могут быть нарушены эволюционно новые, приобретенные человеком особенности метаболизма мозга. Интересно, что похожая гипотеза была сформулирована ранее на основе измерений уровней экспрессии генов у человека, приматов и пациентов с РАС [28]».
Значительные отличия здорового мозга от мозга при РАС удалось найти для 202 (15%) из 1366 детектируемых метаболитов, преимущественно в 16 метаболических путях. Все различия в интенсивности метаболитов, группирующиеся по этим путям, были обнаружены в моче [29], [30]. А отличия, связанные с циклом трикарбоновых кислот, метаболизмом глутатиона и метаболизмом пирувата, были описаны в крови пациентов с РАС [31], [32].
«Из нашего исследования можно сделать вывод, что метаболические изменения в мозге при аутизме отражаются на метаболическом составе крови и мочи. Значит, их можно диагностировать. Возможно, наши наблюдения можно будет использовать для разработки новых методов лабораторной диагностики РАС», — объясняет Екатерина Храмеева.
Выявленные изменения в метаболизме пуринов у людей с РАС очень интересны, ведь передача пуринергических сигналов участвует в процессах развития нервной системы — включая пролиферацию, дифференцировку клеток и перекрестное взаимодействие нейронов и глии. До этого уже было показано, что пуринергическая передача сигналов изменяется при множестве психических расстройств, включая РАС [33].
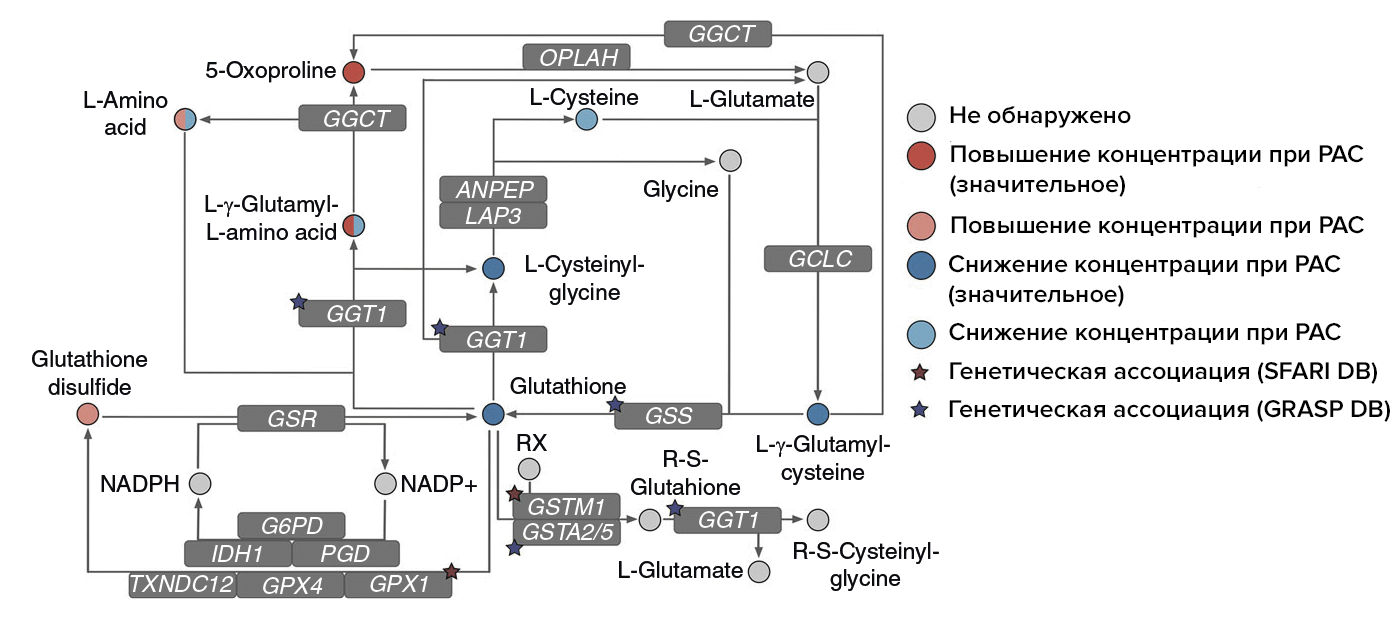
Кроме того, серьезные отличия удалось обнаружить в пути метаболизма глутатиона [34], [35] (рис. 2) — этот синтезируемый прямо в мозге трипептид играет первостепенную роль в антиоксидантной защите мозга, охраняя его от повреждения активными формами кислорода. Истощение запасов глутатиона наблюдается при старении и различных неврологических расстройствах — например, при болезни Альцгеймера и болезни Паркинсона.
Рисунок 2. Упрощенное схематическое изображение пути метаболизма глутатиона. Звездочками отмечены гены, содержащие генетические варианты, связанные с РАС, — их нашлось 5 штук. Кроме того, при этом состоянии многие метаболиты также поменяли свою концентрацию. Эти данные позволяют предположить, что изменения в метаболизме глутатиона должны играть ключевую роль при развитии РАС.
Мозг людей с РАС отличался низкой концентрацией глутатиона и связанных с ним метаболитов: L-цистеинилглицина и L-γ-глутамил-L-цистеина. Но, помимо этого, разница наблюдалась и на уровне генетических вариантов, связанных с ферментами, катализирующими реакции с участием глутатиона и его метаболитов. Таких как ген, кодирующий ферменты из класса глутатионпероксидаз (GPX1 и GGT1), и гены системы детоксикации (GSTM1). Полиморфизмы в этих генах ранее уже связывали с РАС [36].
Екатерина Храмеева: новые проекты
В моей лаборатории параллельно ведется много проектов. В основном это исследования упаковки ДНК в ядре у разных организмов — например, у дрозофилы [37]. Мы пытаемся разобраться, как особенности упаковки связаны с функциями, с работой генов. А связь эта несомненно есть: мы довольно хорошо понимаем, что укладка ДНК может регулировать работу генов.
Но тонкости того, как именно это происходит, не ясны. Кроме того, нарушения в упаковке ДНК могут приводить к различным заболеваниям человека — например, к разным типам рака. Поэтому надо разобраться в деталях. О том, что уже удалось выяснить, можно прочитать в статье «Неуловимая архитектура хроматина мухи» [38].
Исследования мозга мы тоже не забросили. Недавно начали интересный проект совместно с Университетом Бен-Гуриона в Израиле. Мы изучаем белок SIRT6, который участвует в упаковке ДНК и одновременно связан со старением и нейродегенеративными заболеваниями.
Мы «выключили» этот белок в мозге мышей и смотрим на изменения, произошедшие в результате этого, на всех доступных нам молекулярных уровнях: на уровне метаболитов, липидов (жиров), экспрессии генов, упаковки ДНК. Потом будем все эти данные интегрировать и пытаться понять, какие именно процессы регулирует белок SIRT6 и как это связано со старением и нейродегенеративными заболеваниями. Надеюсь, удастся узнать что-то новое про механизмы их возникновения.
Правда ли, что люди пожертвовали регенерацией ради крупного мощного мозга?
Стипендиат 2016 года: Анастасия Иванова, научный сотрудник лаборатории молекулярных основ эмбриогенеза ИБХ РАН.
Название проекта: «Широкомасштабное исследование генетической сети гена Ag1, продукт которого — секретируемый регулятор раннего развития мозга и регенерации, исчезнувший у высших позвоночных».
Исследование Екатерины Храмеевой было сосредоточено на молекулярных основах нарушения развития человеческого мозга: это практичная тема, по результатам которой, возможно, когда-нибудь будут созданы методики для диагностики РАС по крови и моче. Однако исследования мозга — это еще и интереснейшая фундаментальная сторона. Например, Анастасия Иванова и ее коллеги из лаборатории молекулярных основ эмбриогенеза ИБХ РАН во главу угла поставили эволюционную историю. Их задачей было прояснить интересный эволюционный вопрос: чем пришлось «пожертвовать» представителям нашего вида, чтобы приобрести такой великолепный и сложный мозг?
Лаборатория ИБХ РАН, в которой работает Анастасия Иванова, занимается исследованиями механизмов раннего развития мозга. Все началось с исследований генов гомеобокса Anf, которые впервые появились в геномах позвоночных. Гены Anf контролируют развитие конечного мозга — у людей эта структура известна как кора головного мозга. Подробнее о том, как были открыты Anf, можно прочитать в статье «Лаборатория молекулярных основ эмбриогенеза: от гена к признаку» [39].
При этом гены, которые мы утратили в процессе эволюции, не менее интересны, чем гены, которые у нас остались. Один из генов-мишеней гомеобокса Anf, а именно ген секретируемой дисульфид-изомеразы Ag1, присутствует только в геномах низших позвоночных — рыб и амфибий, — но при этом его нет в геномах рептилий, птиц и млекопитающих. При этом у низших позвоночных этот ген регулирует развитие мозга и регенерацию конечностей.
Но что, если высшим позвоночным пришлось «пожертвовать» геном Ag1 и связанной с ним регенерацией как раз для того, чтобы приобрести конечный мозг?
Анастасия Иванова: как был обнаружен ген Ag1 и зачем он нужен
Ген Ag1 был впервые обнаружен в процессе изучения раннего развития у ксенопуса (Xenopus laevis) — гладкой шпорцевой лягушки (прочтите об этом удивительном существе больше: «Модельные организмы: ксенопус» [40]).
Ген Ag1 интересен тем, что вовлечен в формирование переднего мозга у анамний (то есть у рыб и амфибий), причем таким образом, что не дает разрастаться коре больших полушарий. В то же время ген регулирует регенерацию конечностей и хвоста. В ходе эволюции этот ген исчезает у амниот (то есть у рептилий, птиц и млекопитающих). Одновременно с его исчезновением зона коры заметно вырастает, а способность к регенерации сильно снижается.
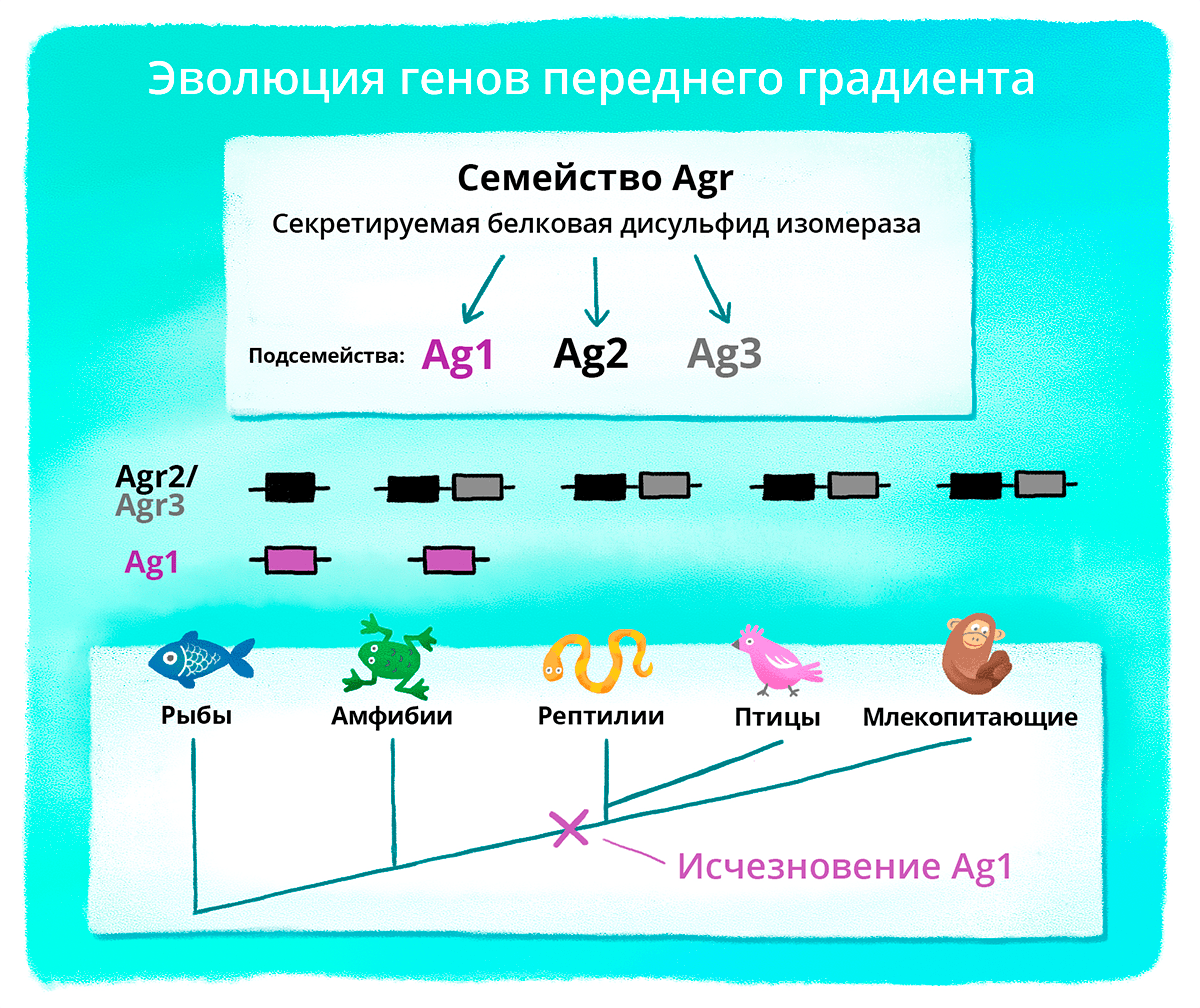
Всего генов из группы Agr три: Ag1, Agr2 и Agr3. Все они регулируют раннее развитие переднего мозга у эмбрионов лягушки. Но из этой троицы в процессе эволюции только Ag1 экспрессируется на стадии формирования мозга (рис. 3). Ген Ag1 заинтересовал исследователей, потому что они увидели шанс проверить гипотезу, что в некоторых случаях крупные эволюционные события — например, изменения в регенеративной способности и развитии мозга у высших позвоночных, — могут быть вызваны «потерей» некоторых важных генов, участвующих в регуляторных механизмах, ответственных за эти события.
Рисунок 3. Как гены из группы Agr постепенно исчезали в процессе эволюции. Фиолетовым цветом выделен ген Ag1. На рисунке видно, что этот ген есть у рыб и амфибий, а у рептилий, птиц и млекопитающих он исчезает. У беспозвоночных этого гена нет.
презентация работы Анастасии Ивановой, адаптация Любови Колосовской
Во время эмбрионального развития у рыб и рептилий ген Ag1 участвует в формировании переднего мозга. Он ограничивает экспрессию нейтральных генов в области, прилегающей к мозгу, так что в результате вокруг формируются эктодермальные плакоды — особые утолщения эпителия.
У Homo sapiens sapiens эктодермальные плакоды, расположенные в верхней части головы, принимают участие в развитии нейронов сенсорной нервной системы, слухового пузырька и вестибулярного аппарата. А у шпорцевых лягушек они так и остаются утолщениями эпителия. Но если подавить экспрессию этого гена (частично, так как при полном подавлении его экспрессии зародыши погибают), передний мозг формируется значительно больших размеров, чем обычно.
«Гены Agr2 и Agr3 есть и у человека, причем их повышенная экспрессия связана со злокачественными опухолями, с их быстрым и агрессивным ростом и метастазированием, — рассказывает Анастасия Иванова. — Однако механизм работы этих генов до сих пор до конца не изучен. Нам показалось важным исследовать ген Ag1 на самой ранней ступени его появления. Мы хотели изучить его консервативность, а также сопоставить регулируемую им генную сеть с его исчезновением в эволюции».
Анастасия и ее коллеги хотели получить весь спектр генов, участвующих в регуляции работы Ag1, чтобы определить основной механизм его действия в раннем развитии и в регенерации. Им было интересно отследить, какой именно сигнальный каскад претерпел перестройку и какие гены были вовлечены в этот процесс.
Анастасия и коллеги подготовили образцы зачатка переднего мозга с нормальной и подавленной экспрессией Ag1 и провели высокопроизводительное РНК-секвенирование транскриптома. Они обнаружили, что во время развития переднего мозга Ag1 ингибирует несколько генов пролиферации. В образцах мозга ксенопуса, где был подавлен этот ген, наблюдалась сильная активация генов POU (у X. Laevis это гены Oct-91, Oct-60 и Oct-25) [41], которые играют решающую роль в развитии и функционировании нервной системы.
Ген Ag1 подавляет гены трех сигнальных путей. Это сигнальный путь MAPK [42], отвечающий за пролиферацию, дифференциацию, развитие, трансформацию и апоптоз; сигнальный путь Fox [43], регулирующий многие физиологические события, в том числе контроль клеточного цикла и апоптоз; и сигнальный путь TGF-β [44], который нужен для управления ростом и дифференциацией клеток у эмбрионов и взрослых особей. Судя по всему, за счет подавления этих сигнальных путей ген Ag1 блокирует деление клеток в соседней области переднего мозга. Так что исчезновение Ag1 у млекопитающих действительно могло привести к увеличению коры головного мозга.
В то же время Ag1 активирует экспрессию генов цитоскелета и нейруляции. Это ингибитор сигнального пути FoxO [45], цитоскелетные белки, фокальные контакты, через которые цитоскелет клетки соединяется с внеклеточным матриксом, и сигнальный путь р53, который реагирует на стрессы, способные нарушить точность репликации ДНК и помешать нормальному делению клеток. Исследователи предположили, что подавление FoxO-пути с эволюционной точки зрения требовалось для поддержания регенерации, потому что без этого невозможна клеточная пролиферация. Это позволяет выдвинуть гипотезу, что рептилии, птицы и млекопитающие были вынуждены «избавиться» от гена Ag1, чтобы защитить себя от рака.
Чтобы регенерация была успешной, организм должен успешно подавлять иммунный ответ. Ведь если иммунная система активна, раны заживают до того, как утраченный орган успеет регенерировать. Так и происходит в реальности: в процессе регенерации ген Ag1 подавляет некоторые гены, ответственные за иммунитет. Таким образом, исчезновение Ag1 может привести к высокому иммунному ответу и быстрой эпителизации раны.
В ходе работы ученые уделили особое внимание зависимым от Ag1 генам, которые также исчезли в ходе эволюции. Один из этих генов — Ras-dva1, кодирующий малую ГТФ-азу [46]. Этот фермент регулирует развитие мозга у эмбрионов ксенопуса. Кроме того, он отвечает за формирование бластемы — особого раневого эпителия со слоем потерявших специализацию клеток, из которого затем формируется утраченная конечность. Данные подтвердили, что Ras-dva1 активируется в ответ на ранение и участвует в регенерации у этого вида лягушек. Вполне вероятно, что утрата генов Ras-dva1 в ходе эволюции позвоночных могла привести к нарушению системы индукции регенерационной бластемы и, следовательно, к резкому ослаблению способности к регенерации у амниот.
Возможно, полное понимание механизмов регенерации у низших позвоночных позволит понять причину ее утраты у высших. А значит — определить, возможно ли путем активации определенных сигнальных каскадов включить «спящие» механизмы регенерации и активировать дедифференцировку клеток у взрослого человека, позволяя ему восстанавливать утраченные части тела, будь то конечность или внутренние органы.
«Проект, связанный со стипендией, завершился, но мы продолжаем подтверждать полученные данные различными методами и писать статьи, — рассказывает Анастасия Иванова. — Например, в 2018 году вышли два исследования, посвященные роли малых ГТФ-аз Ras-dva1 в регенерации у рыб и земноводных [47], [48].
О практическом применении говорить пока рано, мы все-таки фундаментальная лаборатория. Однако мы надеемся, что когда-нибудь фундаментальные исследования эволюционно консервативных мишеней и каскадов среди генов Agr лягут в основу таргетной терапии рака».
Анастасия Иванова — о стипендии ФМИ
В 2016 году я увидела объявление о конкурсе. В нашей работе мы планировали применить метод транскриптомного секвенирования для поиска потенциальных мишеней гена Ag1. Тема оказалась подходящей, и я решила попытаться.
Я очень рада, что мне удалось выиграть стипендию ФМИ. Во-первых, мне удалось познакомиться с биоинформатиками, что оказалось очень важным для нашей работы. Мы неоднократно консультировались с ними и значительно продвинулись в исследованиях. Во-вторых, это возможность пообщаться с учеными из других стран и получить экспертное мнение о своей работе.
Мой совет для соискателей стипендии, которые захотят продолжить изучение мозга: не бойтесь и смотрите на объект широко, не зацикливаясь только на собственном опыте и предположениях.
Будущее нейробиологии
Нейробиология — одно из самых быстро развивающихся направлений биологии. И это неудивительно, ведь о работе мозга мы еще знаем очень мало. До сих пор много неясного в области поведенческой биологии (как мозг управляет поведением). Много загадок в клеточной нейробиологии, которая исследует нейроны и глиальные клетки мозга, и в молекулярной нейробиологии, предмет изучения которой — роль отдельных молекул в нервной системе.
Екатерина Храмеева: что еще предстоит узнать о работе мозга?
Мозг можно изучать еще очень и очень долго. Например, из-за методических сложностей при работе с образцами мозга упаковка ДНК в мозге исследована плохо. Есть буквально пара статей про здоровый мозг, а про изменения упаковки ДНК при когнитивных расстройствах почти ничего не известно. При этом кажется, что такие изменения должны быть: экспрессия генов ведь меняется, и сильно, а она напрямую связана с особенностями упаковки. Может быть, есть какой-то общий механизм регуляции работы генов, который «ломается» при заболеваниях мозга. Найти его будет непросто, но, если удастся, это будет большой прорыв.
Другое перспективное направление, которым мы занимаемся в Сколтехе, — липидомика [49], [50]. Мозг человека состоит из липидов больше, чем наполовину, и они принимают участие во всех процессах в мозге. При этом липидный состав мозга изучен довольно плохо, опять же из-за методических сложностей. Поэтому есть где развернуться. Мало что изучено и конкуренции мало, так как в мире немногие лаборатории занимаются липидомикой.
Кстати, сложности с ней возникают не столько в экспериментальной части, сколько в анализе данных: надо точно идентифицировать липиды, убрать технические эффекты, шум из данных. А готового софта для обработки липидных данных мало, и он работает не идеально. Приходится многое разрабатывать самим.
Только когда эти разделы наук о мозге накопят достаточно данных, наступит эра клинической нейробиологии — науки, которая изучает расстройства нервной системы. Возможно, лет через пятьдесят человечество настолько серьезно продвинется в изучении мозга, что мы наконец-то получим возможность эффективно лечить — а может быть, даже предотвращать — заболевания головного мозга.
Это действительно возможно, в том числе благодаря работам стипендиатов, появлению на свет которых помогли сотрудники ФМИ и Сколтеха, создавшие стипендию по системной биологии (см. врезку). Ведь компания ФМИ уже очень давно занимается не только исследованием табачных продуктов. Это и создание искусственных органов на чипе для научных исследований, и фундаментальные исследования по изучению вторичных метаболитов табака, и даже разработка вакцины от коронавируса. Подробнее о том, чем занимаются в ФМИ, можно прочитать в первой статье цикла «Стипендия по системной биологии: инициатива, которая вдохновляет» [51].
Дмитрий Улупов: история появления стипендиальной программы по системной биологии ФМИ
Дмитрий Улупов, управляющий по научно-исследовательским вопросам у российских аффилированных лиц компании «Филип Моррис Интернэшнл» (регион Восточная Европа)
В ФМИ мы уже много лет используем самые передовые научные методы и подходы для исследования свойств наших бездымных продуктов, в том числе — системную биологию и биоинформатику, и мы с коллегами обсуждали идеи, как компания может помочь развивать эту научную область в России.
В 2013 году на одной из презентаций фонда «Сколково» я узнал от Алексея Пономарева, вице-президента Сколтеха по связям с промышленностью, что в Сколтехе создается научно-образовательный центр системной биологии и биоинформатики. Двумя годами позже я познакомился с Константином Севериновым, директором ЦНИО системной биомедицины и биоинформатики, — он был очень удивлен при первой встрече, что наша компания в принципе занимается исследованиями в области системной биологии. В ходе общения родилась идея стипендиального проекта по поддержке молодых российских ученых, в котором мы участвуем как грантодатель, а Сколтех обеспечивает операционную поддержку и научную экспертизу заявок стипендиатов.
Все проекты стипендиатов настолько разнообразны и интересны, что трудно выделить «самый любимый». Некоторые имеют очевидное прикладное значение, другие ориентированы на фундаментальную науку и разработку новых исследовательских методик. Я надеюсь, что все стипендиаты будут успешны в научной деятельности — кто знает, может, среди них уже есть будущий Нобелевский лауреат.
Стипендия ФМИ по системной биологии с каждым годом играет все более важную роль, причем не только в российской, но и в мировой науке.
«Первые стипендии были вручены весной 2016 года, уже почти 5 лет назад, — рассказывает Дмитрий Улупов. — Сегодня я вижу, что программа продолжает устойчиво работать, вызывает интерес в научном сообществе биологов и биоинформатиков, а главное — реально помогает молодым талантливым ученым реализовывать научные проекты в России».
По окончании трехлетней стипендии стипендиаты подготавливают финальную презентацию научных проектов. В 2018 и 2019 годах ее проводили как выездной симпозиум в Научно-исследовательском центре ФМИ в Невшателе (Швейцария), чтобы стипендиаты могли своими глазами увидеть, как ФМИ работает в области системной биологии, какое оборудование и методы использует, познакомиться с результатами наиболее актуальных исследований.
«С прошлого года из-за пандемии “живые” встречи, не говоря уже о зарубежных поездках, практически невозможны, поэтому симпозиум пришлось проводить в виртуальном формате, через Zoom, — рассказывает Дмитрий Улупов. — Тем не менее всем стипендиатам удалось представить результаты своих проектов и обсудить их с учеными Сколтеха и ФМИ, а мои швейцарские коллеги презентовали результаты краудсорсингового исследования микробиоты кишечника человека. Все это прошло в очень дружеской атмосфере».
На этом мы завершаем наш цикл. Надеемся, что вдохновили кого-то из вас подать заявку на стипендиальную программу!