болевые синдромы в практике клинициста
Миофасциальный болевой синдром в практике клинициста
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Статья посвящена миофасциальному болевому синдрому в практике клинициста
Для цитирования. Рачин А.П., Азимова Ю.Э., Выговская С.Н., Нувахова М.Б., Воропаев А.А., Курбанбагамаева Р.Р. Миофасциальный болевой синдром в практике клинициста // РМЖ. 2015. No 28. С. 1665–1668.
Боль — это психологическое состояние, возникающее в результате сверхсильных или разрушительных воздействий на организм при угрозе его целостности или существованию [1]. Исключительно велико клиническое значение боли как симптома, нарушающего нормальное течение физиологических процессов, поскольку ряд патологических процессов организма дает знать о себе в болевых ощущениях еще до появления внешних признаков заболевания. Боль нужно рассматривать как интегративную функцию организма, которая включает в себя такие компоненты, как сознание, ощущения, эмоции, память, мотивации и поведенческие реакции. Исходя из этого боль не является чертой исключительно физического функционирования организма, она также демонстрирует и его деятельность как индивидуума с соответствующей многовариантностью жизнедеятельности, возрастом, особенностями культуры и т. п. Именно поэтому существует много определений боли [2].
1. Боль — это сигнал опасности, в связи с которым вступают в действие защитные реакции (Л.А. Орбели, 1938).
2. Боль — ощущение страдания (С.И. Ожегов, 1970).
3. Боль — это интегративная функция организма, которая мобилизует функциональные системы для защиты организма и включает такие компоненты, как память, мотивации, вегетативные, соматические и поведенческие реакции, эмоции (А.К. Анохин, 1976).
4. Боль — болезнь, болесть, хворь, хвороба, хворость, недужина, недуг, немочь, немощь, немогута, скорбь (телесная), хиль, хилина, боля, нездоровье — самое чувство, телесное страдание (В.И. Даль. Толковый словарь живого великорусского языка).
В то же время общепринятым является определение боли, предложенное Международным обществом по изучению данного феномена еще в 1994 г.: боль — это неприятное ощущение и эмоциональное переживание, возникающее в связи с настоящей или потенциальной угрозой повреждения тканей или описываемое терминами такого повреждения [3]. В данной статье будут представлены некоторые клинические, диагностические и фармакологические аспекты одного из наиболее запутанных с точки зрения интерпретации патогенеза возникновения боли — миофасциального болевого синдрома (МФБС).
Несколько слов о терминологии МФБС
По мнению Г.А. Иваничева и Н.Г. Старосельцевой (2002), в отечественной литературе существует более 25 определений болевых синдромов с локализацией в мышцах, фасциях и связочном аппарате, что создает определенную путаницу в терминологии данного состояния [4]. В этой связи предпочтительным кажется определение, представленное в терминологическом словаре Дж. Тревелл и Д. Симонс одноименной монографии (1989) «Миофасциальный синдром» (МФС): «Боль и/или вегетативные симптомы, отраженные из активных миофасциальных триггерных точек, с проявлением дисфункции» [5].
В то же время миофасциальный болевой синдром (МФБС), по мнению авторов, представляет синоним МФС. В соответствии с определением МФБС, основную роль в возникновении боли играют миофасциальные триггерные точки (ТТ) — участки повышенной раздражимости (обычно в пределах напряженных пучков скелетных мышц или мышечной фасции), они болезненны при надавливании и могут отражать в характерные для нее зоны боль, повышенную чувствительность и вегетативные проявления [по Дж. Тревелл и Д. Симонс, 1989].
Стадии МФБС
(По Г.А. Иваничеву и Н.Г. Старосельцевой, 2002)
I степень (латентный миогенный триггерный пункт) — местная боль в покое отсутствует, провоцируется давлением или растяжением мышцы, отраженная боль не вызывается. Поперечная пальпация не сопровождается локальным судорожным ответом. Мышца, в составе которой имеется гипертонус, при пальпации обычной консистенции, не укорочена. Местные вегетативные реакции в покое не выражены, могут быть спровоцированы энергичной пальпацией.
II степень (активный триггерный пункт с регионарными мышечно-тоническими реакциями) — спонтанная тянущая боль испытывается во всей мышце, в составе которой имеется локальный мышечный гипертонус. Пальпация вызывает типичную отраженную боль в соседних участках, часто по ходу мышцы. Определяется повышение тонуса всей мышцы или группы мышц-агонистов, вызывается локальный судорожный ответ.
III степень (активный триггерный пункт с генерализованными мышечно-тоническими реакциями) — диффузная выраженная боль в группе мышц в покое, усиливающаяся при любом движении. Пальпация мышцы сопровождается генерализацией болезненности и резким повышением тонуса не только мышц-агонистов, но и антагонистов. Определение локального мышечного тонуса затруднено из-за повышенного тонуса исследуемой мышцы. Поперечная пальпация мышцы невозможна.
Клиническая картина и диагностика МФБС
Для правильной диагностики МФБС необходимо учитывать:
1) историю появления первых болевых ощущений: внезапно, после интенсивной физической нагрузки или постепенно, в результате повседневной работы, вызвавшей переутомление;
2) описание болевого рисунка — характер распределения боли, отраженной от активной миофасциальной ТТ.
• Особые характеристики миофасциальной боли (отраженный характер, специфичность и воспроизводимость для каждой мышцы):
– боль имеет собственный паттерн распределения (специфический рисунок) и не соответствует дерматомному, миотомному или склеротомному распределениям иннервации; боль, отраженная от миофасциальных ТТ, носит несегментарный характер;
– боль локализуется в глубине мышечных тканей;
– боль может носить различный характер интенсивности;
– боль может возникать в покое или только при движениях;
– боль усиливается при выполнении теста на ишемическую компрессию или при пункции ТТ инъекционной иглой;
– боль может появиться внезапно, в результате явного мышечного напряжения или постепенно — при хронической перегрузке мышцы.
• Наличие плотного пальпируемого мышечного тяжа — это области в мышечной ткани, которые ощущаются на ощупь, как уплотнения и связаны с миофасциальной ТТ.
• Наличие локального судорожного ответа — это преходящее сокращение тех мышечных волокон тугого тяжа, которые непосредственно связаны с миофасциальной ТТ. Обычно вызывается поперечной щипковой пальпацией или прикосновением к миофасциальной ТТ кончиком иглы. Иногда проявляется в виде судорожной волны или ряби на кожной поверхности вблизи прикрепления мышечных волокон.
• Наличие «симптома прыжка» — при надавливании на миофасциальную ТТ у пациента возникает непроизвольное движение (вздрагивание) тела и «алгическая» гримаса. Симптом прыжка воспроизводится при повторных надавливаниях.
• Кожные проявления МФБС — панникулез (характеризуется наличием обширного участка плоского утолщения подкожной ткани, которое ощущается при пальпации как грубое гранулярное уплотнение).
• Эмоциональные проявления — коморбидные депрессивно-тревожные расстройства, особенно при хроническом течении МФБС.
Критерии диагностики МФБС
Большие критерии (не менее пяти):
1) жалобы на региональную боль;
2) пальпируемый «тугой» тяж в мышце;
3) участок повышенной чувствительности в области «тугого» тяжа;
4) характерный паттерн отраженной боли или чувствительных расстройств;
5) ограничение объема движений.
Малые критерии (не менее одного из трех):
1) воспроизводимость боли или чувствительных нарушений при пальпации миофасциальной ТТ;
2) локальное сокращение заинтересованной мышцы при пальпации миофасциальной ТТ или ее инъекции;
3) уменьшение боли при растяжении мышцы или лечебной блокаде.
Опрос пациента с МФБС
• При опросе у пациента должна быть удобная поза.
• Ноги больного должны опираться на пол или специальную подставку.
• Руки должны покоиться на подлокотниках, а сиденье необходимо подобрать без бокового наклона тела.
• Для сохранения поясничного лордоза подкладывают небольшой валик.
• В процессе опроса можно использовать специальное «коленное кресло».
Осмотр пациента с МФБС
Оценка подвижности и позы больного:
– использует ли больной подвижность рук в полном объеме;
– поворачивает ли больной голову или весь торс при осматривании окружающей обстановки;
– как больной сидит (прямо или согнувшись, при этом опустив одно плечо);
– симметрично ли лицо пациента;
– выполняет ли больной спонтанные растягивающие движения для уменьшения боли, и какие мышцы при этом он растягивает.
Обследование пациента с МФБС
1. При наличии активных миофасциальных ТТ активное или пассивное растяжение пораженной мышцы вызывает усиление боли.
2. Движение, связанное с растяжением пораженной мышцы, ограничено. При попытке увеличить амплитуду этого движения появляется сильная боль.
3. Максимальная сократительная сила пораженной мышцы ослаблена.
4. В зоне отраженной от миофасциальных ТТ боли наблюдаются глубокая болезненность и нарушение чувствительности.
5. При пальпации выявляется напряженность мышечных волокон, находящихся в непосредственной близости от миофасциальной ТТ (пальпируемые мышечные тяжи).
6. Миофасциальная ТТ при пальпации ощущается как четкая область с острой болезненностью, которая значительно менее выражена в нескольких миллиметрах от границы этой точки.
7. Нажатие пальцем на активную миофасциальную ТТ обычно вызывает «симптом прыжка».
8. Щипковая пальпация вызывает локальный судорожный ответ.
9. Умеренное непрерывное давление на активную миофасциальную ТТ вызывает или усиливает боль в отраженной области.
10. У некоторых больных с МФБС выявляются кожные изменения — выраженный дермографизм или признаки панникулита.
11. У больных, особенно страдающих хроническим МФБС, отмечаются коморбидные депрессивно-тревожные расстройства.
Дифференцированное обследование подвижности мышц головы и шеи
Больному в положении сидя предлагают последовательно выполнить следующие движения:
– опустить подбородок на грудь;
– посмотреть прямо на потолок;
– повернуть голову на 90°, чтобы подбородок был против акромиона;
– приложить ухо к плечу без поднимания плеча;
– достать рот перекинутой за голову рукой (при локализации миофасциальной ТТ в подлопаточной мышце);
– достать лопатку из-за спины кончиками пальцев (при локализации миофасциальной ТТ в подостной и дельтовидной мышцах).
Диагностические пробы при МФБС
Проба на «катание кожи». Кожу и подкожную ткань захватывают пальцами (щипком), оттягивают перпендикулярно поверхности и затем прокатывают ее между пальцами как цилиндр.
Компрессионная проба — сильное продолжительное сдавление миофасциальной ТТ.
Расслабленную мышцу растягивают до первого появления чувства дискомфорта.
1. ТТ сдавливают пальцем (дистальной фалангой или суставом) или локтем до появления переносимой боли.
2. По мере уменьшения боли давление на ТТ постепенно усиливают.
3. Процесс сдавления ТТ продолжается до 1 мин силой 9–13 кг.
4. Если болезненность ТТ сохраняется, то процедуру можно повторить после согревания мышцы горячим компрессом и активных растяжений мышцы.
Пункционная проба — при введении инъекционной иглы в область миофасциальной ТТ обнаруживается уплотнение, напоминающее резину или плотную материю. Проба выполняется в положении пациента лежа с целью избежания возникновения синкопального состояния. После прокалывания миофасциальной ТТ боль сохраняется в течение нескольких минут.
Проба «обнаружение миофасциальной ТТ»
Кожу над пораженной мышцей смазывают мазью или кремом. Большие (или указательные) пальцы обеих рук глубоко погружают с двух сторон тугого мышечного тяжа на одном конце мышцы и проводят вдоль нее скользящим движением по направлению к миофасциальной ТТ, т. е. совершают так называемое «доящее» движение. «Доящее» движение проводят в направлении венозного кровотока. При пальпации миофасциальная ТТ ощущается как узелок или комок.
Лечение миофасциального болевого синдрома
Лечение МФБС требует комплексного подхода. Однако единого мнения относительно алгоритма терапии МФБС не существует [6].
В то же время в большинстве небольших по «выборке» пилотных проектах показана эффективность применения следующих групп и методов терапии:
1) Противовоспалительные препараты (нестероидные противовоспалительные препараты (НПВП) – короткими курсами (до 3–5 дней) в среднетерапевтических суточных дозах [7, 8].
В последние годы становится актуальным применение NO-ассоциированных НПВП [9,10]. Данные анальгетики представляют собой инновационный класс соединений, являющихся производными от обычных НПВП, которые были изменены путем добавления к ним молекулы оксида азота. К препаратам данной группы относится амтолметин гуацил (Найзилат), эффективность и безопасность которого доказана в многочисленных экспериментальных и клинических исследованиях [11,12].
Амтолметин гуацил является предшественником толметина. Оказывает противовоспалительное, анальгезирующее, жаропонижающее, десенсибилизирующее действие, обладает гастропротективным эффектом [13,14]. Подавляет провоспалительные факторы, снижает агрегацию тромбоцитов; угнетает циклооксигенезу (ЦОГ)-1 и ЦОГ-2, нарушает метаболизм арахидоновой кислоты, уменьшает образование простагландинов (ПГ) (в т. ч. в очаге воспаления), подавляет экссудативную и пролиферативную фазы воспаления. Уменьшает проницаемость капилляров; стабилизирует лизосомальные мембраны; тормозит синтез или инактивирует медиаторы воспаления (ПГ, гистамин, брадикинины, цитокины, факторы комплемента) [15,16]. Блокирует взаимодействие брадикинина с тканевыми рецепторами, восстанавливает нарушенную микроциркуляцию и снижает болевую чувствительность в очаге воспаления. Влияет на таламические центры болевой чувствительности; снижает концентрацию биогенных аминов, обладающих альгогенными свойствами; повышает порог болевой чувствительности рецепторного аппарата. Устраняет или уменьшает интенсивность болевого синдрома, увеличивает объем движений через 4 дня лечения [17,18].
Рекомендуемая доза амтолметин гуацила (Найзилата) составляет 600 мг 2 р./сут. В зависимости от степени контроля симптомов заболевания поддерживающая доза может быть снижена до 600 мг 1 р./сут. Максимальная суточная доза – 1800 мг. Для сохранения гастропротекторного действия препарата амтолметин гуацил следует принимать натощак.
2) Мышечные релаксанты (например, флупиртин форте 400 мг однократно утром, 14 дней).
3) Блокады миофасциальных ТТ (2% лидокаин и/или бетаметазон, 1–2 мл раствора или альтернативно – ботулинический токсин 10–20 Ед в каждую миофасциальную ТТ).
4) Трансдермальная терапевтическая система, содержащая лидокаин, – 1/2 пластыря на область миофасциальных ТТ на 10–12 ч [19].
5) Нефармакологические методы, такие как: постизометрическая релаксация, мануальная терапия, кинезотерапия, аромамассаж, фармакопунктура, методика Hivamat (электростатический массаж), криоамплипульс- и криоинтерференц-терапия, методика HILT (высокоинтенсивная лазер-терапия) и другие методы.
Таким образом, подводя итог в изложении проблемы МФБС, следует отметить прогресс в применении эффективных схем терапии, однако до настоящего времени вопросы патогенеза МФБС изучены недостаточно и требуют дальнейшего обсуждения.
Болевые синдромы в клинической практике врача-невролога: патофизиология и принципы фармакотерапии
Боль представляет собой сложную мультисистемную реакцию организма, отличающуюся от простой ноцицепции – физиологического механизма, ответственного за распознавание повреждения тканей организма. В статье представлены последние данные о понимании процесса возникновения ощущения боли, включающие сведения о первичном анализе ноцицептивных стимулов на уровне спинного мозга, восходящих путях болевого трафика и коре головного мозга. Подробно описаны препараты, используемые в настоящее время для купирования болевого синдрома. Особое внимание уделено преимуществам и проблеме безопасности использования нестероидных противовоспалительных средств в клинической практике, в том числе ацеклофенака (Аэртал).
Боль является самым частым симптом, встречающимся в неврологической практике. Наиболее приемлемым для клиницистов является определение боли, предложенное международной ассоциацией по ее изучению в 1994 году: “Боль – неприятное сенсорное и эмоциональное переживание, связанное с существующими или возможными повреждениями ткани или описываемое в терминах такого повреждения” [1]. Главным в данном определении является посыл о том, что боль это не стимул, а именно ощущение, такое как страх, ненависть и пр. Поэтому она крайне субъективна, а в клинической практике мы не сможем с полной уверенностью предположить, насколько сильную боль ощущает тот или иной пациент. В последующем предлагалось большое количество авторских вариантов дефиниции боли.Наша неврологическая школа разработала следующее определение: “Боль – мультисистемная реакция организма,протекающая в рамках физиологических (защитный рефлекс) или патофизиологических (один из синдромов какого-либо заболевания) процессов и направленная на восстановление гомеостаза или реализацию патологической доминанты”. На наш взгляд, данное определение является более прикладным, позволяющим выйти из жестких рамок понимания боли как некой формы вос приятия окружающего мира, и взглянуть на нее как на самостоятельный клинический синдром, который может включать не только субъективные переживания,но и ряд клинических проявлений (мышечный дефанс, вегетативные и поведенческие реакции и пр.).
В настоящее время в научно-практической литературе пролоббирована концепция целесообразности деления боли на ноцицептивную и невропатическую. Ноцицептивная боль вызвана активацией ноцицепторов при тканевом повреждении, соответствует степени тканевой деструкции и длительности заживления (острая боль). Невропатическая боль – это боль, вызванная дисфункцией структур периферической и/или центральной нервной системы, ответственных за трафик и/или модуляцию болевых стимулов(хроническая боль). В основе развития данного варианта боли лежат явления маладаптивной нейропластичности 3.
Данный подход к систематизации болевых синдромов (БС) носит, отчасти, примитивный характер, поскольку ”уводит” клинициста от необходимости топической диагностики заболевания, сопровождающегося алгическим синдромом. В связи с этим нам представляется оправданным использование в клинической практике не только деления боли на ноцицептивную и невропатическую, но и топического подхода к систематизации БС, учитывающего предполагаемый уровень поражения нервной системы.
Подавляющее большинство пациентов (более 92%),обратившихся в центр лечения боли при клинике нервных болезней Военно-медицинской академии им. С.М. Кирова (Санкт-Петербург), предъявляли жалобы на БС периферического генеза, что косвенно указывает на ведущую роль сегментарного аппарата спинного мозга в патогенезе БС и согласуется с основными поло жениями теории воротного контроля боли [5,6]. Тем не менее, идентификация патофизиологических механизмов боли в каждом конкретном случае крайне затруднительна. Поэтому целесообразно во врачебной практике использовать клинико-функциональные критерии (локализация, характер, продолжительность, сопутствующие симптомы) для дифференциации БС с целью совершенствования тактики патогенетической терапии.
В соответствии с этими критериями периферические БС условно разделяют на дизестезические и трункальные. Дизестезическая (деафферентационная, поверхностная) боль характеризуется пациентами как жгучая,саднящая, сопровождающаяся зудом, ползанием мурашек и прохождением электрического тока. Дизестезические боли возникают при вовлечении в патологический процесс малых С-волокон. Трункальная (глубокая) боль характеризуется как ноющая, режущая, ломящая. Возникает, как правило, при проведении возбуждения через А-δ волокна.
Трафик болевых импульсов и составляет суть организации ноцицептивной системы [7,8]. Первичный анализ информации происходит в спинном мозге.Клетки 1 пластины (по классификации Рекседа, 1952),находящиеся в маргинальной зоне, активируются как ноцицептивными, так и неноцицептивными стимуламии обеспечивают проведение болевой импульсации к супраспинальным структурам, образуя наряду с другими интернейронами спиноталамический тракт [9,10]. Клетки 2 и 3 пластин возбуждаются при воздействии механических и термальных стимулов от А-δ и С-волокон и содержат значительное количество Т-клеток (трансмиссионных), образующих обратную связь с терминалями первичных афферентов и дендритами пирамидных клеток [9]. На нейроны 4 пластины конвергируют импульсы, возникающие при механических, термальных и химических раздражениях кожи, но они индифферентны к мышечным и висцеральным стимулам [9,11]. Нейроны 5-6 пластин считаются источниками основной массы проприоспинальных (сегментарных) связей и играют важную роль в формировании соматовисцерального болевого потока. В медиальной части 5 пластины расположены крупные нейроны Кларка, аксоны которых образуют восходящие спинномозжечковые тракты [9,11]. Нейроны 7-8 пластин занимают промежуточное положение между передними и задними рогами серого вещества спинного мозга. Не имея прямых контактов с первичными афферентами, нейроны данных пластин получают импульсацию от дорсальных нейронов, имеют широкие рецептивные поля и максимально активируются периферической ноцицептивной импульсацией. Аксоны интернейронов этих пластин оканчиваются на мотонейронах передних рогов, а также образуют восходящие и нисходящие тракты различного типа. Поэтому простейший ответ на болезненный стимул происходит рефлекторно (отдергивание руки или ноги). Другие ветви сенсорных нервных волокон, идущих от болевых рецепторов, через синапсы с интернейронами передают информацию по восходящим путям в мозг для ее анализа [9,11].
Таким образом, нейроны спинного мозга представляют собой “модуль первичного рефлекторного анали за” ноцицептивной импульсации, где, с одной стороны, возникает двигательная, висцеральная и вазомоторная реакции на боль, а с другой стороны, формируются восходящие пути болевой импульсации. При этом ноцицептивные нейроны подразделяются на специфические, реагирующие только на болевые раздражители, и, так называемые, широко динамичные нейроны, составляющие треть всех нейронов и реагирующие также на низкопороговые механические стимулы, но максимально наноцицептивные [12].
Далее ноцицептивная импульсация поднимается в головной мозг по функционально различным системам. Одна из них является традиционным боковым спиноталамическим трактом, состоящим из миелинизированных быстропроводяших толстых волокон, активация которых дает ощущение острой боли. Волокна “быстрого” пути имеют относительно небольшое число коллатералей, и приблизительно 30% из них заканчиваются моносинаптически в таламусе. Эта система позволяет точно различать, где и в какой момент времени произошло повреждение, насколько оно опасно для организма [7].
Другая система формирует “медленный” путь болевой импульсации и называется спиноретикулодиэнцефальной. Она состоит из безмиелиновых медленно проводящих волокон, при возбуждении которых возникает разлитая ноющая боль. Эта система отличается диффузностью, большим количеством синапсов и коллатералей к различным образованиям спинного мозга и ствола головного мозга. Волокна “медленного” пути идут к ретикулярной формации, к клеткам и центрам продолговатого и среднего мозга, моста, серому веществу около сильвиева водопровода, гипоталамусу и таламусу [8,9,13].
Обе вышеуказанные системы имеют различные зоны назначения в таламусе – конечной станции переключения болевой импульсации. “Быстрый” путь заканчивается в релейных нейронах вентробазального комплекса, а “медленный” – в интраламинарном и медиальном ядрах. Волокна от вентробазального комплекса далее проецируются в постцентральную извилину, островковую кору и височную долю. В постцентральной извилине и островковой коре происходит определение локализации боли, оценка ее типа и вероятной причины [9,11,14]. Теменная доля обеспечивает мнемонический анализ для определения является ли данная боль новой или повторением предыдущего болевого опыта в подобных обстоятельствах.
“Медленный” путь, переключаясь в таламусе, заканчивается в лимбической системе и лобных долях. Ноцицептивное возбуждение лимбической системы формирует сознательно переживаемую боль от острой до агонирующей, вызывает системные висцеральные реакции (тошноту, рвоту, непроизвольное испражнение или мочеиспускание и др.). Лобные доли, особенно префронтальная кора, генерируют предупреждающую тревогу и страх в отношении возможного повторения боли [7].
Таким образом, “быстрая” система, свободная от эмоций, может выполнять функцию предупреждения, доставляя информацию о повреждении, его размерах и месте. Неприятная ноющая боль, характерная для “медленной” системы, как бы напоминает мозгу о про исшедшем повреждении, на которое следует обратить внимание, позволяет приписать болевым ощущениям те или иные эмоциональные качества [15].Несмотря на принципиальное различие, обе ноцицептивные системы функционируют как единое целое, выполняя аналитическое и интегрирующее действие в рамках организма.
Главной теорией, объясняющей механизмы регуляции болевой чувствительности, является теория “воротного контроля”, предложенная R. Melzack и P.D.Wall (1965, 1980). Смысл ее заключается в том, что на уровне нейронов заднего рога спинного мозга импульсация, идущая по первичным афферентам, может тормозиться или амплифицироваться на основе механизма пресинаптического торможения или облегчения [16]. Согласно данной концепции, нейроны студенистого вещества спинного мозга (2 и 3 слои Рекседа) посылают аксоны к пресинаптическим афферентным терминалям, образуя аксо-аксональные синапсы.При возбуждении клеток студенистого вещества импульсацией от толстых сенсорных волокон через аксо-аксональные синапсы происходит деполяризация ноцицептивных терминалей с угнетением выделения трансмиттера в синаптическую щель, что и определяет механизм пресинаптического торможения. Активация тонких ноцицептивных волокон вызывает торможение нейронов студенистого вещества с последующим пресинаптическим облегчением (увеличение выделения трансмиттера и облегчение транссинаптической передачи). Кроме этого, теория “воротного контроля” постулировала наличие цент ральной модуляции данного феномена через изменения функционального состояния нейронов студенистого вещества, осуществляемые супраспинальными структу рами (центральное серое околоводопроводное вещество, ядра шва, хвостатое и красное ядра, параги гантоклеточное ядро ретикулярной формации, паравентрикулярные и передние отделы гипоталамуса, некоторые ядра таламуса и коры больших полушарий) через волокна кортикоспинального тракта [8].
В 2001 году R. Melzack предложил нейроматриксную теорию боли, согласно которой болевое ощущение формируется паттерном нервных импульсов в нейрональ ных цепях ЦНС (преимущественно в лимбической системе).Нейроматрикс представляет собой обширную сеть нейронов, образующих функциональные петли между таламусом и корой, корой и лимбической системой. Синаптические связи в этой нейронной сети генетически детерминированы и, в некотором смысле, составляют материнскую “матрицу”, генерирующую, воспроизводящую и модулирующую сенсорную информацию. Нейронные петли дивергируют, т.е. расходятся в пространстве и формируют три основных компонента нейроматрикса – “нейромодули”: сенсорно-дискриминативный, аффективно-мотивационный и оценочно познавательный. Обработка данных в нейромодулях завершается конвергенцией информации, взаимодействием между ними и формированием конечного результата – нейросигнатуры, представляющей собой непрерывный, исходящий из нейроматрикса поток генетически детерминированных и ситуационно измененных импульсов, направляющихся в следующий компонент системы – “сенсорный невральный центр”, вкотором происходит оценка этого потока сигналов, его осознание, осмысление и накопление опыта [17].
Как следует из приведенных данных, эндогенные механизмы, регулирующие болевую импульсацию, гетерогенны, связаны с различными образованиями ЦНС и опосредуются различными нейрохимическими механизмами (рис. 1).
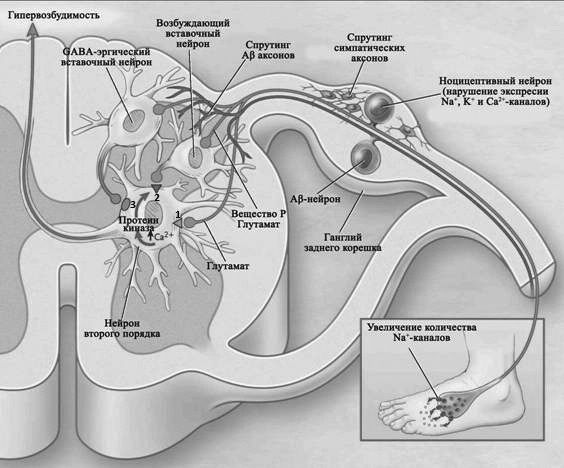
Купирование боли практически всегда представляет значительные трудности как для пострадавшего, так и для медицинского персонала, поскольку интенсивность болевого синдрома зависит от большого числа взаимосвязанных факторов. Лечение, таким образом, должно быть, во-первых, максимально индивидуализированным, во-вторых, комплексным, в-третьих, патогенетическим, в-четвертых, этапным и преемственным. Кроме того, терапию боли необходимо рассматривать в аспекте неотложной помощи и проведения профилактики.
Одни из главных осложнений при применении наркотических анальгетиков – развитие толерантности (снижение эффекта) и зависимости (привыкания),которые могут появиться уже в первые дни при повторном введении препаратов [18].
Обезболивающий эффект наркотических средств усиливается при сочетании с ацетилсалициловой кисло той, антигистаминными средствами, антидепрессантами.
Нестероидные противовоспалительные препараты (НПВП) представляют собой обширную и разнообразную по химическому строению группу лекарственных препаратов, широко применяющихся в неврологичеcкой практике для купирования боли. В большинстве клинических рекомендаций НПВП указаны в качестве первой линии терапии БС легкой или умеренной выра женности. Считается, что противовоспалительный, антипиретический и обезболивающий эффекты НПВП, а также побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ) ассоциированы, главным образом, с подавлением синтеза простагландинов вследствие угнетения активности фермента циклоокси геназы (ЦОГ). Побочные эффекты НПВП являются класс-специфическими, характерными для всех пред ставителей этой группы лекарственных препаратов. Когда в 90-х гг. было установлено, что для клинической практики наиболее важными являются две изоформы циклооксигеназы (ЦОГ-1 и ЦОГ-2), были созданы селективные ингибиторы ЦОГ-2 (коксибы, сНПВП) в качестве более безопасной альтернативы традиционным на тот момент НПВП, позже названными неселективными (нНПВП). Это было важно, поскольку неселективные ингибиторы ЦОГ-1 и ЦОГ-2 (индометацин, диклофенак, кеторолак и др.) обладают рядом серьезных побочных реакций со стороны ЖКТ. Для их обозначения в 1986 г. даже был предложен термин “НПВП-гастропатия”, который позволил дифференци ровать специфическое поражение слизистой оболочки желудка, возникающее при применении НПВП, от классического гастрита и язвенной болезни [20]. Исследование и в последующем широкая кампания по продвижению коксибов основывалась на предположении, что они обладают аналогичным, если не большим, обезболивающим и противовоспалительным действием, как и нНПВП (так как считалось, что эти эффекты опосредованы изоферментом ЦОГ-2), но характери зуются меньшим риском побочных явлений со стороны ЖКТ. Действительно клинические исследования (MELISSA, CLASS, VIGOR, TARGET, SUCCESS, MEDAL и др.) показали, что применение коксибов на 50% снижает риск осложнений со стороны верхних отделов ЖКТ по сравнению с применением нНПВП [21]. Тем не менее, в 2004 г. один из наиболее востребованных ингибиторов ЦОГ-2 (рофекоксиб) был снят с производства в связи с повышенным риском сердечно-сосудистых осложнений. Было установлено, что все НПВП повышают агрегацию тромбоцитов, увеличи вают задержку натрия и воды, что повышает АД и способствует развитию сердечной недостаточности, причем сНПВП оказывают такое действие в большей степени, чем нНПВП [22]. Впоследствии по инициативе Европейского агентства по лекарственным средствам (ЕМА) было проведено два комплексных анализа, по результатам которых в Европе появилось противопоказание для применения коксибов у пациентов с ишемической болезнью сердца, цереброваскулярной болезнью и болезнью периферических артерий. Также был внесен ряд предупреждений в инструкции по применению коксибов относительно токсического действия этих препаратов на сердечно-сосудистую систему, ЖКТ и кожу.
Важно отметить, что побочные эффекты характерны практически для всех представителей группы НПВП (с разной частотой) независимо от их селективности, лекарственной формы и способа введения. Так, в соответствии с Европейскими рекомендациями по лечению болевых синдромов, НПВП обладают сопоставимым обезболивающим действием независимо от принадлежности к той или иной группе, а выбор препарата определяется риском его побочного действия (у неселективных – это в основном поражение ЖКТ и печени, а у селективных сердечно-сосудистые осложнения). При этом выбор конкретного НПВП из множества предлагаемых на фармацевтическом рынке представляет собой непростую задачу. Вследствие вышеуказанного “кризиса коксибов” клиницисты с большой настороженностью относятся к высокоселективным ингибиторам ЦОГ-2. Но и диклофенак, еще недавно абсолютный “эталон” противоболевой тера НПВП.
Результаты ряда зарубежных и отечественных исследований позволяют рассматривать в качестве препарата выбора ацеклофенак (Аэртал) [23,24]. Данный препарат используется в клинической практике с конца 80-х годов. На территории РФ с 2002 г. ацеклофенак представлен препаратом Аэртал® (компания “Гедеон Рихтер”, Венгрия) и выпускается в следующих формах: 1) таблетки для приема внутрь по 100 мг; 2) порошок для приготовления суспензии для приема внутрь по 100 мг; 3) крем для наружного применения 1,5%, туба 60 г. Ацеклофенак представляет собой производное фенилацетиловой кислоты, т.е. близок по строению к диклофенаку. Однако в его формулу включена 2,6-дихлорфениламиногруппа, и это, казалось бы, небольшое отличие существенно меняет фармакологические свойства препарата. Ацеклофенак обладает умеренной селективностью в отношении ЦОГ-2, занимая удачную позицию между нНПВП и сНПВП (коксибами) и явля ясь “золотой серединой” в группе данных лекарственных средств, что обусловливает целесообразность его использования при большинстве БС различного генеза[25]. Все же ацеклофенак оказывает более выраженное действие на ЦОГ-2, что позволяет отнести данный препарат к преимущественно селективным ингибиторам ЦОГ-2, поскольку соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 для ацеклофенака составляет 0,26 мкмоль, а для целекоксиба (эталонного селективного ингибитора ЦОГ-2) – 0,7 мкмоль [26]. Клинические и эпидемиологические исследования показывают, что ацеклофенак обладает хорошей переносимостью в отношении как ЖКТ, так и сердечно-сосудистой системы [23]. Важным достоинством ацеклофенака является высокая биодоступность, близкая к 100%. Пиковая концентрация в плазме крови достигается через 75-180 мин после приема внутрь, при этом прием пищи замедляет всасывание препарата, но не влияет на его степень. Важной для клинической практики особенностью ацеклофенака является способность проникать в синовиальную жидкость, где его концентрация достигает 60% от содержания в плазме крови.
Кроме основного фармакологического эффекта (блокады ЦОГ-2/ЦОГ-1) Аэртал (ацеклофенак) оказывает влияние на синтез важнейших цитокинов, таких как интерлейкин (ИЛ)-1 и фактор некроза опухоли α [27]. Особенностью механизма действия ацеклофенака является его способность подавлять процесс ИЛ-1-ассоциированной активации металлопротеиназ, что является одной из причин положительного воздействия на синтез протеогликанов суставного хряща [27]. В ряде исследований [28,29] было отмечено, что ацеклофенак не только не разрушал хрящ (что свойственно для ибупрофена, индометацина, диклофенака), но и способствовал его активному восстановлению, подавляя катаболизм хрящевой ткани.
Для лечения болевых синдромов в неврологии применяются 3 препарата: трициклический антидепрессант амитриптилин и селективные ингибиторы обратного захвата серотонина и норадреналина дулоксетин и венлафаксин [35]. К концу первой недели применения данных лекарственных средств развивается анальгетический эффект, на 2-3-й неделе наступает психотропное действие – улучшается настроение, повышается трудоспособность, исчезает тревожное ожидание боли. Терапия проводится в течение несколько месяцев с постепенной отменой препаратов.
Местные анестетики (прокаин, лидокаин и пр.) используются, главным образом, в составе локальной инъекционной терапии (блокад). Исключением является трансдермальная терапевтическая система с лидокаином в виде пластыря, одобренная для применения у пациентов с постгерпетическим ганглионевритом. Основным механизмом действия местных анестетиков является инактивация Na+-каналов, в результате чего потенциал действия нервного волокна не генерируется и возникает нервный блок. Действие местных анестетиков распространяется на все нервные волокна, хотя, как правило, мелкие веточки оказываются более чувствительными, чем крупные. Благодаря этому происходит последовательное выключение различных видов чувствительности тканей: в первую очередь, болевой чувствительности, затем – температурной, в последнюю очередь – тактильной. При использовании местных анестетиков в высоких дозах блокируются и двигательные нервные волокна. Наряду с местноанестезирующим действием препараты этой группы могут давать целый ряд резорбтивных эффектов (например, кардиодепрессивный). В высоких дозах местные анестетики могут вызывать диплопию и другие нарушения зрения, в токсических дозах – судороги и кому. Результатом их тормозного вдействия на уровне продолговатого мозга является угнетение дыхания и сердечной деятельности.
Прегабалин, как и габапентин, имеет высокую аффинность к α2δ-субъединицам потенциалзависимых Са2+-каналов в центральной нервной системе, связывание с которыми приводит к уменьшению высвобождения ряда нейротрансмиттеров боли (включая глутамат, норадреналин и субстанцию Р) в нейронах-мишенях. В ряде исследованиях прегабалин по эффективности был идентичен габапентину, но в значительно более низких дозах [13], что снижает риск развития побочных реакций. Вероятным объяснением данного феномена является тот факт, что прегабалин обладает более высокой биодоступностью (90% против 33-66% у габапентина) и более быстрой абсорбцией (пик концентрации наступает через 1 ч). Кроме того, в отличие от габапентина, прегабалин имеет линейную зависимость концентрации в плазме при увеличении дозы [34], что несвойственно габапентину. В исследовании D. Wesche и соавт. указывается, что прегабалин в 2,5 раза более эффективен в лечении нейропатической боли по сравнению с габапентином [36].
Миорелаксанты находят свое применение для лечения болевого синдрома, связанного с патологическим повышением мышечного тонуса. Их разделяют на периферические и центральные. Наиболее ярким представителем лекарственных средств первой группы является ботулинический токсин типа А (БТА). Помимо прямого действия на процесс передачи нервно-мышечного импульса за счет воздействия на протеины транспортной цепи ацетилхолина (миорелаксирующий эффект), БТА также может блокировать высвобождение и других нейротрансмиттеров, в том числе участвующих в передаче болевых стимулов (например, CGRP – сalcitonin gene-related peptide). Этим объясняется способность БТА уменьшать выраженность болевого синдрома при дистониях, постинсультной спастичности, хронической мигрени (доказано для онаботулина).
Среди препаратов, обладающих центральной миорелаксирующей активностью (толперизон, баклофен, тизанидин) особое место занимает толперизона гидрохлорид (Мидокалм) – миорелаксант, механизм действия которого связывают с блокадой натриевых каналов. Последний, ингибируя мышечное напряжение, дает непрямой анальгезирующий эффект без сопутствующей седации. Обладая мембраностабилизирующим свойством и имея химическое родство с лидокаином, препарат оказывает также прямое антиболевое действие. Кроме того, толперизона гидрохлорид способен блокировать α-адренорецепторы, локализованные в сосудах, что объясняет его отчетливое вазодилатирующее свойство. Миорелаксирующее действие толперизона гидрохлорида доказано в многочисленных научных работах. В 10-летнем исследовании, включавшем 519 пациентов с центральной спастичностью, назначение толперизона гидрохлорида приводило к значительному улучшению двигательных функций и ослаблению мышечной спастичности (по шкале Эшворта) [36]. В ряде исследований [37,38] была показана эффективность Мидокалма в комплексной терапии заболеваний опорно-двигательного аппарата, проявляющихся БС. Показатели болезненности и двигательной способности в группе пациентов, получавших наряду со стандартной терапией толперизона гидрохлорид, достоверно улучшились по сравнению с таковыми у пациентов, не получавших миорелаксант. Авторами был сделан вывод о том, что использование толперизона гидрохлорида позволяет снизить дозу противовоспалительных препаратов, не уменьшая их терапевтическую эффективность.
Капсаицин – высокоселективный агонист ванилоидного рецептора с транзиторным рецепторным потенциалом 1 типа (TRPV1). Первоначальный эффект капсаицина заключается в активации кожных болевых рецепторов, экспрессирующих TRPV1, что приводит к развитию жжения и покраснения вследствие высвобождения вазоактивных нейропептидов. В последующем кожные болевые рецепторы становятся менее чувствительными к болевым стимулам. Предполагается, что чувствительность кожных нервов, не экспрессирующих TRPV1, включая волокна, ответственные за механические и вибрационные стимулы, остается интактной. Обусловленное капсаицином изменение кожных болевых рецепторов является обратимым: восстановление нормальной функции (реакция на раздражающие стимулы) происходит в течение нескольких недель. Наибольшую аналгетическую эффективность продемонстрировал капсаицин в виде пластыря, который может быть использован для лечения нейропатической боли периферического генеза (постгерпетический ганглионеврит, болевой синдром на фоне сахарного диабета и пр.). Отрицательной стороной использования данного препарата являются технические сложности в правильном применении пластыря, частые местные побочные эффекты и высокая стоимость.
Другим качественно новым перспективным подходом к решению проблемы хронических болевых синдромов в настоящее время является применение методов функциональной нейрохирургии – малоинвазивных оперативных вмешательств, связанных с электрической или медиаторной стимуляцией различных отделов нервной системы. Методы нейромодуляции делятся на: нейростимуляцию – стимуляцию нервных структур от нервов и сплетений до коры головного мозга; метод дозированного автоматического подоболочечного введения анальгетиков и анестетиков. Суть нейростимуляции заключается в использовании электродов на любом уровне выше источника боли. Электрический импульс, возникающий при включении системы для стимуляции, блокирует путь для прохождения болевого раздражения. Используя хроническую электростимуляцию, возможно получать желаемые клинические эффекты, не разрушая ткани.
Заключение
Таким образом, несмотря на значительные успехи в раскрытии механизмов боли и в разработке новых лекарственных препаратов для лечения болевых синдромов, боль остается актуальной проблемой современной неврологии в связи с недостаточной эффективностью лечения пострадавших и нуждается в дальнейших клинических и экспериментальных исследованиях. Многие аспекты развития болевых синдромом остаются спорными (особенно по вопросам классификации и дифференциальной диагностики). Так, не определена значимость различных нейротрансмиттерных систем в цепи восстановительных и компенсаторных реакций организма. Кроме этого, по данным клинических исследований очевидна несостоятельность антиноцицептивной системы в поддержании структурно-функционального постоянства организма при хронических болевых синдромах. В связи с этим представляется актуальным поиск путей регуляции и стимуляции нейропластичности, а также стандартизации терапевтических схем.

