Что колят недоношенным детям
Особенности антибактериальной терапии у недоношенных новорожденных
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Научный центр здоровья детей РАМН, Москва
И нфекционно-воспалительные заболевания – наиболее частая патология у детей периода новорожденности, что объясняется своеобразием защитных механизмов на данном этапе онтогенеза. Наиболее выражена недостаточность гуморального и клеточного иммунитета, незрелость барьерных функций кожи и слизистых у детей, родившихся преждевременно. В структуре диагнозов в отделениях второго этапа выхаживания недоношеных детей удельный вес гнойно-воспалительных заболеваний приближается к 80%, при этом большинство заболеваний составляют так называемые малые инфекции – гнойничковые сыпи, омфалит, дакриоцистит, отит; у 1% детей выявляются серьезные воспалительные заболевания (флегмона и пузырчатка новорожденных, остеомиелит, менингоэнцефалит, пневмония, сепсис).
В последние годы проблемы инфекционной патологии у незрелых детей приобрели особую актуальность в связи с изменением особенностей как макро-, так и микроорганизмов, что отразилось на течении инфекционного процесса. Утяжелилось течение фоновых состояний, создающих благоприятную почву для манифестации и прогрессирования инфекции – это перинатальные поражения мозга, врожденные пороки развития, пневмопатии; причем достижения современной реаниматологии и интенсивной терапии позволяют обеспечить выживание даже детей с крайне малой массой тела, перенесших тяжелую асфиксию. В свою очередь реанимационные мероприятия, прежде всего длительная ИВЛ и катетеризация магистральных сосудов, создают условия для микробной агрессии. Одним из важных факторов, способствующих бактериальной контаминации и утяжелению течения бактериальных инфекций, является наличие смешанной вирусно-бактериальной внутриутробной инфекции. Внутриутробные паразитарные и вирусные инфекции (так называемый TORCH-синдром) в 13–45% случаев являются основной причиной смертности в периоде новорожденности. Перенесенная внутриутробно специфическая инфекция резко нарушает защитные механизмы ребенка, что способствует присоединению и бурному течению интранатальных и постнатальных бактериальных инфекций.
Современная этиология возбудителей
В этиологической структуре возбудителей бактериальных инфекций у недоношенных детей 10–15 лет назад отмечалось увеличение удельного веса грамотрицательной флоры (клебсиела, протей, псевдомонас). Однако в последующие годы вновь среди этиологических агентов локальных гнойно-воспалительных поражений первое место занимает грамположительная флора (стафилококки, стрептококки). Для недоношенных детей характерны сочетание микроорганизмов, выделяемых из различных очагов (например, из гнойного очага высеваются золотистый и эпидермальный стафилококки, из кала – кишечная палочка и стафилококки), а также смена ведущих возбудителей в процессе лечения (первоначальные агенты воспаления подавляются, их место занимают другие бактерии, часто в сочетании с грибами).
Среди населения циркулируют преимущественно чувствительные к антибиотикам штаммы возбудителей (В.К.Таточенко), а в стационарах дети обсеменяются преимущественно устойчивыми штаммами (внутрибольничная флора), так как условно-патогенные и сапрофитные микроорганизмы многократно пассируются на ослабленных незрелых новорожденных и происходит их селекция под воздействием терапии (Г.В.Яцык, И.В.Маркова). Кроме того, устойчивые штаммы (клебсиеллы, стрептококк В) передаются новорожденным от больных матерей.
Специфика фармакокинетики антибиотиков
У новорожденных детей фармакокинетика любого препарата существенно отличается от таковой у детей более старшего возраста; в наибольшей мере это относится к незрелым (недоношенным) новорожденным. Крайне важной представляется незрелость выделительной функции почек и ферментных систем печени – эти особенности в первую очередь характерны для глубоконедоношенных детей с массой тела менее 1500 г. Помимо этого, незрелость других органов и систем (желудочно-кишечного тракта, нервной системы, органов дыхания), а также общая лабильность метаболизма накладывают на фармакокинетику антибиотиков у недоношенных детей индивидуальные особенности предопределяя высокий риск нежелательных побочных эффектов антибактериальной терапии. Общая особенность фармакокинетики любых препаратов у недоношенных детей – это ее замедление, что способствует кумуляции лекарств и влияет на выбор дозы (уменьшение ее на 1/3–1/4), путей и кратности введения препаратов. В то же время повышенная проницаемость естественных барьеров (кожи и слизистых) способствует всасыванию многих медикаментов. В настоящее время проводятся исследования суточных ритмов фармакодинамики различных препаратов, но в отношении антибиотиков у недоношенных детей таких исследований практически нет.
Показания и выбор антибиотика
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса, включая так называемые малые инфекции, например, нераспространенные гнойничковые поражения кожи, гнойные конъюнктивиты, отиты (в том числе катаральный отит). Лишь в редких случаях легкого течения неосложненной ОРВИ (ринофарингит) антибиотик не назначается – и то только у детей с относительно благополучным фоном (незначительная степень недоношенности, отстутствие анамнестических указаний на внутриутробную инфекцию, нетяжелая перинатальная энцефалопатия).
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса, включая так называемые малые инфекции, например, нераспространенные гнойничковые поражения кожи, гнойные конъюнктивиты, отиты (в том числе катаральный отит). Лишь в редких случаях легкого течения неосложненной ОРВИ (ринофарингит) антибиотик не назначается – и то только у детей с относительно благополучным фоном (незначительная степень недоношенности, отстутствие анамнестических указаний на внутриутробную инфекцию, нетяжелая перинатальная энцефалопатия).
Спорный вопрос о так называемом профилактическом применении антибиотиков у маловесных недоношенных из группы риска по реализации внутриутробной и интранатальной инфекции (больная мать, длительный безводный период и т.п.), как правило, решается в пользу назначения антибиотика, так же как и в случаях так называемых неинфекционных пневмопатий. К условно “профилактическим” можно отнести также назначение антибиотика для “прикрытия” гормональной кортикостероидной терапии и некоторых вмешательств (катетеризации, переливания крови и т.п.).
Выбор антибиотика для недоношенного ребенка – ответственный момент, во многом определяющий эффективность лечения. При выборе препарата следует учитывать следующие факторы:
• вид возбудителя (в начале лечения часто лишь предполагаемый) и его штамм;
• чувствительность возбудителя (также в начале лечения – предполагаемую, через 2–3 дня после получения результатов бактериологических анализов в терапию могут быть внесены коррективы). В последние годы высказывается мнение о том, что параметры чувствительности микробов in vitro не всегда совпадают с таковыми in vivo и нет необходимости строго следовать им при назначении препаратов;
• локализация и степень тяжести инфекционного процесса (при нетяжелых локальных поражениях возможно пероральное применение препарата; при тяжелых, как правило, – сочетание пероральных и парентеральных средств);
• сопутствующие состояния и премобидный фон (предпочтение парентеральных препаратов при тяжелом дисбактериозе или внутривенного введения у крайне маловесных детей с неразвитой мышечной тканью).
Все антибиотики можно условно разделить на 2 группы – препараты первого выбора назначают, когда нет оснований думать о лекарственной устойчивости флоры (полусинтетические пенициллины, аминогликозиды I поколения, цефалоспорины I поколения); препараты второго выбора направлены на преодоление устойчивых штаммов (аминогликозиды и цефалоспорины III–IV поколения, современные макролиды). Существуют и препараты третьего выбора (или препараты резерва), применяемые при крайне тяжелых формах заболеваний с полирезистентной флорой (карбапенемы).
У недоношенных детей в основном сразу используются препараты второго выбора: применение антибиотиков первого ряда у них неэффективно и лишь способствует отсрочке манифестных проявлений инфекционного процесса, маскирует клинические симптомы. У детей периода новорожденности даже по жизненным показаниям не должны использоваться препараты, обладающие высокой токсичностью (фторхинолоны).
Схема 1. Допустимые сочетания антибиотиков у недоношенных детей при одновременном применении (Г.В. Яцык)
Особенности дозировки антибиотиков
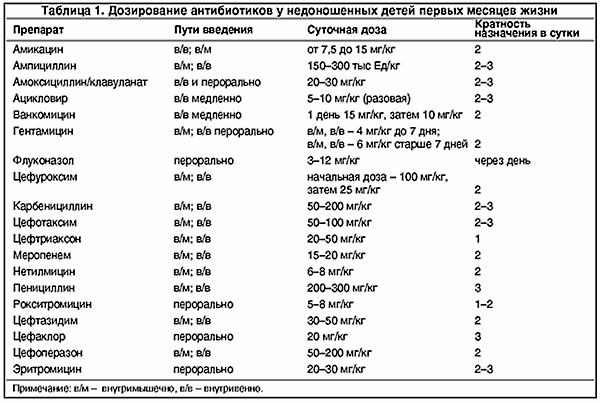
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в табл. 1 (Г.В. Яцык, 1998 г.) Общий принцип подбора дозы для новорожденного ребенка – большее по сравнению со старшими детьми количество препарата на 1 кг массы тела – сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в табл. 1 (Г.В. Яцык, 1998 г.) Общий принцип подбора дозы для новорожденного ребенка – – сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Комбинированная антибактериальная терапия у недоношенных детей должна проводиться с большой осторожностью; одновременное сочетание 2 (очень редко – 3) антибиотиков применяется лишь у детей с тяжелыми гнойно-воспалительными процессами (прежде всего при сепсисе), вызванными смешанной флорой. Допустимые сочетания антибиотиков представлены в табл. 2 и на схеме 1 (данные Н.В. Белобородовой).
Пути и кратность введения антибиотиков недоношенному ребенку
В связи с высокой проницаемостью и ранимостью слизистой желудочно-кишечного тракта у незрелых новорожденных, а также опасностью развития дисбиоза и язвенно-некротического энтероколита пероральные антибиотики использовались ограниченно. К тому же большинство инфекционных заболеваний у недоношенных детей по тяжести состояния требует более мощной терапии. В последние годы появились достаточно действенные антибактериальные и противогрибковые препараты для перорального применения (макролиды, амоксициллин/клавуланат и др.) Кроме того, установлено крайне негативное воздействие болевых раздражений на грудных детей, что делает необходимым ограничение внутримышечных и внутривенных инъекций.
У новорожденных (особенно недоношенных) детей период полувыведения препаратов увеличен вследствие незрелости почек и печени. Поэтому кратность введения большинства препаратов не превышает у них 2 раз в течение суток (за исключением пенициллинов); особенно популярными в неонатологии остаются препараты пролонгированного действия (рокситромицин, цефтриаксон), допускающие однократное применение. Некоторые исследователи (Н.В. Белобородова, О.Б. Ладодо) большинство парентеральных препаратов (в том числе аминогликозиды, цефалоспорины) предлагают вводить однократно – внутривенно или внутримышечно.
Продолжительность антибактериальной терапии и последовательность применяемых антибиотиков у недоношенного ребенка определяются индивидуально, они зависят от эффективности первичного курса антибактериальной терапии, которая оценивается по традиционным клиническим и лабораторным параметрам. Как правило, недоношенным детям со среднетяжелыми инфекционными процессами (омфалит, пневмония, отит и т.д.) проводят два последовательных курса антибиотика (второй курс с учетом чувствительности микрофлоры), каждый по 7–10 дней. При тяжелых заболеваниях (менингит, остеомиелит, сепсис) обычно используют не менее 3–4 курсов антибиотиков (или 2–3 курса; при первом – сочетание антибиотиков, обычно аминогликозида и цефалоспорина III–IV поколения).
Побочные явления и их профилактика
Наиболее распространенные у недоношенных новорожденных нежелательные побочные эффекты антибактериальной терапии обусловлены подавлением симбионтной микрофлоры и, как следствие, колонизацией организма условно-патогенными сапрофитами. В связи с этим даже после короткого курса антибактериальной терапии у недоношенных детей возможно развитие дисбиозов – кандидоза кожи и слизистых, кишечного дисбактериоза. Реже у недоношенных отмечаются токсические (по типу идиосинкразии) и аллергические реакции на антибиотики.
Профилактика осложнений антибактериальной терапии начинается уже с ее правильного подбора, тщательного индивидуального контроля. Одновременно с назначением антибиотиков ребенку необходимо назначать противогрибковые средства (леворин, флуконазол, амфотерицин В) и средства, восстанавливающие микрофлору кишечника (бифидум-бактерин и др.); причем использование последних продолжается не менее недели после окончания курса антибиотиков.
С целью снижения нагрузки антибиотиками на незрелый организм недоношенного ребенка в последние годы делаются попытки сочетания антибактериальной терапии со средствами, усиливающими неспецифическую защиту: иммуноглобулинами, лазеротерапией (использование низкоинтенсивного лазерного излучения на магистральные сосуды с целью иммуностимуляции), метаболитной коррекцией.
Применение интерферонов в комплексной терапии дыхательных расстройств у недоношенных новорожденных

Изучена клинико-иммунологическая эффективность применения препарата рекомбинантного альфа-2b интерферона в составе комплексной терапии дыхательных расстройств у недоношенных новорожденных. Показано, что в профилактике и лечении внутриутробных инфекций пло
Clinical and immunological efficiency of use of recombinant alpha-2b interferon preparation as a component of complex therapy of respiratory disorders in prematurely newborns was studied. It was shown that, in prevention and treatment of intrauterine infections of the fetus and the newborn, except for etiotropic, immune-correcting therapy is also very important. Inclusion of recombinant alpha-2b interferon preparation in the complex therapy contributes to improvement of the course, and reduction of duration of the disease.
Недоношенные новорожденные представляют группу высокого риска по развитию внутриутробных инфекций (ВУИ). Частота преждевременных родов составляет в разных странах от 5% до 12%, и их доля продолжает увеличиваться [1]. Заболевания преждевременно родившихся новорожденных детей вызывают патогены различной природы, среди которых одно из первых мест занимают герпесвирусы: цитомегаловирус и вирус простого герпеса. Клинически выраженные формы герпесвирусных инфекций являются причинами тяжелых патологий, нередко приводящих к гибели ребенка [2, 3].
В связи с особенностями герпесвирусных, цитомегаловирусных инфекций и ВУИ неуточненной этиологии, их склонностью к персистенции и хроническому рецидивирующему течению, высоким риском развития тяжелых генерализованных форм у детей раннего возраста при внутриутробном инфицировании, современная терапия этой группы заболеваний обязательно должна включать в себя препараты с противовирусной и иммуномодулирующей активностью. Персистирующие герпесвирусные, цитомегаловирусные инфекции и ВУИ неуточненной этиологии сопряжены с нарушением неспецифической резистентности организма, формированием аутоиммунного компонента воспалительного процесса на фоне различных иммунологических отклонений. Организм новорожденного и особенно недоношенного ребенка в неонатальном периоде, в силу особенностей становления интерфероногенеза и системы иммунитета в целом, не обладает достаточным уровнем резистентности к вирусам и другим возбудителям инфекционных болезней [4–7].
Интерфероны — полифункциональные белки-цитокины, сочетающие в себе иммуномодулирующее, противовирусное и опосредованное антибактериальное действие. Интерферон в организме начинает действовать намного раньше механизмов специфического иммунитета, при этом он, не обладая специфичностью в отношении вирусов, подавляет их проникновение в клетку, блокируя синтез нуклеиновых кислот, трансляцию вирусных белков и сборку вирионов. Интерферон принимает участие в усилении естественной цитотоксичности, регуляции процессов созревания иммунокомпетентных клеток, межклеточных взаимодействий и антителообразования [2, 5].
В раннем неонатальном периоде, особенно у недоношенных детей, концентрация эндогенного интерферона в несколько раз превышает таковую у взрослых. Однако этот интерферон (получивший название «ранний») характеризуется сниженной противовирусной и иммуномодулирующей активностью: в основном его действие направлено на участие в развитии и дифференциации клеток плода и новорожденного. А противоинфекционные и иммуномодулирующие свойства интерферона развиваются на более поздних этапах [2].
Такие особенности развития системы интерферонов в значительной степени обусловливают высокую восприимчивость детей раннего и младшего возраста к инфекционным заболеваниям, включая герпесвирусные, цитомегаловирусные инфекции, со склонностью к более тяжелому течению и развитию осложнений, что в свою очередь создает предпосылки к целесообразности включения в лечебные схемы препаратов не только с противовирусным, но и с иммуномодулирующим действием [8–11]. Таким требованиям в полной мере отвечает российский препарат рекомбинантного интерферона Виферон®, который на протяжении нескольких десятилетий с успехом используется для лечения и профилактики большого спектра инфекций, являясь единственным в своем классе препаратом, разрешенным Государственным фармкомитетом МЗ РФ для лечения инфекционно-воспалительных заболеваний у детей, включая новорожденных, недоношенных и беременных женщин. А производство данного препарата соответствует требованиям GMP. Виферон® представляет собой комплексный препарат рекомбинантного альфа-2b интерферона в сочетании с антиоксидантным комплексом — токоферола ацетатом (витамин Е) и аскорбиновой кислотой.
Виферон®, в отличие от парентеральных препаратов интерферона, не вызывает побочных эффектов, а лекарственная форма в виде ректальных суппозиториев является наиболее удобной и «неинвазивной», что особенно актуально в педиатрии. Ректальный способ введения обеспечивает быстрое всасывание интерферона, который попадает в кровоток, минуя печеночный барьер, что позволяет достичь более высокой его сывороточной концентрации.
Существенным преимуществом препарата является возможность проведения противовирусной терапии с эффектом иммуномодуляции естественным цитокином, в отличие от индукторов, стимулирующих у детей выработку раннего интерферона, обладающего иными свойствами и функциями. Установлено также, что при длительном применении препарата Виферон® не образуются антитела, нейтрализующие антивирусную активность рекомбинантного альфа-2b интерферона. Виферон® совместим и хорошо сочетается со многими другими средствами этиотропной и патогенетической терапии, включая противовирусные химиопрепараты, иммуноглобулины и другие препараты.
Целью настоящего исследования было изучение клинико-иммунологической эффективности препарата рекомбинантного альфа-2b интерферона (Виферон®) суппозитории ректальные в составе комплексной терапии дыхательных расстройств инфекционного (и другого) генеза у недоношенных новорожденных в зависимости от длительности и течения заболевания, продолжительности антибактериальной терапии, времени пребывания в стационаре.
Материалы и методы исследования
В исследование были включено 100 пациентов гестационного возраста (31–34 недели).
1-я группа (сравнения) — дети гестационного возраста 31–34 недели с дыхательной недостаточностью II–III степени (первые 48 часов после рождения), получающие только комплексную терапию (антибактериальную, симптоматическую, инфузионную) без терапии препаратом Виферон® 150 000 МЕ (n = 50).
2-я группа (основная) — дети гестационного возраста 31–34 недели с дыхательной недостаточностью II–III степени (первые 48 часов после рождения), получающие в составе комплексной терапии (антибактериальная, симптоматическая, инфузионная) и препарат Виферон® 150 000 МЕ по стандартной схеме лечения: по 1 суппозиторию 3 раза в сутки через 8 ч ежедневно в течение 10 суток (n = 50).
В исследование не были включены пациенты с генетической патологией, врожденными пороками развития, гемолитической болезнью новорожденных, аллергической реакцией в момент первого введения препарата Виферон®, а также дети матерей с наркоманией, алкоголизмом, носительством ВИЧ, сифилиса и гепатитов B и С.
Методами исследования являлись общеклинические анализы и обследования: клинический и биохимический анализ крови, общий анализ мочи, нейросонография.
Результаты и обсуждение
Исследование проводилось в ГУ НИИАГиП Республики Таджикистан, Душанбе. Все недоношенные новорожденные, которые имели проявление дыхательной недостаточности, находились в отделении реанимации. В исследуемую группу вошли 100 недоношенных новорожденных с гестационным сроком 31–34 недели с проявлениями дыхательной недостаточности.
50 новорожденных составили основную группу. В ней кроме стандартной терапии применяли препарат Виферон® ректальной формы в первые 48 часов жизни. В группу сравнения были включены новорожденные с теми же проявлениями и тем же сроком гестации на стандартной терапии, но без применения препарата Виферон®.
В обеих группах матери этих новорожденных имели идентичную экстрагенитальную патологию. Роды проходили в основном через естественные родовые пути, и лишь в 28% проводилось кесарево сечение.
В основной группе 23 (46%) новорожденных родились в умеренной асфиксии, 8 (16%) — в тяжелой асфиксии и 19 (38%) без асфиксии. В группе сравнения умеренная асфиксия отмечалась у 22 (44%), тяжелая — у 5 (10%), без асфиксии — 23 (46%) новорожденных соответственно (табл. 1).
Дыхательная недостаточность у младенцев имела как инфекционный генез, так и центральный, имелись и случаи недостаточности сурфактантной системы в силу недоношенности. Перинатальная смертность в основной группе составила 9 (18%), а в группе сравнения — 14 (28%) случаев.
Дыхательная недостаточность купировалась в среднем на 5–6 сутки, и новорожденные переводились в отделение первого и второго этапа выхаживания. Среднее количество койко-дней в основной группе составило 7,1 ± 0,3 дня, что было достоверно (р
ГУ НИИАГиП РТ, Душанбе, Таджикистан
Применение интерферонов в комплексной терапии дыхательных расстройств у недоношенных новорожденных/ А. Г. Юнусов, П. Г. Зарифова, С. М. Негматуллаева, Н. Н. Ниязова, Т. Н. Холова
Для цитирования: Лечащий врач № 6/2019; Номера страниц в выпуске: 27-29
Теги: дети, инфекция плода, иммунокорригирующая терапия
Что колят недоношенным детям

Поиск
Особенности антибактериальной терапии у недоношенных новорожденных
В лекции представлены особенности антибактериальной терапии у недоношенных новорожденных, показания к их назначению. Приводится характеристика применяемых в неонатологии антибактериальных препаратов и их дозы, а также возможные осложнения антибактериальной терапии.
Features of antibacterial therapy at premature newborns
Features of antibacterial therapy at premature newborns and indications to their purpose are presented to lecture. The characteristic antibacterial preparations and their dozes applied in neonatology and also possible complications of antibacterial therapy is resulted.
Преждевременные роды и проблемы детей, родившихся раньше срока, лежат в основе высоких показателей заболеваемости и младенческой смертности в нашей стране и за рубежом [1, 7]. Известно, что дети, родившиеся недоношенными, подвергаются высокому риску инфекционных осложнений. В последние годы проблемы инфекционной патологии у незрелых детей приобрели особую актуальность в связи с изменением особенностей как макроорганизмов, так и контингента новорожденных что отразилось на течении инфекционного процесса [3, 4]. Утяжелилось течение фоновых состояний, создающих благоприятную почву для манифестации и прогрессирования инфекции, — перинатальные поражения мозга, врожденные пороки развития, пневмопатии. Достижения современной реаниматологии и интенсивной терапии позволяют обеспечить выживание даже детей с крайне малой массой тела, перенесших тяжелую асфиксию. В свою очередь реанимационные мероприятия, прежде всего длительная ИВЛ и катетеризация магистральных сосудов, создают условия для микробной агрессии [7, 9]. Одним из важных факторов, способствующих бактериальной контаминации и утяжелению течения бактериальных инфекций, является наличие смешанной вирусно-бактериальной внутриутробной инфекции. Перенесенная внутриутробно, специфическая инфекция резко нарушает защитные механизмы ребенка, что способствует присоединению и бурному течению интранатальных и постнатальных бактериальных инфекций [3, 6]. В этиологической структуре возбудителей бактериальных инфекций у недоношенных характерно сочетание нескольких микроорганизмов, выделяемых из различных очагов. Например, из гнойного очага высеваются золотистый и эпидермальный стафилококки, из кала — кишечная палочка и стафилококки. Произошла также смена ведущих возбудителей в процессе лечения (первоначальные агенты воспаления подавляются, их место занимают другие бактерии, часто в сочетании с грибами) [1].
У новорожденных детей фармакокинетика любого препарата существенно отличается от таковой у детей более старшего возраста; в наибольшей мере это относится к незрелым (недоношенным) новорожденным. Крайне важной представляется незрелость выделительной функции почек и ферментных систем печени — эти особенности в первую очередь характерны для глубоконедоношенных детей с массой тела менее 1500 г. Помимо этого, незрелость других органов и систем (желудочно-кишечного тракта, нервной системы, органов дыхания), а также общая лабильность метаболизма накладывают на фармакокинетику антибиотиков у недоношенных детей индивидуальные особенности, предопределяя высокий риск нежелательных побочных эффектов антибактериальной терапии [2, 3].
Общая особенность фармакокинетики любых препаратов у недоношенных детей — это ее замедление, что способствует кумуляции лекарств и влияет на выбор дозы (уменьшение ее на 1/3-1/4), путей и кратности введения препаратов. В то же время повышенная проницаемость естественных барьеров (кожи и слизистых) способствует всасыванию многих медикаментов. В настоящее время проводятся исследования суточных ритмов фармакодинамики различных препаратов, но в отношении антибиотиков у недоношенных детей таких исследований недостаточно [1, 9].
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса. Спорный вопрос о так называемом профилактическом применении антибиотиков у маловесных недоношенных из группы риска по реализации внутриутробной и интранатальной инфекции (больная мать, длительный безводный период и т.п.), как правило, решается в пользу назначения антибиотика, так же как и в случаях так называемых неинфекционных пневмопатий. К условно «профилактическим» можно отнести также назначение антибиотика для «прикрытия» гормональной кортикостероидной терапии и некоторых вмешательств (катетеризации, переливания крови и т.п.). Эмпирическая антибактериальная терапия у недоношенных младенцев в первые дни жизни часто назначается из-за незрелости их иммунной системы, более высокой летальности при бактериальных инфекциях и более частого раннего неонатального сепсиса по сравнению с доношенными детьми. Однако антибактериальные агенты нарушают колонизацию кишечной флоры и могут повлиять на формирование здоровья таких пациентов [2, 3].
Выбор антибиотика для недоношенного ребенка — ответственный момент, во многом определяющий эффективность лечения. При выборе препарата следует учитывать следующие факторы:
· вид возбудителя (в начале лечения часто лишь предполагаемый) и его штамм;
· чувствительность возбудителя (также в начале лечения — предполагаемую, через 2-3 дня после получения результатов бактериологических анализов в терапию могут быть внесены коррективы). В последние годы высказывается мнение о том, что параметры чувствительности микробов in vitro не всегда совпадают с таковыми in vivo и нет необходимости строго следовать им при назначении препаратов;
· локализация и степень тяжести инфекционного процесса;
· сопутствующие состояния и преморбидный фон (предпочтение парентеральных препаратов при тяжелом дисбактериозе или внутривенного введения у крайне маловесных детей с неразвитой мышечной тканью).
Все антибиотики можно условно разделить на 3 группы:
· препараты первого выбора назначают, когда нет оснований думать о лекарственной устойчивости флоры (полусинтетические пенициллины, аминогликозиды I поколения, цефалоспорины I поколения);
· препараты второго выбора направлены на преодоление устойчивых штаммов (аминогликозиды и цефалоспорины III-IV поколения, современные макролиды);
· препараты третьего выбора (или препараты резерва), применяемые при крайне тяжелых формах заболеваний с полирезистентной флорой (карбапенемы).
У недоношенных детей в основном сразу используются препараты второго выбора: применение антибиотиков первого ряда у них неэффективно и лишь способствует отсрочке манифестных проявлений инфекционного процесса, маскирует клинические симптомы. У детей периода новорожденности даже по жизненным показаниям не должны использоваться препараты, обладающие высокой токсичностью (фторхинолоны) [3, 6].
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в таблице 1. Общий принцип подбора дозы для новорожденного ребенка сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Комбинированная антибактериальная терапия у недоношенных детей должна проводиться с большой осторожностью; одновременное сочетание двух (очень редко — трех) антибиотиков применяется лишь у детей с тяжелыми гнойно-воспалительными процессами (прежде всего при сепсисе), вызванными смешанной флорой [1, 4, 5]. Допустимые сочетания антибиотиков:
· Аминогликозид + пенициллин (или полусинтетические пенициллины)
· Ампициллин + цефалоспорин (предпочтительнее цефотаксим)
Дозировки антибактериальных препаратов, разрешенных для лечения недоношенных новорожденных (мг/кг)
| Антибиотик | Путь введения | Дети 0-4 нед. | Дети первой недели жизни | Дети 7 сут. и старше (с 2 нед. при сроке гестации 30-36 нед.) | |||||
| срок гестации менее 29 нед. | срок гестации 30-36 нед. | срок гестации 37 нед. и более | срок гестации 30-36 нед. | срок гестации 37 нед. и более | |||||
| Аминогликозиды1 | |||||||||
| Амикацин | Внутривенно | 18 на 1-й неделе каждые 48 ч., далее 15 каждые 36 ч. | 18 каждые 36 ч. | 15 каждые 24 ч. | 15 каждые 24 ч. | 15 каждые 24 ч. | |||
| Антистафилококковые пенициллины2 | |||||||||
| Оксациллин | Внутривенно, | 25 каждые 12 ч. | 25-50 каждые 12 ч. | 25-50 каждые 8 ч. | 25-50 каждые 8 ч. | 25-50 каждые 8 ч. | |||
| Карбапенемы3 | |||||||||
| Имипенем + циластатин | Внутри-венно | 25 каждые 12 ч. | 25 каждые 12 ч. | 25 каждые 12 ч. | 25 каждые 8 ч. | 25 каждые 8 ч. | |||
| Меропенем | Внутри-венно | 20 каждые 12 ч. | 20 каждые 12 ч. | 20 каждые 12 ч. | 20 каждые 8 ч. | 20 каждые 8 ч. | |||
| Цефалоспорины | |||||||||
| II поколение | |||||||||
| Цефуроксим | Внутри-венно | 25-50 каждые 12 ч. | 25-50 каждые 12 ч. | 25-50 каждые 8 или 12 ч. | 50 каждые 8 ч. | 50 каждые 8 ч. | |||
| Цефокситин | Внутри-венно, | 25-33 каждые 12 ч. | 25-33 каждые 12 ч. | 25-33 каждые 12 ч. | 25-33 каждые 8 ч. | 25-33 каждые 8 ч. | |||
| III поколение | |||||||||
| Цефотаксим | Внутри-венно, | 50 каждые 12 ч. | 50 каждые 12 ч. | 50 каждые 8 или 12 ч. | 50 каждые 8 ч. | 50 каждые 6-8 ч. | |||
| Цефтазидим | Внутри-венно, | 30-50 каждые 12 ч. | 30-50 каждые 12 ч. | 30-50 каждые 8 или 12 ч. | 50 каждые 8 ч. | 50 каждые 8 ч. | |||
| Цефтриаксон4 | Внутри-венно, | 50 каждые 24 ч. | 50 каждые 24 ч. | 50 каждые 24 ч. | 50 каждые 24 ч. | 50-75 каждые 24 ч. | |||
| IV поколение | |||||||||
| Цефепим | Внутри-венно | 30 каждые 12 ч. | 30 каждые 12 ч. | 30 каждые 12 ч. | 50 каждые 8 ч. | 50 каждые 8 ч. | |||
| Макролиды | |||||||||
| Эритромицин | Пер-орально каждые 6 ч. | 10 каждые 12 ч. 5-10 каждые 6 ч. | 10 каждые 8 ч. каждые 6 ч. | ||||||
| Азитромицин | Пер-орально | 10 каждые 24 ч. 5 дней | 10 каждые 24 ч. 5 дней | 10 каждые 24 ч. 5 дней | 10 каждые 24 ч. 5 дней | 10 каждые 24 ч. 5 дней | |||
| Оксазолидиноны | |||||||||
| Линезолид | Внутри-венно | 10 каждые 8-12 ч. | 10 каждые 8 ч. | 10 каждые 8 ч. | |||||
| Пенициллины | |||||||||
| Ампициллин2 | Внутри-венно, | 25-50 каждые 12 ч. | 25-50 каждые 12 ч. | 25-50 каждые 8 ч. | 25-50 каждые 8 ч. | 25-50 каждые 6 ч. | |||
| Амоксициллин + клавулановая кислота | Пер-орально | Нет сведений | 30 в 2 приема | 30 в 2 приема | 30 в 2 приема | 30 в 2 приема | |||
| Бензилпенициллин | Внутри-венно, | 25 000-50 000 ЕД каждые 12 ч. | 25 000-50 000 ЕД каждые 12 ч. | 25 000-50 000 ЕД каждые 8 ч. | 25 000-50 000 ЕД каждые 8 ч. | 25 000-50 000 ЕД каждые 8 ч. | |||
| Тикарциллин + клавулановая кислота5 | Внутри-венно, | 75-100 каждые 12 ч. | 75-100 каждые 12 ч. | 75-100 каждые 12 ч. | 75-100 каждые 8 ч. | 75-100 каждые 8 ч. | |||
| Гликопептиды | |||||||||
| Ванкомицин1 | Внутри-венно | 10-15 каждые 12 ч. | 10-15 каждые 12 ч. | 10-15 каждые 12 ч. | 10-15 каждые 8-12 ч. | 10-15 1 Оптимальные дозы аминогликозидов и ванкомицина следует определять на основании их концентрации в сыворотке крови (особенно у детей с массой тела менее 1500 г). У детей с массой тела менее 1200 г в течение первой недели жизни препараты целесообразно вводить через 24 ч. Дозы аминогликозидов могут отличаться от рекомендуемых в зависимости от указаний производителя, вложенных в упаковку. 2 При менингите назначают большие дозы. Некоторые эксперты рекомендуют большие дозы и при менингите, вызванном стрептококком группы В. 3 Безопасность для грудных детей не установлена. При назначении карбопенемов новорожденным предпочтительнее использовать меропенем. 4 Цефтриаксон не назначают при гипербилирубинемиях, особенно недоношенным. 5 Тикарциллин противопоказан недоношенным с нарушением функции почек. Пути и кратность введения антибиотиков недоношенному ребенку. В связи с высокой проницаемостью и ранимостью слизистой желудочно-кишечного тракта у незрелых новорожденных, а также опасностью развития дисбиоза и некротического энтероколита использование пероральных антибиотиков у них ограниченно. К тому же большинство инфекционных заболеваний у недоношенных детей по тяжести состояния требуют более мощной терапии. У новорожденных (особенно недоношенных) детей период полувыведения препаратов увеличен вследствие незрелости почек и печени. Поэтому кратность введения большинства препаратов не превышает у них 2 раз в течение суток (за исключением пенициллинов); особенно популярными в неонатологии остаются препараты пролонгированного действия (рокситромицин, цефтриаксон), допускающие однократное применение. Некоторые исследователи большинство парентеральных препаратов (в том числе аминогликозиды, цефалоспорины) предлагают вводить однократно — внутривенно или внутримышечно [2, 4, 6]. Продолжительность антибактериальной терапии и последовательность применяемых антибиотиков у недоношенного ребенка определяются индивидуально, они зависят от эффективности первичного курса антибактериальной терапии, которая оценивается по традиционным клиническим и лабораторным параметрам. Как правило, недоношенным детям со среднетяжелыми инфекционными процессами (омфалит, пневмония, отит и т.д.) проводят два последовательных курса антибиотика (второй курс с учетом чувствительности микрофлоры), каждый по 7-10 дней. При тяжелых заболеваниях (менингит, остеомиелит, сепсис) обычно используют не менее 3-4 курсов антибиотиков (или 2-3 курса; при первом — сочетание антибиотиков, обычно аминогликозида и цефалоспорина III-IV поколения). Наиболее распространенные у недоношенных новорожденных нежелательные побочные эффекты антибактериальной терапии обусловлены подавлением симбионтной микрофлоры и как следствие колонизацией организма условно-патогенными сапрофитами. В связи с этим даже после короткого курса антибактериальной терапии у недоношенных детей возможно развитие дисбиозов — кандидоза кожи и слизистых, кишечного дисбактериоза. Реже у недоношенных отмечаются токсические (по типу идиосинкразии) и аллергические реакции на антибиотики. По данным C. Michael Cotton, длительная эмпирическая антибактериальная терапия увеличивает риск некротического энтероколита и смерти у глубоко недоношенных новорожденных [8]. Кроме того, в настоящее время в литературе активно обсуждается значение применения антибиотиков у новорожденных и связанных с этим дисбиотических нарушений микрофлоры кишечника в повышении риска развития у детей бронхиальной астмы [Alm B., 2008]. Профилактика осложнений антибактериальной терапии начинается уже с момента ее правильного подбора, тщательного индивидуального контроля. Одновременно с назначением антибиотиков ребенку необходимо назначать противогрибковые средства (флуконазол, амфотерицин В) и средства, восстанавливающие микрофлору кишечника (бифидум-бактерин и др.); причем использование последних продолжается не менее недели после окончания курса антибиотиков. С целью снижения нагрузки антибиотиками на незрелый организм недоношенного ребенка в последние годы делаются попытки сочетания антибактериальной терапии со средствами, усиливающими неспецифическую защиту: иммуноглобулинами, лазеротерапией (использование низко-интенсивного лазерного излучения на магистральные сосуды с целью иммуностимуляции), метаболической коррекцией [6, 9]. Таким образом, от правильности выбора антибактериального препарата зависят не только тяжесть течения заболевания и длительность лечения, но нередко и исход заболевания. Поэтому к назначению антибактериальных препаратов у недоношенных детей нужно подходить по строгим показаниям, с учетом чувствительности микрофлоры, особенностей фармакокинетики и фармакодинамики антибиотиков. Е.В. Волянюк Казанская государственная медицинская академия Волянюк Елена Валерьевна — кандидат медицинских наук, ассистент кафедры педиатрии и неонатологии 1. Бомбандирова Е.П., Яцык Г.В.Особенности антибактериальной терапии у недоношенных новорожденных. Русский мед. журнал 2000; 8:18: 749-754. 2. Шабалов Н. П., Маркова И. В. Антибиотики и витамины в лечении новорожденных. Санкт-Петербург: Сотис, 1993. С. 14-23. 3. В.Н.Нечаев Антибиотикотерапия у новорожденных и детей раннего возарста. М.: Практическая Медицина, 2009. 127 с. 4. Белобородова Н.В., Гребенников В.А., Траубе М.А., Черневская E.А., Эверстова Т.Н. Предварительные результаты исследования по оптимизации терапии карбапенемами у новорожденных в ОРИТ под контролем теста на ПКТ. Русский мед.журнал 2007; 15: 4: 241-252. 5. Самсыгина Г. А., Дудина Т. А. Тяжелые внебольничные пневмонии у детей: особенности клиники и терапии.Consilium Medicum 2002; 2: 12-16. 6. Неонатология: национальное руководство. Под ред. академика РАМН Володина Н.Н. М.: ГЭОТАР-Медиа, 2008. 749 с. 7. Кудашов Н.И. Новорожденные высокого риска. М.: Медицина, 2006. С. 104-115. 8. C. Michael Cotten et al. Prolonged duration of initial empirical antibiotic treatment is associated with increased rates of necrotizing enterocolitis and death for extremely low birth weight infants. Pediatrics 2009;23: 1: 58-66.
| |||


.gif)

